Внутрибрюшная аэрозольная химиотерапия под давлением в сочетании с системной химиотерапией - новый подход в лечении больных раком желудка с перитонеальным карциноматозом
Автор: Хомяков Владимир Михаилович, Рябов Андрей Борисович, Колобаев Илья Владимирович, Болотина Лариса Владимировна, Уткина Анна Борисовна, Соболев Дмитрий Дмитриевич, Кузнецова Ольга Сергеевна, Каприн Андрей Дмитриевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Цель исследования - изучить непосредственные и отдалённые результаты применения внутри-брюшной аэрозольной химиотерапии под давлением (ВАХД) у больных с перитонеальным карциноматозом при раке желудка. Материал и методы. На первом этапе, согласно протоколу исследования, пациентам выполняли стадирующую лапароскопию, в ходе которой определяли распространённость перитонеального карциноматоза по шкале PCI с обязательной множественной биопсией брюшины и последующим гистологическим исследованием измененных участков брюшины. Лечение начинали с 4 курсов системной химиотерапии по схеме XELOX или FOLFOX. В дальнейшем больным в условиях торакоабдоминального отделения осуществляли сеансы ВАХД препаратами цисплатин и доксорубицин с интервалом 6-8 нед. Между сеансами пациенты продолжали получать системную химиотерапию по прежней схеме. Каждый сеанс ВАХД включал лапароскопию, повторную биопсию и оценку PCI. Результаты. У 102 (80,3 %) больных был первичный рак желудка с ПК, у 25 (19,7 %) - перитонеальный рецидив. PCI18 - у 34 (26,7 %). Диффузный тип рака желудка выявлен у 114 больных (89,7 %), кишечный тип - у 6 (4,7 %), смешанный тип - у 7 (5,5 %). С 2013 г. 127 больным проведено 310 процедур ВАХД. Тяжелых осложнений и летальности не отмечено. Лечебный патоморфоз был оценен у 72 больных. У 40 (55,6 %) больных отмечен выраженный патоморфоз (PRGS 2) и у 10 (13,9%) - полный патоморфоз (PRGS 1). Выживаемость оценена у 63 % (n=80), получивших более 1 сеанса ВАХД. Медиана выживаемости составила 16,0 мес, 1-годичная выживаемость - 77,9 %. Заключение. Новый подход к лечению больных раком желудка с перитонеальным карциноматозом, сочетающий системную химиотерапию и внутрибрюшную аэрозольную химиотерапию под давлением, зарекомендовал себя как относительно простой и безопасный метод, позволяющий добиться увеличения общей выживаемости у пациентов с диссеминированным раком желудка.
Рак желудка, перитонеальный карциноматоз, внутрибрюшная аэрозольная химиотерапия под давлением
Короткий адрес: https://sciup.org/140254444
IDR: 140254444 | УДК: 616.33-006.6-033.2-08:616.381:615.28 | DOI: 10.21294/1814-4861-2020-19-4-49-58
Текст научной статьи Внутрибрюшная аэрозольная химиотерапия под давлением в сочетании с системной химиотерапией - новый подход в лечении больных раком желудка с перитонеальным карциноматозом
На сегодняшний день одним из наиболее перспективных методов лечения перитонеального карциноматоза является внутрибрюшная аэрозольная химиотерапия под давлением (ВАХД). Впервые данная процедура была осуществлена в 2011 г., в Мюнстерском университете (Германия) [17]. Проведенные исследования продемонстрировали высокую эффективность применения цитостатиков в виде терапевтического аэрозоля в условиях длительного пневмоперитонеума по сравнению с другими способами внутрибрюш-ного лекарственного воздействия. Как показали доклинические исследования, в ходе аэрозольного введения достигаются более глубокое проникновение цитостатика в опухолевую ткань, а также более гомогенное распределение по брюшной полости по сравнению с обычным внутрибрюшным введением или ГИВХ [18–20]. Первые работы, посвященные применению ВАХД, продемонстрировали обнадеживающие результаты. Так, у 25 % больных наблюдался полный патоморфологический ответ на проведенное лечение, еще у 34 % имелись частичный ответ либо стабилизация опухолевого процесса [21]. Немаловажным фактом является то, что для проведения ВАХД используются низкие дозы цитостатиков (в среднем 10 % от обычной дозы), следствием чего является практически полное отсутствие системной токсичности.
Материал и методы
Согласно разработанному протоколу, на первом этапе проводили стадирующую лапароскопию, в ходе которой определяли распространённость перитонеального карциноматоза по шкале PCI с обязательной множественной биопсией брюшины и последующим гистологическим исследованием измененных участков брюшины. Лечение начинали с 4 курсов системной химиотерапии по схеме XELOX или FOLFOX. В дальнейшем больным в условиях торакоабдоминального отделения осуществляли сеансы ВАХД препаратами цисплатин и доксорубицин с интервалом 6–8 нед. Между сеансами пациент продолжал получать системную химиотерапию по прежней схеме.
При наличии отрицательной динамики на фоне проводимого лечения (нарастания индекса PCI на 50 % и более, увеличения темпов накопления асцита, появления новых отдаленных гематогенных или лимфогенных метастазов, а также резкого ухудшения общего состояния) пациент выбывал из исследования – лечебный протокол 1 (рис. 1). Если больной обратился к нам уже в процессе проведения ПХТ, то сеанс ВАХД проводили сразу же во время первой лапароскопии, а режим системной химиотерапии выбирали индивидуально – лечебный протокол 2 (рис. 2). С 2018 г. в комбинации с ВАХД наряду со схемами XELOX/FOLFOX начато применение более современных режимов с включением таксанов у относительно молодых сохранных пациентов с диффузным типом РЖ (25 из 127 больных).
После завершения первых 4 курсов системной химиотерапии, а также перед каждым сеансом ВАХД пациентам проводили комплексное обследование (общий и биохимический анализы крови,
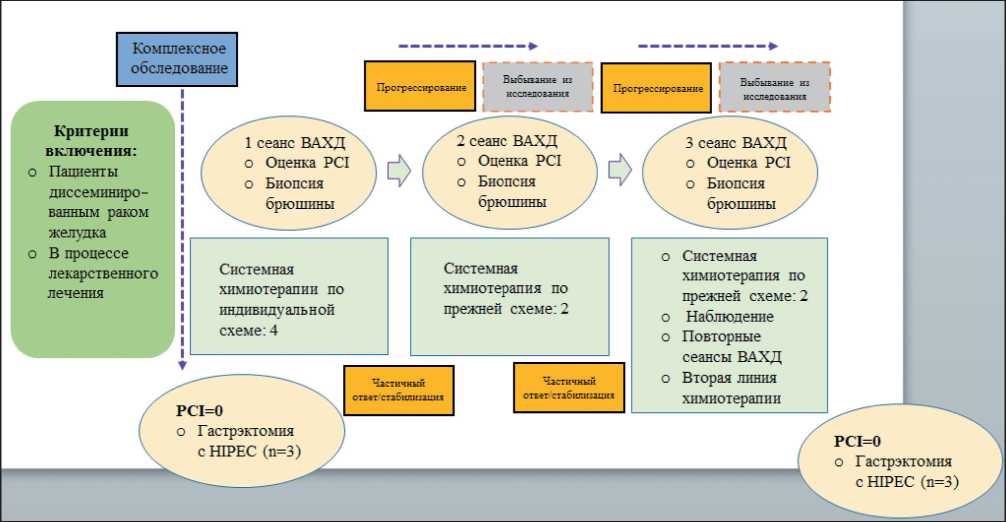
Рис. 1. Лечебный протокол 1 (схема) Fig. 1. Treatment protocol 1 (scheme)
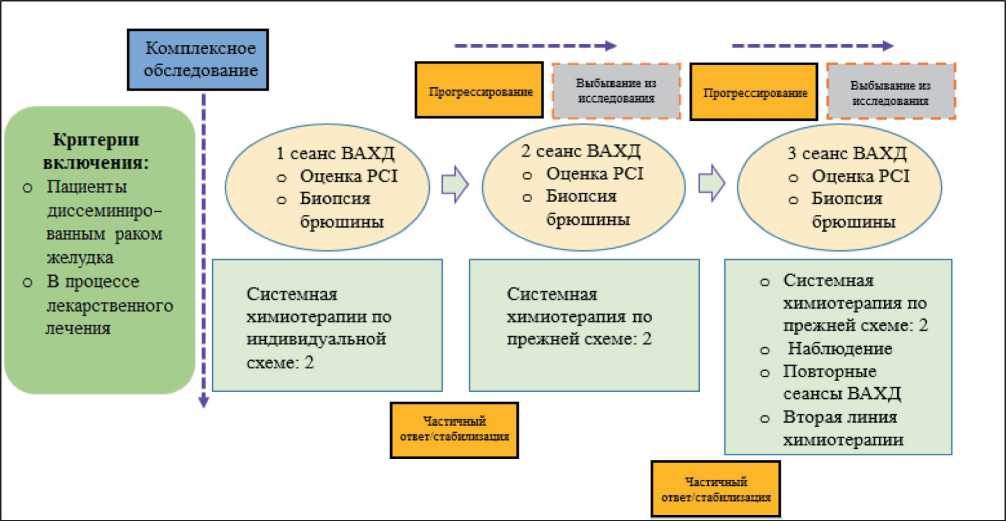
Рис. 2. Лечебный протокол 2 (схема) Fig. 2. Treatment protocol 2 (scheme)
коагулограмма, общий анализ мочи, маркерный статус, ЭГДС, КТ органов грудной и брюшной полости, УЗИ органов брюшной полости, малого таза, шейно-надключичных зон). У пациенток с подозрением на метастатическое поражение яичников сеанс ВАХД дополняли лапароскопической двухсторонней аднексэктомией.
Методика внутрибрюшной аэрозольной химиотерапии под давлением: в условиях карбок-сиперитонума 12 мм рт. ст. в брюшную полость устанавливается два 11-мм троакара, выполняется видеоревизия брюшной полости с подсчетом индекса PCI, множественная биопсия очагов карциноматоза (не менее 3–4 фрагментов). Далее эвакуируется асцит с замером объема жидкости, через один из троакаров вводится форсунка-распылитель, которую подключают к ангиоинжектору высокого давления. Осуществляется распыление растворов химиопрепаратов: цисплатин в дозе 7,5 мг/м2 в 150 мл 0,9 % NaCl, доксорубицин 1,5 мг/м2 в 50 мл 0,9 % NaCl. Терапевтический аэрозоль выдерживается в течение 30 мин на фоне постоянного карбоксиперитонеума 12 мм рт. ст. По окончании времени экспозиции производится эвакуация остатков аэрозоля посредством централизованной системы сброса медицинских газов. Описание метода ВАХД подробно представлено на страницах журналов «Онкология. Журнал имени П.А. Герцена» и «Фарматека» [22].
Для оценки эффекта ВАХД используют следующие клинические и морфологические показатели: динамика индекса PCI, темпы накопления асцита, степень лечебного патоморфоза (PRGS) по данным повторной биопсии. Признаками неэффективности проводимого лечения являются: нарастание индекса PCI на 25 % и более, нарастание объема асцита на 25 % и более, увеличение размеров первичной опухоли, регионарных лимфоузлов, а также появление экстраперитонеальных очагов метастазирования (системное прогрессирование). Безопасность оценивали на основании стандартных лабораторных и клинических тестов.
Результаты и обсуждения
До начала проведения ВАХД лекарственная терапия в силу различных причин не была проведена 5 больным. В соответствии с протоколом 4 курса химиотерапии по схеме XELOX/FOLFOX получили 64 пациента, остальные 58 – прочие схемы лекарственного лечения (DCF, FLOT и т. д.). Всего за период с августа 2013 г. по январь 2019 г. 127 больным проведено 310 процедур ВАХД (таблица). Основной причиной, по которой был проведен только 1 сеанс ВАХД (47 больных), явилось прогрессирование опухолевого процесса (39 больных, 82,9 %) с появлением экстраперито-неальных метастазов и нарастанием карциноматоза либо выраженным ухудшением общего состояния. Из них 8 пациентов ожидают второй сеанс. Асцит таблица/table общая характеристика 127 пациентов general characteristics of 127 patients
Нежелательные явления регистрировались согласно принятым критериям побочных эффектов (CTCAE 4.0). При оценке безопасности было зафиксировано 43 (13,8 %) случая развития нежелательных явлений на 310 процедур. Тяжелых осложнений и летальности не было. Самым частым нежелательным явлением в 1-е сут после операции была боль в местах установки троакара – 28 (65,1 %), купируемая приемом анальгетиков. У 8 (18,6 %) больных отмечена послеоперационная тошнота без позывов на рвоту. В 2 (4,6 %) случаях была десерозирована тонкая кишка при установке троакаров, что потребовало наложения серозномышечных швов. В 1 наблюдении при биопсии диафрагмы возникла перфорация с развитием карбокситоракса, что потребовало дренирования плевральной полости (CTCAE 3). Подкожная эмфизема в месте введения иглы Вереша зафиксирована у 2 больных, и грыжа в области установки троакара в 1-м наблюдении. Средний срок нахождения в стационаре составил 3 дня.
Лечебный патоморфоз (ЛП) по данным повторной биопсии был выявлен у 72 больных, получивших более 1 сеанса ВАХД. Оценка ЛП производилась с помощью международной шкалы лечебного патоморфоза в брюшине – PRGS (Peritoneal Regression Grading Score). Лишь у 4 (5,6 %) больных в повторных биоптатах брюшины было зафиксировано отсутствие лечебного патоморфоза (PRGS 4), у 18 (25 %) пациентов выявлены слабо выраженные признаки лечебного патоморфоза (PRGS 3), у 40 (55,6 %) был отмечен выраженный лечебный патоморфоз (PRGS 2), у 10 (13,9 %) – полный морфологический ответ в виде фиброзной ткани без элементов опухоли (PGRS 1). Случаи полного ответа подтверждали иммуногистохимическим исследованием на панцитокератин.
Также дана оценка динамике PCI на втором сеансе ВАХД. Для исключения влияния субъективного фактора был введен допуск, при котором изменения индекса в пределах ±25 % от исходного расценивали как стабилизацию. Соответственно, нарастание PCI более чем на 25 % характеризовали как прогрессирование. Таким образом, у 15 (18,7 %) больных уровень индекса диссеминации стал ниже исходного, у 42 (52,5 %) отмечена стабилизация, у 23 (28,7 %) зафиксирована отрицательная динамика. Следует отметить, что изменение индекса PCI не всегда коррелировало с лечебным патоморфозом, наблюдались случаи нарастания PCI на фоне выраженного лечебного патоморфоза в биоптатах брюшины и наоборот. В большинстве наблюдений полного и частичного ответа очаги карциноматоза не исчезают полностью, а замещаются фиброзной тканью.
Поскольку 37 % больных выбыло после первого сеанса ВАХД, оценена выживаемость 63 % больных (n=80), получивших более 1 сеанса ВАХД. Медиана выживаемости составила 16,0 мес, 1-годичная выживаемость – 77,9 % (рис. 3), что достоверно выше аналогичных показателей в группе исторического контроля – 7 мес и 28,8 % соответственно (рис. 4).
Также нами произведена оценка выживаемости больных в зависимости от основных прогностических факторов: начального уровня PCI и ответа на системную химиотерапию. Для оценки выживаемости в зависимости от уровня перитонеального карциноматоза больные были условно разделены на три группы с низким (<10), средним (10–18) и высоким (>18) значением PCI. Медиана выживаемости в указанных группах составила 16,0; 12,3
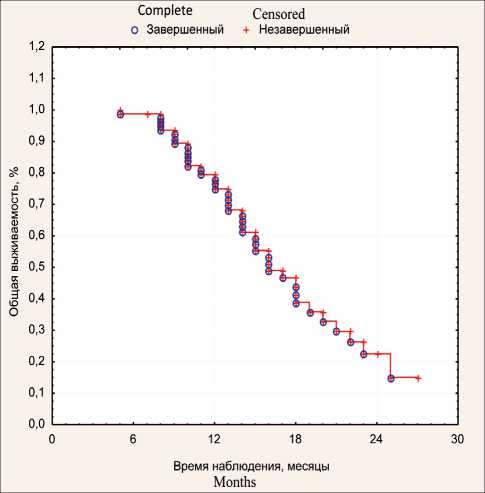
Рис. 3. Общая выживаемость больных Fig. 3. Overall survival of patients
Cumulative Proportion Surviving (Kaplan-Meier)
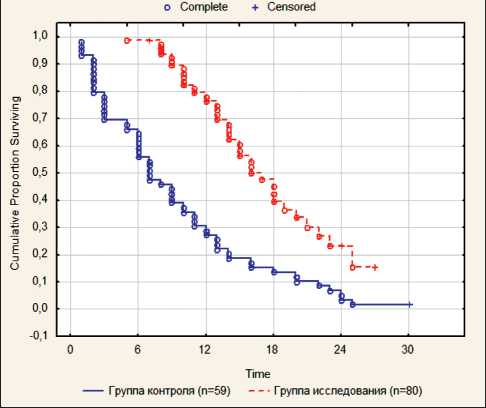
Рис. 4. Общая выживаемость больных по сравнению с группой исторического контроля
Fig. 4. Overall survival of patients compared to the historical control group и 12,0 мес, 1-годичная выживаемость – 80,5 %, 50,0 % и 49,4 % соответственно (рис. 5). Таким образом, максимальный эффект от применения метода был зафиксирован в группе больных с низким значением PCI.
Еще одним важнейшим фактором прогноза являлся ответ на системную химиотерапию, поскольку у большинства больных первичная опухоль не была удалена и эффективность системной лекарственной терапии определяла контроль над первичной опухолью и экстраперитонеальными
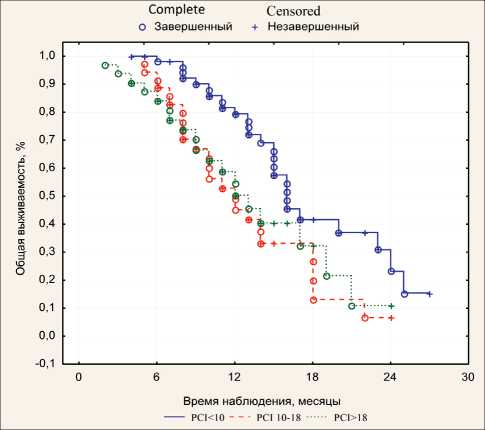
Рис. 5. Общая выживаемость больных в зависимости от исходного значения PCI
Fig. 5. Overall survival of patients with respect to initial PCI value
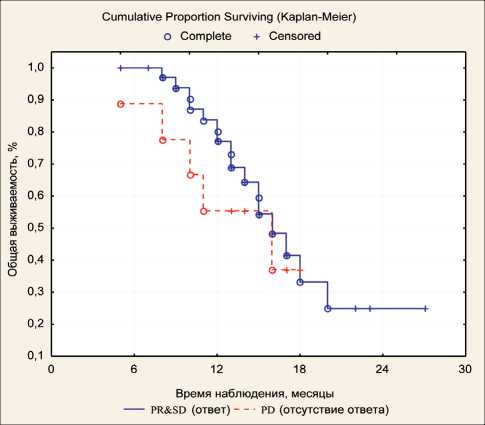
Рис. 6. Общая выживаемость больных в зависимости от ответа на системную химиотерапию
Fig. 6. The overall survival of patients depending on the response to systemic chemotherapy очагами болезни (метастатические лимфоузлы и т. п.). Медиана выживаемости больных, ответивших на системную химиотерапию в виде частичного регресса или стабилизации, была достоверно выше и составила 15,6 мес против 11,3 мес у больных с прогрессированием. Одногодичная выживаемость – 71,9 % и 47,3 % соответственно (рис. 6). У 5 больных проведение сочетанной ВАХД и системной химиотерапии привело к снижению индекса PCI до 0–2, что позволило выполнить циторедуктивную операцию в сочетании с ГИВХ.
Обсуждение
Наилучшие показатели выживаемости отмечены в группе больных, ответивших на системную химиотерапию, а также с уровнем PCI менее 10. Оценка ответа на системную химиотерапию, предшествующую первому сеансу ВАХД, является важным критерием отбора больных для дальнейшего лечения. Очевидно, что при первичном РЖ с ПК проведение сочетанной внутрибрюшной и системной химиотерапии не предполагает удаление первичного очага, а это значит, что контроль за первичной опухолью и экстраперитонеальным распространением в значительной степени зависит от эффективности системного компонента. Таким образом, проведение ВАХД в случае явного прогрессирования заболевания на фоне системной химиотерапии оправдано только с симптоматической целью (снижение темпов накопления асцита).
Список литературы Внутрибрюшная аэрозольная химиотерапия под давлением в сочетании с системной химиотерапией - новый подход в лечении больных раком желудка с перитонеальным карциноматозом
- Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году. М.: 2016: 4—11. [KaprinA.D., Starinsky V.V., Petrova G.V. Malignant neoplasms in Russia in 2017. Moscow: 2016: 411. (in Russian)].
- Каприн А.Д., Соболев Д.Д., Хомяков В.М., Болотина Л.В., Рябов А.Б., Хороненко В.Э., Шеметова М.М., Крамская Л.В., Колобаев И.В., Иванов А.В., Уткина А.Б. Опыт лечения местно-распространенного рака желудка (Cyt+) с применением гипертермической интраоперационной внутрибрюшной химиотерапии. Онкология. Журнал им. П.А. Герцена. 2015; (1): 67—70. [KaprinA.D., SobolevD.D., Khomiakov V.M., Bolotina L.V., Riabov A.B., Khoronenko V.É., Sheme-tova M.M., Kramskaia L.V., Kolobaev I.V., Ivanov A.V., Utkina A.B. Experience with hyperthermic intraoperative intraperitoneal chemotherapy in the treatment of locally advanced gastric cancer (Cyt+). P. A. Herzen Journal of Oncology. 2015; (1): 67—70. (in Russian)].
- Nashimoto A., Akazawa K., Isobe Y., Miyashiro I., Katai H., Kodera Y., Tsujitani S., Seto Y., Furukawa H., Oda I., Ono H., Tanabe S., Kaminishi M. Gastric cancer treated in 2002 in Japan: 2009 annual report of the JGCA nationwide registry. Gastric Cancer. 2013 Jan; 16(1): 1—27. doi: 10.1007/s10120-012-0163-4.
- СтепановИ.В., Падеров Ю.М., Афанасьев С.Г. Перитонеальный канцероматоз. Сибирский онкологический журнал. 2014; (5): 45—53. [Stepanov I.V., Paderov Yu.M., Afanasyev S.G. Peritoneal carcinomatosis. Siberian Journal of Oncology. 2014; (5): 45—53. (in Russian)].
- Roviello F., Marrelli D., de Manzoni G., Morgagni P., Di Leo A., Saragoni L., De Stefano A.; Italian Research Group for Gastric Cancer. Prospective study of peritoneal recurrence after curative surgery for gastric cancer. Br J Surg. 2003 Sep; 90(9): 1113—9. doi: 10.1002/bjs.4164.
- Thomassen I., van Gestel Y.R., van Ramshorst B., Luyer M.D., Bosscha K., Nienhuijs S.W., Lemmens V.E., de Hingh I.H. Peritoneal carcinomatosis of gastric origin: a population-based study on incidence, survival and risk factors. Int J Cancer. 2014 Feb 1; 134(3): 622—8. doi: 10.1002/ijc.28373.
- SadeghiB., Arvieux C., Glehen O., Beaujard A.C., RivoireM., Bau-lieux J., FontaumardE., Brachet A., Caillot J.L., Faure J.L., Porcheron J., Peix J.L., François Y., Vignal J., GillyF.N. Peritoneal carcinomatosis from non-gynecologic malignancies: results of the EVOCAPE 1 multicentric prospective study. Cancer. 2000 Jan 15; 88(2): 358—63. doi: 10.1002/ (sici)1097-0142(20000115)88:2-358::aid-cncr16-3.0.co;2-o.
- 8.KuramotoM., ShimadaS., IkeshimaS., MatsuoA., Yagi Y,MatsudaM., Yonemura Y., Baba H. Extensive intraoperative peritoneal lavage as a standard prophylactic strategy for peritoneal recurrence in patients with gastric carcinoma. Ann Surg. 2009 Aug; 250(2): 242—6. doi: 10.1097/ SLA.0b013e3181b0c80e.
- Бесова Н.С., Болотина Л.В., Калинин А.Е., Кононец П.В., Малихова О.А., Проценко С.А. Практические рекомендации по лекарственному лечению рака желудка. Злокачественные опухоли. Практические рекомендации RUSSCO. 2019; 9(3s2): 308—323. [Besova N.S., Bolotina L.V., Kalinin A.E., Kononets P.V., Malikhova O.A., Protsenko S.A. Practical recommendations for the treatment of gastric cancer. Malignant tumors. Practical recommendations of RUSSCO. 2019 9 (3s2): 308—323. (in Russian)].
- Mori T., Fujiwara Y., Sugita Y., Azama T., Ishii T., Taniguchi K., Yamazaki K., Takiguchi S., Yasuda T., YanoM., MondenM. Application of molecular diagnosis for detection of peritoneal micrometastasis and evaluation of preoperative chemotherapy in advanced gastric carcinoma. Ann Surg Oncol. 2004 Jan; 11(1): 14-20. doi: 10.1007/BF02524340.
- Elias D., Gilly F., Boutitie F., Quenet F., Bereder J.M., Mansvelt B., Lorimier G., Dube P., Glehen O. Peritoneal colorectal carcinomatosis treated with surgery and perioperative intraperitoneal chemotherapy: retrospective analysis of 523 patients from a multicentric French study. J Clin Oncol. 2010 Jan 1; 28(1): 63-8. doi: 10.1200/JC0.2009.23.9285.
- Hanker L.C., Loibl S., Burchardi N., Pfisterer J., Meier W., Pujade-Lauraine E., Ray-CoquardI., Sehouli J., Harter P., du Bois A.; AGO and GINECO study group. The impact of second to sixth line therapy on survival of relapsed ovarian cancer after primary taxane/platinum-based therapy. Ann Oncol. 2012 Oct; 23(10): 2605-12. doi: 10.1093/annonc/ mds203.
- Каприн А.Д., Хомяков В.М., Соболев Д.Д., Болотина Л.В., Рябов А.Б., Хороненко В.Э., Соболева М.М., Крамская Л.В. Опыт комбинированного лечения больных местно-распространенным и диссеминированным раком желудка с использованием методики гипертермической интраоперационной внутрибрюшной химиотерапии. Исследования и практика в медицине. 2015; 2(4): 17-27. [Kaprin A.D., Khomyakov V.M., Sobolev D.D., Bolotina L. V., Ryabov A.B., Khoronenko V.E., Soboleva M.M., Kramskaya L.V. Our experience of hyperthermic intraperitoneal chemotherapy for patients with advanced gastric cancer. Research and Practical Medicine Journal. 2015; 2(4): 17-27. (in Russian)]. doi: 10.17709/2409-2231-2015-4.
- Gill R.S., Al-Adra D.P., Nagendran J., Campbell S., Shi X., Haase E., Schiller D. Treatment of gastric cancer with peritoneal carci-nomatosis by cytoreductive surgery and HIPEC: a systematic review of survival, mortality, and morbidity. J Surg Oncol. 2011 Nov 1; 104(6): 6928. doi: 10.1002/jso.22017.
- Chia C.S., You B., Decullier E., Vaudoyer D., Lorimier G., Ab-boudK., Bereder J.M., Arvieux C., Boschetti G., Glehen O.; BIG RENAPE Group. Patients with Peritoneal Carcinomatosis from Gastric Cancer Treated with Cytoreductive Surgery and Hyperthermic Intraperitoneal Chemotherapy: Is Cure a Possibility? Ann Surg Oncol. 2016 Jun; 23(6): 1971-9. doi: 10.1245/s10434-015-5081-3.
- Solass W., Kerb R., Mürdter T., Giger-Pabst U., Strumberg D., Tempfer C., Zieren J., Schwab M., Reymond M.A. Intraperitoneal chemotherapy of peritoneal carcinomatosis using pressurized aerosol as an alternative to liquid solution: first evidence for efficacy. Ann Surg Oncol. 2014 Feb; 21(2): 553-9. doi: 10.1245/s10434-013-3213-1.
- Reymond M.A., Hu B., Garcia A., Reck T., Köckerling F., Hess J., Morel P. Feasibility of therapeutic pneumoperitoneum in a large animal model using a microvaporisator. Surg Endosc. 2000 Jan; 14(1): 515. doi: 10.1007/s004649900010.
- Solaß W., HetzelA., Nadiradze G., Sagynaliev E., ReymondM.A. Description of a novel approach for intraperitoneal drug delivery and the related device. Surg Endosc. 2012 Jul; 26(7): 1849-55. doi: 10.1007/ s00464-012-2148-0.
- Eveno C., Haidara A., Ali I., Pimpie C., Mirshahi M., PocardM. Experimental pharmacokinetics evaluation of chemotherapy delivery by PIPAC for colon cancer: first evidence for efficacy. Pleura Peritoneum. 2017 Jun 1; 2(2): 103-109. doi: 10.1515/pp-2017-0015.
- Nadiradze G., Giger-Pabst U., Zieren J., StrumbergD., Solass W., Reymond M.A. Pressurized Intraperitoneal Aerosol Chemotherapy (PIPAC) with Low-Dose Cisplatin and Doxorubicin in Gastric Peritoneal Metastasis. J Gastrointest Surg. 2016 Feb; 20(2): 367-73. doi: 10.1007/ s11605-015-2995-9.
- Каприн А.Д., Хомяков В.М., Рябов А.Б., Болотина Л.В., Иванов А.В., Уткина А.Б., Волченко Н.Н. Внутрибрюшная аэрозольная химиотерапия под давлением (ВАХД) в сочетании с системной химиотерапией у больных раком желудка с перитонеальной диссемина-цией. Фарматека. 2016; 330(17): 59-65. [KaprinA.D., Khomyakov V.M., Ryabov A.B., Bolotina L.V., Ivanov A.V., Utkina A.B., Volchenko N.N. Pressurized intraperitoneal aerosol chemotherapy (PIAC) in combination with systemic chemotherapy for stomach cancer patients with peritoneal dissemination. Pharmateca. 2016; 330(17): 59-65. (in Russian)].
- Jacquet P., Sugarbaker P.H. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat Res. 1996; 82: 359-74. doi: 10.1007/978-1-4613-1247-5_23.
- Alberto M, Brandl A., Garg P.K., Gul-Klein S., Dahlmann M., Stein U., Rau B. Pressurized intraperitoneal aerosol chemotherapy and its effect on gastric-cancer-derived peritoneal metastases: an overview. Clin Exp Metastasis. 2019 Feb; 36(1): 1-14. doi: 10.1007/s10585-019-09955-4.


