Внутриклеточный кальций и цАМФ опосредуют кардиотропные эффекты агонистов опиоидных рецепторов
Автор: Лишманов Ю.Б., Маслов Л.Н., Ласукова Т.В., Горбунов А.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1-1 т.26, 2011 года.
Бесплатный доступ
Цель работы: исследовать эффект активации 1- и 1-опиоидных рецепторов на устойчивость изолированного перфузируемого сердца крыс к глобальной ишемии и реперфузии. Эксперименты проведены на изолированном перфузируемом сердце крыс. Результаты показали, что стимуляция кардиальных 1- и 1-опиоидных рецепторов с помощью соответствующих агонистов DPDPE и U-50,488 способствует уменьшению реперфузионного выброса креатинкиназы из сердца по сравнению с контрольной группой. Оба препарата оказывали отрицательный хронотропный и инотропный эффекты в период, предшествующий ишемии, и в реперфузионный период. Оккупация 1-опиоидных рецепторов пептидом DPDPE не изменяла уровень цАМФ в сердце до и после ишемии. Активация 1-опиоидных рецепторов препаратом U-50.488 не влияла на уровень цАМФ в миокарде до ишемии, но уменьшала содержание цАМФ в реперфузионном периоде по сравнению с контролем. Предварительное введение ингибитора Ca2+&АТФазы саркоплазматического ретикулума циклопиазоновой кислоты устраняло кардиопротекторный эффект 1-агониста. Кардиопротекторный эффект стимуляции 1-опиоидных рецепторов зависит от снижения уровня цАМФ в сердце, а Ca2+-АТФаза саркоплазматического ретикулума участвует в проявлении кардиопротекторного эффекта активации 1-опиоидных рецепторов.
Опиоидные рецепторы, изолированное сердце, ишемия, реперфузия
Короткий адрес: https://sciup.org/14919361
IDR: 14919361 | УДК: 616.001.16-092.19
Текст научной статьи Внутриклеточный кальций и цАМФ опосредуют кардиотропные эффекты агонистов опиоидных рецепторов
Интерес исследователей к участию опиоидных рецепторов (ОР) в формировании устойчивости миокарда к действию ишемии и реперфузии в последние годы значительно возрос. Доминирующими типами ОР в миокарде являются δ- и κ-рецепторы [19], которые, в свою очередь, подразделяются на соответствующие субтипы: δ1 и δ2, κ1 и κ2[6, 23]. Однако значение этих рецепторов и внутриклеточные сигнальные системы, опосредующие их влияние на регуляцию сердечной деятельности в норме и при ишемии-реперфузии, окончательно не определены. Данные одних авторов свидетельствуют об участии опиоидов в регуляции сократительной функции миокарда [8, 20], а результаты других указывают на отсутствие инотропных эффектов после активации ОР [3]. Нет однозначного мнения и о том, как влияет стимуляция δ- и κ-ре-цепторов на насосную функцию сердца в условиях возобновления коронарной перфузии. Нет полной яснос- ти и относительно роли названных рецепторов в формировании устойчивости миокарда к действию ишемии и реперфузии. Имеются лишь отдельные публикации о том, что после предварительной активации δ- и κ-ОР замедляется формирование необратимых повреждений кардиомиоцитов в условиях коронароокклюзии in vivo [16,17]. Вместе с тем, по данным других авторов [3], κ-агонист бремазоцин, напротив, усугубляет ишемические и реперфузионные повреждения сердца.
Внутриклеточные механизмы, реализующие кардио-тропные эффекты опиоидов, изучены также недостаточно. Известно, что активация ОР может приводить к снижению образования цАМФ в сердце и интактных кардиомиоцитах [22]. Именно с этим феноменом некоторые авторы связывают кардиопротекторное действие, оказываемое опиоидами в условиях ишемии-реперфузии сердца [1, 3]. В свою очередь, циклический АМФ играет важную роль в регуляции транспорта Са2+ в клетках сердца [14]. Известно, что избыточное увеличение концентрации этого катиона в миоплазме во время ишемии служит одной из причин развития необратимых повреждений кардиомиоцитов [11]. Согласно данным К. Вентура с соавт. [20], δ- и κ-ОР участвуют в регуляции транспорта кальция в кардиомиоцитах на уровне саркоплазматического ретикулума. Однако исследований кальцийрегулирующей роли опиоидных рецепторов в условиях ишемии-реперфузии миокарда до сих пор никем не проводилось.
Настоящая работа посвящена исследованию роли δ 1- и κ 1-опиоидных рецепторов в регуляции устойчивости сердца к действию ишемии-реперфузии; оценке вклада цАМФ и внутриклеточного Ca2+ в реализацию кардио-тропных эффектов агонистов этих рецепторов.
Материал и методы
Эксперименты проведены на изолированных перфузируемых по Лангендорфу сердцах крыс-самцов линии Вистар массой 250–300 г. Животные содержались в стандартных условиях вивария. Тотальную нормотермическую ишемию миокарда моделировали посредством полного прекращения подачи перфузионного раствора на 45 мин, возобновляли коронарную перфузию и продолжали наблюдение в течение 30 мин.
В ходе опыта регистрировали частоту сердечных сокращений (ЧСС, уд./мин), давление, развиваемое левым желудочком (ДРЛЖ, мм рт. ст.), конечное диастолическое давление (КДД, мм рт. ст.). Степень повреждения кардиомиоцитов оценивали по уровню креатинфосфокиназы (КФК) в объеме раствора, прошедшем через сердце за период реперфузии. Активность КФК определяли с помощью энзиматических наборов “CK-NAc” компании Biocon Diagnostik (Vohl/Marienhagen, Германия). Конечный результат выражали в мкмоль NADH/мин в пересчете на 1 г ткани сердца за 30 мин реперфузии (U/г).
Для активации ОР по окончании 20-минутной адаптации сердца к условиям нормоксической перфузии и за 20 мин до моделирования ишемии в раствор Кребса–Хен-зелайта добавляли один из агонистов ОР в конечной концентрации 0,1 мкМ/л. После 10-минутной перфузии с препаратом сердце “отмывали” от лиганда в течение еще 10 мин. Стимуляцию δ 1-ОР проводили с помощью селективного δ 1-агониста H-Tyr-D-Pen-Gly-Phe-D-Pen-OH (DPDPE) [6], активацию κ 1-ОР селективным κ 1-агонистом trans(±)-3,4-Dichloro-N-methyl-N-[2-(1-pyrrolidinyl) cyclohexyl] benzeneacetamide HCl (U-50.488) [10]. Опиоиды растворяли в физиологическом растворе перед началом опыта.
Для изучения процессов внутриклеточного транспорта Са2+ была проведена отдельная серия экспериментов с ингибитором Са2+-АТФ-азы саркоплазматического ретикулума (СПР) циклопиазоновой кислотой в конечной концентрации 100 нМ [5]. Эксперименты проводили по вышеизложенной схеме. Контролем служили изолированные сердца, которые после 40-минутного стабилизационного периода подвергали тотальной ишемии (45 мин) с последующей реперфузией (30 мин).
Содержание циклического АМФ в ткани миокарда оп- ределяли с помощью стандартных коммерческих радиоиммунных наборов “RIA AMPc/cAMP” (компания “Immunotech”, Марсель, Франция). Результаты всех проведенных экспериментов обработаны статистически с применением критерия Манна–Уитни.
Результаты
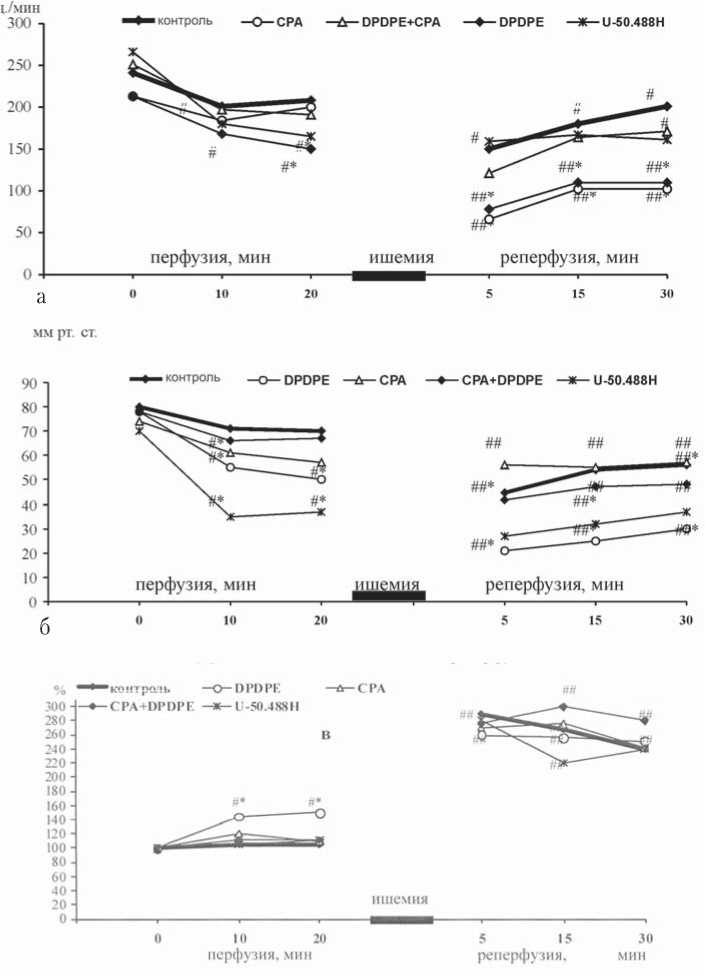
В контрольной группе тотальная ишемия приводила к полной остановке сердца, а возобновление коронарной перфузии сопровождалось неполным восстановлением его насосной функции и повреждением кардиомиоцитов. Значения силы и частоты сердечных сокращений во время реперфузии были ниже исходных на 50% и 60% соответственно, а конечное диастолическое давление возросло почти в 3 раза по сравнению с доишеми-ческим уровнем (рис. 1). До ишемии выход КФК из миокарда составлял в среднем 5,5 U/г, а после реперфузии этот показатель увеличился в 4 раза (22,5 U/г).
Было установлено, что активация δ 1- и k1-опиоидных рецепторов снижает частоту и силу сердечных сокращений в доишемическом периоде. Так, ДРЛЖ через 10 мин после введения в перфузат d1-агониста DPDPE достоверно уменьшалось на 40%, КДД возрастало на 50% по сравнению с исходным уровнем (рис. 1 б, в). Через 10 мин от начала перфузии интактных сердец раствором Кребса– Хензелайта, содержащим κ 1-агонист U-50.488H, отмечалось уменьшение ЧСС (на 33%) и ДРЛЖ – на 47% по сравнению с исходным уровнем (рис. 1 а, б). Статистически значимых изменений КДД после стимуляции κ 1-рецеп-торов мы не отметили (рис. 1 в).
После применения агонистов δ 1- и κ 1-ОР (DPDPE и U-50.488) содержание цАМФ, измеренное в ткани сердца через 10 мин перфузии, не отличалось от показателей контрольной группы (рис. 2а).
Активация δ 1- и κ 1-опиоидных рецепторов сопровождалась усилением реперфузионной сократительной дисфункции сердца. После стимуляции δ 1-ОР частота и сила сокращений в реперфузионном периоде были примерно в 2 раза ниже соответствующих контрольных величин (рис. 1 а, б). При этом средние значения КДД статистически достоверно не отличались от соответствующих величин в контрольной группе, превышающих исходные показатели в 2,5 раза (рис. 1 в). Активация κ 1-ОР с помощью U-50.488 также вызывала стойкое снижение ЧСС в постишемическом периоде на 27% от значений в контрольной группе. Применение κ 1-агониста приводило к уменьшению ДРЛЖ (рис. 1). Постишемического увеличения КДД по сравнению с контролем не наблюдалось.
Воздействие ишемии и реперфузии на сердца крыс контрольной группы сопровождалось развитием необратимых повреждений кардиомиоцитов, о чем косвенно свидетельствовало 4-кратное (по отношению к доише-мическому уровню) увеличение активности креатинки-назы в растворе, оттекающем от сердца во время реперфузии (рис. 2 б). После стимуляции δ 1- или κ 1-ОР степень ишемического и реперфузионного повреждения миокарда существенно снижалась.
Доказательством тому послужило снижение реперфузионного выброса креатинкиназы в оттекающий от сер-
KOIII рои.
ГРА+DPDPE
в
Рис. 1. Влияние агонистов δ 1- и k1-опиоидных рецепторов DPDPE и U-50.488 на частоту сердечных сокращений (а), давление, развиваемое левым желудочком (б) и конечное диастолическое давление, выраженное в % от исходных показателей (в). СРА – циклопиазоно-вая кислота. Достоверные отличия от контроля: * – р<0,05; отличия от значений до ишемии: # – р<0,05; ## – р<0,01
текторный эффект δ 1-агониста DPDPE (рис. 2 б). Использование одной циклопиазоновой кислоты не влияло на уровень КФК, КДД, ЧСС, но вызывало снижение ДЛРЖ на 24% по сравнению с контролем в доишемическом периоде.
Обсуждение
Полученные данные свидетельствуют о том, что повышение устойчивости сердца к повреждающему действию ишемии-реперфузии связано с активацией δ1- и κ1-ОР. На это указывает уменьшение реперфузионного выброса креатинкиназы, обнаруженное после активации названных рецепторов. Как известно, при необратимых повреждениях мембран кардиомиоцитов некоторые внутриклеточные энзимы поступают в кровь или раствор, которым перфузируют изолированное сердце [9]. При этом гиперфер-ментемия обычно тесно коррелирует с размерами некротического поражения миокарда [9], поэтому снижение реперфузионного выброса КФК в ответ на активацию ОР является косвенным показателем уменьшения количества необратимо поврежденных кардиомиоцитов. Близкие по значению результаты были получены и в работах других исследователей. Так, в экспериментах in vivo было установлено, что внутривенное введение селективных κ-агонистов способствует ограничению зоны реперфузионного некроза миокарда у крыс [16], а стимуляция κ-рецепторов на мембранах изолированных кардиомиоцитов сопровождается сни- дца раствор, на 32 и 48% соответственно по сравнению с контролем (рис. 2 б).
На 30-й мин реперфузии содержание цАМФ в миокарде снижалось в 2 раза в ответ на стимуляцию κ 1-ОР и не изменялось после использования δ 1-агониста (рис. 2 а).
Мы предположили, что кардиопротекторное действие δ1-агониста связано с изменением транспорта кальция в миоплазму из СПР, и провели эксперименты с циклопиа-зоновой кислотой (блокатором Са2+-АТФ-азы СПР). Применение названного ингибитора устраняло кардиопро- жением степени повреждения последних при аноксии-реоксигенации [21]. В то же время в экспериментах на изолированных перфузируемых сердцах крыс показано, что κ2-агонист бремазоцин вызывает увеличение размеров зоны некроза сердечной мышцы [3]. Следует заметить, что авторы, применявшие κ1-агонисты, обнаружили повышение устойчивости сердца действию ишемии-реперфузии [16, 17], а исследователи, использовавшие in vitro κ2-агонист бремазоцин, наблюдали усиление ишемического и реперфузионного повреждения сердца [3]. Возможно, противоречия обусловлены существованием
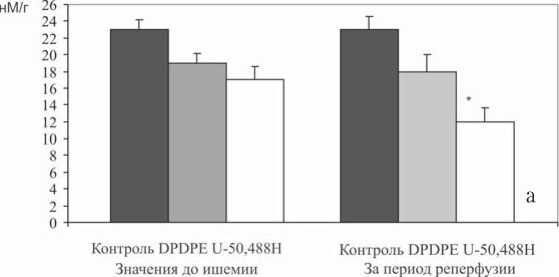
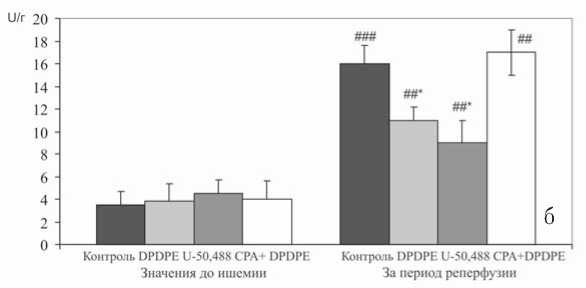
Рис. 2. Уровень цАМФ в миокарде после предварительной стимуляции κ 1- и δ 1-опиоидных рецепторов с помощью U-50.488 и DPDPE (а); активность креатинфосфокиназы в перфузионном растворе после предварительной стимуляции κ 1- и д1-опиоидных рецепторов с помощью U-50.488H и DPDPE (б). Статистически значимые отличия от контроля: * – р<0,05; отличия от значений до ишемии: # – р<0,05; ## – р<0,01
на мембранах кардиомиоцитов двух субтипов κ -опиоид-ных рецепторов ( κ 1 и κ 2) [23]. Мы обнаружили цитопро-текторный эффект κ 1-агониста U-50.488H в концентрации 0,1 мкМ, обеспечивающей взаимодействие этого лиганда только с κ 1-ОР [7]. Приняв во внимание данные об ингибирующем эффекте κ -агонистов на активность аде-нилатциклазы [22] и, соответственно, на синтез цАМФ, мы предположили, что в реализации кардиопротекторного эффекта U-50.488H определяющую роль играет снижение образования цАМФ в миокарде во время ишемии и реперфузии.
Механизм защитного действия κ1-агониста представляется следующим. Известно, что один из основных способов повышения выживаемости клеток сердца при ишемии заключается в уменьшении потребности миокарда в кислороде [15]. Имеются данные о прямом стимулирующем действии цАМФ на активность ферментов митохондрий: сукцинатдегидрогеназы и НАД(Ф)+-трансгидроге-назы [2]. Исходя из известного постулата об увеличении утилизации кислорода в процессе окислительного фосфорилирования, логично предположить, что обнаруженное нами κ1-опиоидергическое снижение образования цАМФ во время ишемии и реперфузии будет способствовать уменьшению потребности миокарда в кислороде и, в конечном итоге, приведет к замедлению формирования необратимых повреждений кардиомиоцитов [15]. Следовательно, кардиопротекторный эффект U-50.488H опосредуется через уменьшение уровня цАМФ.
Однако мы не обнаружили существенного влияния d1-агониста на содержание цАМФ в миокарде. Следовательно, цитопротектор-ный эффект, наблюдаемый после активации кардиальных δ 1-ОР, не связан с изменением внутриклеточного уровня цАМФ. Мы предположили, что эффект обусловлен опиоидерги-ческим изменением транспорта кальция в клетке. В пользу этого предположения говорит тот факт, что DPDPE в период, предшествующий ишемии, вызывал подъем КДД. Такое изменение диастолической функции сердца принято связывать с увеличением концентрации ионов кальция [Ca2+]i в цитоплазме. Известно, что стимуляция опиоидных рецепторов способствует усиленной мобилизации Ca2+ из саркоплазматического ретикулума [20]. Однако чрезмерное увеличение концентрации Ca2+ в цитоплазме должно было бы повлечь за собой повреждение кардиомиоцитов в период ишемии-реперфузии по механизму, напоминающему “кальциевый парадокс” [13], чего мы не наблюдали. Напротив, в условиях стимуляции δ 1-ОР происходило повышение толерантности сердца к действию ишемии-реперфузии.
Можно предположить два возможных объяснения данному феномену. Первое заключается в том, что стимуляция ОР способствует усиленной мобилизации Ca2+ из саркоплазматического ретикулума [20] с после дующим истощением запасов Ca2+СПР в доишемическом периоде. Подобные изменения кальциевого гомеостаза могут, в принципе, предупреждать Са2+-перегрузку кардиомиоцитов во время ишемии и реперфузии [5, 18], а, следовательно, повышать устойчивость сердца к гипоксии и реоксигенации. В основе другого δ1-опиоидерги-ческого механизма может лежать активация протеинки-назы С, которая катализирует фосфорилирование ряда белков, обеспечивающих повышение устойчивости сердца к ишемии и реперфузии [4]. В свою очередь, повышение активности названного фермента может происходить в ответ на кратковременный подъем [Ca2+]i [12]. Мы установили, что ингибирование Са2+-АТФ-азы СПР циклопи-азоновой кислотой устраняет как подъем КДД в ответ на стимуляцию δ1-ОР, так и кардиопротекторный эффект DPDPE. Между тем известно, что циклопиазоновая кислота способствует истощению запасов Са2+ в саркоплазматическом ретикулуме [5] с последующим уменьшением [Ca2+]i а мы наблюдали снижение амплитуды сокращений серд, ца в ответ на добавление в перфузат названной кислоты, что можно объяснить уменьшением выброса кальция из СПР. Следовательно, в механизме δ1-рецептор-обусловленной кардиопротекции определяющая роль принадлежит изменению транспорта Са2+ на уровне СПР.
Таким образом, полученные результаты доказывают участие кардиальных δ1- и κ1-опиоидных рецепторов в формировании устойчивости миокарда к повреждающе- му действию ишемии и реперфузии. Кардиопротектор-ное действие U-50.488H связано со снижением уровня цАМФ в миокарде, а аналогичный эффект DPDPE опосредован опиоидергическим изменением транспорта кальция на уровне саркоплазматического ретикулума. Стимуляция δ1- и κ1-рецепторов способствует снижению сократимости изолированного сердца в условиях нормальной оксигенации и усугубляет нарушение систолической функции миокарда при возобновлении коронарной перфузии.
Материалы статьи подготовлены при поддержке грантов Министерства образования и науки (2.1.1/530 и 2.1.1/ 211), РФФИ (грант 10-04-00288-а) и Федерального агентства по науке и инновациям.
Список литературы Внутриклеточный кальций и цАМФ опосредуют кардиотропные эффекты агонистов опиоидных рецепторов
- Ласукова Т.В., Маслов Л.Н. Опиоидные рецепторы и устойчивость сердца к патогенным воздействиям//Сибирский медицинский журнал (Томск). -2007. -Т. 22, № 3. -С. 46-50.
- Медведев А.Е., Кунцевич А.К., Труфанова Л.В. О возможном участии протеинкиназы А в цАМФ-зависимой активации окислительных ферментов митохондрий//Сб. науч. тр. Красноярского мед. ин&та. -Красноярск, 1983. -С. 32-36.
- Aitchison K.A., Baxter G.F., Awan M.M. et al. Opposing effects on infarction of delta and kappa opioid receptor activation in the isolated rat heart: implications for ischemic preconditioning//Basic Res. Cardiol. -2000. -Vol. 95. -P. 1-10.
- Clement O., Puceat M., Walsh M.P. et al. Protein kinase C enhances myosin light&chain kinase effects on force development and ATPase activity in rat single skinned cardiac cells//Biochem. J. -1992. -Vol. 285. -P. 311-317.
- Du Toit E.F., Opie L.H. Antiarrhythmic properties of specific inhibitors of sarcoplasmic reticulum calcium ATPase in the isolated perfused rat heart after coronary artery ligation//J.Am. Coll. Cardiol. -1994. -Vol. 23. -P. 1505-1510.
- International union of pharmacology. XII. Classification of opioid receptors/B.N. Dhawan, F. Cesselin, R. Raghubir et al.//Pharmacol. Rev. -1996. -Vol. 48(4). -P. 567-592.
- Ela C., Barg J., Vogel Z. et al. Distinct components of morphine effects on cardiac myocytes are mediated by the kappa and delta opioid receptors//J. Mol. Cell. Cardiol. -1997. -Vol. 29. -P. 711-720.
- Fujita S., Smart S.C., Stowe D.F. Enhanced contractile responsiveness to cytosolic Ca2+ by delta&2 opioid agonist deltorphin in intact guinea pig hearts//J. Mol. Cell. Cardiol. -2000. -Vol. 32(9). -P. 1647-1659.
- Karck M., Tanaka S., Bolling S.F. et al. Myocardial protection by ischemic preconditioning and &opioid receptor activation in the isolated working rat heart//J. Thorac. Cardiovasc. Surg. -2001. -Vol. 122. -P. 986-992.
- Lahti R.A., Mickelson M.M., McCall J.M. et al. [3H]U-69593 a highly selective ligand for the opioid к receptor//Eur. J. Pharmacol. -1985. -Vol. 109. -P. 281-284.
- Lubbe W.F., Podzuweit T., Opie L.H. Potential arrhythmogenic role of cyclic adenosine monophsphate (AMP) and cytosolic calcium overload: Implications for prophilactic effects of beta& blockers in myocardial infarction and proarrhythmic effects of phosphodiesterase inhibitors//J. Am. Coll. Cardiol. -1992. -Vol. 19(7). -P. 1622-1633.
- Miyawaki H., Ashraf M. Ca2+ as a mediator of ischemic preconditioning//Circ. Res. -1997. -Vol. 80. -P. 790-799.
- Opie L.H. Calcium channel blockers and preconditioning//J. Mol. Cell. Cardiol. -2000. -Vol. 32(5). -P. 859-860.
- Osnes J.B., Skomedal T., Oye I. On the role of cyclic nucleotides in the heart muscle contraction and relaxation//Progr. Pharmacol. -1980. -Vol. 4. -P. 47-62.
- Ostadal B., Kolar F. Cardiac Ischemia: From Injury to Protection. -Boston; Dordrecht; London: Kluwer Academic Publishers. -1999. -173 p.
- Peart J.N., Gross E.R., Gross G.J. Effect of exogenous kappa-opioid receptor activation in rat model of myocardial infarction//J. Cardiovasc. Pharmacol. -2004. -Vol. 43(3). -P. 410-415.
- Schultz J.El.J., Hsu A.K., Nagase H. et al. TAN&67, a 1-opioid receptor agonist, reduces infarct size via activation of Gi/o proteins and KATP channels//Am. J. Physiol. -1998. -Vol. 274(3). -P. H909-H914.
- Steenbergen C., Murphy E., Levy L. et al. Elevation in cytosolic free calcium concentration early in myocardial ischemia in perfused rat heart//Circ. Res. -1987. -Vol. 60. -P. 700-707.
- Tai K.K., Jin W.Q., Chan T.K.Y. et al. Characterization of [3H]U69593 binding sites in the rat heart by receptor binding assays//J. Mol. Cell. Cardiol. -1991. -Vol. 23. -P. 1297-1302.
- Ventura C., Spurgeon H.A., Lakatta E.G. et al. and opioid receptor stimulation affects cardiac myocyte function and Ca2+ release from an intacellular pool in myocytes and neurons//Circ. Res. -1992. -Vol. 70. -P. 66-81.
- Wu S., Li H.Y., Wong T.M. Cardioprotection of preconditioning by metabolic inhibition in the rat ventricular myocyte. Involvement of kappa-opioid receptor//Circ. Res. -1999. -Vol. 84. -P. 1388-1395.
- Yu X.C., Wang H.X., Pei J.M. et al. Anti&arrhythmic effect of -opioid receptor stimulation in the perfused rat heart: involvement of a cAMP&dependent pathway//J. Mol. Cell. Cardiol. -1999. -Vol. 31. -P. 1809-1819.
- Zhang W&M., Jin W.&M., Wong T.M. Multiplicity of kappa opioid receptor binding in the rat cardiac sarcolemma//J. Mol. Cell. Cardiol. -1996. -Vol. 28. -P. 1547-1554.


