Внутриопухолевая морфологическая и молекулярно-генетическая гетерогенность в астроцитомах разной степени злокачественности в материале от первой операции
Автор: Мацко Дмитрий Евгеньевич, Мацко Марина Витальевна, Бакшеева Анастасия Олеговна, Имянитов Евгений Наумович, Улитин Алексей Юрьевич, Моисеенко Владимир Михайлович, Шелехова Ксения Владимировна, Волков Никита Михайлович, Иевлева Аглая Геннадиевна, Тюрин Владислав Ильич, Скляр Софья Сергеевна, Зрелов Андрей Андреевич, Морозова Анастасия Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.20, 2021 года.
Бесплатный доступ
Введение. Внутриопухолевая гетерогенность является одним из ключевых факторов неблагоприятного прогноза в лечении пациентов со всеми онкологическими заболеваниями. Астроцитарные новообразования неизбежно рецидивируют с приобретением резистентности к дальнейшей терапии. Одна из возможных причин - это гетерогенность опухоли. Цель исследования - определить наличие морфологической и молекулярно-генетической гетерогенности в первичной глиобластоме, анапластической астроцитоме и диффузной астроцитоме. Материал и методы. Проведено проспективное исследование с анализом морфологических (n=22) и молекулярно-генетических характеристик (n=8) впервые прооперированных пациентов с глиобластомой GiV (ГБ), анапластической астроцитомой Giii (АА) и диффузной астроцитомой Gii (ДА) в возрасте от 18 лет и старше. Забор образцов опухолевой ткани производился из 5 равноудаленных точек одного опухолевого узла при субтотальном и близко к тотальному удалении. Были получены 110 фрагментов опухолевой ткани. Гистологический диагноз ставился в каждом образце опухоли согласно классификации ВОЗ опухолей ЦНС (2007/2016). Относительная экспрессия мРНК генов: MGMT, C-kit, TOP2a, PDGFR-a, ERCC1, VEGF и мутации в генах IDH1
Глиобластома, анапластическая астроцитома, внутриопухолевая гетерогенность, морфологическая гетерогенность, молекулярно-генетическая гетерогенность, экспрессия генов, мутации в генах idh1 и idh2
Короткий адрес: https://sciup.org/140261352
IDR: 140261352 | УДК: 616-006.484-091.8:577.21 | DOI: 10.21294/1814-4861-2021-20-6-55-68
Текст научной статьи Внутриопухолевая морфологическая и молекулярно-генетическая гетерогенность в астроцитомах разной степени злокачественности в материале от первой операции
История изучения астроцитарных опухолей уходит корнями в середину XIX века, когда Р. Вирхов в 1864 г. впервые представил их макроскопическое описание [1]. Свое название «глиомы» эти опухоли получили за структурное сходство с глией. Сам термин «глиобластома» впервые был введен Strauss и Globus в 1918 г. [2]. Авторы связывали название глиобластомы с недифференцированными «клетками-глиобластами», из которых она состояла. Впервые на полиморфность строения «глиоматозных» опухолей обратил внимание В.В. Веденгаммер [3]. Морфологической вну-триопухолевой гетерогенности посвятил несколько своих работ Л.И. Смирнов, в них он отметил наличие не просто фенотипически отличных клеток в опухоли, но и участков разной степени зрелости [4, 5]. На многообразие клеточного состава и присутствие в опухоли компонентов разных тканевых элементов указывали и отечественные, и зарубежные исследователи первой половины ХХ века, ещё задолго до того, как появились первые предположения о влиянии гетерогенности на резистентность опухоли к проводимой адъювантной терапии [4, 6–9]. В настоящее время научный интерес смещается от изучения фенотипических особенностей к познанию генетической гетерогенности злокачественных астроцитом.
Последние годы ознаменовались активным развитием молекулярной биологии, усовершенствованием стандартов лечения, диагностики и динамического наблюдения за пациентами, однако продолжительность жизни по-прежнему остается невысокой. Показатели 5-летней выживаемости больных диффузной астроцитомой GII (ДА) составляют 50,1 %, анапластической астроцитомой GIII (АА) – 29,8 %, первичной глиобластомой GIV (ГБ) – 5,5 %. Работы, посвященные молекулярной генетике, пролили свет на патогенетические механизмы возникновения этих новообразований, а также выявили предиктивные и прогностические биомаркеры, имеющие существенное клиническое значение [10–16].
Согласно данным немногочисленных исследований, ключевыми причинами развития рецидива заболевания рассматриваются наличие гетерогенности в опухоли, нарушение работы систем репарации ДНК и присутствие плюрипотентных стволовых опухолевых клеток с заведомо неизвестной их дифференцировкой в процессе эволюции самой опухоли. Именно поэтому интерес к морфологической и молекулярно-генетической гетерогенности в опухоли только растет [17–19]. Однако обнаружить морфологическую гетерогенность опухоли можно лишь при исследовании интраоперационного материала, полученного из нескольких точек опухолевого узла. В зарубежных работах, посвященных данной проблеме, оптимальное число исследуемых образцов опухолевой ткани составляет от трех до шести [20, 21].
Цель исследования – определить наличие морфологической и молекулярно-генетической гетерогенности в первичной глиобластоме, анапластической астроцитоме и диффузной астроцитоме.
Материал и методы
Проведено проспективное исследование 22 больных в возрасте 18 лет и старше с впервые диагностированной нейроэпителиальной опухолью супратенториальной локализации, в том числе 8 мужчин. Всеми пациентами подписано информированное согласие на участие в данном исследовании, одобренном этическим комитетом.
Пациентам было выполнено хирургическое удаление опухоли со степенью циторедукции от субтотального до практически тотального удаления, которые оценивались посредством интраоперационной УЗ-навигации и МРТ с контрастным усилением в раннем послеоперационном периоде. Под макроскопически тотальным удалением понималась резекция опухоли 95 % и более, под субтотальным – 80–94 %. Интраоперационно проводился забор фрагментов опухолевой ткани из пяти равноудаленных точек с минимальным расстоянием между ними 15 мм под контролем УЗ-навигации и флюоресцентной микроскопии с использованием 5 АLA (рис. 1). Кусочки опухоли помещались в пробирки с 10 % нейтральным формалином с соответствующей их маркировкой по локализации с последующим изготовлением парафиновых блоков по стандартной методике. Гистологический диагноз ставился в соответствии с классификациями ВОЗ опухолей ЦНС (2007/2016) в каждом фрагменте опухолевой ткани. Всем больным выполнялось иммуногистохимическое исследование (ИГХ) c использованием антител GFAP (poly, DakoCytomation) и Ki67 (MIB-1, DakoCytomation), а при необходимости: Syn (27G12, DakoCytomation), NB (NB84A, Leica), CD99 (12E7, DakoCytomation). На первом этапе проводился анализ гистологических препаратов с окрасками: гематоксилин и эозин, Ki-67, GFAP. В части случаев (при наличии примитивного нейроэктодермального компонента в опухоли) составля-
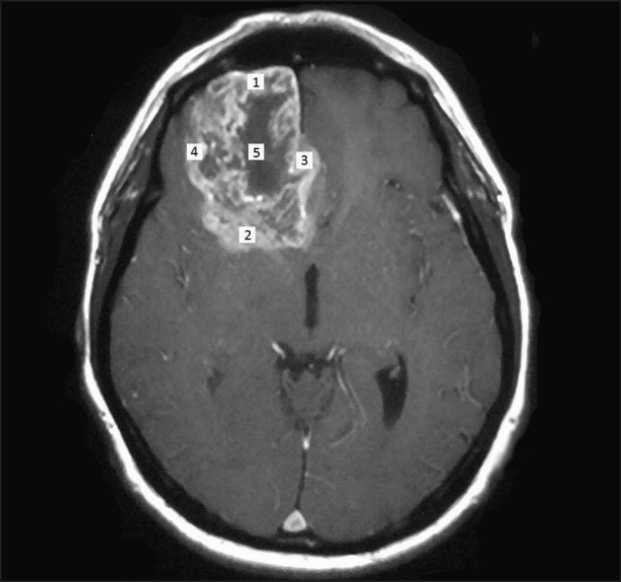
Рис. 1. Точки интраоперационного забора материала для определения внутриопухолевой гетерогенности
Fig. 1. Intraoperative sampling points for determining intratumoral heterogeneity
лась панель для второго этапа ИГХ-исследования с постановкой окончательного диагноза в каждом фрагменте опухолевой ткани. При оценке цитоплазматического окрашивания антителами GFAP, Syn, NB, CD99 пользовались полуколичественным методом: 0 – окрашивание отсутствует, 1+ – слабое окрашивание, 2+ – умеренное окрашивание, 3+ – интенсивное окрашивание. При ядерном окрашивании антителом Ki67 определялся процент окрашенных клеток к их общему числу.
Для молекулярно-генетического исследования с блока производился прицельный забор опухолевых клеток с минимальным объемом информативного
Мутации в генах IDH1 (экзон 4) и IDH2 (экзон 4) в опухолевой ткани детектировали при помощи анализа кривых плавления ПЦР-продуктов с высоким разрешением (HRMA – High Resolution Melting Analysis) с последуюшим секвенированием ДНК.
Результаты
Внутриопухолевая морфологическая гетерогенность была изучена у 22 больных (110 парафиновых блоков) (табл. 1). Первичная ГБ была диагностирована у 16 больных, АА – у 5, и ДА – у одного пациента. В 16 (72,7 %) случаях из 22 была выявлена внутриопухолевая морфологическая гетерогенность. Таким образом, в первичной ГБ она присутствовала в 68,8 % (11/16), в АА – в 80 % (4/5) и в единственном случае ДА. Ровно в половине случаев опухоль была гетерогенна в 3 и более фрагментах из 5 (50 %).
Ниже приводится описание клинического случая (табл. 1, 19) с морфологической гетерогенностью в опухоли (рис. 3–7). Представленный случай имел разнообразную морфологическую картину: «мозг», «диффузная астроцитома GII» и «анапластическая астроцитома GIII». Окончательный диагноз – анапластическая астроцитома GIII.
Внутриопухолевая молекулярно-генетическая гетерогенность была изучена в 8 случаях (2 случая – АА и 6 – ГБ). Всего проанализировали 40 фрагментов опухолевой ткани (по 5 фрагментов из каждого опухолевого узла), из них в 7 не удалось выделить достаточное количество РНК для проведения анализа. Таким образом, молекулярногенетическое исследование удалось выполнить в 33 фрагментах опухолевой ткани, и в каждом определялся уровень экспрессии мРНК генов MGMT, ERCC1, PDGFR-α, VEGF, TOP2A, C-kit и материала 85 %. Относительная экспрессия мРНК генов TP, ERCC1, TOP2A, MGMT, VEGF, C-kit, PDGFR-α определялась при помощи полимеразной цепной реакции (ПЦР) в режиме реального времени на оборудовании CFX96 Real-Time PCR мутации в генах IDH1 и IDH2 (табл. 2).
Изменение уровней экспрессии шести генов изучено в 48 экспрессионных анализах. Уровни экспрессии мРНК большинства генов ( PDGFR-α, VEGF, TOP2A, MGMT ) в разных фрагментах одного
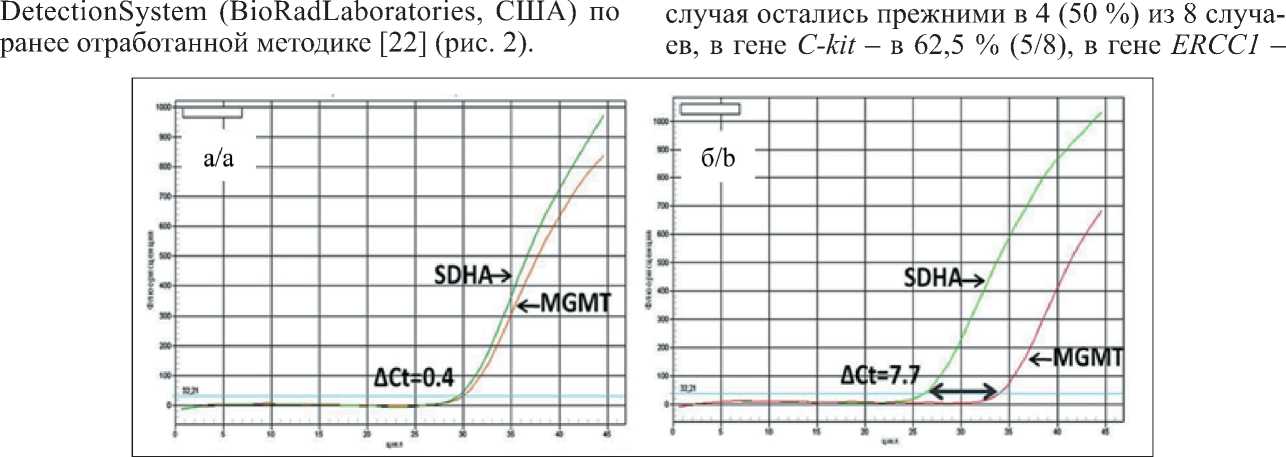
Рис. 2. Метод определения экспрессии мРНК – ПЦР в режиме реального времени. а) высокий уровень экспрессии; б) низкий уровень экспрессии (∆Ct<0,7 – высокий; 0,7<∆Ct< 3 – средний; ∆ Ct=> 3 – низкий)
Fig. 2. A method for determining the expression of mRNA – real time PCR. a – a high level of expression, b – a low level of expression (ΔCt<0,7 – high; 0,7<ΔCt<3 – medium; Δ Ct =>3 – low)
Таблица 1/table 1

-D
I— О О
ф о о. ф I— ф
г*
Ф с Ф ГО 2 ф ф
О
С
Ж S к
ксУ
S
Ы)
о с; о -8-О. О 5
О X О. Н > Z CD
Ъ) о о
О.
О Е о Е э
2 с
3 S
щ

2 о с


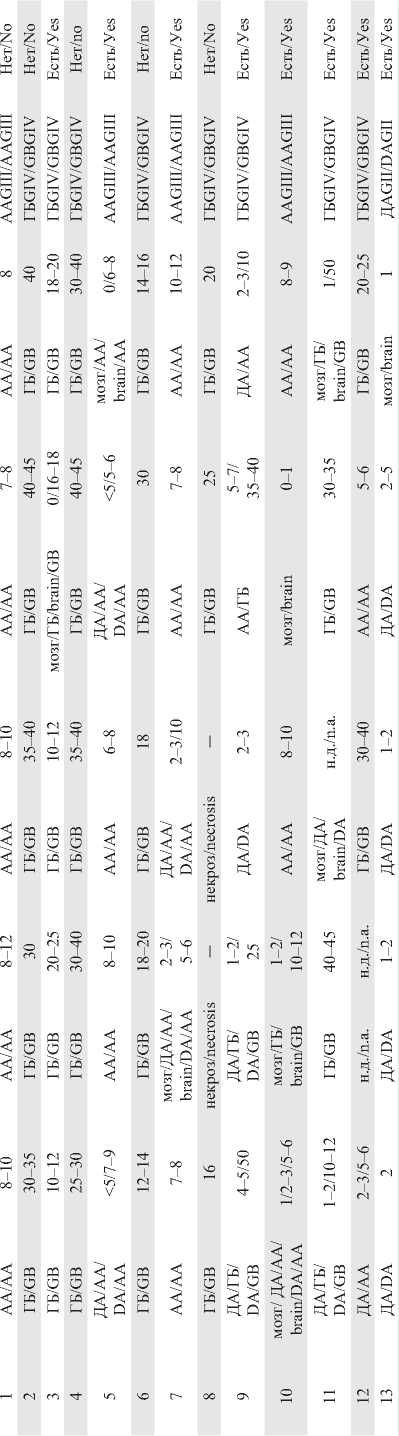
Note: DA – diffuse astrocytoma GII; AA – anaplastic astrocytoma GIII; GB – primary glioblastoma GVI; Ki67 – proliferative index; PNET – primitive neuroectodermal tumor; n.a. – no information available.
в 87,5 % (7/8). Таким образом, в общей сложности уровни экспрессии мРНК всех изучаемых генов отличались в 41,7 % (20/48) (в табл. 2 выделены цветом) и оказались без изменений в 58,3 % случаев.
Генетическая гетерогенность отсутствовала только при определении мутаций в генах IDH1 и IDH2. Мутация была выявлена в гене IDH1 (R132H) в 50 % (4/8) случаев – в двух первичных ГБ и двух АА (табл. 2). В пяти из восьми исследуемых случаев наблюдалась морфологическая гетерогенность в опухоли с разной пролиферативной активностью (Ki67). Отметим, что Ki67 порой существенно отличался в рамках одного случая. Морфологическая гетерогенность отличалась большей частотой, чем молекулярно-генетическая (72,7 % и 41,7 % соответственно).
Обсуждение
Актуальность изучения гетерогенности в первичных опухолях ЦНС с годами усиливается, и связано это в первую очередь с растущей заболеваемостью и неизбежным рецидивированием астроцитом, которые составляют более 50 % от всех нейроэпителиальных опухолей. Внутриопухо-левая гетерогенность злокачественных астроцитом вполне может объяснить наличие первоначальной резистентности опухоли к лечению и развитие рецидива заболевания даже после достижения объ-
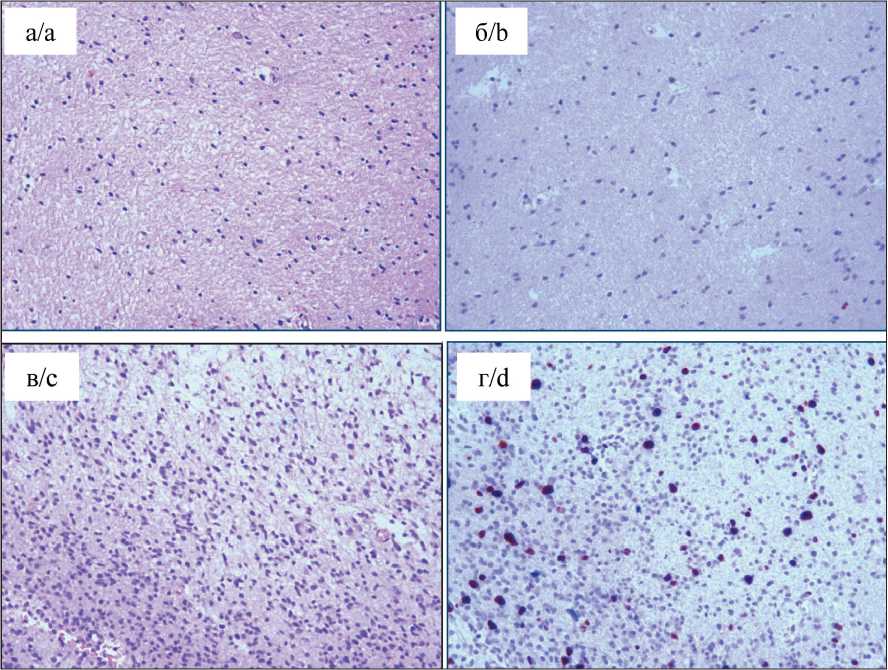
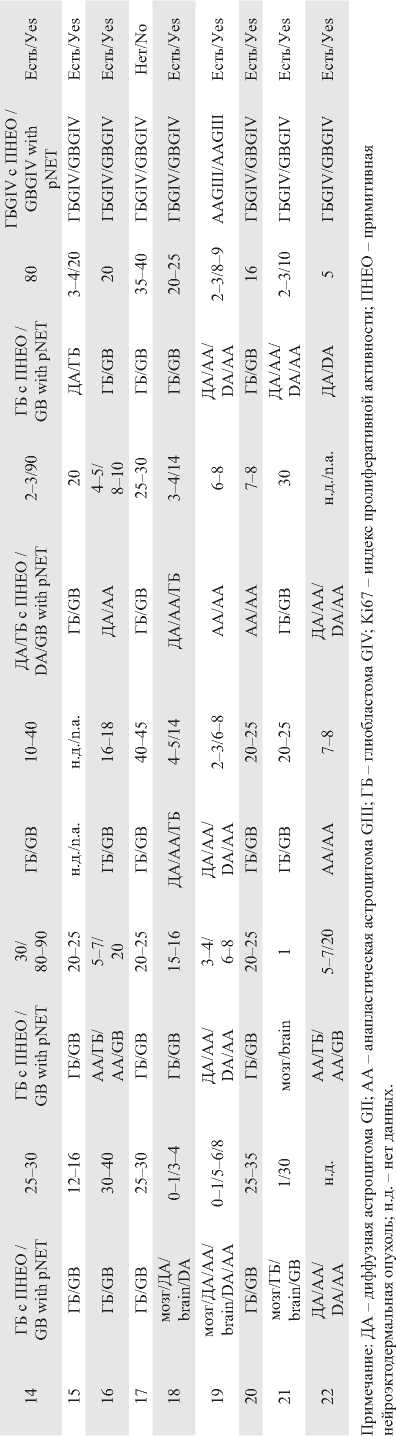
Рис. 3. Морфологическая гетерогенность. Правый полюс: а – мозг; окраска гематоксилином и эозином, ×100;
б – мозг; ИГХ-исследование, ядерное окрашивание антителом Ki67 (0–1 %), ×100; в – фрагмент диффузной астроцитомы GII и анапластической астроцитомы GIII с плотноклеточностью; окраска гематоксилином и эозином, ×100;
г – фрагмент диффузной астроцитомы GII и анапластической астроцитомы GIII; ИГХ-исследование, ядерное окрашивание антителом Ki67 (5–6 %/8 %), ×100 Fig. 3. Morphological heterogeneity. Right pole. a – the brain. Hematoxylin-eosin staining; ×100. b – the brain. Immunohistochemistry, nuclear staining with Ki67 antibody (0–1 %); ×100. с – fragment of diffuse astrocytoma GII and anaplastic astrocytoma GIII with hypercellularity. Hematox-ylin-eosin staining; ×100. d – fragment of diffuse astrocytoma GII and anaplastic astrocytoma GIII. Immunohistochemistry, nuclear staining with Ki67 antibody (5–6 % / 8 %); ×100
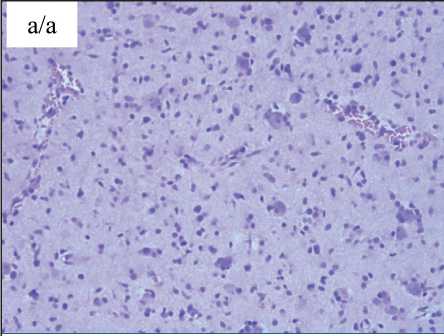
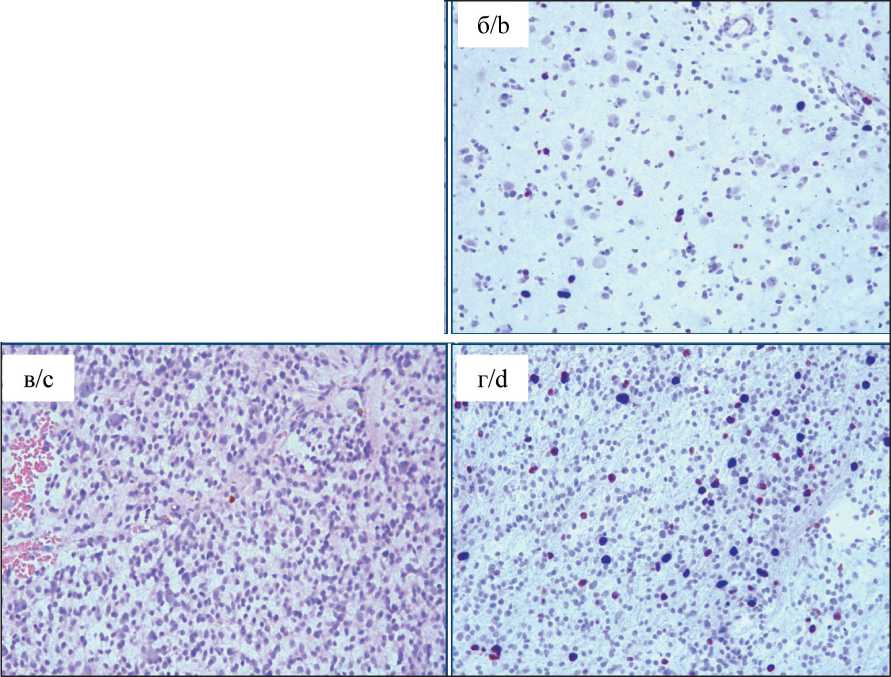
Рис. 4. Морфологическая гетерогенность. Левый полюс: а – диффузная астроцитома GII с явлением нейро-нофагии; окраска гематоксилином и эозином, ×100; б – диффузная астроцитома GII; ИГХ-исследование, ядерное окрашивание антителом Ki67 (3–4 %), ×100; в – анапластическая астроцитома
GIII; плотноклеточность, пролиферация сосудов; окраска гематоксилином и эозином, ×100; г – анапластическая астроцитома GIII; ИГХ-исследование, ядерное окрашивание антителом Ki67 (6–8 %), ×100
Fig. 4. Morphological heterogeneity. Left pole. a – diffuse astrocytoma GII with the phenomenon of neuronophagy; Hema-toxylin-eosin staining; ×100. b – diffuse astrocytoma GII. Immunohistochemistry, nuclear staining with Ki67 antibody (3–4 %); ×100. c – anaplastic astrocytoma GIII. Hypercellularity, vascular proliferation. Hematoxylin-eosin staining; ×100. d – anaplastic astrocytoma GIII. Immunohistochemistry, nuclear staining with Ki67 antibody (6–8 %); ×100
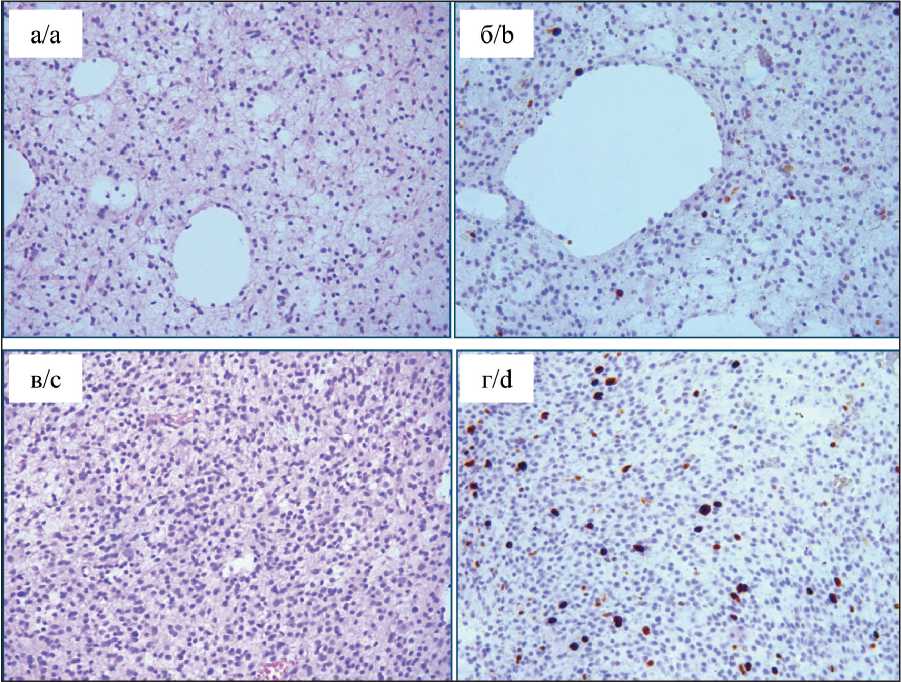
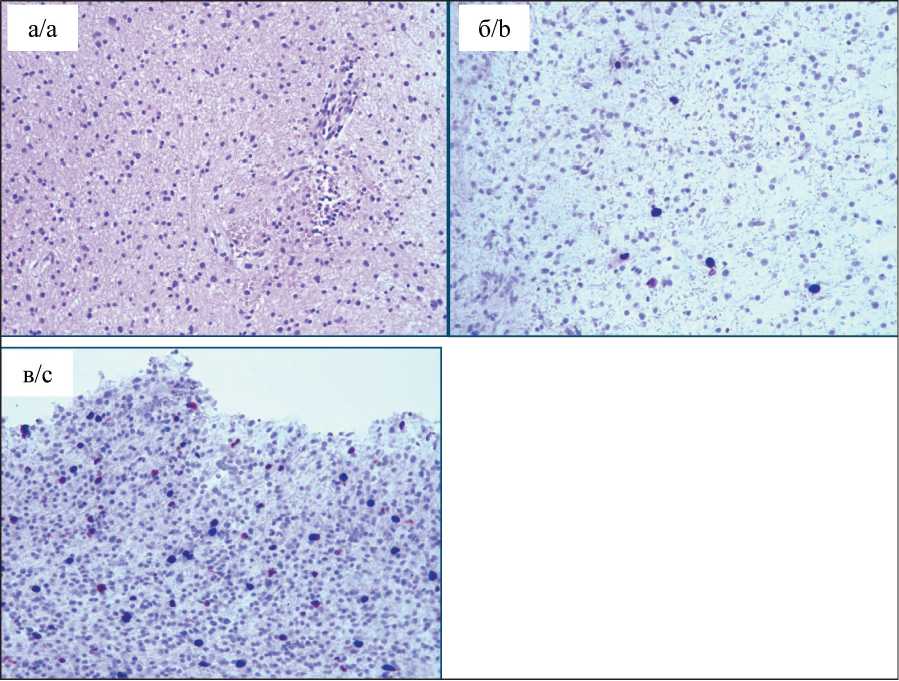
Рис. 5. Морфологическая гетерогенность. Центр: а – диффузная астроцитома GII с микрокистозом; окраска гематоксилином и эозином, ×100; б – диффузная астроцитома GII с микро-кистозом; ИГХ-исследование, ядерное окрашивание антителом Ki67 (2–3 %), ×100; в – анапластическая астроцитома
GIII; пролиферация сосудов, плотно-клеточность; окраска гематоксилином и эозином, ×100; г – анапластическая астроцитома GIII; ИГХ-исследование, ядерное окрашивание антителом Ki67 (6–8 %), ×100
Fig. 5. Morphological heterogeneity. Center. a – diffuse astrocytoma GII with microcystosis. Hematoxylin-eosin staining; ×100. b – diffuse astrocytoma GII with microcystosis. Immunohistochemistry, nuclear staining with Ki67 antibody (2–3 %); ×100. c – anaplastic astrocytoma GIII. Vascular proliferation, hypercellular-ity. Hematoxylin-eosin staining; ×100. d – anaplastic astrocytoma GIII. Immunohistochemistry, nuclear staining with Ki67 antibody (6–8 %); ×100
Рис. 6. Морфологическая гетерогенность. Задний полюс: а – фрагмент диффузной астроцитомы GII и анапластической астроцитомы GIII с плотно-клеточностью; пролиферациия сосудов на границе ДА и АА; окраска гематоксилином и эозином, ×100; б – диффузная астроцитома GII; ИГХ-исследование, ядерное окрашивание антителом Ki67 (2–3 %), ×100;
в – анапластическая астроцитома GIII. ИГХ-исследование, ядерное окрашивание антителом Ki67 (8–9 %), ×100 Fig. 6. Morphological heterogeneity. Dorsal pole. a – fragment of diffuse astrocytoma GII and anaplastic astrocytoma GIII with hypercellularity. Vascular proliferation at the border of DA and AA. Hematoxylin-eosin staining; ×100.
b – diffuse astrocytoma GII. Immunohistochemistry, nuclear staining with Ki-67 antibody (2–3 %), ×100; с – anaplastic astrocytoma GIII. Immunohistochemistry, nuclear staining with Ki-67 antibody (8–9 %); ×100
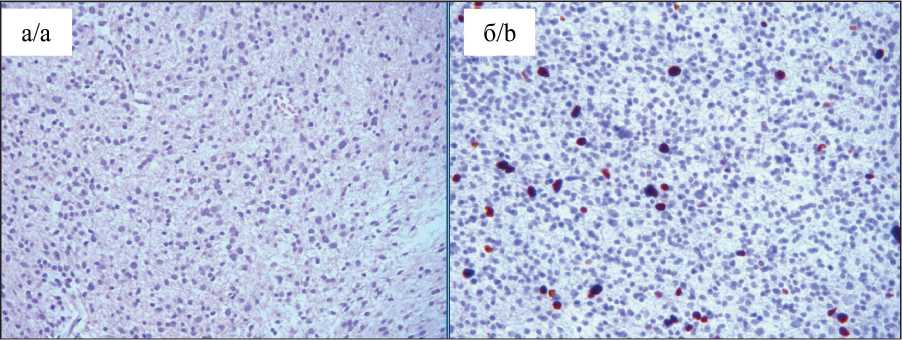
Рис. 7. Передний полюс: а – анапластическая астроцитома GIII, плотноклеточ-ность, пролиферация сосудов, окраска гематоксилином и эозином, ×100; б – ИГХ-исследование, ядерное окрашивание антителом Ki67 (6–8 %), ×100 Fig. 7. Morphological heterogeneity.
Anterior pole. a – anaplastic astrocytoma GIII hypercellularity, vascular proliferation.
Hematoxylin-eosin staining; ×100;
b – immunohistochemistry, nuclear staining with Ki67 antibody (6–8 %); ×100
Таблица 2/table 2
Окончание таблицы 2/end of table 2
ективного ответа на терапию первой линии. Еще в 1937 г. при микроскопическом исследовании обратили внимание на то, что в структуру глиобластомы могут входить как элементы всего астроцитарного ряда, так и эмбриональной опухоли («медулло-бласты») [23–25]. В нашем исследовании была диагностирована глиобластома с примитивным нейроэктодермальным компонентом с индексом пролиферативной активности Ki67 до 80–90 % в участках эмбриональной опухоли и позитивной окраской антителами Syn и NSE в ней (табл. 1, случай 14). Фенотипическая гетерогенность ДА, АА и первичной ГБ при гистологическом исследовании подтверждена в 72,7 % случаев (16/22). Иногда в рамках одного новообразования опухоль имела черты «диффузной астроцитомы GII» и «глиобластомы GIV» с соответствующим им индексом пролиферативной активности (Ki67). Так, в случае ГБ с примитивным нейрональным компонентом были участки опухоли с картиной «диффузной астроцитомы GII» и индексом пролиферативной активности в них 2–3 % и Ki67 около 80–90 % в фокусах примитивного нейроэктодермального компонента. Интересным также представляется более частое присутствие гетерогенности в АА (80 %) по сравнению с ГБ (68,8 %). Наличие гетерогенности в опухоли необходимо учитывать при заборе опухолевого материала во время операции. По результатам нашего исследования в 50 % случаев опухоль была гетерогенна в 3 и более фрагментах. В связи с чем во избежание ошибочного гистологического диагноза число фрагментов опухолевой ткани, забираемых интраоперационно, должно быть от трех и выше.
Молекулярно-генетическая гетерогенность изучается на разных уровнях (на клеточном и в опухоли человека), разными методиками и с целой мозаикой изучаемых генов [19, 26, 27]. В немногочисленных публикациях подтверждается наличие генетической гетерогенности в одной опухоли для разных генов: MGMT, PDGFR-α, EGFR, MET [17, 28–30]. В нашем исследовании изучались изменения экспрессии генов репарации ДНК – MGMT, ERCC1 и онкогенов – PDGFR-α, VEGF, C-kit, а также TOP2A. Удалось выяснить, что уровни экспрессии генов MGMT, ERCC1, PDGFR-α, VEGF, TOP2A, C-kit чаще были стабильными и различались в 41,7 % случаев (20/48) в рамках одного опухолевого узла, и только в одном случае (№ 6) уровень экспрессии мРНК гена ERCC1 был в категории от «низкого» до «высокого» (табл. 2). Возможно, только в данном наблюдении речь идет об истинной гетерогенности, поскольку на небольшие колебания экспрессии «низкий-средний» или «высокий-средний» теоретически мог повлиять процент опухолевых клеток в образцах. Данный методологический аспект мы постарались свести к минимуму, забирая материал для генетического исследования с содержанием опухолевых клеток более 85 %. Разный уровень экспрессии изучаемых генов можно объяснить разным уровнем эволюции и дифференцировки клеток опухоли. Полученный нами результат подтверждается и другими немногими исследованиями, в которых подчеркивается наличие разнообразных экспрессий генов и вариаций числа их копий, что объясняется авторами наличием определенных альтераций для каждого этапа онкогенеза [30–32]. Самой стабильной аберрацией по результатам нашего исследования оказалась мутация в гене IDH1(R132H), которая или присутствовала, или отсутствовала во всех фрагментах опухоли. Данные литературы объясняют это явление тем, что характер мутаций для генов IDH является неслучайным событием, и чаще всего повреждение происходит в одном и том же положении аминокислоты (R132H) [33].
В некоторых исследованиях гетерогенность изучалась при анализе данных, полученных разными методиками изготовления блока (заморозка и фиксация в парафине), а результаты истолковывались как «гетерогенность», когда на самом деле имела место межметодовая дискордантность. Так, например, определяли статус метилирования промотора гена MGMT в образцах опухоли, полученных от 14 пациентов с диагнозом «глиобластома», исследуя 2 фрагмента из каждого опухолевого узла (используя метод заморозки для одного фрагмента и заливку в парафин для другого). В 50 % случаев авторы отметили разные результаты по статусу метилирования [20]. В другом исследовании также при разной методике изготовления блока (заморозка и фиксация в парафине) определяли статус метилирования промотора гена MGMT у 13 больных (c забором по 3 фрагмента из каждого узла). В 30 % случаев (4/13) получили межметодовую несопоставимость, и только в одном – истинную внутриопухолевую гетерогенность [21]. В части работ сравнивались результаты, полученные при разных методах определения активности гена MGMT (ПЦР, ИГХ и др.), также c логичным получением в итоге разных результатов [34, 35]. На наш взгляд, для выявления истинной гетерогенности необходимо соблюсти идентичность лабораторных методик.
Однако оказывается, что не только эволюция клеток на разном уровне приводит в итоге к гетерогенности, но и цитостатическая терапия. B.E. Johnson et al. отметили, что 98,7 % мутаций в ГБ (после рецидива) связаны с терапией темозоломидом, и эти повреждения не были выявлены в первичных опухолях. Таким образом, ХТ темозоломидом способна повлечь за собой темозоломид-индуцированные мутации и гипермутации в лечебно-резистентных субклонах глиобластомы, что может только усилить гетерогенность опухоли при рецидиве [27]. В другом исследовании обнаружили, что гетерогенность опухоли после химиотерапии темозоломидом возрастает в 4 раза [18]. S. Akgül et al. также показали, что частота мутаций увеличивается после лучевой и химиотерапии с (0,2–4,5 %) до (31,9–90,9 %) при трансформации глиом низкой степени злокачественности во вторичные ГБ, при этом остается неясным: рост числа мутаций обусловлен проведенным лечением или является следствием самой анаплазии опухоли [36].
Изучается также влияние микроокружения опухоли на ее гетерогенность, а именно исследуется способность различных клеточных субпопуляций (опухолевых клеток) приобретать свойства стволовых клеток с появлением, в конечном итоге, генетически различных клонов клеток [19, 37, 38]. Эра изучения стволовых опухолевых клеток началась в 90-х годах XX века с их открытия при остром мие-лобластном лейкозе. Спустя несколько лет в опухолях ЦНС (примитивная нейроэктодермальная опухоль (PNET), включая медуллобластому, диффузную астроцитому GII и глиобластому GIV) были обнаружены клетки, которые обладают высокой способностью к самообновлению, пролиферации и дифференцировке. Эти клетки, инициирующие опухоль головного мозга BTICS (Brain tumor-initiating cells), были определены по экспрессии маркера клеточной поверхности CD133 [39, 40]. Y. Ding et al., сравнивая нейронные стволовые клетки и стволовые клетки глиобластомы при выполнении скрининга shRNA kinome, выделили ген BUB1 Mitotic Checkpoint Serine/Threonine Kinase B ( BUB1B ), который играет одну из ключевых ролей в экспансии стволовых клеток глиобластомы, участвуя в регуляции митоза на этапе контрольных точек клеточного цикла [41, 42]. В другой работе, используя данные экспрессионного анализа генов в стволовых клетках ГБ, астроцитах и нервных клетках-предшественниках, разработали классификацию на основании чувствительности опухолевых клеток к ингибированию гена BUB1B [43].
На гетерогенность опухоли также оказывает влияние и микроокружение иммунными клетками. В ткани опухоли присутствуют скопления различных иммунных клеток – лимфоциты, СD4+ и СD 8+, T-клетки, макрофаги [44–46]. В одном исследовании сообщалось о положительном влиянии инфильтрации опухоли T-лимфоцитами на продолжительность жизни пациентов с анапластической астроцитомой, в другом выявили зависимость между степенью инфильтрации B-клетками и выживаемостью пациентов с ГБ [47, 48]. При этом значимых результатов при проведении иммунотерапии опухолей ЦНС пока нет [49].
В последние два года основное внимание уделяется изучению генетической гетерогенности на клеточном уровне. В одной работе проводился анализ молекулярного профиля клонов клеток с определением множества генетических аберраций (CDK4/6, FGFR1, AKT1/2, MTOR, MET, PIK3C2A, WNT5A, SFRP4 и MYC) и активации специфических сигнальных каскадов [36, 50]. В другом исследовании обратили внимание на на- личие в одной опухоли до 4 подтипов ГБ (нейрональный, олигодендроглиальный, астроцитарный и мезенхимальный) [51] и присутствие в разных участках ГБ гетерогенного метилирования ДНК в менее стабильных областях гена [52]. Интересной представляется работа, в которой авторы предположили, что за формирование внутриопухолевой гетерогенности отвечают определенные гены (CYB5R2, TPPP3) и lncRNAs [53].
Таким образом, проведенные исследования по определению внутриопухолевой гетерогенности в ГБ выявили большое число генетических и эпигенетических событий в опухоли, что способствовало выделению в ГБ нескольких биологических подтипов (пронейрального, нейронального, мезенхимального и классического). В основу такого деления положено присутствие в опухоли следующих ключевых признаков: мутации в генах IDH1 и IDH2, наличие или отсутствие метилирования промотора гена MGMT , присутствие мутаций в гене рецептора
Список литературы Внутриопухолевая морфологическая и молекулярно-генетическая гетерогенность в астроцитомах разной степени злокачественности в материале от первой операции
- Virchow R. Cellular pathology. As based upon physiological and pathological histology. Lecture XVI--Atheromatous affection of arteries. 1858. Nutr Rev. 1989 Jan; 47(1): 23–5. doi: 10.1111/j.1753-4887.1989.tb02747.x.
- Strauss Y., Globus J. Spongioblastoma with unusually rapid growth following decompression. Neurol. Bull. 1918; 1: 273–279.
- Земская А.Г. Мультиформные глиобластомы головного мозга. Л., 1976. 178 с. [Zemskaja A.G. Multiforme Glioblastoma of the Brain. Leningrad, 1976. 178 p. (in Russian)].
- Смирнов Л.И. Морфология нервной системы, общая нормальная и патологическая гистология. М., 1935. 256 с. [Smirnov L.I. Morphology of the nervous system, general normal and pathological histology. Мoscow, 1935. 256 p. (in Russian)].
- Гейманович А.И., Смирнова Л.И. Опухоли центральной нервной системы. Гос. мед. издат. УССР, 1936; С. 401–421. [Geymanovich A.I., Smirnova L.I. Tumors of the central nervous system. State honey. published. 1936. P. 401–421. (in Russian)].
- Васкин И.С., Васильев А.А. Патогистологическая характеристика опухолей центральной нервной системы. Современная хирургия. 1934; 6: 506–526. [Vaskin I.S., Vasil’ev A.A. Pathohistological characteristics of tumors of the central nervous system. Modern Surgery. 1934; 6: 506–526. (in Russian)].
- Савенко С.Н. Мультиформная спонгиобластома. Опухоли центральной нервной системы. 1936; С. 424–443. [Savenko S.N. Multiforme Spongioblastoma. Tumors of the Central Nervous System. 1936. P. 424–443. (in Russian)].
- Scherer H., Gliomstudien. I.I. Uber die Grenzen der Zelldiagnostik der Gehirngeschwulsten, gargestellt am Beispiel des «Glioblastoma multiforme ganglioides. Virchow s, Arch. 1935; 294: 795–822.
- Scherer H. The forms of growth in gliomas and their practical significance. Brain. 1940; 63: 11–35.
- Hegi M.E., Diserens A.C., Gorlia T., Hamou M.F., de Tribolet N., Weller M., Kros J.M., Hainfellner J.A., Mason W., Mariani L., Bromberg J.E., Hau P., Mirimanoff R.O., Cairncross J.G., Janzer R.C., Stupp R. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med. 2005 Mar 10; 352(10): 997–1003. doi: 10.1056/NEJMoa043331.
- Chinot O.L., Barrié M., Fuentes S., Eudes N., Lancelot S., Metellus P., Muracciole X., Braguer D., Ouafik L., Martin P.M., Dufour H., Figarella-Branger D. Correlation between O6-methylguanine-DNA methyltransferase and survival in inoperable newly diagnosed glioblastoma patients treated with neoadjuvant temozolomide. J Clin Oncol. 2007 Apr 20; 25(12): 1470–5. doi: 10.1200/JCO.2006.07.4807.
- Watanabe T., Nobusawa S., Kleihues P., Ohgaki H. IDH1 mutations are early events in the development of astrocytomas and oligodendrogliomas. Am J Pathol. 2009 Apr; 174(4): 1149–53. doi: 10.2353/ajpath.2009.080958.
- Kim Y.H., Nobusawa S., Mittelbronn M., Paulus W., Brokinkel B., Keyvani K., Sure U., Wrede K., Nakazato Y., Tanaka Y., Vital A., Mariani L., Stawski R., Watanabe T., De Girolami U., Kleihues P., Ohgaki H. Molecular classification of low-grade diffuse gliomas. Am J Pathol. 2010 Dec; 177(6): 2708–14. doi: 10.2353/ajpath.2010.100680.
- Labussière M., Idbaih A., Wang X.W., Marie Y., Boisselier B., Falet C., Paris S., Laffaire J., Carpentier C., Crinière E., Ducray F., El Hallani S., Mokhtari K., Hoang-Xuan K., Delattre J.Y., Sanson M. All the 1p19q codeleted gliomas are mutated on IDH1 or IDH2. Neurology. 2010; 74(23): 1886–90. doi: 10.1212/WNL.0b013e3181e1cf3a.
- Kim Y.H., Nobusawa S., Mittelbronn M., Paulus W., Brokinkel B., Keyvani K., Sure U., Wrede K., Nakazato Y., Tanaka Y., Vital A., Mariani L., Stawski R., Watanabe T., De Girolami U., Kleihues P., Ohgaki H. Molecular classification of low-grade diffuse gliomas. Am J Pathol. 2010 Dec; 177(6): 2708–14. doi: 10.2353/ajpath.2010.100680.
- Hartmann C., Hentschel B., Tatagiba M., Schramm J., Schnell O., Seidel C., Stein R., Reifenberger G., Pietsch T., von Deimling A., Loeffler M., Weller M. Molecular markers in low-grade gliomas: predictive or prognostic? Clin Cancer Res. 2011; 17(13): 4588–99. doi: 10.1158/1078-0432.CCR-10-3194.
- Meyer M., Reimand J., Lan X., Head R., Zhu X., Kushida M., Bayani J., Pressey J.C., Lionel A.C., Clarke I.D., Cusimano M., Squire J.A., Scherer S.W., Bernstein M., Woodin M.A., Bader G.D., Dirks P.B. Single cell-derived clonal analysis of human glioblastoma links functional and genomic heterogeneity. Proc Natl Acad Sci USA. 2015; 112(3): 851–6. doi: 10.1073/pnas.1320611111.
- Parker N.R., Hudson A.L., Khong P., Parkinson J.F., Dwight T., Ikin R.J., Zhu Y., Cheng Z.J., Vafaee F., Chen J., Wheeler H.R., Howell V.M. Intratumoral heterogeneity identified at the epigenetic, genetic and transcriptional level in glioblastoma. Sci Rep. 2016 Mar 4; 6: 22477. doi: 10.1038/srep22477.
- Qazi M.A., Vora P., Venugopal C., Sidhu S.S., Moffat J., Swanton C., Singh S.K. Intratumoral heterogeneity: pathways to treatment resistance and relapse in human glioblastoma. Ann Oncol. 2017 Jul 1; 28(7): 1448–56. doi: 10.1093/annonc/mdx169.
- Juillerat-Jeanneret L., Bernasconi C.C., Bricod C., Gros S., Trepey S., Benhattar J., Janzer R.C. Heterogeneity of human glioblastoma: glutathione-S-transferase and methylguanine-methyltransferase. Cancer Invest. 2008 Jul; 26(6): 597–609. doi: 10.1080/07357900802072913.
- Hamilton M.G., Roldán G., Magliocco A., McIntyre J.B., Parney I., Easaw J.C. Determination of the methylation status of MGMT in different regions within glioblastoma multiforme. J Neurooncol. 2011 Apr; 102(2): 255–60. doi: 10.1007/s11060-010-0307-5.
- Mitiushkina N.V., Iyevleva A.G., Poltoratskiy A.N., Ivantsov A.O., Togo A.V., Polyakov I.S., Orlov S.V., Matsko D.E., Novik V.I., Imyanitov E.N. Detection of EGFR mutations and EML4-ALK rearrangements in lung adenocarcinomas using archived cytological slides. Cancer Cytopathol. 2013 Jul; 121(7): 370–6. doi: 10.1002/cncy.21281.
- Журид И.С. К учению о спонгиобластомах. Сборник, посвященный 30-летию деятельности С.Н. Давиденкова. 1936; С. 193–194. [Zhurid I.S. Towards the doctrine of spongioblastomas. In the collection dedicated to the 30th anniversary of S.N. Davidenkov, 1936; P. 193–194. (in Russian)].
- Маньковский Б.Н., Савенко С.Н. О корреляции клиники и структуры глиом. Советская психоневрология. 1937; 8: 43–49. [Man'kovskii B.N., Savenko S.N. On the correlation between the clinical and the structure of gliomas. Soviet Psychoneurology. 1937; 8: 43–49. (in Russian)].
- Ротенберг С.И. К характеристике мультиформных спонгиобластом. Труды II Всесоюзного съезда невропатологов и психиатров. T. IV. 1937; 331–355. [Rotenberg S.I. Characterization of multiforme spongioblastomas. II Soviet Union Congress of Neuropathologists and Psychiatrists. Vol. IV. 1937; 331–355. (in Russian)].
- Cancer Genome Atlas Research Network. Comprehensive genomic characterization defines human glioblastoma genes and core pathways. Nature. 2008 Oct 23; 455(7216): 1061–8. doi: 10.1038/nature07385.
- Johnson B.E., Mazor T., Hong C., Barnes M., Aihara K., McLean C.Y., Fouse S.D., Yamamoto S., Ueda H., Tatsuno K., Asthana S., Jalbert L.E., Nelson S.J., Bollen A.W., Gustafson W.C., Charron E., Weiss W.A., Smirnov I.V., Song J.S., Olshen A.B., Cha S., Zhao Y., Moore R.A., Mungall A.J., Jones S.J.M., Hirst M., Marra M.A., Saito N., Aburatani H., Mukasa A., Berger M.S., Chang S.M., Taylor B.S., Costello J.F. Mutational analysis reveals the origin and therapy-driven evolution of recurrent glioma. Science. 2014 Jan 10; 343(6167): 189–193. doi: 10.1126/science.1239947.
- Yip S., Miao J., Cahill D.P., Iafrate A.J., Aldape K., Nutt C.L., Louis D.N. MSH6 mutations arise in glioblastomas during temozolomide therapy and mediate temozolomide resistance. Clin Cancer Res. 2009 Jul 15; 15(14): 4622–9. doi: 10.1158/1078-0432.CCR-08-3012.
- Little S.E., Popov S., Jury A., Bax D.A., Doey L., Al-Sarraj S., Jurgensmeier J.M., Jones C. Receptor tyrosine kinase genes amplified in glioblastoma exhibit a mutual exclusivity in variable proportions reflective of individual tumor heterogeneity. Cancer Res. 2012 Apr 1; 72(7): 1614–20. doi: 10.1158/0008-5472.CAN-11-4069.
- Sottoriva A., Spiteri I., Piccirillo S.G., Touloumis A., Collins V.P., Marioni J.C., Curtis C., Watts C., Tavaré S. Intratumor heterogeneity in human glioblastoma reflects cancer evolutionary dynamics. Proc Natl Acad Sci USA. 2013 Mar 5; 110(10): 4009–14. doi: 10.1073/pnas.1219747110.
- Soeda A., Hara A., Kunisada T., Yoshimura S., Iwama T., Park D.M. The evidence of glioblastoma heterogeneity. Sci Rep. 2015 Jan 27; 5: 7979. doi: 10.1038/srep07979.
- Reinartz R., Wang S., Kebir S., Silver D.J., Wieland A., Zheng T., Küpper M., Rauschenbach L., Fimmers R., Shepherd T.M., Trageser D., Till A., Schäfer N., Glas M., Hillmer A.M., Cichon S., Smith A.A., Pietsch T., Liu Y., Reynolds B.A., Yachnis A., Pincus D.W., Simon M., Brüstle O., Steindler D.A., Scheffler B. Functional Subclone Profiling for Prediction of Treatment-Induced Intratumor Population Shifts and Discovery of Rational Drug Combinations in Human Glioblastoma. Clin Cancer Res. 2017 Jan15; 23(2): 562–574. doi: 10.1158/1078-0432.CCR-15-2089.
- Yan H., Parsons D.W., Jin G., McLendon R., Rasheed B.A., Yuan W., Kos I., Batinic-Haberle I., Jones S., Riggins G.J., Friedman H., Friedman A., Reardon D., Herndon J., Kinzler K.W., Velculescu V.E., Vogelstein B., Bigner D.D. IDH1 and IDH2 mutations in gliomas. N Engl J Med. 2009 Feb 19; 360(8): 765–73. doi: 10.1056/NEJMoa0808710.
- Parkinson J.F., Wheeler H.R., Clarkson A., McKenzie C.A., Biggs M.T., Little N.S., Cook R.J., Messina M., Robinson B.G., McDonald K.L. Variation of O(6)-methylguanine-DNA methyltransferase (MGMT) promoter methylation in serial samples in glioblastoma. J Neurooncol. 2008 Mar; 87(1): 71–8. doi: 10.1007/s11060-007-9486-0.
- Cao V.T., Jung T.Y., Jung S., Jin S.G., Moon K.S., Kim I.Y., Kang S.S., Park C.S., Lee K.H., Chae H.J. The correlation and prognostic significance of MGMT promoter methylation and MGMT protein in glioblastomas. Neurosurgery. 2009 Nov; 65(5): 866–75; discussion 875. doi: 10.1227/01.NEU.0000357325.90347.A1.
- Akgül S., Patch A.M., D’Souza R.C.J., Mukhopadhyay P., Nones K., Kempe S., Kazakoff S.H., Jeffree R.L., Stringer B.W., Pearson J.V., Waddell N., Day B.W. Intratumoural Heterogeneity Underlies Distinct Therapy Responses and Treatment Resistance in Glioblastoma. Cancers (Basel). 2019; 11(2): 190. doi: 10.3390/cancers11020190.
- Lemée J.M., Clavreul A., Menei P. Intratumoral heterogeneity in glioblastoma: don’t forget the peritumoral brain zone. Neuro Oncol. 2015 Oct; 17(10): 1322–32. doi: 10.1093/neuonc/nov119.
- Parker N.R., Khong P., Parkinson J.F., Howell V.M., Wheeler H.R. Molecular heterogeneity in glioblastoma: potential clinical implications. Front Oncol. 2015 Mar 3; 5: 55. doi: 10.3389/fonc.2015.00055.
- Hemmati H.D., Nakano I., Lazareff J.A., Masterman-Smith M., Geschwind D.H., Bronner-Fraser M., Kornblum H.I. Cancerous stem cells can arise from pediatric brain tumors. Proc Natl Acad Sci USA. 2003 Dec 9; 100(25): 15178–83. doi: 10.1073/pnas.2036535100.
- Singh S.K., Clarke I.D., Terasaki M., Bonn V.E., Hawkins C., Squire J., Dirks P.B. Identification of a cancer stem cell in human brain tumors. Cancer Res. 2003 Sep 15; 63(18): 5821–8.
- Ding Y., Hubert C.G., Herman J., Corrin P., Toledo C.M., Skutt-Kakaria K., Vazquez J., Basom R., Zhang B., Risler J.K., Pollard S.M., Nam D.H., Delrow J.J., Zhu J., Lee J., DeLuca J., Olson J.M., Paddison P.J. Cancer-Specific requirement for BUB1B/BUBR1 in human brain tumor isolates and genetically transformed cells. Cancer Discov. 2013 Feb; 3(2): 198–211. doi: 10.1158/2159-8290.CD-12-0353.
- Herman J.A., Toledo C.M., Olson J.M., DeLuca J.G., Paddison P.J. Molecular pathways: regulation and targeting of kinetochore-microtubule attachment in cancer. Clin Cancer Res. 2015 Jan 15; 21(2): 233–9. doi: 10.1158/1078-0432.CCR-13-0645.
- Lee E., Pain M., Wang H., Herman J.A., Toledo C.M., DeLuca J.G., Yong R.L., Paddison P., Zhu J. Sensitivity to BUB1B Inhibition Defines an Alternative Classification of Glioblastoma. Cancer Res. 2017; 77(20): 5518–5529. doi: 10.1158/0008-5472.CAN-17-0736.
- Berghoff A.S., Kiesel B., Widhalm G., Rajky O., Ricken G., Wöhrer A., Dieckmann K., Filipits M., Brandstetter A., Weller M., Kurscheid S., Hegi M.E., Zielinski C.C., Marosi C., Hainfellner J.A., Preusser M., Wick W. Programmed death ligand 1 expression and tumor-infiltrating lymphocytes in glioblastoma. Neuro Oncol. 2015 Aug; 17(8): 1064–75. doi: 10.1093/neuonc/nou307.
- Yang I., Tihan T., Han S.J., Wrensch M.R., Wiencke J., Sughrue M.E., Parsa A.T. CD8+ T-cell infiltrate in newly diagnosed glioblastoma is associated with long-term survival. J Clin Neurosci. 2010 Nov; 17(11): 1381–5. doi: 10.1016/j.jocn.2010.03.031.
- Hussain S.F., Yang D., Suki D., Aldape K., Grimm E., Heimberger A.B. The role of human glioma-infiltrating microglia/macrophages in mediating antitumor immune responses. Neuro Oncol. 2006 Jul; 8(3): 261–79. doi: 10.1215/15228517-2006-008.
- Donson A.M., Birks D.K., Schittone S.A., Kleinschmidt-DeMasters B.K., Sun D.Y., Hemenway M.F., Handler M.H., Waziri A.E., Wang M., Foreman N.K. Increased immune gene expression and immune cell infiltration in high-grade astrocytoma distinguish long-term from short-term survivors. J Immunol. 2012 Aug 15; 189(4): 1920–7. doi: 10.4049/jimmunol.1103373.
- Li B., Severson E., Pignon J.C., Zhao H., Li T., Novak J., Jiang P., Shen H., Aster J.C., Rodig S., Signoretti S., Liu J.S., Liu X.S. Comprehensive analyses of tumor immunity: implications for cancer immunotherapy. Genome Biol. 2016 Aug 22; 17(1): 174. doi: 10.1186/s13059-016-1028-7.
- Huang B., Zhang H., Gu L., Ye B., Jian Z., Stary C., Xiong X. Advances in Immunotherapy for Glioblastoma Multiforme. J Immunol Res. 2017; 2017: 3597613. doi: 10.1155/2017/3597613.
- Daniel P.M., Filiz G., Tymms M.J., Ramsay R.G., Kaye A.H., Stylli S.S., Mantamadiotis T. Intratumor MAPK and PI3K signaling pathway heterogeneity in glioblastoma tissue correlates with CREB signaling and distinct target gene signatures. Exp Mol Pathol. 2018 Aug; 105(1): 23–31. doi: 10.1016/j.yexmp.2018.05.009.
- Neftel C., Laffy J., Filbin M.G., Hara T., Shore M.E., Rahme G.J., Richman A.R., Silverbush D., Shaw M.L., Hebert C.M., Dewitt J., Gritsch S., Perez E.M., Gonzalez Castro L.N., Lan X., Druck N., Rodman C., Dionne D., Kaplan A., Bertalan M.S., Small J., Pelton K., Becker S., Bonal D., Nguyen Q.D., Servis R.L., Fung J.M., Mylvaganam R., Mayr L., Gojo J., Haberler C., Geyeregger R., Czech T., Slavc I., Nahed B.V., Curry W.T., B.S., Wakimoto H., Brastianos P.K., Batchelor T.T., Stemmer-Rachamimov A., Martinez-Lage M., Frosch M.P., Stamenkovic I., Riggi N., Rheinbay E., Monje M., Rozenblatt-Rosen O., Cahill D.P., Patel A.P., Hunter T., Verma I.M., Ligon K.L., Louis D.N., Regev A., Bernstein B.E., Tirosh I., Suvà M.L. An Integrative Model of Cellular States, Plasticity, and Genetics for Glioblastoma. Cell. 2019 Aug 8; 178(4): 835–849.e21. doi: 10.1016/j.cell.2019.06.024.
- Wenger A., Ferreyra Vega S., Kling T., Bontell T.O., Jakola A.S., Carén H. Intratumor DNA methylation heterogeneity in glioblastoma: implications for DNA methylation-based classification. Neuro Oncol. 2019 May 6; 21(5): 616–627. doi: 10.1093/neuonc/noz011.
- Pang L., Hu J., Li F., Yuan H., Yan M., Liao G., Xu L., Pang B., Ping Y., Xiao Y., Li X. Discovering Rare Genes Contributing to Cancer Stemness and Invasive Potential by GBM Single-Cell Transcriptional Analysis. Cancers (Basel). 2019 Dec 16; 11(12): 2025. doi: 10.3390/cancers11122025.
- Lee E., Yong R.L., Paddison P., Zhu J. Comparison of glioblastoma (GBM) molecular classification methods. Semin Cancer Biol. 2018 Dec; 53: 201–211. doi: 10.1016/j.semcancer.2018.07.006.


