Внутриполостная автономная "ин виво" дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: разработка технологии и первые результаты
Автор: Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Обухов А.А., Анохин Ю.Н.
Рубрика: Научные статьи
Статья в выпуске: 2 т.26, 2017 года.
Бесплатный доступ
Представлены первые результаты разработки и апробации в клинических условиях технологии внутриполостной автономной «ин виво» дозиметрии при высокомощностной (высокодозной) брахитерапии рака предстательной железы излучением 192Ir с использованием автономных мини- и микродетекторов в виде кристаллов миллиметровых размеров и порошков из микрокристаллов (Al2O3, аланин). Детекторы герметически упаковывали внутри гибких тканеэквивалентных трубок в условиях электронного равновесия, а затем размещали внутри медицинских катетеров. С целью взаимной верификации результатов «ин виво» дозиметрии измерения радиационно обусловленных сигналов в детекторах проводили независимыми методами: термостимулированной люминесценции (ТЛ) и электронного парамагнитного резонанса (ЭПР). Поглощённые дозы определяли с использованием калибровочных дозовых зависимостей, построенных для каждого детектора с применением стандартных источников ионизирующего излучения. Данная технология позволяет проводить измерения поглощённых доз во многих точках тела и при внутриполостном размещении дозиметров в автономном режиме, то есть, при отсутствии кабельных соединений с регистрирующими системами. Испытания технологии начаты в МРНЦ им. А.Ф. Цыба в 2016 г. Области интереса для инструментальных оценок доз при брахитерапии рака предстательной железы, определённые онкологом-радиологом: мочевой пузырь (катетер с размещёнными в нём дозиметрами, вводимый через уретру); периферическая (ректальная) область - при введении катетера с размещёнными в нём дозиметрами в просвет прямой кишки. Введение медицинских катетеров предусмотрено технологией высокомощностной брахитерапии. Наличие детекторов внутри катетеров не мешает проведению всех необходимых медицинских процедур - в силу миниатюрности детекторов. Все процедуры по размещению мини- и микродетекторов проводились онкологом-радиологом под контролем УЗИ. Сравнение результатов инструментальной дозиметрии и расчётных данных показывает, что в области мочевого пузыря измеренные дозы достаточно хорошо согласуются с расчётными (различия не превышают 5% по сравнению с расчётными дозами). Между тем, расчётные дозы в периферической (ректальной) области существенно превышают данные, полученные инструментальным способом - от 2 до 5 раз. Сделан вывод о необходимости создания усовершенствованной расчётной системы планирования терапевтических доз - с более точным учётом реальной геометрии облучаемых органов и тканей, а также различий в плотностях облучаемых тканей, в особенности, между мягкой и костной тканями.
"ин виво" дозиметрия, внутриполостная инструментальная дозиметрия, брахитерапия, высокомощностная (высокодозная) брахитерапия, внутритканевая радиотерапия, рак предстательной железы, локальные поглощённые дозы, расчётные дозы, планирование радиотерапии, радиационная безопасность пациентов, люминесцентные детекторы, термостимулированная люминесценция, тл-дозиметрия, эпр-спектрометрия, эпр-дозиметрия
Короткий адрес: https://sciup.org/170170296
IDR: 170170296 | DOI: 10.21870/0131-3878-2017-26-2-72-82
Текст научной статьи Внутриполостная автономная "ин виво" дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: разработка технологии и первые результаты
Высокомощностная (высокодозная) брахитерапия занимает одно из ведущих мест среди методов радиотерапии рака предстательной железы наряду с низкомощностной (низкодозной) брахитерапией и дистанционной лучевой терапией [1-4].
Актуальность разработки и применения инструментальных («ин виво») методов дозиметрии для обеспечения радиационной безопасности пациентов и снижения риска лучевых повреждений, а также для адекватного принятия мер в случае негативных эффектов облучения окружающих опухоль тканей подчеркивается в рекомендациях ВОЗ [5] и МАГАТЭ [6, 7]. Согласно публикации 97 МКРЗ «ин виво» дозиметрия необходима как часть программы обеспечения качества радиотерапии [8].
В доступной литературе есть небольшое количество публикаций о разработках и результатах применения технологии внутриполостной «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы с 192Ir, при этом использовалось кабельное соединение с регистрирующими системами (см., например, [9, 10]).
В данной работе представлены первые результаты разработки и апробации в клинических условиях технологии внутриполостной «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы с применением 192Ir. Дозиметрия проведена с использованием автономных мини- и микродозиметров – в виде миникристаллов и порошка из микрокристаллов и с регистрацией радиационно обусловленных сигналов различными методами (ТЛ и ЭПР) – для взаимной верификации измеренных доз. Разработанная технология позволяет проводить измерения поглощённых доз во многих точках тела пациента при внутриполостном размещении миниатюрных дозиметров в автономном режиме, то есть при отсутствии кабельных соединений с регистрирующими системами.
Материалы и методы
Для проведения измерений интенсивности термостимулированной люминесценции (ТЛ) использовали систему регистрации радиационно обусловленного люминесцентного сигнала – модель «Harshow 3500». Программное обеспечение системы TLDShell позволяет отображать режимы термостимуляции и обрабатывать кривые высвечивания исследуемых образцов по заданным режимам и параметрам. Дозиметрическую калибровку каждого детектора осуществляли встроенным паспортизированным источником 90Sr/90Y, защищённым в целях безопасности свинцовым «домиком». В свою очередь, калибровку источника 90Sr/90Y проводили на вторичном образцовом источнике 60Co МРНЦ им. А.Ф. Цыба (с относительной погрешностью по дозе гамма-облучения не более 3%). В качестве ТЛ-детекторов были применены миниатюрные (5x1 мм) кристаллы оксида алюминия (α-Al 2 O 3 :C) подобно тому, как это выполнено нами ранее при измерениях локальных доз облучения персонала источников 125I [11].
Для проведения измерений методом электронного парамагнитного резонанса (ЭПР) использовали спектрометр исследовательского класса ESP-300E (Bruker) в Х-диапазоне. В качестве миниатюрных ЭПР-детекторов применяли аланин в виде порошка из микрогранул и в виде таблеток (2,9 ммх4,8 мм) - в смеси аланина с полипропиленом (с соотношением 98/2 %% по массе). Дозиметрическую калибровку аланиновых детекторов проводили в условиях электронного равновесия на установке «Исследователь» (МРНЦ им. А.Ф. Цыба) при относительной погрешности калибровки по дозе гамма-облучения не более 3%.
Испытание разработанной технологии «ин виво» дозиметрии проводили в клинике МРНЦ им. А.Ф. Цыба (отдел онкологии репродуктивных органов) в процессе высокомощностной брахитерапии рака предстательной железы c применением 192Ir.
Результаты
Разработанная технология изготовления и применения сборок миниатюрных дозиметров для внутриполостной «ин виво» дозиметрии
Дозиметры в виде таблеток миллиметровых размеров или же в виде порошка с размерами гранул менее 0,3 мм герметически фиксировали внутри гибких тканеэквивалентных трубок, которые, в свою очередь, размещали внутри медицинских катетеров – в условиях электронного равновесия при облучении источником 192Ir. Описание способа размещения мини- и микродозиметров представлено на рис. 1.
«Ин виво» дозиметрия при высокодозной брахитерапии рака предстательной железы - испытания (2016 г.)

Дозиметры в виде таблеток миллиметровых размеров или в виде порошка из микрочастиц герметически фиксируются внутри гибких тканеэквивалентных пластиковых трубок , которые, в свою очередь, размещаются внутри медицинских катетеров

Рис. 1. Разрабо родозиметров в медицинских катетерах для последующего внутриполостного введения с целью «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы источниками 192Ir.
Испытания метода «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы только начаты. Измерения проводятся независимыми методами: термостимулированной люминесценции и электронного парамагнитного резонанса. Области интереса для инструментальных оценок доз, определённые онкологом-радиологом:
-
- в уретре, в области мочевого пузыря – катетер с размещёнными в нём дозиметрами, вводимый через уретру на глубину 150 мм;
-
- периферическая (ректальная) область – при введении катетера с размещёнными в нём дозиметрами в просвет прямой кишки (на глубину 150 мм).
Введение медицинских катетеров предусмотрено технологией высокомощностной брахитерапии. Наличие дозиметров внутри катетеров не мешает проведению всех необходимых медицинских процедур в силу миниатюрности дозиметров. Все процедуры по размещению мини- и микродозиметров проводятся онкологом-радиологом под контролем УЗИ (рис. 2).
“Ин виво” дозиметрия при высокодозной брахитерапии рака предстательной железы – испытания (2016 г. )
Во время операции, при наличии необходимости введения катетеров, онколог-радиолог имеет возможность под контролем УЗИ подвести микродозиметры через катетеры в зоны интереса
Все процедуры проводятся онкологом- радиологом
Рис. 2. П у ом для
«ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы источниками 192Ir.
Разработанная технология люминесцентных измерений (Al2O3)
Для обработки кривых люминесцентного высвечивания минидетекторов (оксид алюминия – Al 2 O 3 :C) в соответствии с разработанными режимами и параметрами проведения измерений использовали программное обеспечение «TLDShell» системы «Harshow 3500» (см. раздел «Материалы и методы»). Построение калибровочных дозовых зависимостей проводили для каждого ТЛ-детектора с применением встроенного стандартного источника 90Sr/90Y (см. раздел «Материалы и методы»). Термостимуляцию образцов осуществляли контактным нагревом с замкнутой системой обратной связи, которая обеспечивает линейное возрастание температуры с точностью ± 1 °С до 600 °С. Чтобы подавить мешающий сигнал и улучшить отношение сиг-нал/шум систему продували азотом (очистка 99,9%), который вентилирует планшет с образцами. Устраняя кислород в области планшета, азот ликвидирует нежелательный ТЛ-сигнал, производимый кислородом. Азот также прокачивается через камеру фотоумножителя, регистрирующего люминесцентное излучение, для устранения влаги, вызванной конденсацией.
Для измерения дозы в соответствии с построенными калибровочными зависимостями использовали величину интеграла от термостимулированного радиационно обусловленного пика высвечивания люминесценции, соответствующего 190 °С, поскольку интенсивность этого пика наиболее чувствительна к облучению ионизирующим излучением и в то же время этот пик весьма стабилен во времени (обладает малым федингом – время его «жизни» составляет сотни лет при комнатной температуре).
Минидетекторы из монокристаллов Al2O3:C (оксид алюминия) подвергали предварительному отжигу в течение 30 мин при температуре 450 °С. После охлаждения до комнатной температуры кристаллы размещали на подложках из нержавеющей стали диаметром 10 мм. После этого на люминесцентном ридере проводили регистрацию интенсивности люминесцентного свечения от каждого образца в зависимости от температуры нагрева при скорости нагрева 1 °С/с в диапазоне от комнатной температуры до 450 °С. При регистрации использовали 7,5 мм фильтр «Hoya U-340» с длиной волны пропускания от 280 до 370 нм и максимумом 340 нм. После считывания радиационно обусловленного сигнала (от неизвестной дозы облучения или же от стандартных доз облучения) проводили повторное измерение люминесцентного свечения от этого же образца для регистрации фонового сигнала, обусловленного «шумами» ридера и образцом. Неизвестную дозу облучения определяли по калибровочным дозовым зависимостям, построенным на основе стандартных доз облучения.
Разработанная технология измерений ЭПР-дозиметров (аланин)
-
- Измерения проводили на ЭПР-спектрометре ESP-300E (Bruker), работающем в Х-диапазоне (см. раздел «Материалы и методы»). Параметры измерений: развёртка магнитного поля 200 Гс; модуляция 3 Гс; время записи спектра с четырьмя накоплениями – 4 мин.
-
- Обработку спектров проводили путём сравнения спектра анализируемого аланинового детектора (АД) с предварительно измеренным калибровочным спектром АД, облучённого в дозе 100 Гр на гамма-установке «Исследователь». С помощью программы обработки спектров под контролем оператора на экране монитора совмещали по положению в спектре центральный пик анализируемого спектра и калибровочного спектра. Затем совмещали эти пики по амплитуде от максимума до минимума центрального пика. Из коэффициента масштабирования получали соотношение амплитуд пиков для двух образцов.
-
- Дозу в анализируемом АД определяли, исходя из соотношения амплитуд пиков этих двух образцов с учётом дозы облучения калибровочного образца и соотношения масс образцов. Относительную погрешность оценки дозы устанавливали, исходя из относительного вклада шумов спектрометра в спектр АД, который находили путём измерения средней амплитуды шумов, а также исходя из повторных измерений спектров и их обработки. Абсолютную погрешность определяли путём пересчёта относительной погрешности в единицы дозы.
Результаты расчёта действующего спектра гамма-излучения от источника 192Ir в зонах интереса
Для сравнения полученных данных «ин виво» дозиметрии при высокомощностной брахитерапии с расчётными дозами был проведён расчёт действующего спектра гамма-излучения от источника 192Ir в зонах интереса, т.е. там, где были размещены дозиметры. Информация о действующем спектре излучения необходима для того, чтобы учесть возможную энергетическую зависимость отклика люминесцентных дозиметров, принимая во внимание «смягчение» средней энергии гамма-спектра фотонного излучения 192Ir за счёт рассеяния гамма-квантов в биологических тканях (мягкие и костные ткани), окружающих источники. Расчёт проводился с использованием программы стохастического моделирования взаимодействия ионизирующего излучения с веществом MCNP, версия 4C [12, 13] c добавлением дополнительного органа – предстательной железы. Учитывали реальное расположение (по данным УЗИ) источников 192Ir в области предстательной железы и с учётом характеристик излучений 192Ir (табл. 1).
Характеристики излучений 192Ir
Таблица 1
|
Тип излучения |
Средняя энергия (МэВ) |
Интенсивность в расчёте на 1 распад |
|
Бета-частицы и элект |
роны |
|
|
β- |
0,0211 |
0,0010 |
|
β- |
0,0716 |
0,0560 |
|
β- |
0,1621 |
0,4143 |
|
β- |
0,2099 |
0,4800 |
|
Ожэ-L e- |
0,0069 |
0,0337 |
|
Ожэ-L e- |
0,0072 |
0,0770 |
|
Ожэ-K e- |
0,0365 |
0.0004 |
|
Оже-K e- |
0,0483 |
0,0017 |
|
Оже-K e- |
0,0510 |
0,0035 |
|
ce-K e- |
0,0580 |
0,0011 |
|
ce-L e- |
0,0974 |
0,0001 |
|
ce-L e- |
0,1225 |
0,0015 |
|
ce-K e- |
0,1274 |
0,0011 |
|
ce-K e- |
0,1319 |
0,0052 |
|
ce-M e- |
0,1330 |
0,0004 |
|
ce-N+ e- |
0,1356 |
0,0001 |
|
ce-L e- |
0,1883 |
0,0006 |
|
ce-L e- |
0,1928 |
0,0037 |
|
ce-M e- |
0,1983 |
0,0001 |
|
ce-M e- |
0,2027 |
0,0009 |
|
ce-N+ e- |
0,2051 |
0,0003 |
|
ce-K e- |
0,2094 |
0,0002 |
|
ce-K e- |
0,2176 |
0,0188 |
|
ce-K e- |
0,2301 |
0,0180 |
|
ce-K e- |
0,2381 |
0,0444 |
|
ce-L e- |
0,2821 |
0,0088 |
|
ce-M e- |
0,2927 |
0,0022 |
|
ce-L e- |
0,2946 |
0,0078 |
|
ce-N+ e- |
0,2952 |
0,0007 |
|
ce-K e- |
0,3006 |
0,0002 |
|
ce-L e- |
0,3026 |
0,0195 |
|
ce-M e- |
0,3052 |
0,0020 |
|
ce-N+ e- |
0,3077 |
0,0006 |
|
ce-M e- |
0,3132 |
0,0049 |
|
ce-N+ e- |
0,3158 |
0,0015 |
|
ce-K e- |
0,3381 |
0,0003 |
|
ce-K e- |
0,3897 |
0,0102 |
|
ce-K e- |
0,4107 |
0,0006 |
|
ce-L e- |
0,4542 |
0,0030 |
|
ce-M e- |
0,4648 |
0,0007 |
|
ce-N+ e- |
0,4673 |
0,0002 |
|
ce-L e- |
0,4716 |
0,0002 |
|
ce-K e- |
0,5102 |
0,0006 |
|
ce-K e- |
0,5260 |
0,0018 |
|
ce-K e- |
0,5341 |
0,0006 |
|
ce-L e- |
0,5747 |
0,0001 |
|
ce-L e- |
0,5905 |
0,0003 |
|
ce-L e- |
0,5986 |
0,0001 |
|
Характеристическое излучение |
||
|
L X-ray |
0,0089 |
0,0158 |
|
L X-ray |
0,0094 |
0,0420 |
|
Kα2 X-ray |
0,0615 |
0,0122 |
|
K α1 X-ray |
0,0630 |
0,0210 |
|
K α2 X-ray |
0,0651 |
0,0267 |
|
K α1 X-ray |
0,0668 |
0,0457 |
|
Kβ X-ray |
0,0714 |
0,0090 |
|
Kβ X-ray |
0,0757 |
0,0199 |
|
Гамма-излучение |
||
|
ϒ |
0,1104 |
0,0001 |
|
ϒ |
0,1363 |
0,0020 |
|
ϒ |
0,2013 |
0,0047 |
|
ϒ |
0,2058 |
0,0334 |
|
ϒ |
0,2833 |
0,0027 |
|
ϒ |
0,2960 |
0,2872 |
|
Тип излучения |
Средняя энергия (МэВ) |
Интенсивность в расчёте на 1 распад |
|
ϒ |
0,3085 |
0,2968 |
|
ϒ |
0,3165 |
0,8271 |
|
ϒ |
0,3292 |
0,0002 |
|
ϒ |
0,3745 |
0,0073 |
|
ϒ |
0,4165 |
0,0067 |
|
ϒ |
0,4205 |
0,0007 |
|
ϒ |
0,4681 |
0,4781 |
|
ϒ |
0,4846 |
0,0319 |
|
ϒ |
0,4891 |
0,0044 |
|
ϒ |
0,5886 |
0,0452 |
|
ϒ |
0,5935 |
0,0004 |
|
ϒ |
0,6044 |
0,0820 |
|
ϒ |
0,6125 |
0,0534 |
|
ϒ |
0,8845 |
0,0029 |
|
ϒ |
1,0610 |
0,0005 |
Корпускулярное излучение (бета-частицы и электроны), а также низкоэнергетическое характеристическое квантовое излучение практически полностью поглощаются внутри капсулы источника 192Ir. Для расчётов действующего спектра квантового излучения в областях интереса в качестве исходных данных были приняты характеристики гамма-излучения из табл. 1.
На рис. 3 приведены расчётные спектры квантового излучения (с учётом данных табл. 1) в областях интереса – уретра (вблизи мочевого пузыря) и толстый кишечник. Средняя энергия приведённых спектров квантового излучения равна 145 кэВ. С учётом величины средней энергии и в соответствии с данными работ [14, 15] был использован коэффициент 1,7 для коррекции результатов измерений доз облучения используемыми люминесцентными дозиметрами.
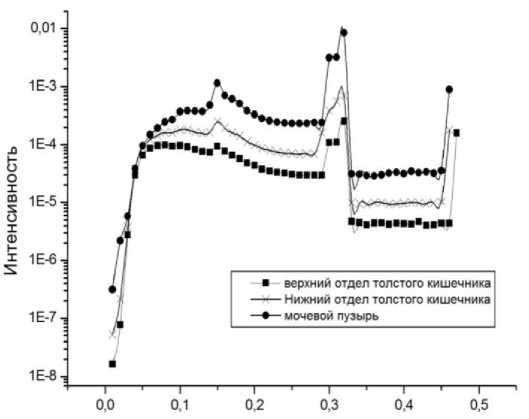
Энергия, МэВ
Рис. З. Расчётные действующие спектры квантового излучения от источников 192Ir в областях интереса – вблизи мочевого пузыря (уретра) и различных отделах толстого кишечника.
Результаты внутриполостной инструментальной «ин виво» дозиметрии в сравнении с планируемыми расчётными дозами
В табл. 2 приведены результаты «ин виво» люминесцентной и ЭПР-дозиметрии при высокомощностной брахитерапии рака предстательной железы в сравнении с расчётными (планируемыми) дозами.
Таблица 2
Данные «ин виво» люминесцентной и ЭПР-дозиметрии при высокомощностной брахитерапии рака предстательной железы в сравнении с расчётными дозами
|
Пациент |
Измеренная доза, Гр |
Погрешность измеренной дозы, Гр (1 SD) *) |
Расчётная доза, Гр |
|
Пациент 1 (Ф.А.Ф.) |
|||
|
Поглощённая доза в уретре |
12,3 |
0,29 |
12,9 |
|
Поглощённая доза в толстом кишечнике |
2,10 |
0,061 |
11,6 |
|
Пациент 2 (М.А.А.) |
|||
|
Поглощённая доза в уретре |
16,2 |
0,30 |
16,7 |
|
Поглощённая доза в толстом кишечнике |
3,00 |
0,085 |
7,5 |
|
Пациент 3 (М.С.П.) |
|||
|
Поглощённая доза в уретре |
13,8 |
0,051 |
13,2 |
|
Поглощённая доза в толстом кишечнике |
1,50 |
0,041 |
6,0 |
|
Пациент 4 (Ш.А.Г.) |
|||
|
Поглощённая доза в уретре |
16,8 |
0,49 |
16,6 |
|
Поглощённая доза в толстом кишечнике |
1,93 |
0,050 |
7,5 |
)Погрешности учитывают вариабельность результатов измерений различными методами – ТЛ и ЭПР.
Заключение
Сравнение данных инструментальной «ин виво» дозиметрии при высокомощностной брахитерапии рака предстательной железы и расчётных доз показывает, что в области уретры на глубине 150 мм (в области мочевого пузыря и, соответственно, вблизи предстательной железы) измеренные дозы достаточно хорошо согласуются с расчётными (расхождения между измеренными и расчётными дозами не превышают 5%). Вместе с тем, расчётные дозы в периферической (ректальной) области существенно превышают данные, полученные методом «ин виво» дозиметрии: различия в дозах составляют от 2 до 5 раз.
Это указывает на необходимость создания усовершенствованной системы планирования терапевтических доз, более точно учитывающей реальную геометрию облучаемых органов и тканей, а также различия в плотности облучаемых тканей, особенно между мягкой и костной тканями.
Дальнейшие исследования будут проведены с применением мини- и микроавтономных дозиметров, которые будут распределены по глубине их размещения в области уретры и в ректальной области с целью верификации соответствующих градиентов расчётных доз.
Список литературы Внутриполостная автономная "ин виво" дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: разработка технологии и первые результаты
- Каприн А.Д., Галкин В.Н., Иванов С.А. Роль брахитерапии в лечении локализованных форм рака предстательной железы//Biomedical Photonics. 2015. Т. 4, № 4. С. 21-26.
- Иванов С.А. Брахитерапия как метод радикального лечения при раке предстательной железы: дис. … док. мед. наук. М., 2011. 265 с.
- Иванов С.А., Каприн А.Д., Миленин К.Н., Альбицкий И.А., Иваненко К.В. Результаты применения низкодозной брахитерапии в качестве радикального лечения при раке предстательной железы//Диагностическая и интервенционная радиология. 2015. Т. 5, № 1. С. 73-76.
- Каприн А.Д., Паньшин Г.А., Альбицкий И.А., Миленин К.Н., Цыбульский А.Д. Брахитерапия локализованного рака предстательной железы (медицинская технология). . URL: http://www.rncrr.ru/nauka/new-technology/brakhiterapiya-lokalizovannogo-raka-predstatelnoy-zhelezy (дата обращения 08.02.2017).
- WHO. Radiotherapy Risk Profile WHO/IER/PSP/2008.12. Geneva: WHO, 2008. 51 р. . URL: http://www.who.int/patientsafety/activities/technical/radiotherapy_risk_profile.pdf (дата обращения 19.04.2017).
- IAEA. Lessons learned from accidental exposures in radiotherapy. IAEA Safety Report Series 17. Vienna: IAEA, 2000. 96 p. . URL: http://www-pub.iaea.org/mtcd/publications/pdf/pub1084_web.pdf (дата обращения 19.04.2017).
- IAEA. IAEA Human Health Reports No. 8 Development of Procedures for In Vivo Dosimetry in Radiotherapy. Vienna: IAEA, 2013. 178 p. . URL: http://www-pub.iaea.org/books/IAEABooks/8962/Development (дата обращения 19.04.2017).
- Valentin J. Prevention of high-dose-rate brachytherapy accidents. ICRP Publication 97//Annals of the ICRP. 2005. V. 35, N 2. P. 1-51.
- Therriault-Proulx F., Briere T.M., Mourtada F., Aubin S., Beddar S., Beaulieu L. A phantom study of an in vivo dosimetry system using plastic scintillation detectors for real-time verification of 192Ir HDR brachytherapy//Med. Phys. 2011. V. 38, N 5. P. 2542-2551 DOI: 10.1118/1.3572229
- Andersen C.E., Nielsen S.K., Greilich S., Helt-Hansen J., Lindegaard J.C., Tanderup K. Characterization of a fiber-coupled Al2O3:C luminescence dosimetry system for online in vivo dose verification during 192Ir brachytherapy//Med. Phys. 2009. V. 36, N 3. P. 708-718 DOI: 10.1118/1.3063006
- Степаненко В.Ф., Бирюков В.А, Карякин О.Б., Каприн А.Д., Галкин В.Н., Иванов С.А., Мардынский Ю.С., Колыженков Т.В., Петухов А.Д., Богачева В.В., Ахмедова У.А., Яськова Е.К., Лепилина О.Г., Санин Д.Б., Скворцов В.Г., Иванников А.И., Хайлов А.М., Анохин Ю.Н. Локальные поглощённые дозы облучения медицинского персонала при брахитерапии рака предстательной железы микроисточниками 125I российского производства//Радиация и риск. 2017. Т. 26, № 1. C. 44-59.
- Briemeister J.F. MCNP -A general Monte-Carlo N-particle transport code. Version 4C. Los Alamos: Los Alamos National Laboratory, 2000.
- Adult Reference Computational Phantoms: ICRP Publication 110//Annals of the ICRP. V. 39, N 2. Maryland Heights, MO: Elsevier, 2009. P. 1-165.
- Agyingi E.O., Mobit P.N., Sandison G.A. Energy response of an aluminum oxide detector in kilovoltage and megavoltage photon beams: An EGSnrc Monte-Carlo simulation study//Radiat. Prot. Dosim. 2005. V. 118. P. 28-31.
- Asni H.B. Photon energy response of silicon dioxide fibre optic and TLD 100 using Monte-Carlo simulation. Universiti Teknologi Malaysia, 2011. 72 p. . URL: http://eprints.utm.my/26923/(дата обращения 19.04.2017).


