Внутриполостная "ин виво" дозиметрия при высокомощностной брахитерапии в онкогинекологии
Автор: Богачева В.В., Степаненко В.Ф., Крикунова Л.И., Петухов А.Д., Кулиева Г.З., Колыженков Т.В., Жарова Е.П., Коротков В.А., Иванов С.А., Шегай П.В., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 4 т.31, 2022 года.
Бесплатный доступ
Разработана технология создания и применения гибких дозиметрических сборок с люминесцентными микрокристаллами LiF:Mg,Ti (размеры около 0,1 мм) для автономных измерений пространственного распределения поглощённой дозы внутри полостных органов риска (прямая кишка, уретра, влагалище) при высокомощностной брахитерапии в онкогинекологии. Переход от применения люминесцентных дозиметров LiF:Mg,Ti с макроразмерами (более 1 мм) к микродозиметрам с размерами около 0,1 мм, в сочетании с разработанными протоколами оценки доз с использованием миниаликвот (10 мг) микродозиметров, обеспечили возможность более точного измерения в терапевтическом диапазоне доз при высокомощностной брахитерапии гинекологических злокачественных новообразований. Разработанная технология внутриполостной дозиметрии при высокомощностной брахитерапии (источник 129Ir) в онкогинекологии апробирована в клинике (25 пациенток). Установлено, что, как правило, измеренные дозы хорошо согласуются с расчётными дозами. Однако в четырёх случаях (16% от всех пациенток) было установлено, что в уретре и прямой кишке имело место превышение измеренных локальных поглощённых доз над расчётными: от 0,6 до 1 Гр (в области максимальных расчётных доз). Эти случаи можно рассматривать как основание для наблюдения за состоянием пациентов в посттерапевтическом периоде. Тем не менее, величины максимальной дозы находились в допустимом диапазоне, рекомендованном GEC-ESTRO. Разработанная технология и сроки измерений микродозиметров позволяют корректировать дозиметрические планы при мультифракционной высокомощностной брахитерапии. Результаты клинической апробации разработанной технологии « ин виво » дозиметрии показывают её значимость как необходимого элемента дозиметрического обеспечения качества высокомощностной брахитерапии в онкогинекологии.
Ин виво дозиметрия, люминесцентные микродозиметры, высокомощностная брахитерапия, онкогинекология
Короткий адрес: https://sciup.org/170196155
IDR: 170196155 | УДК: 618.1-006.6-085.849.1 | DOI: 10.21870/0131-3878-2022-31-4-119-131
Текст научной статьи Внутриполостная "ин виво" дозиметрия при высокомощностной брахитерапии в онкогинекологии
Злокачественные новообразования женских репродуктивных органов занимают ведущее место в структуре частоты встречаемости среди онкологических заболеваний у женщин. Одним из эффективных методов радиотерапии злокачественных опухолей различной этиологии и локализации является брахитерапия. Она позволяет создавать оптимальные дозы облучения в очаге опухоли при минимизации доз в окружающих здоровых тканях [1-6]. Применение «ин виво» дозиметрии (ИВД) при брахитерапии необходимо для инструментальной верификации расчётных (планируемых) доз облучения очага и органов риска пациента [7, 8]. Различия между расчётными и реальными дозами облучения опухоли, нормальных органов и тканей могут иметь место не только вследствие возможных ошибок при дозиметрическом планировании радиотерапии, но и в результате подвижности и соответствующих непредсказуемых вариаций геометрии органов и
Богачева В.В.* – c.н.с., к.б.н.; Степаненко В.Ф. – зав. лаб., д.б.н., проф.; Крикунова Л.И. – зав. отд., д.м.н., проф.; Петухов А.Д. – н.с., к.б.н.; Кулиева Г.З. – м.н.с.; Колыженков Т.В. – в.н.с., к.б.н.; Коротков В.А. – зав. отд., к.м.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России. Жарова Е.П. – уч. секретарь; Шегай П.В. – зам. ген. директора, к.м.н. ФГБУ «НМИЦ радиологии» Минздрава России. Иванов С.А. – директор МРНЦ им А.Ф. Цыба, чл.-корр. РАН, д.м.н., проф. кафедры РУДН.; Каприн А.Д. – ген. директор ФГБУ «НМИЦ радиологии» Минздрава России, зав. кафедрой РУДН, акад. РАН, д.м.н., проф.
тканей, изменений расстояний между источником излучения и органами пациента. При брахитерапии, когда имеет место большой пространственный градиент дозы, эти изменения в расстояниях могут существенно влиять на распределение доз в областях интереса по сравнению с тем распределением доз, которое планировалось до сеанса брахитерапии [9]. Поэтому использование методов ИВД для снижения риска возможных посттерапевтических лучевых осложнений рекомендуется в документах ВОЗ, МАГАТЭ, МКРЗ и МКРЕИ [7, 10-13] – как существенный элемент дозиметрического обеспечения качества радиотерапии.
Типичными примерами полостных органов риска, где необходим инструментальный контроль доз облучения при брахитерапии злокачественных новообразований женских репродуктивных органов, являются прямая кишка, уретра, мочевой пузырь и вагина [14, 15]. Инструментальная верификация расчётных (планируемых) доз облучения необходима для своевременного принятия мер по профилактике и лечению возможных лучевых осложнений, для корректировки дозиметрических планов при мультифракционной брахитерапии, обеспечения дозиметрических гарантий качества брахитерапии.
Материалы и методы исследования
В работе применены микрокристаллы LiF:Mg,Ti с размерами около 0,1 мм, полученные путём их сортировки по размерам из порошковой смеси кристаллов или же после механического измельчения термоспекаемых компаундов LiF:Mg,Ti. Для регистрации интенсивности термо-сти-мулированной радиационно-обусловленной люминесценции (ТЛ) от микрокристаллов LiF:Mg,Ti применялся полуавтоматический ТЛ ридер исследовательского класса «Harshaw TLD™ Model 3500» c программным обеспечением TLD-Shell. Интенсивность излучаемой люминесценции, измеряемой с помощью ФЭУ в режиме счёта единичных фотонов, пропорциональна поглощённой дозе ионизирующего излучения. Количественная связь между дозой облучения и интенсивностью стимулированной люминесценции устанавливается с помощью процедуры дозиметрической калибровки. Калибровочный источник 90Sr/90Y был поверен на вторичном образцовом источнике 60Co МРНЦ им. А.Ф. Цыба и прошёл международное интерсличение [16-18]. Наличие специального планшета с контролируемым нагревом обеспечивает считывание люминесценции от миниаликвот микрокристаллов LiF:Mg,Ti (масса 10 мг), размещаемых в виде монослоя на планшете.
После дозиметрических измерений на системе «Harshaw 3500» с использованием калибровочных дозовых зависимостей создаются соответствующие базы дозиметрических данных для каждого пациента. Для каждого органа риска и каждой пациентки строятся численные последовательности «величина поглощённой дозы и её погрешность – глубина расположения микродозиметров в органах риска». Величины расчётных (планируемых) доз в местах расположения микродозиметров в органах риска получаются с помощью программы дозиметрического планирования BrachyVision после соответствующего оконтуривания органов риска на изображениях, полученных при компьютерной томографии пациенток в процессе дозиметрического планирования. Графические построения полученных численных последовательностей пространственного распределения доз облучения очага и органов риска выполняются с использованием программных средств Microcal Origin 6.0. В результате получается численная и графическая информация для сравнения измеренных и расчётных доз в органах риска у каждой пациентки.
Результаты исследования
Технология измерений радиационно-обусловленной стимулированной люминесценции микрокристаллов LiF:Mg,Ti
Микрокристаллы LiF:Mg,Ti сортировали по размерам с использованием набора специальных сит в условиях ультразвуковой вибрации. Применяли микрокристаллы с размерами 0,1 мм, так как такие размеры создают возможность формирования гибких дозиметрических минисборок для их дальнейшего использования для внутриполостного измерения пространственного распределения доз облучения при брахитерапии [9, 16-18]. После сортировки по размерам микрокристаллы подвергали отжигу в течение 1 ч при температуре 400 оC, что необходимо для «снятия» радиационно-обусловленной люминесценции за счёт возможных предыдущих радиационных воздействий, в том числе в результате фонового облучения за период их хранения. После охлаждения микрокристаллов до комнатной температуры на высокоточных аналитических весах отмеряли аликвоты микрокристаллов массой 10 мг, что было достаточно и необходимо для их равномерного распределения тонким монослоем на подложке применяемой для измерений установке «Harshaw 3500». Для построения калибровочных дозовых зависимостей аликвоты подвергали облучению поверенным источником 90Sr/90Y при мощности дозы 2,99 мГр/с. Регистрацию радиационно-обусловленной термостимулированной люминесценции от каждой аликвоты проводили при контролируемой скорости нагрева 3 oС/с в диапазоне от комнатной температуры до 300 oC.
Таблица 1
Параметры отжига микродозиметров LiF:Mg,Ti перед их использованием и параметры измерений радиационно-обусловленной интенсивности термостимулированной люминесценции на установке «Harshaw 3500»
|
ПАРАМЕТРЫ ОТЖИГА |
|
|
Температура предварительного отжига (до облучения) Длительность предварительного отжига Длительность последующего охлаждения до комнатной температуры Интервал температуры остывания |
400 °С 1 ч не менее 1 ч от 400 °С до 25 °С |
|
ПАРАМЕТРЫ ИЗМЕРЕНИЙ |
|
|
Преднагрев Скорость преднагрева Диапазон температуры при термостимуляции и считывании люминесценции Скорость нагрева при термостимуляции Температурный диапазон регистрации интенсивности радиационно-обусловленной термостимулированной люминесценции Температурный диапазон интегрирования пика интенсивности радиационно-обусловленного термостимулированного люминесцентного свечения Остывание Температурный диапазон регистрации фонового термостимулированного люминесцентного свечения Скорость нагрева при регистрации фоновой люминесценции |
от 25 °С до 100 °С 25 °С/c от 100 °С до 300 °С 3 °С/с от 100 °С до 300 °С ±30 °С от максимальной величины пика ТЛ от 300 °С до 100 °С от 100 °С до 300 °С 3 °С/с |
В табл. 1 приведены выбранные параметры отжига микродозиметров перед их использованием и параметры измерений на установке «Harshaw 3500» радиационно-обусловленной интенсивности термостимулированной люминесценции микрокристаллов LiF:Mg,Ti с размерами около 0,1 мм, отсортированных с помощью набора сит с микроячейками и полученных из термоспекаемого материала.
Дозиметрические характеристики исследованных микрокристаллов LiF:Mg,Ti в терапевтическом диапазоне доз
На рис. 1 приведены результаты исследования зависимости интенсивности радиационно-обусловленной термостимулированной люминесценции микрокристаллов LiF:Mg,Ti с размерами около 100 мкм от температуры нагрева при разных дозах облучения. Для регистрации доз облучения использовали высокотемпературный пик интенсивности люминесценции, соответствующий 245 оС. В отличие от пика в области 245 оС, пики, соответствующие более низким температурам, менее выражены и характеризуются быстрым уменьшением своей величины в зависимости от времени (фединг) при комнатной температуре. Установлено, что с увеличением дозы облучения в терапевтическом диапазоне доз положение максимума высокотемпературных пиков несколько смещается в сторону более высоких температур. Поэтому для того, чтобы обеспечить более высокую точность результатов оценки доз был выбран интегральный метод, а именно, интенсивность люминесцентного излучения оценивалась по его площади (интегралу), вычисляемому в диапазоне ±30 оC от положения регистрируемого максимума пика высвечивания в области 245 оС для каждой из доз облучения. Этот приём обработки данных также вошел в протокол, описывающий параметры технологии измерений (табл. 1).
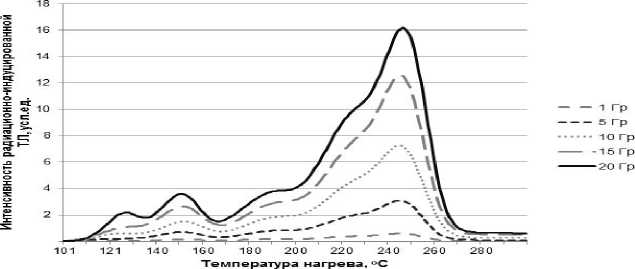
Рис. 1. Зависимость интенсивности радиационно-обусловленной термостимулированной люминесценции (ТЛ) от температуры нагрева при разных дозах облучения микрокристаллов LiF:Mg,Ti с размерами 100 мкм.
На рис. 2 приведена зависимость интенсивности радиационно-обусловленной термостимулированной люминесценции от скорости нагрева исследуемых микрокристаллов LiF:Mg,Ti.

Скорость нагрева. °С/с
Рис. 2. Зависимость интенсивности радиационно-обусловленной термостимулированной люминесценции (ось ординат) от скорости нагрева микрокристаллов LiF:Mg,Ti (ось абсцисс).
Для протокола измерений была выбрана скорость нагрева 3 °С/c (табл. 1), так как практически при тех же величинах интенсивности термостимулированного люминесцентного сигнала и его погрешности, что и при 1 °С/c, скорость 3 °С/c контролируется с большей точностью и в то же время обеспечивает достаточно высокую оперативность измерений.
Для пересчёта величины измеренной интенсивности радиационно-обусловленного термостимулированного люминесцентного сигнала к величине поглощённой дозы использовали калибровочные дозовые зависимости в терапевтическом диапазоне доз. Пример такой зависимости представлен на рис. 3.
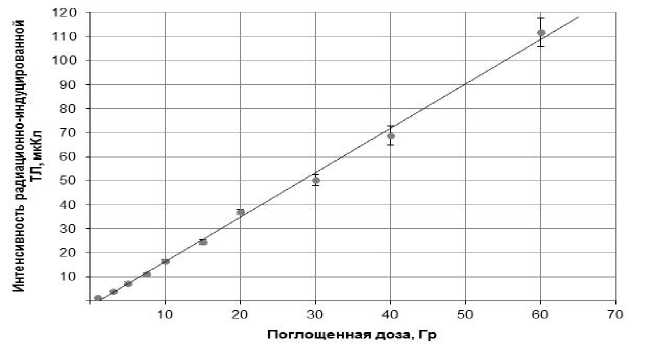
Рис. 3. Пример калибровочной дозовой зависимости интенсивности радиационно-обусловленной термостимулированной люминесценции микрокристаллов LiF:Mg,Ti (ось ординат) в терапевтическом диапазоне доз (1-60 Гр) – ось абсцисс. Указанные на рисунке погрешности соответствуют двум стандартным отклонениям (2 SD).
Установлено, что люминесцентные тканеэквивалентные микродозиметры в виде микрокристаллов с размерами около 100 мкм из термоспекаемых компаундов LiF:Mg,Ti имеют линейный дозовый отклик при термостимуляции радиационно-обусловленной люминесценции в широком диапазоне терапевтических доз облучения – от 1 до 60 Гр, с коэффициентом линейной корреляции 0,9999 при p<0,0001. Погрешность измерений не превышает 3,2% (2 SD).
Дозиметрические сборки из люминесцентных микрокристаллов LiF:Mg,Ti и их клиническое применение
Для проведения внутриполостной ИВД при адъювантной высокомощностной брахитерапии (ВМБТ) в онкогинекологии изготавливали по три дозиметрические минисборки длиной до 20 см из люминесцентных микродозиметров LiF:Mg,Ti, размещаемых в трубках из ПХВ [9, 16-18]. Диаметр гибких герметичных сборок не превышал 1 мм, что необходимо для их расположения внутри полостных органов с помощью катетеров. Одна сборка предназначена для размещения на вагинальном эндостате, а две другие сборки вставляются внутрь ректального и уретрального катетеров – для измерений пространственного распределения поглощённых доз по глубине размещения сборок микродозиметров в органах риска. При апробации технологии все процедуры по размещению сборок микродозиметров в полостных органах риска проводились в радиологической клинике МРНЦ им. А.Ф. Цыба непосредственно онкологами-радиологами в соответствии с Протоколом, утверждённым Этическим комитетом МРНЦ им. А.Ф. Цыба. После введения катетеров и эндостата пациентке проводили компьютерную томографию, что необходимо для создания дозиметрического плана проведения высокомощностной брахитерапии с использованием программы BrachyVision. Определяли мишень облучения и критические органы на поверхности мультимодальных изображений. Положение дозиметрических сборок хорошо визуализирова- лось (рис. 4).
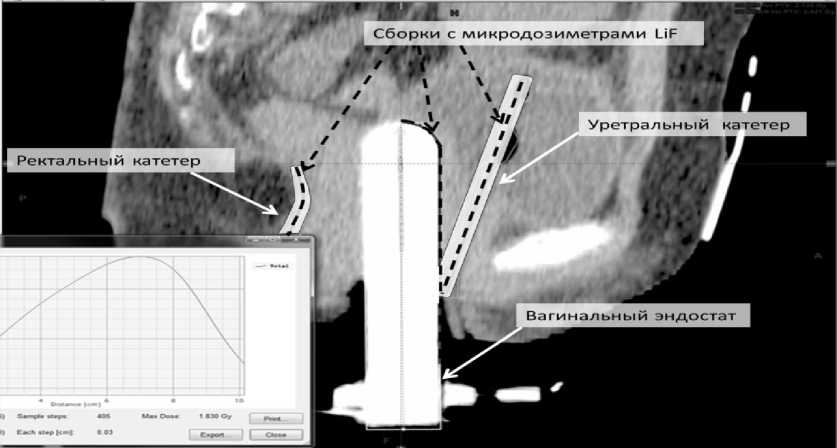
Рис. 4. КТ-изображение расположений уретральной, ректальной и вагинальной сборок микродозиметров LiF:Mg,Ti в катетерах и на эндостате. Положение минисборок микродозиметров хорошо визуализируется.
Результаты анализа данных, полученных при апробации внутриполостной «ин виво» люминесцентной дозиметрии органов риска в процессе высокомощностной брахитерапии в онкогинекологии в сравнении с расчётными (планируемыми) дозами облучения
При клинической апробации разработанной технологии получены данные о пространственном распределении измеренных доз в полостных органах риска у 25 пациенток при ВМБТ в онкогинекологии. Измерения пространственных распределений поглощённых доз в полостных органах риска проведены с помощью разработанных сборок люминесцентных микродозиметров LiF:Mg,Ti при адъювантной мультифракционной ВМБТ рака шейки матки источником 192Ir.
Обобщённые результаты измерений для всех 25 пациенток, в сравнении с расчётными дозами, представлены в табл. 2.
Установлено, что, как правило, измеренные дозы хорошо согласуются с расчётными дозами в области очага. Однако, в четырёх случаях (16%) установлено, что в уретре и прямой кишке измеренные дозы превышают расчётные на 0,6-1 Гр в области максимальных величин расчётных доз.
По результатам « ин виво » дозиметрии были построены графики пространственного распределения измеренных доз в уретре и мочевом пузыре, вагине, прямой кишке при брахитерапии опухолей гинекологической сферы – в сравнении с расчётными дозами в местах локализации дозиметрических сборок.
На рис. 5 (а, б, в) приведены типичные примеры пространственного распределения измеренных и расчётных доз для одной из пациенток.
Таблица 2
Обобщённые результаты инструментальной «ин виво» внутриполостной автономной люминесцентной дозиметрии синтетическими микродозиметрами LiF:Mg,Ti в сравнении с расчётными (планируемыми) дозами при брахитерапии в онкогинекологии
|
№ |
Пациент |
Информация о соответствии измеренных и расчётных доз* |
||
|
уретра |
прямая кишка |
вагина |
||
|
1 |
КВВ |
>0,5 Гр (2 SD) |
>0,2 Гр (2 SD) |
+ |
|
2 |
ТНГ |
>0,6 Гр (2 SD) |
>0,1 Гр (2 SD) |
+ |
|
3 |
АИА |
>0,1 Гр (2 SD) |
+ |
+ |
|
4 |
СЗВ |
+ |
>0,6 Гр (2 SD) |
+ |
|
5 |
САВ |
>0,3 Гр (2 SD) |
>0,5 Гр (2 SD) |
+ |
|
6 |
ЗНЮ |
---** |
+ |
+ |
|
7 |
МОХ |
>0,1 Гр (1 SD) |
>0,05 Гр (1 SD) |
+ |
|
8 |
ШЛА |
<0,13 Гр (1SD) |
+ |
>0,15 Гр (1 SD) |
|
9 |
ЛЛИ |
>1 Гр (2 SD) |
+ |
+ |
|
10 |
ШТЮ |
<0,1 Гр (1 SD) |
+ |
>0,05 Гр (1 SD) |
|
11 |
РТЮ |
<0,5 (1 SD) |
<0,8 Гр (1 SD) |
+ |
|
12 |
АМХ |
+ |
<0,6 Гр (1 SD) |
>0,07 Гр (1 SD) |
|
13 |
МНИ |
>0,04 Гр (1 SD) |
+ |
<0,03 Гр (1 SD) |
|
14 |
ЯВВ |
+ |
>0,015Гр (1 SD) |
+ |
|
15 |
ЛНК |
+ |
+ |
>0,05 Гр (1SD) |
|
16 |
КВП |
+ |
< 0,02 Гр (1 SD) |
+ |
|
17 |
ЖМВ |
<0,11 Гр (1 SD) |
+ |
+ |
|
18 |
ГАИ |
<0,5 Гр (1 SD) |
SD |
+ |
|
19 |
КИВ |
<0,95 Гр (1 SD) |
>0,07 Гр (1 SD) |
>0,06 Гр (1 SD) |
|
20 |
ШСЮ |
---** |
+ |
+ |
|
21 |
КЛГ |
>0,2 Гр (2 SD) |
>0,5 Гр (2 SD) |
+ |
|
22 |
ЧВВ |
<0,04 Гр (1 SD) |
+ |
+ |
|
23 |
ХАА |
+ |
+ |
>0,06 Гр (1 SD) |
|
24 |
ЦФА |
>0,15 Гр (1 SD) |
<1,3 Гр (2 SD) |
+ |
|
25 |
НГВ |
+ |
<0,07 Гр (1 SD) |
+ |
Список литературы Внутриполостная "ин виво" дозиметрия при высокомощностной брахитерапии в онкогинекологии
- Иванов С.А., Каприн А.Д., Миленин К.Н., Альбицкий И.А., Иваненко К.В. Результаты применения низкодозной брахитерапии в качестве радикального лечения при раке предстательной железы //Диагностическая и интервенционная радиология. 2015. Т. 5, № 1. C. 73-76.
- Каприн А.Д., Галкин В.Н., Иванов С.А. Роль брахитерапии в лечении локализованных форм рака предстательной железы //Biomedical Photonics. 2015. Т. 4, № 4. C. 21-26.
- Брахитерапия /под общ. ред. акад. РАН А.Д. Каприна, чл.-корр. РАН Ю.С. Мардынского. Обнинск: МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2017. 244c.
- Кутревелис П. Новый метод лечения рака предстательной железы /под ред. А.Ф. Цыба. М.: Открытое Решение, 2007. 167 с.
- Brachytherapy: applications and techniques. 2nd ed. /Eds.: Ph.M. Devlin, R.A. Cormack, C.L. Holloway, A.J. Stewart. New York: Springer Publishing Company, 2015. 576 p.
- Williamson J.F. Brachytherapy technology and physics practice since 1950: a half-century of progress //Phys. Med. Biol. 2006. V. 51, № 13. P. R303-R325.
- Radiotherapy Risk Profile. WH0/IER/PSP/2008.12. Geneva: WHO, 2008. 51 p.
- Van Dyk J., Barnett R.B., Cygler J.E., Shragge P.C. Commissioning and quality assurance of treatment planning computers //Int. J. Radiat. Oncol. Biol. Phys. 1993. V. 26, N 2. P. 261-273.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Иванников А.И., Борышева Н.Б., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков B.А., Обухов А.А., Анохин Ю.Н. Внутриполостная автономная «ин виво» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: разработка технологии и первые результаты //Радиация и риск. 2017. T. 26, № 2. С. 72-82.
- Development of procedures for in vivo dosimetry in radiotherapy. Human Health Reports No. 8. Vienna: IAEA, 2013. 179 p.
- ICRP, 2005. Prevention of high-dose-rate brachytherapy accidents. ICRP Publication 97 //Ann. ICRP. 2005. V. 35, N 2. P. 1-52.
- ICRP, 2000. Prevention of accidental exposures to patients undergoing radiation therapy. ICRP Publication 86 //Ann. ICRP. 2000. V. 30, N 3. P. 1-70.
- Potter R., Van Limbergen E., Gerstner N., Wambersie A. Survey of the use of the ICRU 38 in recording and reporting cervical cancer brachytherapy //Radiother. Oncol. 2001. V. 58, N 1. P. 11-18.
- Allahverdi M., Sarkhosh M., Aghili M., Jaberi R., Adelnia A., Geraily G. Evaluation of treatment planning system of brachytherapy according to dose to the rectum delivered //Radiat. Prot. Dosim. 2012. V. 150, N 3. P. 312-315.
- Suchowerska N., Jackson M., Lambert J., Yin Y.B., Hruby G., McKenzie D.R. Clinical trials of a urethral dose measurement system in brachytherapy using scintillation detectors //Int. J. Radiat. Oncol. Biol. Phys. 2011. V. 79, N 2. P. 609-615.
- Степаненко В.Ф., Бирюков В.А., Каприн А.Д., Галкин В.Н., Иванов С.А., Борышева Н.Б., Карякин О.Б., Мардынский Ю.С., Гулидов И.А., Колыженков Т.В., Обухов А.А., Иванников А.И., Скворцов В.Г., Ахмедова У.А., Богачева В.В., Петухов А.Д., Яськова Е.К., Хайлов А.М., Лепилина О.Г., Санин Д.Б., Коротков В.А., Анохин Ю.Н. «Ин виво» дозиметрия при высокомощностной брахитерапии рака предстательной железы с применением 192Ir: сравнение распределения планируемых и измеренных доз при внутриполостном размещении автономных люминесцентных микродозиметров //Радиация и риск. 2018. T. 27, № 1. С. 77-85.
- Коротков В.А., Бирюков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Борышева Н.Б., Обухов А.А., Колыженков Т.В., Ахмедова У.А., Богачева В.В., Петухов А.Д., Жарова Е.П. Проявления позднего лучевого уретрита в сравнении с инструментальными оценками пространственного внутриполостного распределения доз в органе при выскомощностной брахитерапии рака предстательной железы с применением 192Ir: предварительные результаты //Радиация и риск. 2019. Т. 28, № 1. С. 110-123.
- Богачева В.В., Коротков В.А., Бирюков В.А., Каприн А.Д., Иванов С.А., Степаненко В.Ф., Петухов A.Д., Колыженков Т.В., Ахмедова У.А. Технология внутриполостной «ин виво» дозиметрии с использованием автономных люминесцентных микродозиметров для измерения пространственного распределения поглощённой дозы у пациентов при проведении высокомощностной брахитерапии рака предстательной железы //Вопросы урологии и андрологии. 2019. Т. 7, № 2. С. 39-40.
- Титова В.А., Коконцев Д.А., Белле Т.С. Клинические задачи прямой дозиметрии (in vivo) при контактной лучевой терапии //Biomedical photonics. 2018. T. 7, № 2. С. 19-24.
- Сумин А.В., Медведков А.М., Васильев В.Н., Смыслов А.Ю., Русецкий С.С., Коконцев А.А., Титова B.А., Коконцев Д.А. Верификация работы сцинтилляционного многоканального клинического дозиметра МКД-04 в коллимированном пучке гамма-излучения источника 60Co //Медицинская физика. 2017. Т. 75, №3. С. 24-33.


