Водородные и галогенные связи в трииодаминобензоатах азотистых оснований
Автор: Жеребцов Д.А., Шарутин В.В., Найферт С.А., Регель Р.Л., Раджакумар К., Адонин С.А., Полозов М.А., Спиридонова Д.В., Осипов А.А., Луценко А.И.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 1 т.16, 2024 года.
Бесплатный доступ
Описана кристаллическая структура трех органических солей трииодаминобензойной кислоты (1-3) и моногидрата трииодаминобензойной кислоты (4), особенности строения установлены методом РСА. Соединение 1: C20H19I6N3O6, М 1158,78; моноклинная сингония, пространственная группа - Сс; параметры ячейки: a = 32,0782(10), b = 9,5284(3), c = 9,3745(3) Å; a = 90, β = 90,0(1), g = 90 град; V = 2865,35(16) Å3, Z = 4, ρрасч. = 2,684 г/см3. Соединение 2: C16H15I6N3O4, М 1074,71; моноклинная сингония, пространственная группа - P21/c; параметры ячейки: a = 8,990(5), b = 28,541(11), c = 9,945(5) Å; a = g = 90, β = 91,23(2) град; V = 2551(2) Å3, Z = 4, ρрасч. = 2,798 г/см3. Соединение 3: C17H17I3N2O4, М 694,03; моноклинная сингония, пространственная группа - I2/a; параметры ячейки: a = 36,02(2), b = 7,254(5), c = 16,468(9) Å; a = g = 90, β = 105,29(2) град; V = 4150(4) Å3, Z = 8, ρрасч. = 2,222 г/см3. Соединение 4: C7H6I3NO3, М 532,83; ромбическая сингония, пространственная группа - Iba2; параметры ячейки: a = 30,2146(4), b = 13,9830(2), c = 5,80740(10) Å; a = β = g = 90 град; V = 2453,57(6) Å3, Z = 8, ρрасч. = 2,885 г/см3. Кристаллическая структура двух солей и моногидрата трииодаминобензойной кислоты отличается как доминированием водородных связей, так и наличием множества галогенных связей. Однако соль 7-метилхинолина лишена галогенных связей вследствие особенностей стопочной упаковки плоских молекул. Для двух соединений (3 и 4) определены особенности их термолиза методом синхронного термического анализа (атмосфера - аргон): на первом этапе (52 и 73 °С соответственно) происходит потеря кристаллизационной воды; при 700 °С в условиях термолиза обоих соединений продуктом разложения является стеклоуглерод.
Водородные связи, галогенные связи, трийодаминобензойная кислота, азотистые основания, термолиз
Короткий адрес: https://sciup.org/147243266
IDR: 147243266 | УДК: 548.3 | DOI: 10.14529/chem240111
Текст научной статьи Водородные и галогенные связи в трииодаминобензоатах азотистых оснований
Исследование галогенных связей – нековалентных взаимодействий с участием атомов галогена – составляет быстро развивающуюся отрасль структурной химии [1–7]. Наиболее сильные взаимодействия обычно наблюдаются для иодированных соединений из-за высокой поляризуемости атома иода [8, 9].
3-амино-2,4,6-трииодбензойная кислота – соединение, используемое исследователями во многих областях химии: данная кислота является стандартным соединением при анализе свободных ароматических аминов в рентгенодиагностических исследованиях [10]; N,N'-адипил бис (3-амино-2,4,6-трииодбензойная кислота) – вещество, которое начали использовать в медицине с 50-х годов ХХ века при рентгенологических исследованиях желчных путей и желчного пузыря в качестве рентгеноконтрастного вещества [11].
Соединения трииодаминобензойной кислоты (HTriIABA) с алифатическими и ароматическими азотистыми основаниями представляют интерес с точки зрения формирования в них галогенных связей. Ранее были исследованы особенности нековалентных взаимодействий 2,4,6-трииод-3-аминобензоатов никеля, которые описаны в статье [12]. В качестве оснований удобны- ми объектами являются γ-пиколин, диметиламин и 7-метилхинолин. В работе рассмотрены результаты исследования трех солей, структура которых до сих пор не была известна: γ-Pic(TriIABA)∙(HTriIABA)∙2H2O (1) H2NMe2(TriIABA)∙(HTriIABA) (2) и 7MQuin(TriIABA)∙2H2O (3), а также моногидрата трииодаминобензойной кислоты HTriIABA∙H2O (4).
Экспериментальная часть
Соединения 1 и 3 были приготовлены смешением горячих растворов трииодаминобензойной кислоты и соответствующего основания в соотношении 1 : 1 в растворе вода – ДМФА (70 : 30). Соединение 2 образовалось при длительной выдержке в горячем растворе HTriIABA-вода-ДМФА из-за гидролиза ДМФА с образованием диметиламина. Кристаллы 1 – 3 выращены при медленном охлаждении раствора от 100 °С. Кристаллы 4 выращены при медленном испарении водного раствора HTriIABA. Процессы термолиза 3 и 4 исследовали с помощью синхронного термического анализатора Netzsch STA 449 F1 Jupiter в атмосфере аргона.
Исследование четырех структур было проведено в двух лабораториях с использованием мо-нокристальных дифрактометров: для 1 и 4 – Rigaku XtaLab Synergy-S с детектором HyPix-6000HE, для 2 и 3 – BRUKER D8 Quest.
Первичная обработка экспериментальных данных 1 и 4 и поправка на поглощение выполнены в пакете программ CrysAlisPro (Agilent Technologies) [13]. Сбор, редактирование данных и уточнение параметров элементарной ячейки для 2 и 3 , а также учет поглощения проведены с применением SMART и SAINT-Plus [14]. Структуры соединений 1 – 4 решены с использованием программ Olex2 [15], SHELXS [16] и уточнены в анизотропном приближении для неводородных атомов с помощью программы SHELXL [17]. Положения атомов водорода уточняли с использованием модели «наездника».
Таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджский банк структурных данных (№ 2110029 для 1, № 2048320 для 2, № 2045165 для 3, № 2159588 для 4; ; . Кристаллографические параметры структур и данные дифракционного эксперимента приведены в табл. 1.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структур 1‒4
|
Параметр |
1 |
2 |
3 |
4 |
|
Молекулярная формула |
C 7 H 4 I 3 NO 2 , C 7 H 3 I 3 NO 2 –, C 6 H 8 N+, 2(H 2 O) |
C 7 H 4 I 3 NO 2 , C 7 H 3 I 3 NO 2 –, C 2 H 8 N+ |
C 7 H 3 I 3 NO 2 –, C 10 H 10 N+, 2(H 2 O) |
C 7 H 4 I 3 NO 2 , H 2 O |
|
Брутто-формула |
C 20 H 19 I 6 N 3 O 6 |
C 16 H 15 I 6 N 3 O 4 |
C 17 H 17 I 3 N 2 O 4 |
C 7 H 6 I 3 NO 3 |
|
Молекулярная масса |
1158,78 |
1074,71 |
694,03 |
532,83 |
|
Температура, K |
100,0(1) |
293(2) |
293(2) |
99,9(5) |
|
Сингония |
моноклинная |
моноклинная |
моноклинная |
ромбическая |
|
Пр. гр. |
Cc |
P 2 1 / c |
I2/a |
Iba2 |
|
a , b , c , Å |
32,0782(10), 9,5284(3), 9,3745(3) |
8,990(5), 28,541(11), 9,945(5) |
36,02(2), 7,254(5), 16,468(9) |
30,2146(4), 13,9830(2), 5,80740(10) |
|
α, β, γ, град |
90, 90,0(1), 90 |
90, 91,23(2), 90 |
90, 105,29(2), 90 |
90, 90, 90 |
|
Объем ячейки V , Å3 |
2865,35(16) |
2551(2) |
4150(4) |
2453,57(6) |
|
Z |
4 |
4 |
8 |
8 |
|
ρ расч. , г/см3 |
2,684 |
2,798 |
2,222 |
2,885 |
|
Коэффициент поглощения μ, мм–1 |
6,544 |
7,333 |
4,543 |
59,935 |
|
F (000) |
2104,0 |
1928.0 |
2592,0 |
1904,0 |
|
Размер кристалла, мм |
0,16 × 0,12 × 0,05 |
0,45 × 0,2 × 0,15 |
0,48 × 0,14 × 0,04 |
0,16 × 0,05 × 0,04 |
|
Излучение |
Mo K α (λ = 0,71073) |
Mo K α (λ = 0,71073) |
MoK α ( λ = 0,71073) |
CuK α (λ = 1,54184) |
|
Диапазон углов 2θ, град |
6,228–59,428 |
5,7–57,52 |
5,74–58,5 |
5,85–139,728 |
Окончание табл. 1
|
Параметр |
1 |
2 |
3 |
4 |
|
Диапазоны индексов |
–41 ≤ h ≤ 41 –12 ≤ k ≤ 12, –11 ≤ l ≤ 12 |
–11 ≤ h ≤ 11, –38 ≤ k ≤ 38, –12 ≤ l ≤ 13 |
–48 ≤ h ≤ 49, –9 ≤ k ≤ 9, –22 ≤ l ≤ 21 |
–36 ≤ h ≤ 36, –16 ≤ k ≤ 17, –7 ≤ l ≤ 6 |
|
Измерено отражений |
15640 |
43818 |
44771 |
13276 |
|
Независимые рефлексы |
6065 [ R int = 0,0228, R sigma = 0,0263] |
5937 [ R int = 0,0570, R sigma = 0,0344] |
5593 [ R int = 0,1228, R sigma = 0,0687] |
2288 [ R int = 0,0699, R sigma = 0,0421] |
|
Данные / ограничения / параметры |
6065/2/326 |
5937/0/266 |
5593/0/244 |
2288/1/108 |
|
F 2 |
1,022 |
1,226 |
1,101 |
1,044 |
|
Фактор сходимости R [I> = 2σ (I)] |
R 1 = 0,0169, wR 2 = 0,0358 |
R 1 = 0,0614, wR 2 = 0,1634 |
R 1 = 0,0711, wR 2 = 0,1812 |
R 1 = 0,0488, wR 2 = 0,1235 |
|
Фактор сходимости R [все данные] |
R 1 = 0,0177, wR 2 = 0,0362 |
R 1 = 0,0719, wR 2 = 0,1683 |
R 1 = 0,1110, wR 2 = 0,2028 |
R 1 = 0,0491, wR 2 = 0,1240 |
|
Остаточная электронная плотность, э·Å–3 |
0,37/–0,78 |
1,21/–2,05 |
2,35/–1,77 |
2,13/–1,47 |
Для соединений 2 и 4 (табл. 2) была произведена оптимизация структуры кристалла с периодическими граничными условиями с помощью программного обеспечения CRYSTAL17 [18], применяя обменно-корреляционный функционал B3LYP. Был использован модифицированный базисный набор DZVP для атома иода и базисный набор TZVP для остальных атомов в молекуле. Локализация равновесной геометрии велась с сохранением параметров ячейки кристаллов. Квантово-топологический анализ электронной плотности [19] для оптимизированных структур кристаллов был произведён с помощью программы TOPOND [20].
Для характеристики галогенных связей в исследуемых структурах был применён электронный критерий [21]. Эффективный электронный критерий характеристики связи основан на анализе положения минимумов распределения электронной плотности и электростатического потенциала вдоль линии, соединяющей атомы.
Таблица 2
Результаты топологического анализа структур 2 и 4
|
Нековалентная связь |
Тип связи |
Длина связи, эксперимент, Å |
Длина связи, расчёт, Å |
ρ ( r bcp ), ат. ед. |
∇ 2 ρ ( r bcp ), ат. ед. |
g( r bcp ), ат. ед. |
v( r bcp ), ат. ед. |
|
2 |
|||||||
|
I2∙∙∙H1A |
(I∙∙∙H–N), внутримол. |
2 , 834 |
2 , 7826 |
0 , 0143 |
0 , 0503 |
0 , 0110 |
–0 , 0095 |
|
I2∙∙∙H15 |
(I∙∙∙H–C), межмол. |
3 , 426 |
3 , 2705 |
0 , 0060 |
0 , 0167 |
0 , 0034 |
–0 , 0026 |
|
I2∙∙∙H5 |
(I∙∙∙H–C), межмол. |
3 , 407 |
3 , 3959 |
0 , 0058 |
0 , 0181 |
0 , 0036 |
–0 , 0027 |
|
I1∙∙∙H1B |
(I∙∙∙H–N), внутримол. |
3 , 522 |
2 , 7132 |
0 , 0156 |
0 , 0498 |
0 , 0110 |
–0 , 0096 |
|
I1∙∙∙O3 |
(I∙∙∙O=), межмол. |
2 , 990 |
2 , 9618 |
0 , 0173 |
0 , 0568 |
0 , 0126 |
–0 , 0110 |
|
I1∙∙∙H9B |
(I∙∙∙H–CN), межмол. |
3 , 855 |
3 , 2282 |
0 , 0061 |
0 , 0154 |
0 , 0032 |
–0 , 0025 |
|
I3∙∙∙O4 |
(I∙∙∙O–H), межмол. |
3 , 064 |
3 , 0037 |
0 , 0169 |
0 , 0539 |
0 , 0122 |
–0 , 0109 |
|
I5∙∙∙H15 |
(I∙∙∙H–C), межмол. |
3 , 398 |
3 , 4194 |
0 , 0052 |
0 , 0160 |
0 , 0032 |
–0 , 0024 |
Окончание табл. 2
|
Нековалентная связь |
Тип связи |
Длина связи, эксперимент, Å |
Длина связи, расчёт, Å |
ρ ( r bcp), ат. ед. |
∇ 2 ρ ( r bcp ) , ат. ед. |
g( r bcp ), ат. ед. |
v( r bcp ), ат. ед. |
|
I6∙∙∙O2 |
(I∙∙∙O=), межмол. |
3 , 000 |
2 , 9305 |
0 , 0181 |
0 , 0608 |
0 , 0137 |
–0 , 0121 |
|
I4∙∙∙H8A |
(I∙∙∙H–CN), межмол. |
3 , 382 |
3 , 2737 |
0 , 0054 |
0 , 0141 |
0 , 0029 |
–0 , 0022 |
|
O2∙∙∙H9C |
(O∙∙∙H–CN), межмол. |
2 , 430 |
2 , 2725 |
0 , 0117 |
0 , 0476 |
0 , 0093 |
–0 , 0067 |
|
O2∙∙∙H9A |
(O∙∙∙H–CN), межмол. |
2 , 685 |
2 , 4547 |
0 , 0084 |
0 , 0316 |
0 , 0062 |
–0 , 0046 |
|
O3∙∙∙H1 |
(=O∙∙∙H–O), межмол. |
1 , 760 |
1 , 4838 |
0 , 0758 |
0 , 1491 |
0 , 0607 |
–0 , 0840 |
|
O4∙∙∙H3A |
(H–O∙∙∙H– CN), межмол. |
2 , 266 |
2 , 1074 |
0 , 0166 |
0 , 0694 |
0 , 0140 |
–0 , 0107 |
|
O4∙∙∙N3 |
(H–O∙∙∙N– (CH 3 ) 2 ), межмол. |
2 , 803 |
2 , 8046 |
0 , 0372 |
0 , 1238 |
0 , 0323 |
–0 , 0336 |
|
O1∙∙∙H8B |
(H–O∙∙∙H– CN), меж-мол. |
2 , 855 |
2 , 6095 |
0 , 0064 |
0 , 0229 |
0 , 0045 |
–0 , 0032 |
|
4 |
|||||||
|
I1∙∙∙O3 |
(I∙∙∙OH 2 ), межмол. |
3 , 075 |
3 , 0736 |
0 , 0143 |
0 , 0464 |
0 , 0101 |
–0 , 0086 |
|
I2∙∙∙H1A |
(I∙∙∙H–N), внутримол. |
2 , 992 |
2 , 7544 |
0 , 0144 |
0 , 0495 |
0 , 0108 |
–0 , 0092 |
|
I2∙∙∙H4 |
(I∙∙∙H–C), межмол. |
3 , 484 |
3 , 4795 |
0 , 0044 |
0 , 0135 |
0 , 0026 |
–0 , 0019 |
|
I3∙∙∙I3 |
(I∙∙∙I), межмол. |
3 , 973 |
3 , 9228 |
0 , 0086 |
0 , 0203 |
0 , 0044 |
–0 , 0037 |
|
O2∙∙∙H3A |
(=O∙∙∙H– OH), межмол. |
1 , 887 |
1 , 6656 |
0 , 0478 |
0 , 1434 |
0 , 0419 |
–0 , 0480 |
|
O2∙∙∙H3B |
(=O∙∙∙H– OH), межмол. |
1,926 |
1,7701 |
0 , 0332 |
0 , 1231 |
0 , 0302 |
–0 , 0297 |
|
N1∙∙∙H1A |
(N∙∙∙H–N), межмол. |
2,721 |
2,4866 |
0 , 0098 |
0 , 0324 |
0 , 0064 |
–0 , 0048 |
Обсуждение результатов
Во всех четырех структурах решающую роль играют ионные и водородные связи. В соединениях 1 – 3 происходит перенос протона от карбоксильной группы на неподеленную электронную пару азота органического основания с образованием ионной соли (рис. 1–3). Перенос протона происходит благодаря значительной разнице в константах диссоциации оснований и кислоты. рК а сопряженной кислоты для γ-пиколина и диметиламина равны соответственно 6,05 [22] и 10,64 [23]. Для 7-метилхинолина эта величина неизвестна, но может быть равна 5,0–6,0, поскольку для хинолина она равна 4,94 [24]. По собственным измерениям рКа трииодаминобензойной кислоты равна 3,3, что существенно отличается от бензойной и м-аминобензойной кислоты (4,21 и 4,74 соответственно) благодаря электроноакцепторным свойствам атомов галогена.
Строение солей 1–3 типично для ионных структур, в них отрицательно заряженные атомы кислорода карбоксильных групп анионов ориентированы в направлении атомов азота, несущих положительный заряд в органическом катионе. Соединения 1 и 2 относятся к кислым солям, в них содержатся два эквивалента кислоты на один эквивалент основания. Две молекулы кислоты в них связаны друг с другом с помощью водородных связей, образованных непосредственно между двумя карбоксильными группами в случае соединения 2 или опосредованно через две молекулы воды в случае 1 (рис. 1, 2). Один из протонов кислоты находится у неподеленной электронной пары атома азота γ-пиколина, второй сложно поддается локализации и находится, по-видимому, у неподеленных электронных пар молекул воды или у карбоксильной группы. Расстояния O···O между атомами, образующими в 1 водородную связь, составляют 2,58 и 2,79 Å. Следует отметить и водородную связь длиной 1,812 Å между протоном у пиколина и молекулой воды.
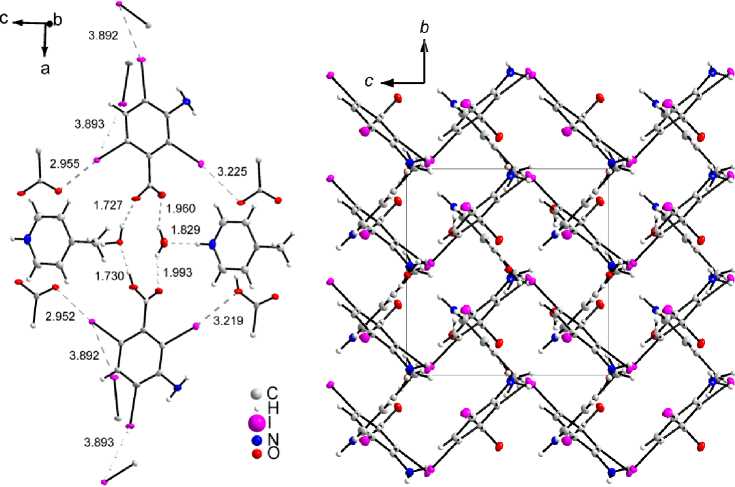
а) б)
Рис. 1. Структура соединения 1. Разорванные линии обозначают водородные связи и кратчайшие контакты I···I и I···O. На рисунках часть атомов соседних молекул опущена для ясности
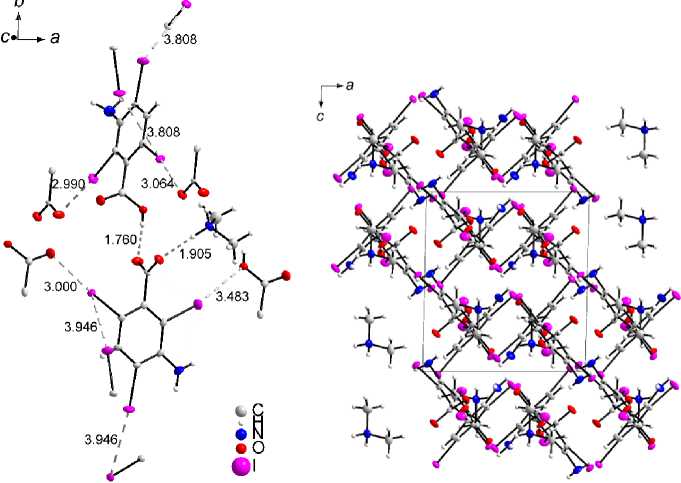
а) б)
Рис. 2. Структура соединения 2. Разорванные линии обозначают водородные связи и кратчайшие контакты I···I и I···O. На рисунке а часть атомов соседних молекул опущена для ясности
Следующими по прочности после ионных и водородных связей в обсуждаемых структурах являются галогенные связи. В 1 кратчайшие расстояния между атомами иода составляют 3,89 Å, что меньше суммы ван-дер-ваальсовых радиусов ароматического иода, а углы между атомами, образующими галогенную связь, близки к идеальным 90°/180° (76°/145°). Кроме этого, в 1 два атома иода участвует в образовании галогенных связей длиной 2,96 и 3,23 Å с участием атомов кислорода карбонильных групп соседних молекул (см. рис. 1). Таким образом, в 1 все три атома иода участвуют в образовании галогенных связей, а именно двух I···I и двух I···O. Плоскости молекул γ-пиколина и трииодаминобензойной кислоты ориентированы перпендикулярно друг другу и параллельно оси a так, что формируют почти квадратную сетку (см. рис. 1). Вместе с тем стопочного мотива не образуется. Структура 1 ламеллярная, подобно многим солям карбоновых кислот она имеет слои анионов типа «хвост к хвосту, голова к голове», при этом карбоксильные группы, молекулы воды и пиколина образуют более полярный слой.
В 2 р е а ли зу е тс я а н а логи ч н ый с 1 ламеллярный мотив. В нем также присутствуют галогенные связи: четыре I···I и четыре I···O на две молекулы кислоты (см. рис. 2). Длина связей иод – иод составляет 3,81 и 3,95 Å при у гла х соответственно 80°/150° и 81°/147°. Рассто ян и я и од –кислород равны 2,99, 3,00 и 3,48 Å. Р ас с тоян ие O···O и O···N между атомами, образующими в 2 водород н у ю связь, с оста в ляе т 2, 5 2 и 2, 80 Å соответственно, близко к таковым в 1 .
В структурный мотив 3 б ольшой вклад вносит плоская форма катиона и ан ион а , об ра зу ю щ их сме ш а н ные с топ к и . У чи т ыв а я б о льшой радиус атомов иода, латеральные разме ры три и од а ми но- бе н зой ной к и с л оты б ли зки к ра зме ру 7 -метилхинолина (рис. 3а). Кроме того, электронная плотность на π- си с те ме к и с ло ты п онижена благодаря электроноакцепторным свой с тв а м тре х а том ов и ода и к а рбок с ильн ой г ру п п ы, а н а 7-метилхинолине – повышена благодаря донорным свойствам мет и л ьн ой г руп п ы. Э то да е т д ополнительный энергетический выигрыш при а льтерн а н тн ой у па ковк е в обще й с топк е мо ле к у л к и слоты и 7-метилхинолина за счет усиления π-π взаимодействия между ними (рис. 3).
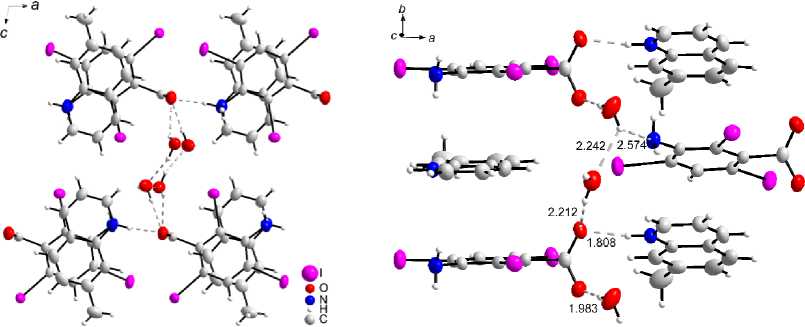
а) б)
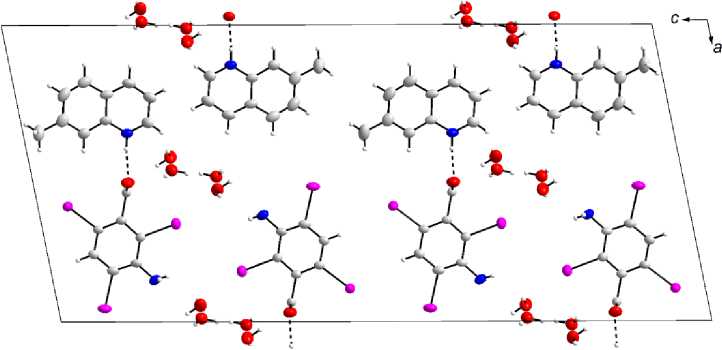
в)
Рис. 3. Структура соединения 3. Разорванные линии обозначают водородные связи
Стопочная упаковка в 3 приводит к меньшей свободе в ориентации молекул кислоты (см. рис. 3). Как результат в 3 отсутствуют галогенные связи. Стопки несколько развернуты от- носительно друг друга (рис. 3б). Расстояние между плоскостями молекул в стопке составляет 3,55 Å, что близко к межплоскостному расстоянию в графите, с учетом большого размера атомов иода. Водородные связи с участием молекул 7-метилхинолина, воды и карбоксильных групп дополнительно объединяют стопки между собой. Расстояния O···O и O···N между атомами, образующими в 3 водородную связь, составляют соответственно 2,83, 2,86, 2,88 и 2,66, 2,98 Å. Последняя величина относится к расстоянию между аминогруппой кислоты и молекулой воды.
В 4 , так же как в 1 и 3 , дом инирующую роль в упаковке молекул играют в о д ород ные с в язи с участием молекул воды (рис. 4) . В 4 , так же как в 3 , водородные связи с участием молекул воды сое д и н яю т д в е с м е жные с топ к и молекул в одну общую колонну (рис. 4б). При этом между сосе д н и ми ка рб о к с и льным и гру ппами помещается одна молекула воды, образ у я бе с к он е чн ы е зигза г ооб р а з н ы е це п очк и . В д оп о лнение к двум водородным, на каждую молек ул у кислоты приходятс я с е мь га ло ге н н ых св язе й : ш е с ть I···I и одна I···O (с участием кислорода молекулы воды) (см. рис. 4 ) . Д ли н а с в язе й и од – иод составляет 3,97, 4,1 и 4,11 Å при углах соответственно 9 8° /151°, 80°/152° и 77°/ 147°. Ещ е о д и н коротк ий к он так т I···I 4,107 Å не является галогенной св я зью, п ос к о льк у у глы ме жд у связями равны 131°/131°. Длина галогенной с в язи и од – кислород равна 3,07 Å. Расстояния O··· O между атомами, образующими в 4 водородную связь, составляют 2,56 и 2,80 Å, бли зко к так ов ым в 1 и 2 . В целом соединения 1 , 2 и 4 имеют много общих особенностей, в том числе обилие г а л огенных связей. Можно отметить, что увеличе н и е чи с ла галоге нных связей в 4, п о сравн ен и ю с 1 и 2 , ожидаемо приводит к увеличению их длины.
а)
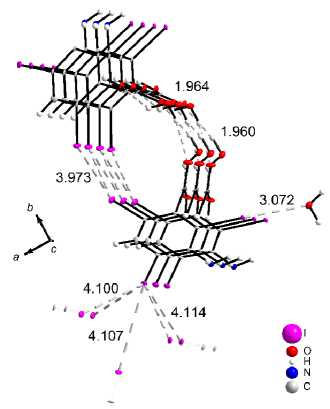
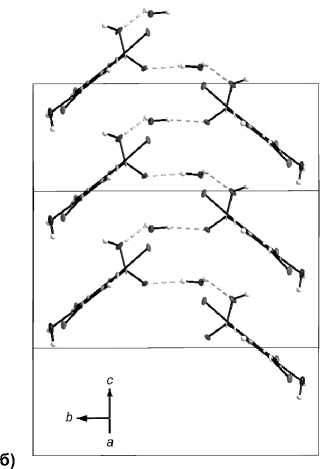
Рис. 4. Структура соединения 4. Разорванные линии обозначают водородные или галогенные связи
М ожн о предп оло жи ть, ч то на взаимное расположение молекул в криста л ли че ск ой ре шё тк е п ов л иял и га л оге н ные и в од ородные связи, так как они образуют цепочку из ме жмо ле к у лярн ы х св я зе й , что м ож ет гов орить о структуроопределяющей роли галогенных и в од ород н ы х с в язе й в да н н ых с тру к турах к рист а ллов .
После оп ти ми з ац ии а томных позиций равновесные расстояния водоро д ных с в язе й с ок ра тились в среднем на 21 %, д ля га ло ге н н ых с в язе й – уменьшились в среднем на 4 %. Наибольшие о т л и чи я п ри л ок а ли за ц и и ра в новесной геометрии наблюдались для структуры 2 , а именно уточн и л а с ь ло к а ли з а ц и я п рот он ов для относительно сильных мостиковых водород н ых с в язе й .
На образование водородных связей указывает наличие критической точки электронной плотности с сигнатурой (3, –1) и короткие расстояния O∙∙∙H между атомами карбоксильных групп и молекулами воды. Анализ величин электронной плотности в критических точках связей показал (см. табл. 2), что водородные связи характеризуются наиболее высокими значениями ρ(rbcp). В структуре 2 для O1–O3∙∙∙H1 ρ(rbcp) = 0,0758 ат. ед. Тем не менее, атом Н1, принимающий участие в образовании самой сильной водородной связи O1–H1∙∙∙O3, остаётся приближённым к ковалентно связанному с ним атому кислорода О1, не смещаясь на центр мостиковой связи между соседними карбоксильными группами. В структуре 4 атомы кислорода соседних карбоксильных групп связаны двумя Н-связями с молекулой воды. Обе водородные связи O3–H3B∙∙∙O2 и O3– H3A∙∙∙O2 сохранили свою неэквивалентность в структуре, полученной в ходе квантовохимических расчетов. Для O2∙∙∙H3A ρ(rbcp) = 0,0478 ат. ед., ρ(rbcp) O2∙∙∙H3B = 0,0332 ат. ед. При этом они выделяются на фоне других нековалентных взаимодействий, в том числе галогенных связей. Наибольшее значение ρ(rbcp) в структуре 2 в критической точке галогенной связи I6∙∙∙O2 составляет 0,0181 ат. ед., а в структуре 4 для I1∙∙∙O3 ρ(rbcp) = 0,0143 ат. ед.
Наличие галогенных связей I3∙∙∙I3 (структура 4 ) и O3∙∙∙I1 (структура 2 ) подтверждается кри тическими точками связей, найденными в ходе квантово -топологического анализа электронной плотности.
Также обнаруженные галоген ные связи характеризуются углами, соответст вующими определ ению ИЮПАК [25] для г алогенных связей (тип II: угол α→180°, угол β→90°). В оптимизированной структуре 2 валентные углы в плоскостях галогенных связей равны: α(С2–I1∙∙∙O3) = 175,59°, β(I1∙∙∙O3–C17) = 118,81°; α(С6–I 3 ∙∙∙O4) = 167,90°, β(I3∙∙∙O4–С17) = 118,39°; α(С16–I6∙∙∙O2) = 175,68°, β(I6∙∙∙O2– С7) = 124,12°. Для структуры 4 соответствующие значения углов равны: α(C5–I3∙∙∙I3) = 150,22°, β(I3∙∙∙I3–C5) = 96,48°; α( C 1–I1∙∙∙O3) = 175,14°, β(I1∙∙∙O3–H3A) = 108,59°. В целом, величины углов, характеризующих галогенные связи, изменилис ь не более чем на 3°.
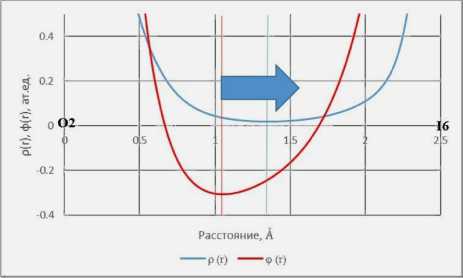
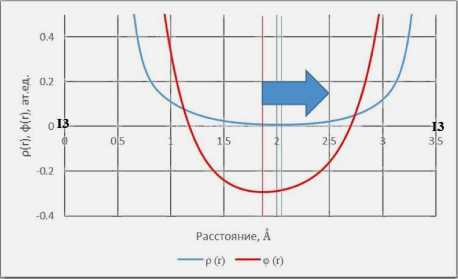
Применение э лектронного к ритерия [4] показало, что нековалентные вз аимодействия I3∙∙∙I3 (в структуре 4 ) и O2∙∙∙I 6 (в структуре 2 ) относятся к типичным галогенным связям. Минимумы электронной плотности ρ( r) и электростатического потенциала φ( r ) вдоль линии связей смещены относительно друг друга, следов ательно, можно сделать вывод о том, что в рассмотренных сл учаях: атом I 6 выступает как донор электрофильного сайта, а O3 является донором электронов (рис. 5а); один из атомов I 3, при нимающий участие в образовании галогенно й связи, выступает в качестве донора электрофильного сайта, а другой атом I3 является донором электронов (рис. 5б).
а) б)
Рис. 5. Выполнение электронного критерия, подтверждающего, что а) O2∙∙∙I6 (2), б) I3∙∙∙I3 (4) относятся к типичным галогенным связям, так как атомы I предоставляют электрофильную область для формирования связи
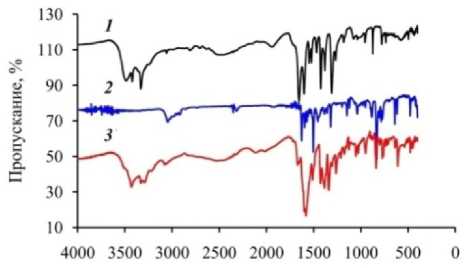
Для 3 было получено достато чное количество чистой фазы для исследован ия его ИК -спектра и термических свойств. ИК-спектр 3 подтверждает его структуру, демонстрируя в целом суперпозицию спектров компонентов (рис. 6). Так, в 3 присутствует плечо около 3496 см–1, соответствующее ва лентным колебаниям молекул кристаллизационной воды, наблюдаемым в моногидрате трииодамино-бензойной кислоты 4 как широкая полоса при 3485 см–1. Полосу около 3426 см–1 в 3 можно сопоставить полосе при 3422 см–1 в трии одаминобензойной кислоте, относящуюся к п ротонам карбоксил ьных групп. Полоса при 3329 см–1 в трииодаминобензойной кислоте после образования 3 разделяется на две: 3329 и 3291 см–1 , что мож но отнести к колебаниям протонов аминогруп пы. Валентные кол е бания ароматических протонов находятся в диапазоне 3076 –2911 см–1. В 4 это единственная полоса при 3057 см–1, в 7- метилхинолине – ряд полос при 3046, 3015, 2982, 2945 и 2915 см–1. В 3 все эти по лосы выявляются как более слабые при 3076, 3053, 3023 и 2911 см–1.
Термограммы 3 и 4 (рис. 7) показывают, что соответственно при 52 и 73 °С они теряют кристаллизационную воду и далее при сравнительно невысоких температурах, 118 и 194 °С соответственно, они плавятся с разложением. Продуктом разложения при нагревании до 700 °С в аргоне в обоих случаях является крупнопористый стеклоуглерод, содержащий по 1–2 масс. % иода и азота. Согласно рентгенофазовому анализу, продукт является аморфным.
Волновое число, см 1
Рис. 6. ИК-спектры соединения 4 ( 1 ), 7-метилхинолина ( 2 ) и соединения 3 ( 3 )
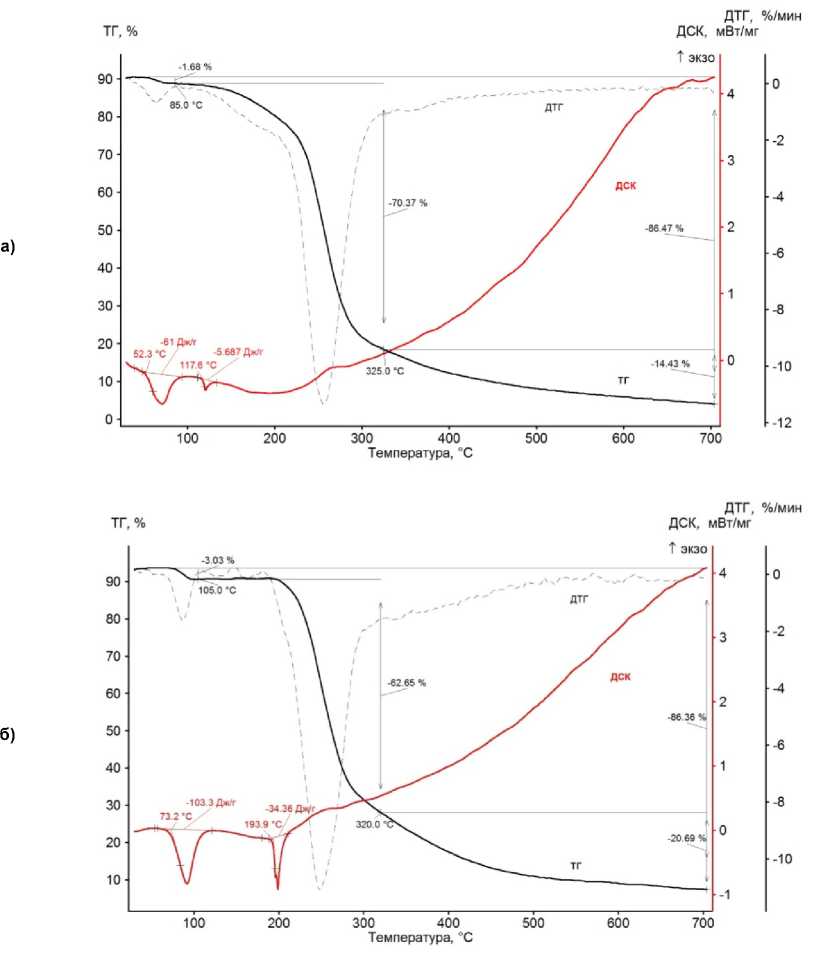
Рис. 7. Термограммы соединений 3 (а) и 4 (б)
Заключение
Наличие множества атомов иода в соединениях 1 , 2 и 4 привело к образованию большого числа галогенных связей. В случае 3 участие крупной плоской молекулы 7-метилхинолина приводит к стопочному мотиву упаковки и отсутствию нековалентных взаимодействий с участием иода. Можно считать, что π-π взаимодействия в этом соединении оказываются сильнее галогенных связей.
Список литературы Водородные и галогенные связи в трииодаминобензоатах азотистых оснований
- Cavallo G., Metrangolo P., Milani R. et al. // Chem. Rev. 2016. V. 116, No. 4. P. 2478. DOI: 10.1021/acs.chemrev.5b00484.
- Mikherdov A.S., Novikov A.S., Boyarskiy V.P. et al. // Nat. Commun. 2020. V. 11, No. 1. P. 1. DOI: 10.1038/s41467-020-16748-x.
- Matveychuk Y.V., Ilkaeva M.V., Vershinina E.A. // J. Mol. Struct. 2016. V. 1119. P. 227. DOI: 10.1016/j.molstruc.2016.04.072.
- Yushina I., Tarasova N, Kim D. et al. // Crystals. 2019. V. 9, No. 10. P. 506. DOI: 10.3390/cryst9100506.
- Politzer P., Lane P., Concha M.C. et al. // J. Mol. Model. 2007. V. 13, No. 2. P. 305. DOI: 10.1007/s00894-006-0154-7.
- Auffinger P., Hays F.A., Westhof E. // Pnas. 2004. V. 101, No. 48. P. 16789. DOI: 10.1073/pnas.0407607101.
- Gilday L.C., Robinson S.W., Barendt T.A. et al. // Chem. Rev. 2015. V. 115, No. 15. P. 7118. DOI: 10.1021/cr500674c.
- Albright E, Cann J., Decken A. // CrystEngComm. 2017. V. 19, No. 7. P. 1024. DOI: 10.1039/C6CE02339H.
- Baykov S.V., Filimonov S.I., Rozhkov A.V. et al. // Cryst. Growth Des. 2020. V. 20. P. 995. DOI: 10.1021/acs.cgd.9b01334.
- Nemcova I., Rychlovsky P., Halirova A. et al. // Anal. Lett. 1999. V. 32, No. 5. P. 925. DOI: 10.1080/00032719908542866.
- Hastings-James R., GlazebrookA.J. // CMAJ. 1955. V. 72, No. 8. P. 561.
- Zherebtsov D.A., Sharutin V.V., Polozov M.A. et al. // J. Struct. Chem. 2022. V. 63. P. 1850. DOI: 10.1134/S0022476622110154.
- CrysAlisPro 1.171.41.103a (Rigaku Oxford Diffraction, 2021).
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. App. Crystallogr. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Sheldrick G.M. // Acta Cryst. A. 2008. V. 64. P. 112. DOI: 10.1107/S0108767307043930.
- Sheldrick G.M. // Acta Cryst. C. 2015. V. 71. P. 3. DOI: 10.1107/S2053229614024218.
- Dovesi R., Erba A., Orlando R. et al. // Wiley Interdiscip. Rev. Comput. Mol. Sci. 2018. V. 8, No. 4. DOI: 10.1002/wcms.1360.
- Бэйдер Р. Атомы в Молекулах: Квантовая Теория. М.: Мир, 2001. 532 с.
- TOPOND a Program for the Topological Analysis of the Electron Density (C. Gatti). URL: https://www.crystal.unito.it/topond/topond.php (дата обращения: 25.07.2023).
- Bartashevich E., Mukhitdinova S., Yushina I. et al. //. Acta Cryst. 2019. V. 75, No. 2. P. 117. DOI: 10.1107/S2052520618018280.
- Химическая Энциклопедия: в 5 т.: т. 5: Триптофан-Ятрохимия / редкол.: Зефиров Н.С. (гл. ред.) и др. М.: Большая Российская энцикл., 1998. 782 с.
- Hall H.K. // J. Am. Chem. Soc. 1957. V. 79, No. 20. P. 5441. DOI: 10.1021/ja01577a030
- Джилкрист Т. Химия гетероциклических соединений. M.: Мир, 1996. 464 с.
- Legon G.R., Ho P.S., Kloo L. et al. // Pure Appl. Chem. 2013. V. 85, No. 8. P. 1711. DOI: 10.1351/PAC-REC-12-05-10.


