Вопросы вакцинации против COVID-19 у реципиентов трансплантатов солидных органов
Автор: Парабина Е.В., Константинов Д.Ю., Каабак М.М., Раппопорт Н.Н., Пушкин С.Ю., Селютин А.А., Навасардян А.С., Масликова У.В., Александрова В.Э., Яремин Б.И.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Новая коронавирусная инфекция COVID-19
Статья в выпуске: 4 (52), 2021 года.
Бесплатный доступ
Цель работы - дать основные ответы на вопросы, посвященные вакцинации реципиентов трансплантатов солидных органов на основе последних источников литературы и клинических рекомендаций. Вакцинация реципиентов трансплантатов солидных органов и лиц, находящихся с ними в постоянном контакте, является обязательным, жизненно важным мероприятием, эффективно снижающим риск смерти от COVID-19. Сомнения в меньшей эффективности в условиях иммуносупрессии или потенциальный риск развития нежелательных реакций значительно уступают риску смерти и развития тяжёлых осложнений. До появления более новых данных режим вакцинации должен строго соответствовать инструкции по медицинскому применению препарата. Перед трансплантацией пациент должен быть обследован по скрининговому протоколу, а также консультирован врачом-трансплантологом, осуществляющим его наблюдение. Возможно, что цельновирионные вакцины (КовиВак) имеют преимущество перед прочими при вакцинации реципиентов солидных органов, но клинический опыт в этом вопросе ещё не получен.
Covid-19, вакцинация, спутник-v, ковивак, реципиенты солидных органов
Короткий адрес: https://sciup.org/143177463
IDR: 143177463 | УДК: 616.9-084-085.371 | DOI: 10.20340/vmi-rvz.2021.4.COVID.2
Текст научной статьи Вопросы вакцинации против COVID-19 у реципиентов трансплантатов солидных органов
УДК 616.9-084-085.371
Cite as: Parabina E.V., Konstantinov D.Yu., Kaabak M.M., Rappoport N.N., Pushkin S.Yu., Selyutin A.A., Navasardyan A.S., Maslikova U.V., Alexandrova V.E. and Yaremin B.I. COVID-19 Vaccination Issues in Solid Organ Transplant Recipients. Bulletin of the Medical Institute Reaviz. Rehabilitation, Doctor and Health. 2021;4(52).
Пандемия новой коронавирусной инфекции COVID-19 продолжает оставаться катастрофой, изменившей жизнь и судьбу всего человечества. К сожалению, прогнозировать сроки конца пандемии в настоящее время не представляется возможным. Лечение COVID-19 у реципиентов трансплантатов солидных органов (РТСО), трансплантации гемопоэтических стоволо-вых клеток (ТГСК) и реципиентов клеточной иммунотерапии может быть сложной задачей из-за наличия сопутствующих заболеваний, цитопений, связанных с трансплантатом, и необходимости хронической иммуносупрессивной терапии для предотвращения отторжения трансплантата и реакции «трансплантат против хозяина». У реципиентов трансплантатов может иметь место повышенный риск контакта с SARS-CoV-2, учитывая их частый контакт с системой здравоохранения. Поскольку иммуноде- прессанты модулируют несколько аспектов иммунного ответа, на тяжесть COVID-19 потенциально может влиять тип и интенсивность иммунодепрессанта. У некоторых реципиентов трансплантата есть сопутствующие соматические заболевания, которые бывают связаны с более тяжелыми случаями COVID-19 и повышенным риском смерти, что затрудняет оценку влияния трансплантации на тяжесть заболевания. Кроме того, лекарства, которые используются для лечения COVID-19, могут представлять различные риски для пациентов, перенесших трансплантацию (рис. 1). На сегодня вакцины имеют решающее значение для сдерживания дальнейшего распространения пандемии. Вопросы вакцинации пациентов из уязвимых групп населения, включая реципиентов трансплантатов солидных органов (РТСО), требуют принципиального ответа.
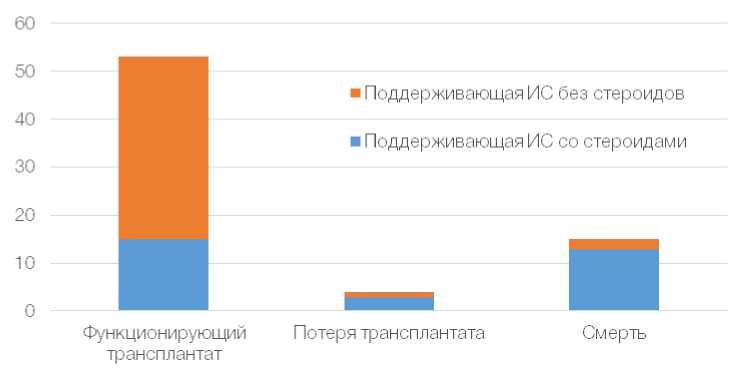
P = 0.00191, n = 72
Рис. 1. Зависимость исхода течения COVID-19 от проводимой иммуносупрессивной терапии по данным научной базы , февраль 2020 – апрель 2021
Fig. 1. Dependence of the outcome of the course of COVID-19 on the ongoing immunosuppressive therapy according to the scientific base , February 2020 – April 2021
В чём специфика процесса вакцинации у РТСО?
Антительный ответ на вакцину COVID-19 у реципиентов трансплантата снижен по сравнению с населением в целом [1–14]. Тем не менее, уровень защитных антител еще не определен. Основываясь на данных, полученных в результате испытаний в общей популяции, существует корреляция между уровнем нейтрализующих антител к белку SARS-CoV-2 и симптоматичностью заболевания. Порог защиты от тяжелого COVID-19 значительно ниже, чем требуется для предотвращения развития вирусной инфекции в целом [15]. Определение защитных уровней антител затруднено из-за большого разнообразия коммерчески доступных тестов на антитела без прямых средств для сравнения результатов различных тестов. Защитные компоненты клеточных (Т-клетки и NK-Т-клетки) и гуморальных ответов (IgG/IgM против IgA) могут не быть связаны у отдельных реципиентов РТСО; возможен активный приобретенный или врожденный иммунный ответ в отсутствие антител и наоборот [3, 6, 9, 10]. Однако клинические последствия этого расхождения неизвестны и не поддаются измерению. Даже при отсутствии «защитных тит- ров антител», вероятно, существует определенная защита от более тяжелого заболевания после вакцинации [16–18].
Так имеет ли смысл вакцинация от COVID-19 у РТСО?
Текущие данные об эффективности, полученные в результате клинических испытаний у иммунокомпрометированных пациентов, уверенно демонстрируют 100 % защиту от тяжелого течения COVID-19, которое может привести к интенсивной терапии или смерти [1–5]. Данные наблюдений в реальном мире продемонстрировали значительную эффективность вакцины в снижении симптоматических заболеваний, госпитализаций и смертности от COVID-19 в разных странах в диапазоне от 88 % до 91 % [6–8]. На сегодняшний день во всем мире было введено около 1,59 миллиарда доз вакцин [9]. Общие побочные эффекты являются локальными для места инъекции и связаны с реактогенностью вакцин. Анафилаксия очень редка и колеблется между 2,47–4,7 случая на миллион доз, введенных для вакцины с мРНК; 60 % пациентов с анафилаксией имели в анамнезе аллергические реакции в анамнезе, и о связанной с этим смерти не сообщалось [10, 11]. Инду- цированная вакциной иммунная тромбоцитопения (VITT), ассоциированная с тромбозом, является редким серьезным неблагоприятным явлением, недавно выявленным при применении аденовирусных векторных вакцин, с совокупной оценкой частоты 0,73/100000 человек, вакцинированных однократной дозой [12–15]. Появляются данные об эффективности вакцины против SARS-CoV-2 у реципиентов трансплантатов, демонстрирующих серологический ответ у до 50 % реципиентов трансплантата после двух доз мРНК-вакцин [16–20]. Одно исследование у реципиентов легкого выявило Т-клеточный ответ в трети случаев, без обнаруживаемых анти-спайк-IgG [20]. Вакцины в целом демонстрируют безопасность в популяции трансплантатов, не опасаясь отторжения или других серьезных побочных эффектах в ранний период после введения [21]. Риск отторжения, вероятно, останется низким и не будет отличаться от того, который наблюдался в предыдущих исследованиях вакцины адъювантной вакцины против опоясывающего лишая или высоких доз вакцины против гриппа у реципиентов трансплантатов [22, 23].
Каков риск отторжения трансплантата или развития опасных осложнений вакцинации от COVID-19 у РТСО?
Поступил как минимум один отчет о нетяжелом отторжении после вакцинации. Данных о фатальных осложнениях вакцинации или потере трансплантата у РТСО на настоящий момент в литературе не приводится. Таким образом, риск развития осложнений COVID-19 выше, чем потенциальный риск вакцинации.
Существует ли необходимость отмены или коррекции дозировки иммуносупрессивной терапии при вакцинации РТСО от COVID-19?
В настоящее время нет данных, подтверждающих необходимость корректировки иммуносупрессии в ожидании повторной вакцинации. Несмотря на указание в инструкциях по медицинскому применению некоторых вакцин, отмена иммуносупрессивной терапии на время вакцинации недопустима. Перед вакцинацией у РТСО необходима консультация ведущим пациента трансплантологом на предмет нормализации иммуносупрессии и устранения избыточной супрессии, особенно за счёт препаратов цитостатического действия (микофе-нолаты, азатиоприн). Международные эксперты не рекомендуют изменять иммуносупрессию специально в связи с вакцинацией, так как риск отторжения может быть выше.
Каков круг лиц, подлежащих вакцинации?
Кандидаты на трансплантацию солидных органов в листах ожидания почки, поджелудочной железы должны быть привиты в обязательном порядке при отсутствии абсолютных противопоказаний. Ряд центров трансплантации почки в настоящее время не выполняет трансплантацию пациентам, не прошедшим вакцинацию от COVID-19. В листах ожидания трансплантации печени и сердца вакцинация производится с учётом тяжести состояния и должна проводиться у подавляющего большинства пациентов.
Все РТСО, не привитые ранее, в течение двух месяцев после трансплантации и далее должны быть вакцинированы против SARS-CoV-2 с использованием разрешенных на местном уровне вакцин. Все домочадцы и близкие контакты РТСО должны быть также вакцинированы против SARS-CoV-2, чтобы минимизировать риски инфицирования в окружении для реципиента. Несомненно, должны быть вакцинированы ВСЕ медицинские работники, осуществляющие профессиональный контакт с РТСО.
В какие сроки необходимо выполнение вакцинации РТСО?
Большинство авторов рекомендует отложить вакцинацию как минимум на один месяц после операции трансплантации и как минимум на три месяца после использования агентов, истощающих Т-лимфоциты, таких как антитимоцитарный глобулин или ритуксимаб. В случае выполнения трансплантации между введениями доз вакцины, следует отложить вторую дозу до, по крайней мере, одного месяца после операции по трансплантации, если не использовался агент, истощающий Т-клетки/В-клетки для индукции или по крайней мере через три месяца после операции по трансплантации, если для индукции использовался агент, истощающий Т-клетки/В-клетки.
Каков интервал между дозами вакцины и количество введений вакцины?
Существует клинический опыт трехкратного введения вакцин, вместо двухкратного, для достижения более эффективного иммунитета у РТСО. Однако до официальной регистрации подобных схем, необходимо строго следовать инструкциям производителей и нормативным требованиям в отношении интервала между введениями первой и второй доз.
Каковы мероприятия лабораторного контроля перед и после вакцинации?
Перед вакцинацией желательно исследование нейтрализующих антител к домену связывания рецептора спайк-белка (RBD) SARS-CoV-2 (вирус-нейтрализующих антител), но их прогностическое значение до конца остается неизвестным. Не существует общепризнанного титра, который был бы определен как защитный от инфекции SARS-CoV-2. Клеточные защитные реакции могут возникать и в отсутствие определяемых антител. Рутинное определение антител после вакцинации не рекомендуется большинством авторов, так как оно не коррелирует с протективным действием вакцины. Необходимо выполнение стандартных скрининговых исследований перед вакцинацией, которые выполняются пациенту на регулярной основе.
Каков санитарнопротивоэпидемический режим РТСО после вакцинации?
Хотя варианты COVID-19 продолжают циркулировать в обществе, а степень защиты у реципиентов трансплантата все еще неизвестна, рекомендуется, чтобы кандидаты на трансплантацию и РТСО продолжали придерживаться защитных мер, включая ношения масок в общественных местах, социальное дистанцирование, частое мытье рук и избегание скопления людей внутри помещений.
Какова предпочтительная вакцина против COVID-19 при вакцинации РТСО?
Международные рекомендации не выделяют какого-либо класса из вакцин против новой коронавирусной инфекции, более предпочтительного при вакцинации реципиентов солидных органов. Единственной из зарегистрированных в настоящее время в России вакцин, упомянутой в рекомендациях AST, ISHLT, ASTS, TTS, является Гам Ковид Вак (Спутник V) с эффективностью в отношении развития заболевания 91,4 % и в отношении фатального исхода 100 %. Рекомендации признают достоверную высокую клиническую эффективность данной вакцины, в том числе при вакцинации реципиентов донорских органов. В то же время, опасения в недостаточной выработке иммунитета на фоне постоянной иммуносупрессивной терапии, позволяют предположить, что использование цельновирионной вакцины позволит достичь выработки более гармоничного иммунитета. Цельновирионные вакцины позволяют стимулировать как развитие клеточного иммунитета, так и гуморального за счёт выработки антител против нуклепротеина, S-белка и домена RBD. В этом случае использование единственной зарегистрированной цельновирионной вакцины в нашей стране – Кови-Вак – у РТСО может являться более предпочтительным, хотя клинические данные для такого суждения ещё не получены.
Каков основной выводо вакцинации у РТСО?
Вакцинация РТСО и лиц, находящихся с ними в постоянном контакте, является обязательным, жизненно важным мероприятием, эффективно снижающем риск смерти от COVID-19. Сомнения в меньшей эффективности в условиях иммуносупрессии или потенциальный риск развития нежелательных реакций значительно уступают риску смерти и развития тяжёлых осложнений. До появления более новых данных режим вакцинации должен строго соответствовать инструкции по медицинскому применению препарата. Перед вакцинацией пациент должен быть обследован по скрининговому протоколу, а также консультирован врачом-трансплантологом, осуществляющим его наблюдение. Возможно, что цельновирионные вакцины (КовиВак) имеют преимущество перед прочими при вакцинации реципиентов солидных органов, но клинический опыт в этом вопросе ещё невелик.
Список литературы Вопросы вакцинации против COVID-19 у реципиентов трансплантатов солидных органов
- Boyarsky BJ, Werbel WA, Avery RA, Tobian AAR, Massie AB, Segev DL, Garonzik-Wang JM: Antibody Response to 2-Dose SARS-CoV-2 mRNA Vaccine Series in Solid Organ Transplant Recipients. JAMA. 2021.
- Benotmane I, Gautier-Vargas G, Cognard N, Olagne J, Heibel F, Braun-Parvez L et al. Weak anti-SARS-CoV-2 antibody response after the first injection of an mRNA COVID-19 vaccine in kidney transplant recipients. Kidney Int. 2021.
- Sattler A SE, Weber U, Potekhin A, Bachmann F, Budde K, Storz E, Proß V, Bergmann Y, Thole L, Tizian C, Hölsken O, Diefenbach A, Schrezenmeier H, Jahrsdörfer B, Zemojtel T, Jechow K, Conrad C, Lukassen S, Stauch D, Lachmann N, Choi M, Halleck F, Kotsch K. MedRxv. https://doi.org/10.1101/2021.04.06.21254963. Accessed 4/19/2021.
- Impaired Humoral and Cellular Immunity after SARS-CoV2 BNT162b2 (Tozinameran) Prime-Boost Vaccination in Kidney Transplant Recipients. Available from: Yi SG, Knight RJ, Graviss EA, Nguyen DT, Ghobrial RM, Gaber AO et al. Kidney Transplant Recipients Rarely Show an Early Antibody Response Following the First COVID-19 Vaccine Administration. Transplantation. 2021.
- Peled Y RE, Lavee J, Sternik L, Segev A, Wieder-Finesod A, Mandelboim M, Indenbaum V, Levy I, Raanani E, Lustig Y, Rahav G. BNT162b2 vaccination in heart transplant recipients: clinical experience and antibody response. J Heart Lung Transplant. 2021.
- Havlin J SM, Dvorackova E et al. Immunogenicity of BNT162b2 mRNA COVID19 Vaccine and SARS-CoV-2 Infection in Lung Transplant Recipients. Journal of Heart and Lung Transplantation. 2021.
- Narasimhan M ML, Clark AE, Usmani A, Cao J, Raj E, Torres F, Sarode R, Kaza V, Lacelle C, Muthukumar A. Serological Response in Lung Transplant Recipients after Two Doses of SARS-CoV-2 mRNA Vaccines. medRxiv 2021.
- Shostak Y SN, Heching M, Rosengarten D, Shtraichman O, Shitenberg D, Amor SM, Yahav D, Zvi HB, Pert-zov B, Kramer MR. Early humoral response among lung transplant recipients vaccinated with BNT162b2 vaccine. The Lancet Resp Med. 2021. v. 5 07.13.2021
- Miele M, Busa R, Russelli G, Sorrentino MC, Di Bella M, Timoneri F et al. Impaired anti-SARS-CoV-2 Humoral and Cellular Immune Response induced by Pfizer-BioNTech BNT162b2 mRNA Vaccine in Solid Organ Transplanted Patients. Am J Transplant. 2021.
- Cucchiari D, Egri N, Bodro M, Herrera S, Del Risco-Zevallos J, Casals-Urquiza J et al. Cellular and humoral response after mRNA-1273 SARS-CoV-2 vaccine in kidney transplant recipients. Am J Transplant. 2021.
- Rozen-Zvi B, Yahav D, Agur T, Zingerman B, Ben-Zvi H, Atamna A et al. Antibody response to SARS-CoV-2 mRNA vaccine among kidney transplant recipients: a prospective cohort study. Clin Microbiol Infect. 2021.
- Rabinowich L, Grupper A, Baruch R, Ben-Yehoyada M, Halperin T, Turner D et al. Low immunogenicity to SARS-CoV-2 vaccination among liver transplant recipients. J Hepatol. 2021.
- Grupper A, Rabinowich L, Schwartz D, Schwartz IF, Ben-Yehoyada M, Shashar M et al. Reduced humoral response to mRNA SARS-Cov-2 BNT162b2 vaccine in kidney transplant recipients without prior exposure to the virus. Am J Transplant. 2021.
- Itzhaki Ben Zadok O, Shaul AA, Ben-Avraham B, Yaari V, Ben Zvi H, Shostak Y et al. Immunogenicity of the BNT162b2 mRNA vaccine in heart transplant recipients - a prospective cohort study. Eur J Heart Fail. 2021CHC Inc. (n.d.).
- Khoury, D. S., Cromer, D., Reynaldi, A., Schlub, T. E., Wheatley, A. K., Juno, J. A., Subbarao, K., Kent, S. J., Triccas, J. A., & Davenport, M. P. (2021). Neutralizing antibody levels are highly predictive of immune protection from symptomatic SARS-CoV-2 infection. Nature Medicine. https://doi.org/10.1038/s41591-021-01377-8
- Basic-Jukic N, Jelicic I. SARS-CoV-2 infection after two doses of mRNA vaccine in renal transplant recipients. Transpl Infect Dis. 2021:e13628.
- Tsalouchos A, Rossolini GM, Magg L, Mazzoni A, Annunziato F, Dattolo PC. COVID-19 in a kidney transplant recipient after mRNA-based SARS-CoV-2 vaccination. Transpl Infect Dis. 2021:e13649.
- Tau N, Yahav D, Schneider S, Rozen-Zvi B, Abu Sneineh M, Rahamimov R. Severe consequences of COVID-19 infection among vaccinated kidney transplant recipients. Am J Transplant. 2021.
- CDC Director Rochelle Walensky Talks Boosters, Masks and Health Equity. Home - Community Health Center Presents Conversations on Health Care. https://www.chcradio.com/episode/Rochelle-Walensky/579.
- U.S. Department of Health and Human Services. (2021, June 1). NIH clinical trial evaluating mixed COVID-19 vaccine schedules begins. National Institutes of Health. https://www.nih.gov/news-e vents/news-releases/nih-clinical-trial-evaluating-mixed-covid-19-vaccine-schedules-begins
- Kamar, N., Abravanel, F., Marion, O., Couat, C., Izopet, J., & Del Bello, A. (2021). Three Doses of an mRNA Covid-19 Vaccine in Solid-Organ Transplant Recipients. New England Journal of Medicine. https://doi.org/10.1056/nejmc2108861
- Werbel, W. A., Boyarsky, B. J., Ou, M. T., Massie, A. B., Tobian, A. A. R., Garonzik-Wang, J. M., & Segev, D. L. (2021). Safety and Immunogenicity of a Third Dose of SARS-CoV-2 Vaccine in Solid Organ Transplant Recipients: A Case Series. Annals of Internal Medicine. https://doi.org/10.7326/l21-0282
- Joint Statement about Vaccine Efficacy in Organ Transplant Recipients. AST. ISHLT. ASTS. TTS. TID. IPTA. ISVCA. IRT. IXA. ISODT. SPLIT. I PITA. NATCO. UNOS. CST. ESOT. AASLD. ASHI. ITNS. AOPO. PIDS. https://ishlt.org/ishlt/media/documents/ISHLT-AST_SARS-CoV-2-Vaccination_7-15-21.pdf
- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Perez Marc G, Moreira ED, Zerbini Cet al: Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020.
- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, Angus B, Baillie VL, Barnabas SL, Bhorat QEet al: Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020.
- Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, Diemert D, Spector SA, Rouphael N, Creech CBet al: Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2020.
- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, Kovyrshina AV, Lubenets NL, Grousova DM, Erokhova ASet al: Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021,397(10275):671-681.
- Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial. Accessed 3/13/2021 [https://ir.novavax.com/news-releases/news-release-details/novavax-covid-19-vaccine-demonstrates-893-efficacy-uk-phase-3]
- Dagan N, Barda N, Kepten E, Miron O, Perchik S, Katz MA, Hernan MA, Lipsitch M, Reis B, Balicer RD: BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting. N Engl J Med. 2021.
- Vasileiou E, Simpson CR, Shi T, Kerr S, Agrawal U, Akbari A, Bedston S, Beggs J, Bradley D, Chuter Aet al: Interim findings from first-dose mass COVID-19 vaccination roll-out and COVID-19 hospital admissions in Scotland: a national prospective cohort study. Lancet. 2021;397(10285):1646-1657.
- Pritchard E MP, Stoesser N, Eyre DW, Gethings O, Vihta K, Jones J, House T, VanSteenHouse H, Bell I Bell JI, Newton JN, Farrar J, Diamond A, Rourke E, Studley R, Crook D, Peto T, Walker AS, Pouwels KB, Coro-navirus Infection Survey team: Impact of vaccination on SARS-CoV-2 cases in the community: a population-based study using the UK's COVID-19 Infection Survey. medRxiv Posted April 23, 2021.
- NYT Vaccinations Tracker. Accessed 3/13/21 [https://www.nytimes.com/interactive/2021/world/covid-vaccinations-tracker.html]
- Shimabukuro TT, Cole M, Su JR: Reports of Anaphylaxis After Receipt of mRNA COVID-19 Vaccines in the US-December 14, 2020-January 18, 2021. JAMA. 2021.
- Blumenthal KG, Robinson LB, Camargo CA, Jr., Shenoy ES, Banerji A, Landman AB, Wickner P: Acute Allergic Reactions to mRNA COVID-19 Vaccines. JAMA. 2021.
- Chan BT BP, Odutayo A, Pai M: Meta-Analysis of Risk of Vaccine-Induced Immune Thrombotic Thrombocytopenia Following ChAdOx1-S Recombinant Vaccine.medRxiv Posted May 8, 2021 2021.
- Schultz NH, Sorvoll IH, Michelsen AE, Munthe LA, Lund-Johansen F, Ahlen MT, Wiedmann M, Aamodt AH, Skattor TH, Tjonnfjord GEet al: Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. N Engl J Med. 2021.
- Greinacher A, Thiele T, Warkentin TE, Weisser K, Kyrle PA, Eichinger S: Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. N Engl J Med. 2021.
- Shay DK, Gee J, Su JR, Myers TR, Marquez P, Liu R, Zhang B, Licata C, Clark TA, Shimabukuro TT: Safety Monitoring of the Janssen (Johnson & Johnson) COVID-19 Vaccine -United States, March-April 2021. MMWR Morb Mortal Wkly Rep. 2021;70(18):680-684.
- Brian J. Boyarsky WAW, Robin K. Avery, Aaron A. R. Tobian, Allan B. Massie, Dorry L. Segev, Jacqueline M. Garonzik-Wang: Antibody Response to 2-Dose SARS-CoV-2 mRNA Vaccine Series in Solid Organ Transplant Recipients. JAMA. 2021.
- Grupper A, Rabinowich L, Schwartz D, Schwartz IF, Ben-Yehoyada M, Shashar M, Katchman E, Halperin T, Turner D, Goykhman Yet al: Reduced humoral response to mRNA SARS-Cov-2 BNT162b2 vaccine in kidney transplant recipients without prior exposure to the virus. Am J Transplant. 2021.
- Impaired Humoral and Cellular Immunity after SARS-CoV2 BNT162b2 (Tozinameran) Prime-Boost Vaccination in Kidney Transplant Recipients.
- Peled Y RE, Lavee J, Sternik L, Segev A, Wieder-Finesod A, Mandelboim M, Indenbaum V, Levy I, Raanani E, Lustig Y, Rahav G: BNT162b2 vaccination in heart transplant recipients: clinical experience and anti-bodyresponse. J Heart Lung Transplant. 2021.
- Havlin J SM, Dvorackova E et al. : Immunogenicity of BNT162b2 mRNA COVID19 Vaccine and SARS-CoV-2 Infection in LungTransplant Recipients. Journal of Heart and Lung Transplantation. 2021.
- Boyarsky BJ, Ou MT, Greenberg RS, Teles AT, Werbel WA, Avery RK, Massie AB, Segev DL, Garonzik-Wang JM: Safety of the First Dose of SARS-CoV-2 Vaccination in Solid Organ Transplant Recipients. Transplantation. 2021.
- Vink P, Ramon Torrell JM, Sanchez Fructuoso A, Kim SJ, Kim SI, Zaltzman J, Ortiz F, Campistol Plana JM, Fernandez Rodriguez AM, Rebollo Rodrigo Het al: Immunogenicity and Safety of the Adjuvanted Recombinant ZosterVaccine in Chronically Immunosuppressed Adults Following Renal Transplant: A Phase 3, Randomized Clinical Trial. Clin Infect Dis. 2020;70(2):181-190.
- Natori Y, Shiotsuka M, Slomovic J, Hoschler K, Ferreira V, Ashton P, Rotstein C, Lilly L, Schiff J, Singer Let al: A Double-Blind, Randomized Trial of High-Dose vs Standard-Dose Influenza Vaccine in Adult Solid-Organ Transplant Recipients. Clin Infect Dis. 2018;66(11):1698-1704.
- Sette A, Crotty S: Adaptive immunity to SARS-CoV-2 and COVID-19. Cell. 2021;184(4):861-880.
- SARS-CoV-2 Vaccination in Heart and Lung Transplantation, MCS and PHRecommendations from the ISHLT COVID-19 Task Force. May 21, 2021. https://ishlt.org/ishlt/media/documents/COVID19_Vaccine-Recommendations_5-21 -2021.pdf
- COVID-19 Treatment Guidelines34017.Montagud-Marrahi E, Cofan F, Torregrosa JV, et al. Preliminary data on outcomes of SARS-CoV-2 infection in a Spanish single center cohort of kidney recipients. Am J Transplant. 2020;20(10):2958-2959. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32368838.
- Kates OS, Haydel BM, Florman SS, et al. COVID-19 in solid organ transplant: a multi-center cohort study. Clin Infect Dis. 2020. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32766815.
- Sharma A, Bhatt NS, St. Martin A, et al. Clinical characteristics and outcomes of COVID-19 in haematopoietic stem-cell transplantation recipients: an observational cohort study. Lancet Haematol. 2021;8(3):e185-e193. Available at: https://www.ncbi.nlm.nih.gov/pubmed/33482113.
- Shah GL, DeWolf S, Lee YJ, et al. Favorable outcomes of COVID-19 in recipients of hematopoietic cell transplantation. J Clin Invest. 2020;130(12):6656-6667. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32897885.
- Aydillo T, Gonzalez-Reiche AS, Aslam S, et al. Shedding of viable SARS-CoV-2 after immunosuppressive therapy for cancer. N Engl J Med. 2020;383(26):2586-2588. Available at: https://www.ncbi.nlm.nih.gov/pubmed/33259154.
- Horby P, Lim WS, Emberson JR, et al. Dexamethasone in hospitalized patients with COVID-19. N Engl J Med. 2021;384(8):693-704. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32678530.
- Horby PW, Pessoa-Amorim G, Peto L, et al. Tocilizumab in patients admitted to hospital with COVID-19 (RECOVERY): preliminary results of a randomised, controlled, open-label, platform trial. medRxiv. 2021;preprint. Available at: https://www.medrxiv.org/content/10.1101/2021.02.11.21249258v1.
- Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with COVID-19. N Engl J Med. 2021. Available at: https://www.ncbi.nlm.nih.gov/pubmed/33631065.
- American Association for the Study of Liver Diseases. Clinical best practice advice for hepatology and liver transplant providers during the COVID-19 pandemic: AASLD expert panel consensus statement. 2021. Available at: https://www.aasld.org/sites/default/files/2021 -03/AASLD-COVID19-ExpertPanelConsensusStatement-March92021.pdf. Accessed April 12, 2021.
- Elens L, Langman LJ, Hesselink DA, et al. Pharmacologic treatment of transplant recipients infected with SARS-CoV-2: considerations regarding therapeutic drug monitoring and drug-drug interactions. Ther Drug Monit. 2020;42(3):360-368. Available at: https://www.ncbi.nlm.nih.gov/pubmed/32304488.
- Special Considerations in Solid Organ Transplant, Hematopoietic Stem Cell Transplant, and Cellular Therapy Candidates, Donors, and Recipients. Section 84. COVID-19 and Special Populations. COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health. Available at https://www.covid19treatmentguidelines.nih.gov/. Accessed July 19th, 2021.


