Восстановление Cr(VI) в сернокислых растворах железом с использованием стальной стружки
Автор: Фазлутдинов Константин Камилиевич, Марков Вячеслав Филиппович, Маскаева Лариса Николаевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.9, 2017 года.
Бесплатный доступ
Изучены особенности протекания химического процесса в системе хромовый ангидрид - серная кислота - стальная стружка с целью утилизации шестивалентного хрома. Установлено наличие периодических концентрационных автоколебаний содержания Cr(VI) и Cr(III) в растворе при восстановлении Cr(VI) стальной стружкой. Показано влияние состава реакционной смеси и температуры на ход кинетических кривых восстановления Cr(VI). Изучена морфология, структура и состав получаемых осадков при различных исходных концентрациях Cr(VI) в растворе. С ростом исходной концентрации Cr(VI) в системе происходит изменение фазового состава осадков от простых оксигидратных форм к образованию гидроксосульфатных железо-хромсодержащих соединений. Исходя из элементного состава осадков, оценена возможность их практического использования в металлургическом производстве.
Утилизация хромсодержащих стоков, стальная стружка, колебательная реакция, швертманнит, гидрониумярозит
Короткий адрес: https://sciup.org/147160383
IDR: 147160383 | УДК: 66.011; | DOI: 10.14529/chem170202
Текст научной статьи Восстановление Cr(VI) в сернокислых растворах железом с использованием стальной стружки
Очистка водных растворов от шестивалентного хрома является одной из важнейших экологических задач. Наиболее распространенным способом очистки хромсодержащих стоков является двухстадийный метод. Его первая стадия основана на реакции восстановления шестивалентного хрома до трехвалентного состояния, а вторая – на переводе трехвалентного хрома в слаборастворимую форму, например, в гидроксидную. В известных реагентных методах очистки используются соли железа (II), сульфит, бисульфит и тиосульфат натрия, сернистый газ, сульфиды, пиритный огарок, перекись водорода, отработанные растворы травления стали, а также гидразин, гидроксиламин, клетчатка древесины, растительные отходы и т. д.
Наиболее широко в качестве восстановителя применяют сульфат железа (II). Преимущество последнего заключается в высокой скорости восстановления не только в кислой, но и в нейтральной среде. При этом извлечение хрома проводится обычно в виде осадков Cr(OH) 3 . В данном методе достижение норм ПДК затруднено возможностью образования растворимых комплексных гидроксосоединений трехвалентного хрома при локальной передозировке реагента-осадителя хотя бы на 10 %. Кроме этого, процесс сопровождается образованием большого количества обводненных шламов, состоящих из гидроксидов железа (III), хрома (III) и ряда других тяжелых металлов. Образующийся гальваношлам трудно поддается фильтрации и до настоящего времени не нашел экономически выгодного практического применения. Существующий реагентный метод также плохо сочетается с замкнутым циклом водоснабжения на предприятиях, так как в процессе очистки образуется вода с повышенным солесодержанием.
В [1, 2] нами был предложен и описан одностадийный метод нейтрализации хромсодержащих стоков, основанный на использовании в качестве восстановителя Cr(VI) стальной стружки в сернокислых растворах. Достоинством его в сравнении с известными методами является одностадийный характер процесса с одновременным удалением из раствора соединений хрома в составе образующихся слаборастворимых компактных осадков на основе соединений железа и хрома без использования (в отличие от гальвано- и электрокоагуляции) гальванопар или внешнего электрического тока [1, 3].
Как показано в [1], процесс образования компактного феррохромового осадка возможен только при определенном соотношении концентрации серной кислоты и навески железной стружки к содержанию в растворе Cr(VI). Заметим, что при более высоком содержании серной кислоты процесс вырождается в обычное травление стружки с образованием раствора сульфатов железа и хрома (III), а при ее недостатке процесс утилизации полностью останавливается ввиду пассивации стали.
Экспериментальная часть
В работе использовали модельные реакционные смеси, содержащие в качестве основных компонентов хромый ангидрид CrO3 квалификации «ч» и серную кислоту H2SO4 квалификация «хч», в которые вводили навеску измельченной стальной стружки «сталь Ст3» или гранулированное химически чистое железо AppliChemPanreac 211934.1209. В качестве вспомогательных реактивов при выполнении анализов применяли только реактивы квалификации «хч». Согласно ГОСТ 380–2005 на сталь Ст3 стружка имела следующий элементный состав, масс. %: C – 0,14÷0,22; Si – 0,15÷0,3; Mn – 0,4÷0,65; Ni – до 0,3; S – до 0,05; P – до 0,04; Cr – до 0,3; N – до 0,008; Cu – до 0,3; As – до 0,08. Стружку использовали в виде частиц с размерами 3–5 мм, имеющих удельную поверхность около 2,8 м2/кг. Удельная поверхность частиц чистого гранулированного железа составляла 2,1 м2/кг.
Процесс проводили в стеклянном реакторе объемом 1000 мл. Стружку перед использованием предварительно обезжиривали моющим средством Tide и активировали в течение 15 минут в 1 М растворе соляной кислоты.
Кинетические исследования в работе проводили в термостатируемых условиях с использованием метода избыточных концентраций [4]. При этом исходное содержание компонентов реакционной смеси варьировали в следующих концентрационных пределах: хром (VI) в пересчете на CrO 3 1,0–400 г/л; H 2 SO 4 – от 3,6 до 146 г/л (0,038–1,50 моль/л); навеска стальной стружки – от 50 до 1100 г/л. Реакцию восстановления во времени контролировали по остаточному содержанию Cr (VI) в реакционной смеси путем отбора проб через определенные промежутки времени и их анализа методом обратного перманганатометрического титрования [5]. Погрешность анализа составила ± 5%. Пробы реакционной смеси отбирали пипеткой Plastomed F100 на 0,1 мл и Sartorius Proline Plus 500 на 0,5 мл с механическим фильтром с временными интервалами 20 с в первые 10 минут процесса. Затем интервал времени отбора пробы увеличивали до 10–30 минут. Для определения содержания в растворе трехвалентного хрома применяли объемное титрование с предварительным переводом хрома в Cr(VI) 10%-ным раствором надсернокислого аммония [5].
Состав растворов дополнительно изучали методом спектроскопии с индуктивно связанной плазмой, выполняемый на оптическом эмиссионном спектрометре iCAP 6300 Duo Thermo Scientific. Погрешность метода не превышала 0,5 отн. %.
Оценку эффективности утилизации Cr(VI) в работе проводили на модельных растворах, имитирующих промывную воду ванн улавливания после процесса хромирования, содержащую до 40 г/л хромового ангидрида (квалификация «ч») и 24 мл/л (0,455 моль/л) концентрированной серной кислоты (ч.д.а). Длительность процесса химического взаимодействия составляла 24– 72 часа.
Химический состав осадков определяли на оптическом эмиссионном спектрометре iCAP 6300 Duo Thermo Scientific.
Рентгеновский анализ осадков проводили на приборе RIGAKU DNAX 2200 PC. Микроизображения осадков получены на электронном микроскопе JSM – 5900 LV.
Обсуждение результатов
В [6] было установлено, что остаточное содержание Cr(VI) в растворе после установления равновесия в системе CrO3 – H2SO4 – Fe – H2O (через 1–3 суток) снижается в ряде случаев более чем в 1000 раз по сравнению с исходной концентрацией. При этом упрощается процесс фильтрации осадков в связи с их кристаллической природой и компактностью, и благодаря высокому содержанию в них хрома они могут быть использованы в дальнейшем в качестве феррохромового сырья в металлургическом производстве. В проведенных нами исследованиях были изучены некоторые общие закономерности процесса восстановления хрома (VI) стальной стружкой путем контроля содержания в растворе железа (II) и хрома в трех-, и шестивалентном состоянии на протяжении нескольких часов. До настоящего времени в доступной литературе отсутствуют комплексные кинетические исследования этого процесса с установлением его особенностей, вклада каждого компонента системы, определением состава осадков и оценки остаточного содержания хрома (VI) в растворе.
В связи с этим в настоящей работе изучена кинетика процесса восстановления хрома (VI) стальной стружкой в сернокислых растворах, исследованы состав, структура и морфология образующихся осадков и определена эффективность извлечения хрома из водных растворов при использовании этого метода.
Учитывая ранее полученные результаты [6], для кинетических исследований была выбрана система со следующим содержанием основных компонентов: хром (VI) в пересчете на CrO3 – 20,0 г/л, H 2 SO 4 – 11,0 г/л (0,113 моль/л), стальная стружка марки Ст3 – 800 г/л с контролируемой удельной поверхностью около 2,8 м2/кг.
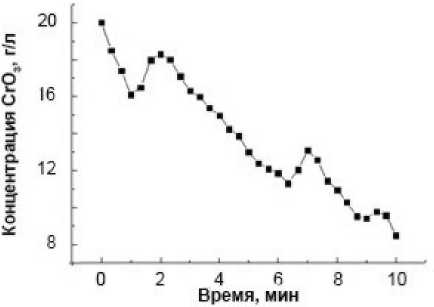
Кинетические кривые изменения содержания шестивалентного хрома в растворе в течение первых 10 минут процесса при 297 и 333 K приведены на рис. 1.
а)
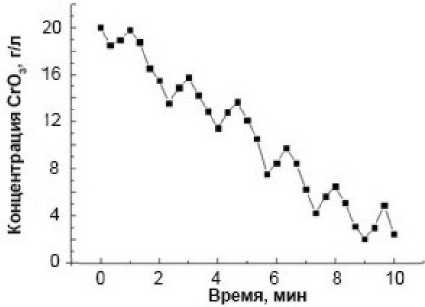
Рис. 1. Кинетические кривые содержания Cr (VI) (в пересчете на CrO 3 ) в реакционной смеси при температуре процесса, K: 297 (а) и 333 (б). Начальные концентрации, г/л: CrO 3 – 20, H 2 SO 4 – 11, стальная стружка – 800
б)
Обращает на себя внимание наблюдаемый на рисунке выраженный автоколебательный характер содержания Cr(VI) в растворе от времени процесса восстановления. На кинетических кривых формируются циклы изменения концентрации хрома (VI) в объеме раствора «снижение – рост». При этом если при 297 K на протяжении первых 10 минут проявляется три выраженных цикла колебаний: через 1, 6, 9 минут от начала процесса, то при 333 K концентрационные колебания Cr(VI) в растворе становятся более упорядоченными. Интервал между ними устанавливается примерно 1,5–2,0 минуты при практически одинаковом на фоне снижения периодическом повышении содержания Cr(VI) в растворе до 2 г/л (в пересчете на CrO 3 ).
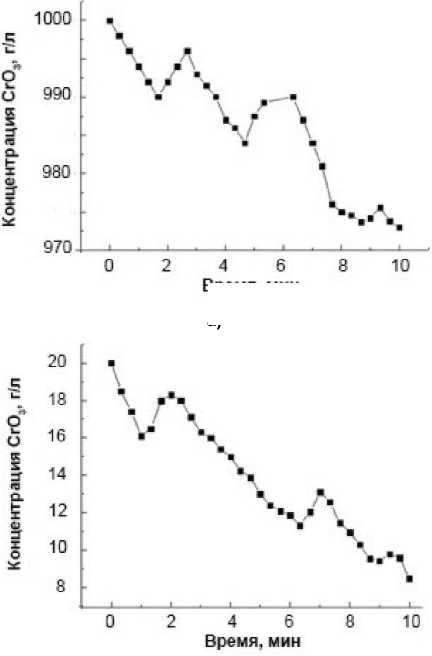
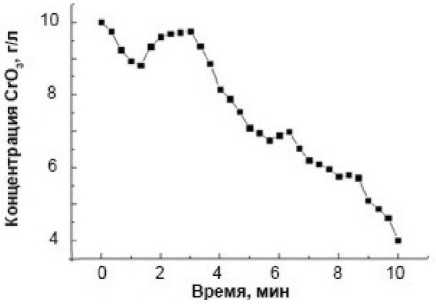
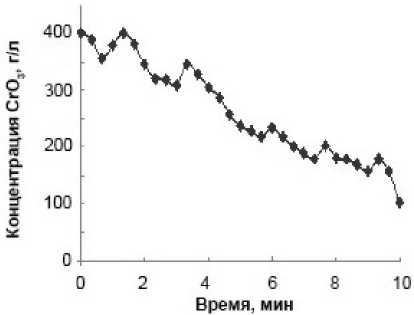
Влияние исходной концентрации хрома Cr(VI) на кинетику его восстановления приведено на рис. 2. Анализ, приведенных кинетических кривых при изменении начального содержания CrO 3 от 1 до 400 г/л показывает, что колебания концентрации Cr(VI) в растворе имеют место во всем указанном диапазоне. При этом они наиболее заметны при низком исходном содержании шестивалентного хрома в системе. Из рис. 2 видно, что с увеличением содержания Cr(VI) возникновение первого колебания и его максимум постепенно сдвигаются к началу процесса на 0,5– 1,0 мин. Начало второго колебательного цикла соответствует 3,0–6,0 минутам, а третьего – 5,5– 9,0 минутам. Следует отметить, что с повышением исходной концентрации хрома(VI) амплитуда колебаний возрастает. Как видно из рисунка, ее величина повышается с 8 мг/л при исходной концентрации Cr(VI) 1,0 г/л (0,8 % от исходной концентрации) до 2,0 и даже 50 г/л при начальном содержании хрома (VI) в реакторе соответственно 20 и 400 г/л (10,0 и 12,5 %).
Время, мин
в)
Рис. 2. Кинетические кривые содержания Cr (VI) (в пересчете на CrO 3 ) в реакционной смеси при начальной концентрации CrO 3 , г/л: 1 (а); 10 (б); 20 (в); 400 (г). Температура процесса – 297 K
а)
б)
г)
При изменении содержания серной кислоты в пределах 11–55 г/л наблюдается слабое ее влияние на частоту колебаний Cr(VI) при исходном содержании хромового ангидрида CrO 3 20 г/л. В то же время дальнейшее увеличение содержания серной кислоты нивелирует частоту и амплитуду колебаний.
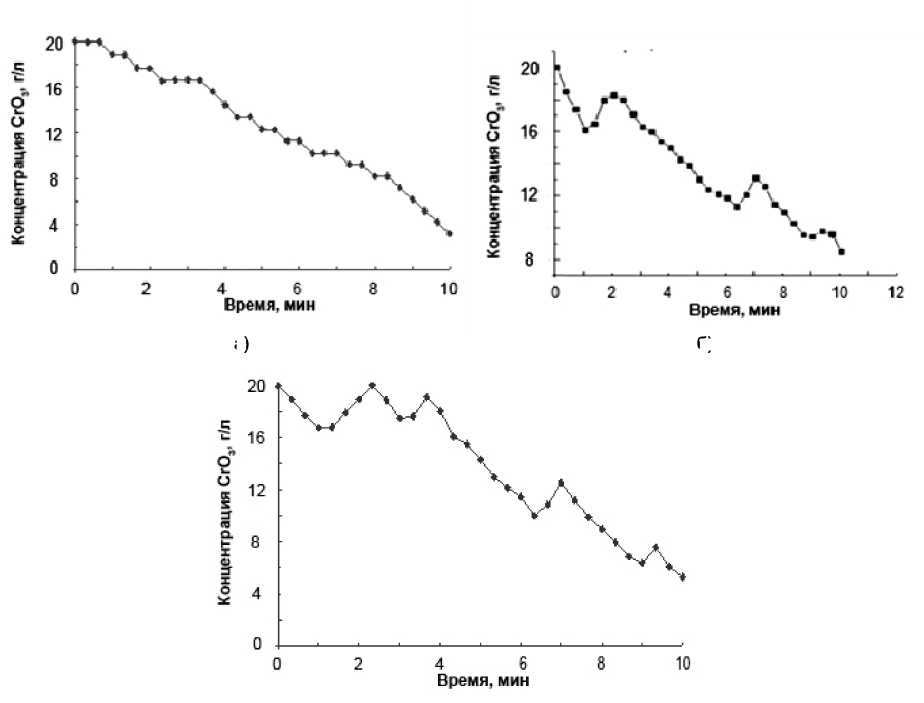
Кинетические кривые содержания Cr(VI) в реакционной смеси при различном исходном количестве стальной стружки приведены на рис. 3. Их анализ позволяет сделать вывод об определяющем влиянии количества стружки, а следовательно, величины ее удельной поверхности в растворе на характер и кинетику процесса восстановления Cr(VI). Как видно из рисунка, увеличение добавки стальной стружки с 200 до 1000 г/л при одной и той же начальной концентрация хромового ангидрида 20 г/л приводит к возрастанию амплитуды колебаний концентрации Cr(VI) в системе. Отметим, что уменьшение добавки стальной стружки ниже 50 г/л практически нивелирует концентрационные колебания шестивалентного хрома в реакционной смеси. Этот факт свидетельствует об определяющей роли в исследуемом колебательном процессе межфазной поверхности раздела введенной в раствор стальной стружки, которая контролировалась, исходя из введенной навески.
Практически для всех изученных в работе составов реакционной смеси колебательный характер процесса восстановления Cr(VI) наиболее заметно проявлялся в течение первых 10–15 минут его протекания, резко уменьшаясь в последующем, как по величине временных интервалов концентрационных колебаний, так и по их амплитуде. При этом в течение этого времени (в зависимости от условий) происходила утилизация, как правило, от 60 до 90 %, содержащегося в растворе шестивалентного хрома за счет его восстановления и перевода в осадок. Эта величина возрастала с повышением начальной концентрации Cr(VI), количества стружки и температуры процесса.
Для того, чтобы выявить возможное влияние примесей, присутствующих в стружке из стали Ст3, на ход процесса, были проведены эксперименты в аналогичных условиях с заменой стружки на гранулированное химически чистое железо с удельной поверхностью 2,1 м2/кг. При этом принципиальных отличий в характере протекания процесса установлено не было: концентрация шестивалентного хрома во времени испытывала аналогичные периодические изменения, воспроизводя с точностью ± 4 % ход кривой для стали.
а)
б)
в)
Рис. 3. Кинетические кривые содержания Cr(VI) (в пересчете на CrO 3 ) в реакционной смеси при исходном содержании стальной стружки, г/л: 200 (а), 800 (б), 1000 (в).
Начальная концентрация хромового ангидрида – 20 г/л, серной кислоты – 11 г/л.
Температура процесса – 297 K
Весьма интересными являю тся результаты по содержанию в растворе C r(III ), в который пе реходит шестивалентный хром п ри восстановлении. Выяснилось, что содержа ние трехвалентного хрома в реакторе также подвер жено периодическим колебаниям, причем эти колебания, что представляет интерес, совпадают по фазе с колебаниями концентраци и Cr(VI). Важным отличием является их относительно малая амплитуда. Так, если для шестивалентного хрома при базовых условиях она составляет 2000– 25 00 мг/л в пределах одного цикла, то для его трехвалентной фо рмы всего около 20– 150 мг/л. В целом концентрация трехвалентного хрома в растворе не превы шает нескольких сотен мг. Одн ако выявленные совпадения начала и период ичности колебаний концентрации Cr(VI) и Cr(III) в растворе подчеркива ют их органическую связь и предполагает общую причину одновременного изменен ия содержания обеих валентных форм хрома в системе.
Ранее [1, 2] нами было уста новлено, что при определенном соотношении между содержан и ем в растворе Cr(VI), серной кис лоты и стальной стружки в реакторе выпада ет компактный ос а док. Цвет его при низких значе ниях исходной концентрации хромового ангидрида в системе светло- коричневый, структура п орошкообразная. При высоких начальных ко нцентрациях хрома в растворе осадок имеет темно- к оричневый, местами черный цвет и стеклов идную кристаллич ескую структуру. Осадки обладаю т высокими фильтрационными характеристи ками.
В проведенных исследованиях [1] было показано, что с учетом потенциального образования в исследуемой системе гидроксидов, оксигидроксидов, основных солей двух-, трехвалентного железа и хрома (III), хроматов и хромитов железа, твердых растворов замещения на их основе состав образующихся осадков может быть чрезвычайно сложным и переменным во времени.
Р е зуль та ты хим и ч е ског о а нализа осадков, полученных из растворов с исх о дн ы м с одер ж ан ием хромового ангидрида от 1 д о 400 г/л показывают, что основными элемен тами , вх о дя щ и м и в и х с о став, явл я ются хр о м, ж елезо , сера и кислород, содержание которых варьируе тся в за висимости о т ус л ов и й образо в ания в сле д ующих п р еде л ах, % ве с .: желе з о 24,5 –63,8; хром 19,6–31,6; сера 4,6–10,2, кислород 11,1– 29 ,3. Обращает на себя внимание относительно высокое содержани е во всех осад ка х хро м а, что по зволяет предположить потенциальный интере с е к нему со с то роны фе р рохро м ового производ с тва .
И н те р есны изм е не н ия ми кр оструктуры и м о р фо лог и и осадков, полученных с различным ис х о дны м со д ержани е м Cr (VI) в с и с те ме. Как в идно из рис. 4 , с увеличением концентрации шести валентного хрома (в пер е счете на C rO 3 ) с 20 до 400 г/л размер и морфология частиц образовавше гося ос а дка посто я нн о эво л ю ц ионирует. Т ак, при исходных концентрациях в реакционной систе ме о с н о вны х комп о н е н тов : 2 0 г/л Cr O 3 , 11 г/л H 2 SO 4 , 800 г/л стружки осадок сформирован из доста то чно о дн о родных аг ло м е ратов сферической формы с размерами части ц в п р еделах 500 –700 нм и имеет весьма высокую у дельную поверхность. Далее размер первичн ых ч астиц н е ско лько уменьш а ется, а сте п е н ь их агрегатировани я во з растае т (ри с . 4 , б). При исходной концентрации CrO 3 20 0 г /л ра з мер ы бо ль шин ства частиц осадка возрастают до 10 мкм и боле е . Форма частиц, как видно, из рис. 4, в п ри этом неправи л ьна ,я и они склонны к огранке. С увеличением содержания CrO 3 до 40 0 г/л осад о к ста новится стекловидным и склонен к растрески в а нию (рис. 4, г).

а)

б)

в)
Рис. 4. Микроизображения осадков, полученных из сернокислых реакционных систем с исходной концентрацией Cr(VI) в пересчете на CrO 3 , г/л: 20 (а), 100 (б), 200 (в), 400 (г) при восстановлении Cr(VI) стальной стружкой. Температура растворов 297 K

г)
Для опред ел ения фа з ового состава образующихся осадков был исполь зов а н рентгенов с кий а н а л из. На р и с . 5 прив ед ены р ентгенограммы осадков, полученных при с одержани и хр о мо в ог о ангидрида в си стеме соотв е тст венно 5, 200 и 400 г/л. Согласно приведенны м р е н тг енограммам можно с д ела ть вы в од, что п р и этих начальных концентрациях в системе ос ад ки п р еимущ е ств енно содержат фазу гетита α- F e OOH ( рис. 5, а), швертманнита Fe 16 O 16 (SO 4 ) 3 (OH) 10 ·10H 2 O (рис. 5, б)
и гидрониумярозита (H 3 O)Fe 3 (SO 4 ) 2 (OH) 6 (рис. 5, в). В соответствии с этим, структурная эволюция осадка с ростом исходной концентрации хромового ангидрида в системе происходит в направлении от оксигидратных форм железа к образованию гидроксосульфатных форм.
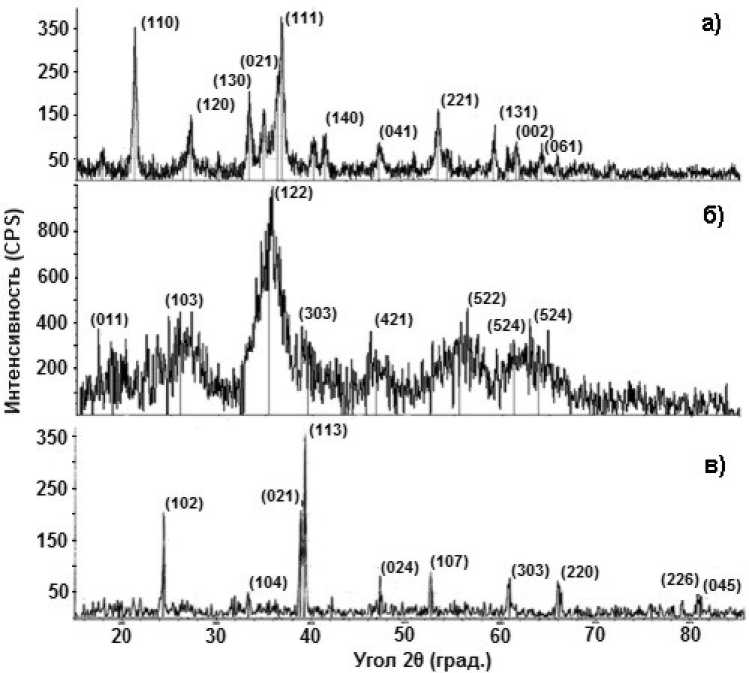
Рис. 5. Рентгенограммы осадков, полученных из сернокислых реакционных систем с исходными концентрациями Cr(VI) в пересчете на CrO 3 , г/л: 5 (а), 200 (б), 400 (в) при восстановлении Cr(VI) стальной стружкой. Исходное содержание стружки 800 г/л. Индексы кристаллографических граней приведены для фазы гетита (а), швертманнита (б), гидрониумярозита (в)
Малое уширение дифракционных отражений, наблюдаемых на рентгенограммах осадков, содержащих гетит и гидрониумярозит, свидетельствует о достаточно высокой кристалличности этих фаз. В свою очередь уширение дифракционных отражений швертманнита может быть объяснено большим количеством слабосвязанной воды, входящей в состав кристаллогидрата.
Рентгеновским анализом не установлено присутствие в осадках других кристаллических фаз: оксидов железа (FeO, Fe 2 O 3 , Fe 3 O 4 ), а также оксидов, гидроксида хрома (Cr 8 O 21 , CrO 2 , Cr 2 O 3 , Cr(OН)3 и хромата железа (FeCr2O4). Следует отметить, что не исключена вероятность присутствия в осадке основного сульфата хрома (III) – Cr 3 (SO 4 ) 2 O 6 H 7 , поскольку дифракционные отражения этого соединения практически совпадают с более интенсивными рефлексами гидрониумяро-зита. Учитывая данные элементного анализа осадков, демонстрирующих относительно высокое содержание в них хрома, можно сделать вывод о его нахождении преимущественно в составе рентгеноаморфных фаз, а также в виде изоморфно замещенной примеси.
Для исследования процессов фазообразованияв исследуемой системе проанализируем некоторые из них, которые достаточно очевидны. Начальный этап – гетерогенная реакция окисления металлического железа серной кислотой:
Fe + H 2 SO 4 →Fe2++ SO 4 2-+ H 2 ↑
Образующиеся по реакции (1) ионы двухвалентного железа, исходя из своего редокс-потенциала (φ), способны восстанавливать шестивалентный хром, окисляясь до трехвалентного состояния. Кроме того, железо в дальнейшем может участвовать в образовании гидроксосуль- фатных соединений-матриц, в которые за счет адсорбции может включаться хром в шестивалентной форме.
Так как доля ионных форм CrO 4 2– и Cr 2 O 7 2– зависит от рН раствора, то эффективность и кинетические характеристики процесса восстановления хрома (VI) определяются кислотностью среды и описываются следующими реакциями:
– в кислой среде:
6Fe2+ + Cr2O72- + 14H+ → 6Fe3+ + 2Cr3+ + 7H2O(2)
– в слабокислой или нейтральной среде:
3Fe2++ CrO42– + 4H2O → Cr3++ 3Fe3++ 8OH–(3)
– в нейтральной среде процесс может протекать также с участием коллоидной формы образующегося гидроксида железа (II):
6Fe(OH)2 + Cr2O72– + 7H2O → 6Fe(OH)3↓ + 2Cr(OH)3↓ + 2OH–(4)
Как нами было показано выше, при определенном соотношении компонентов в системе возможно образование гидрониумярозита (H 3 O)Fe 3 (SO 4 ) 2 (OH) 6 за счет оксигидролиза сульфата железа (II) при участии шестивалентного хрома как реагента-окислителя:
3Fe2+ + 2SO42– + 7H2O + Cr6+ → (H3O)Fe3(SO4)2(OH)6↓ + Cr3++ 5H+(5)
а также гетерогенный процесс встраивания трехвалентного хрома в структуру (H 3 O)Fe 3 (SO 4 ) 2 (OH) 6 путем замещения ионов Fe3+ с образованием хромсодержащего гидрониумя-розита.
(H3O)Fe3(SO4)2(OH)6 + yCr3+→ (H3O)Fe(3-y)Cry(SO4)2(OH)6 + yFe3+(6)
Взаимодействие трехвалентного железа с хромат-ионами, в свою очередь, может приводить к образованию малорастворимого хромата железа (III):
2Fe3++ 3CrO42- + 3H2O → Fe2[CrO4]3[H2O]3↓(7)
Согласно [7] зависимости окислительно-восстановительных потенциалов φ для базовых реакций в системе от величины рН при условии единичных концентраций ионных форм хрома и железа имеют вид:
Cr2O72–+ 14H+ → 2Cr3++ 7Н2О, φ= 1,33 – 0,138рН(8)
CrO42–+ 4Н2О → Cr(OН)3+ 5ОH–, φ = 1,247 – 0,098рН(9)
Fe(OH)3 + 3H+ → Fe2+ + 3Н2О, φ = 1,05 – 0,177pH(10)
Fe(OH)3+ H+ → Fe(OH)2 + Н2О, φ = 0,271 – 0,059pH(11)
Из приведенных уравнений следует, что окислительно-восстановительный потенциал системы Fe3+/Fe2+ практически не зависит от рН до величины ~3,2, а при больших значениях резко снижается вследствие процесса гидролиза ионов Fe3+. По данным работы [8] восстановление хрома (VI) все же достаточно полно происходит и при рН ≥ 4,0. Однако при этом резко ухудшаются кинетические характеристики гетерогенного процесса растворения металлической стружки. Последнее обусловлено значительным снижением кислотности среды.
Учитывая автоколебательный характер содержания в растворе Cr(VI), была проведена оценка вероятности протекания обратной окислительно-восстановительной реакции Cr(III) → Cr(VI) в исследуемой системе. Известно, что в кислой среде окисление соединений хрома (III) возможно только в азотнокислых растворах узким кругом окислителей, таких как хлораты, броматы, перманганаты и висмутаты, причем окисление идет до Cr2O72 – . В остальных случаях (в том числе в исследуемой системе) анализ редокс-потенциалов присутствующих веществ позволяет заключить, что окисление соединений хрома (III) практически невозможно или требует создания особых условий.
Характер кинетических кривых для шести- и трехвалентного хрома свидетельствует о том, что для полного извлечения хрома из раствора необходимо выдерживать определенное соотношение между концентрацией Cr(VI), железом и серной кислотой на протяжении всего процесса. В противном случае в определенный момент времени произойдет либо остановка процесса восстановления за счет пассивации железа (недостаток кислоты), либо усилится травление стружки с образованием растворимых сульфатов железа и хрома (относительный избыток кислоты). В последнем случае будет наблюдаться значительное повышение концентраций трехвалентного хрома в растворе до граммовых значений.
Одной из возможных причин выявленных концентрационных колебаний хрома в системе являются, судя по всему, протекающие процессы фазообразования на межфазной границе стружка – раствор, способствующие возникновению цикличности процесса пассивация – депассивация. В исследуемой системе железо может мигрировать между дисперсионной средой, где оно находится в форме Fe2+, и осадками, где оно фиксируется преимущественно в трехвалентном состоянии. При этом в области локального повышения рН вблизи поверхности стальной стружки будет происходить образование промежуточных гидроксосульфатных фаз, в которых железо может находиться в обеих валентных формах. Такие фазы метастабильны, обладают высокой реакционной способностью и постепенно переходят в оксигидроксиды железа и ферригидрит. В связи с этим нельзя исключить локального образования метастабильных фаз фойгеритной природы (GreenRust), имеющих структуру слоевых двойных гидроксидов (СДГ), которые были идентифицированы сравнительно недавно [7]. В сульфатных растворах их состав в общем виде можно представить как FeII y FeIII x (OH) 3 x +2 y –2 z (SO 4 ) z [7].
Согласно [8], первая стадия образования СДГ связана с частичным окислением Fe2+ за счет реакции гидролиза и включением ионов Fe3+ в плохо закристаллизованную структуру ферригид-рита (FeO) 5 (OH) 5 ·2H 2 O. Ферригидрит быстро реагирует с катионами Fe2+ и трансформируется в слоевую структуру ромбоэдрической сингонии СДГ (GreenRust). Вторая стадия процесса связана с образованием частиц лепидокрокита γ -Fe(OOH).
Авторами работы [9] было показано, что в хромсодержащей водной среде CrO 4 2--ионы могут замещать сульфат-ионы в структуре СДГ с последующим восстановлением в них Cr(VI) и образованием в межслойном пространстве на поверхности раздела фаз слаборастворимых хромсодержащих агрегатов, в которых хром может находиться также в обеих основных валентных формах. По нашему мнению, в исследуемой системе будет происходить образование и непрерывная эволюция слоевых двойных гидроксидов состава FeII y FeIII x (OH) 3 x +2 y –2 z (CrO 4 ) z с формированием в качестве конечного продукта хромсодержащего гетита. Конечным продуктом фазообразования может выступить Cr x Fe1– x (OH)3. В работе [10] удалось идентифицировать ряд промежуточных кристаллических фаз, способных образоваться в хроматсодержащих растворах Cr(VI)–Fe(III)– H 2 O в зависимости от рН среды. Так, при рН = 1,5–2,5 выявлена фаза FeOHCrO 4 , имеющая рПР = 22,50±0,07, а при рН = 2,5–3,5 установлено образование соединения FeOHCrO 4 ·2Fe(OH) 3 . В соответствии с представлениями авторов [11] механизм связывания Cr(VI) включает в себя реакцию между CrO 4 2–-ионом и редокс-парой Fe(II)/Fe(III) на межфазной поверхности, а также учитывает вхождение восстановленного до Cr(III) хрома в СДГ структуру.
Учитывая вышеизложенное, можно предположить, что в приповерхностных слоях стальной стружки из-за локального повышения рН происходит образование малорастворимых соединений в виде СДГ-структур, содержащих одновременно хром и железо в различных валентных состояниях. Это приводит к быстрой пассивации поверхности стружки и затуханию процесса восстановления Cr(VI) [12]. В то же время непрекращающийся процесс травления стружки, сопровождающийся газообразованием и накоплением под слоем осадка газообразных продуктов, в первую очередь водорода по реакции (1), будет приводить к периодическому «сбрасыванию» образовавшихся хромсодержащих гидроксидных фаз в объем реакционной смеси, приводя к депассивации поверхности стружки. С учетом состава образовавшихся фаз, включающих шестивалентный хром, и чередования процессов пассивации – депассивации в объеме раствора будет происходить периодическое повышение содержания шестивалентного хрома. Являясь на первой стадии процесса фазобразования структурами коагуляционного типа, слоистые гидроксиды легко разрушаются в объеме раствора, имеющем более высокий уровень кислотности. Аналогично можно объяснить и симбатный Cr(VI) характер концентрационных колебаний Cr(III) в растворе. Однако, учитывая его более низкое содержание в слоистых гидроксидах на начальной стадии их формирования, диапазон концентрационных колебаний Cr(III) будет значительно меньшим. Образующиеся же в качестве конечного продукта осадки будут постепенно трансформироваться в относительно устойчивые в этой среде структуры типа гетита, швертманнита, гидрониумярозита. Думаем, что нельзя полностью исключить и окислительно-восстановительную природу концентрационных автоколебаний хрома, однако это требует более глубокого изучения процессов в системе.
Проведенные в работе кинетические исследования позволили установить, что прямая реакция восстановления шестивалентного хрома при начальном содержании CrO3 – 20 г/л, H2SO4 – 11 г/л и варьировании добавки стальной стружки в пределах 50–1200 г/л имеет первый частный кинетический порядок металлу. Найденные значения эффективной (кажущейся) константы скорости процесса при добавке стружки 800 г/л монотонно изменяются от 4,16 . 10–3 до 6,39 . 10–3 с–1 при варьировании температуры в пределах 297–343 K. С использованием уравнения Аррениуса была определена эффективная энергия активации Е акт процесса восстановления. Ее значения при начальном содержании CrO 3 в растворе 1 и 20 г/л достаточно близки между собой и составили соответственно 10,3 и 8,6 кДж/моль, что говорит о протекании процесса в кинетическом режиме.
С точки зрения практического использования полученных в работе результатов интересно было провести оценку степени извлечения хрома их водных растворов в осадок при использовании для его восстановления стальной стружки. С этой целью в модельные растворы, содержащие 2,5 г/л Cr(VI), были введены различные порции стальной стружки. Из полученных экспериментальных данных можно сделать вывод, что повышение концентрации стружки способствует монотонному понижению остаточного содержания хрома в растворе. Так остаточное содержание хрома в реакторе при исходной концентрации стружки 880 г/л через 24 часа процесса было на уровне 6,8 мг/л, то есть снизилось более чем в 350 раз. С увеличением продолжительности выдержки реакционной смеси до 72 часов содержание общего хрома в растворе уменьшилось до 4,8 мг/л, что более чем 500 раз меньше его исходной концентрации. Многократное повторение описанных экспериментов дало относительно близкие результаты, которые могут представлять принципиальный интерес для разработки одностадийного метода очистки стоков от шестивалентного хрома. Обратим внимание также на достаточно интенсивную кинетику процесса в течение первых двух часов его проведения, обеспечивающую в течение этого времени основную долю извлечения хрома из раствора в осадок.
Выводы
В ходе работы было установлено наличие периодических концентрационных автоколебаний содержания шестивалентного хрома во времени до 50 г/л в процессе его восстановления стальной стружкой в сернокислых растворах при определенном соотношении исходных компонентов реакционной смеси. Показано, что повышение температуры раствора способствует резкому увеличению частоты и упорядочению автоколебаний содержания в Cr(VI) в реакционной смеси. В возникновении и интенсивности колебаний Cr(VI) в реакционной смеси выявлена определяющая роль содержания стальной стружки при добавке ее выше 50 г/л и соответствующей концентрации серной кислоты.
Выявлен синхронный по отношению к содержанию Cr(VI) в растворе характер концентрационных колебаний восстановленной формы хрома Cr(III) во времени до 150 мг/л.
Изучение элементного и фазового состава осадков, полученных при восстановлении Cr(VI) в сернокислых растворах стальной стружкой позволило высказать предположение о том, что природа периодических концентрационных автоколебаний Cr(VI) и Cr(III) в растворе при восстановлении шестивалентного хрома связана с циклическим характером процессов пассивации и депассивации поверхности стружки. В основе процессов «пассивация – депассивация» лежит образование в приповерхностных областях и перевод их в объем раствора за счет продуктов газовыде-ления сложных хромсодержащих гидроксидов, возможно со структурой фойгерита FeII y FeIII x (OH) 3 x +2 y –2 z (CrO 4 ) z .
Показана возможность снижения в одну стадию остаточного содержания хрома в растворе до 6,8 и 4,8 мг/л в течение первых 24 и 72 часов процесса соответственно при исходном содержании в реакционной смеси 880 г/л стальной стружки и 11 г/л серной кислоты.
Список литературы Восстановление Cr(VI) в сернокислых растворах железом с использованием стальной стружки
- Фазлутдинов, К.К. Утилизация хромсодержащих стоков. Часть 1. Структура и состав осадков при восстановлении хрома (VI) железной стружкой в сернокислых растворах/К.К. Фазлутдинов, В.Ф. Марков, Л.Н. Маскаева//Бутлеровские сообщения. -2014. -Т. 37, № 2. -С. 10-17. ROI: jbc-01/14-37-2-10.
- Фазлутдинов, К.К. Утилизация хромсодержащих стоков. Часть 2. Условия осаждения хрома (VI) стальной стружкой из сернокислых хромсодержащих растворов с образованием гидрониумярозита/К.К. Фазлутдинов, В.Ф. Марков, Л.Н. Маскаева//Бутлеровские сообщения. -2014. -Т. 39, № 8. -С. 34-39. ROI: jbc-01/14-39-8-34.
- Thermodynamic properties, low-temperature heat capacity anomalies, and single crystal X-ray refinement of hydronium jarosite, (H3O)Fe3(SO4)2(OH)6/J. Majzlan, R. Stevens, J. Boerio-Goates et al.//Physics and Chemistry of Minerals. -2004. -V. 31, № 8. -P. 518-531 DOI: 10.1007/s00269-004-0405-z
- Мейтис, Л. Введение в курс химического равновесия и кинетики/Л. Мейтис. -М.: Мир, 1984. -480 с.
- Анализ электролитов и растворов/Л.И. Никандрова, Н.И. Герасимова, Л.В. Иванова, Г.А. Кондратович. -М.: ГХИ, 1963. -211 с.
- Reduction of aqueous chromate by Fe(II)/Fe(III) carbonate green rust: kinetic and mechanistic studies/L. Legrand, A. El Figuigui, F. Mercier, A. Chausse//Environmental Science and Technology.-2004. -V. 38, № 17. -P. 4587-4595 DOI: 10.1021/es035447x
- Фролова, С.И. Очистка техногенных сточных вод оксигидратами железа/С.И. Фролова, Г.А. Козлова, Н.Б. Ходяшев//Вестник Пермского университета. Серия Химия. -2011. -Вып. 2(2). -С. 60-88.
- Лавриненко, Е.Н. Fe(II)-Fe(III)-слоевые двойные гидроксиды (GreenRust). Часть 1. Химический и электрохимический синтез, роль микроорганизмов в процессах синтеза, структура/Е.Н. Лавриненко//Наноструктурное материаловедение. -2009. -№ 3. -С. 15-40.
- Schwertmann, U. The Formation of Green Rust and Its Transformation to Lepidocrocite/U. Schwertmann, H. Fechter//Clay Minerals. -1994. -V. 29. -P. 87-92.
- The Mechanisms of Reduction of Hexavalent Chromium by Sodium Green Rust Sulphate: Formation of Cr-goethite/L.L. Skovbjerg, S.L.S. Stipp, S. Utsunomiya, R.C. Ewing//Geochimicaet Cosmochimica Acta. -2006.-V. 70, Iss.14. -P. 3582-3592 DOI: 10.1016/j.gca.2006.02.017
- Precipitation equilibria of the Cr(VI)/Fe(III) system and spectrospcopic characterization of the precipitates/M.A. Olazabal, N.P. Suib S. Nikolaidis, J.M. Madariaga//Environmental Science and Technology. -1997. -V. 31, № 10. -P. 2898-2902 DOI: 10.1021/es9700865
- Influence of chromium on the local structure and morphology of ferric oxyhydroxides/S. Suzuki, Takahashi Y., Kamimura T. et al.//Corrosion Science. -2004. -V. 46, iss. 7. -P. 1751-1763 DOI: 10.1016/j.corsci.2003.10.011


