Восстановление повреждённого плечевого сплетения при помощи клеток стромально-васкулярной фракции аутожировой ткани
Автор: Богов мЛ. А. А., Ахтямов И. Ф., Данилов В. И., Старостина И. Г., Ханнанова И. Г., Богов А. А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 т.13, 2023 года.
Бесплатный доступ
Цель исследования - ускорить восстановление повреждённого плечевого сплетения при помощи клеток стромально-васкулярной фракции из жировой ткани.Материалы и методы. Исследование было проведено 62-м пациентам с использованием клеток стромально-васкулярной фракции из жировой ткани и классических методов лечения при травме плечевого сплетения. Эффективность регенерации оценивали с помощью электромиографического исследования и положительного восстановления двигательной и чувствительной функции.Результаты и обсуждение. Оценка результатов хирургического лечения с применением клеток стромально-васкулярной фракции из жировой ткани после невролиза плечевого сплетения показала восстановление ранней функции M3-M5 и S3-S4 у 90 % пациентов, а в контрольной группе сравнения 68 % соответственно. Количество пациентов с функциями M4-M5 в группе с применением стромально-васкулярной фракции при невротизации плечевого сплетения составило 85 %, в то время как в группе контроля 64 % соответственно. Данные электронейромиографии также свидетельствовали об увеличении среднего числа двигательных единиц на 30 % после использования клеток стромально-васкулярной фракции из жировой ткани в отличии от группы сравнения.Выводы. Клетки стромальной васкулярной фракции, выделенные из жировой ткани, представляются перспективными стимуляторами для восстановления при травме плечевого сплетения.
Повреждение плечевого сплетения, клетки стромальной васкулярной фракции из жировой ткани
Короткий адрес: https://sciup.org/143179800
IDR: 143179800 | УДК: 617.5-089.844 | DOI: 10.20340/vmi-rvz.2023.1.CLIN.3
Текст научной статьи Восстановление повреждённого плечевого сплетения при помощи клеток стромально-васкулярной фракции аутожировой ткани
УДК 617.5-089.844
Повреждение плечевого сплетения занимает особую нишу в травматологии, поскольку является пограничным объектом внимания травматологов и нейрохирургов. Основной проблемой при восстановлении плечевого сплетения является давность и степень травматизации самих нервов, а в случаях необходимости применения аутонервной пластики и размер дефекта.
При совокупности всех этих факторов происходит резкое ухудшение регенерации, в особенности деваскуляризированного трансплантата при больших дефектах во время невротизации. В связи с этим перспективным направлением является использование стимуляторов регенерации, способных улучшить реваскуляризацию травмированной области и увеличить экспрессию ряда нейротрофических факторов.
Подобными свойствами обладают клетки стромально-васкулярной фракции (СВФ-ЖТ). Наиболее доступным методом получения подобных клеток является забор жировой ткани путем липосакции. Существует ряд экспериментальных работ, где показан нейропротекторный и стимулирующий эффект клеток СВФ, полученных из жировой ткани. По их данным при анализе гистологических препаратов выявляется неоангиогенез, образование продольно ориентированных пучков коллагеновых волокон и пучков леммоцитов [1].В настоящий период, многие лаборатории, изучающие жировую ткань в качестве источника стволовых клеток, обратили внимание на стромальноваскулярную фракцию, используемую в качестве физиологического регенераторного субстрата [2, 3]. В связи со способностью к самообновлению и дифференцировке по различным направлениям, данная фракция могла оказывать влияние на регенерацию костной, хрящевой и других тканей. Основным её компонентом являются мультипотент-ные мезенхимальные стромальные клетки (МСК) периваскулярной локализации [4, 5]. Эти клетки способны к дифференцировке в различные ткани с помощью индукторов, представляют собой гетерогенную популяция клеток, стимулирующую процес- сы регенерации и реваскуляризации [6, 7]. Одним из значимых ключей к успеху для улучшения регенерации повреждённого нерва является ускоренная реваскуляризация повреждённого нерва. МСК позволяет активизировать выработку факторов роста фибробластов, эндотелиального фактора роста, плацентарного фактора роста и других ангиогенных белков [8].
Недостаточная удовлетворённость результатами оперативных вмешательств на стволах плечевого сплетения побуждает нас к использованию стимуляторов регенерации, в качестве которых выступают клетки СВФ-ЖТ.
Цель исследования: улучшение эффективности хирургического лечения повреждений плечевого сплетения применением дополнительной нейрорегенерции в виде клеток стромальной васкулярной фракции аутожировой ткани.
Материалы и методы
Уже на диагностическом этапе мы определяемся с видом оперативного лечения на плечевом сплетении. В большинстве случаев в своей практике мы сталкиваемся с закрытым тракционным повреждением плечевого сплетения, где диагностика играет ключевую роль предоперационного планирования.
Наиболее доступным и информативным методом исследования при данной патологии являлась электронейромиография (ЭНМГ) и ультразвуковое исследование (УЗИ). Игольчатая и стимуляционная электромиография позволила оценить степень повреждения аксонов, локализацию повреждения, выраженность процесса реинервации и денервации мышц. УЗИ определяло целостность структуры самого нерва и близлежащих тканей, наличие невром или диастаз между концами нерва, что играет немаловажную роль в рамках предоперационного планирования. В диагностическом комплексе особое место имели компьютерная томография (КТ) и магнитно-резонансная томография (МРТ).
Производилась оценка целостности стволов плечевого сплетения, наличие параневрального рубца, повреждение параневральных тканей. При сохранности корешков плечевого сплетения выполнялся эндоневролиз с последующим введением клеток СВФ-ЖТ.
При отрыве корешков от спинного мозга выполнялась невротизация плечевого сплетения, которая остаётся единственным способом ре-инервации конечности. Невротизация заключается в перемещении аксонов из нервов, взятых извне или в пределах плечевого сплетения, на периферический отрезок повреждённого нерва. Существует несколько вариантов комбинаций невротизаций. Так, для невротизации мышечнокожного нерва для восстановления двуглавой мышцы плеча в качестве донорских нервов мы чаще всего используем межреберные нервы или добавочный нерв, а в качестве стимулятора регенерации – клетки СВФ-ЖТ.
В отделении микрохирургии ГАУЗ «РКБ» МЗ РТ за период с 2013 по 2019 гг. невролиз и эндоневролиз, а также невротизация стволов плечевого сплетения с применением клеток стромальной васкулярной фракции из жировой ткани выполнены 30 пациентам.
В основную группу исследования входили пациенты с тракционным повреждением плечевого сплетения (20 человек), которым при выполнении классического невролиза и эндоневролиза интраоперационно вводились клетки стромальной васкулярной фракции.
Так же с применением СВФ-ЖТ при невротизации плечевого сплетения прооперировано 10 пациентов с тракционными повреждениями плечевого сплетения
В контрольную группу сравнения, после проведения ретроспективного анализа за 2005–2010 г., вошли пациенты с аналогичным механизмом травмы и клинической картиной. Были отобраны 20 пациентов с тракционным повреждением плечевого сплетения с сохранением корешков и 12 пациентов с пре- и постганглионарным повреждением плечевого сплетения, которым выполнялась невротизация для восстановления функции верхней конечности, но без использования стимуляторов регенерации.
Общее число пациентов, включённых в исследование, составило 62 человека (44 мужчины и 18 женщин) в возрасте от 18 до 63 лет. При определении показаний к применению клеток СВФ-ЖТ учитывались следующие критерии: диагностированное повреждение плечевого сплетения, возраст старше 18 лет, отсутствие онкологических заболеваний, вирусных гепатитов и ВИЧ-инфекции.
Как было изложено ранее, для получения клеток стромально-васкулярной фракции наиболее простым и доступным методом является липосакция (рис. 1), во время которой возможно получение необходимого количества жировой ткани. Зоны забора жировой ткани определялись во время предоперационного планирования. Чаще всего забор жира осуществлялся из области живота или поясницы в объёме 150–200 мл.
При липосакции с предварительным обезболиванием 0,25 % раствором Лидокаина (ЗАО «Фармацевтический завод ЭГИС», Венгрия) использовались канюли 4,0 мм. В условиях специализированной лаборатории, после проведённой липоаспирации, получали СВФ-ЖТ. В среднем из 150–200 мл жира мы получали 7,5–8 млн клеток СВФ-ЖТ.
Далее выполнялось оперативное вмешательство на стволах плечевого сплетения. При микрохирургическом наружном и внутреннем невролизе, эндоневролизе стволов плечевого сплетения введение СВФ-ЖТ осуществлялось в зону с наиболее выраженным очагом фиброзного поражения (рис. 2).
Рисунок 1. Забор жировой ткани методом липосакции
Figure 1. Fat harvesting by liposuction
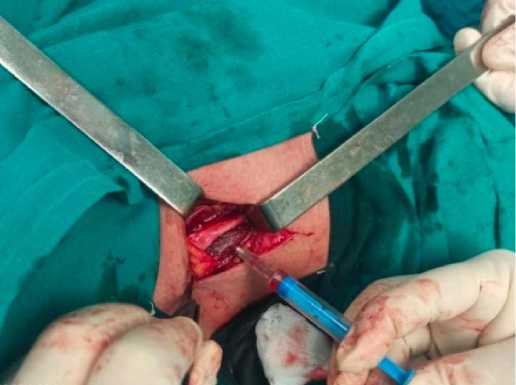
Рисунок 2. Этап невролиза стволов плечевого сплетения. Введение клеток СВФ-ЖТ
Figure 2. Stage of neurolysis of the trunks of the brachial plexus. Introduction of SVF-AT cells
Результаты лечения и обсуждение полученных результатов
Оценка результатов проводилась с учётом клинических данных. Исследовалась степень восстановления чувствительности в зоне иннервация восстанавливаемых нервов по шкале S0–S5, двигательную функцию оценивали по показателям М0–М5, на основании методики принятой Британским Медицинским Советом (MRC- Britain`s Medical Research Council) и дополненной И.Н. Шевелевым.
Электрофизиологическая оценка проводилась по данным электронейромиографического исследования (ЭНМГ) в динамике на различных сроках. Параметры функционального восстановления оценивались путём подсчёта количества двигательных единиц (КДЕ) относительно аналогичных показателей интактной конечности. Регистрировали М-ответ с восстанавливаемых мышц и дальнейшую динамику роста показателей.
В таблице 1 представлены данные о начальных сроках появления двигательной и чувствительной функций после невролиза плечевого сплетения в основной и контрольной группах.
После выполнения невролиза плечевого сплетения с использованием стимуляторов регенерации в виде клеток СВФ-ЖТ положительный функциональный результат был получен у 18 пациентов, у 2 пациентов функция не восстановилась. У 13 (65 %) пациентов было достигнуто восстановление двигательной функции с показателями М4–М5 на сроках от 3 до 6 месяцев после операции, у 5 пациентов (25 %) показатели М3–М4 зафиксированы на сроках 6–12 месяцев после операции. В контрольной группе восстановление двигательной функции до уровня М4–М5 было зафиксировано на сроке 3–6 месяцев у 6 пациентов. На сроке 6–12 месяцев после операции в контрольной группе двигательная функция восстановилась до уровня М3–М4 у 10 пациентов. Таким образом, при сравнительном анализе частоты восстановления двигательной функции нами была выявлена статистически значимо большая доля пациентов с восстановленной функцией к концу периода наблюдения в основной группе при сравнении с контрольной (p = 0,023).
У пациентов после невролиза оценивали электрофизиологические параметры, отражающие динамику функционального восстановления с подсчётом КДЕ в процентном отношении к интактной конечности. В основной группе первые признаки М-ответа регистрировались на сроке 0–6 месяцев после операции и достигали показателей интактной конечности к 18–24 месяцам. В группе контроля КДЕ было значительно ниже по сравнению с основной группой исследования (рис. 3). При сравнительном анализе нами было установлено статистически значимо большее количество двигательных единиц на всех сроках наблюдения в основной группе (табл. 2).
Таблица 1. Сравнительные данные восстановления двигательной и чувствительной сфер после выполнения невролиза и эндоневролиза плечевого сплетения в течение одного года
Table 1. Comparative data on recovery of motor and sensory areas after neurolysis and endoneurolysis of the brachial plexus within one year
|
Группа |
Двигательная функция, месяцы |
Чувствительная функция, месяцы |
||
|
М0–М2 |
М3–М5 |
S0–S2 |
S3–S4 |
|
|
Основная |
4 |
9 |
2 |
7 |
|
Контрольная |
9 |
12 |
6 |
12 |
Таблица 2. Результаты электромиографического исследования пациентов после невролиза плечевого сплетения в контрольной и опытной (с введением СВФ-ЖТ) группах на разных сроках тестирования
Table 2. The results of an electromyographic study of patients after brachial plexus neurolysis in the control and experimental (with the introduction of SVF-VT) groups at different testing periods
|
Срок наблюдения |
Группа |
p |
|
|
Контрольная |
Основная |
||
|
0–6 месяцев |
17,91 ± 6,79 |
30,35 ± 6,49 |
< 0,0001 |
|
6–12 месяцев |
27,14 ± 5,38 |
52,85 ± 5,86 |
< 0,0001 |
|
12–18 месяцев |
41,57 ± 5,01 |
78,07 ± 5,79 |
< 0,0001 |
|
18–24 месяцев |
65,23 ± 7,43 |
86,85 ± 7,27 |
< 0,0001 |
|
24–36 месяцев |
71,06 ± 5,19 |
85,97 ± 6,10 |
< 0,0001 |
Таблица 3. Результаты восстановления двигательной функции в основной группе на сроке 12–18 и 24–36 месяцев после невротизации
Table 3. The results of the restoration of motor function in the main group for a period of 12–18 and 24–36 months after neurotization
|
Тип операции |
Количество пациентов/ наблюдений |
Степень восстановления двигательной функции на сроке |
|||||||||||
|
12–18 месяцев после операции |
24–36 месяцев после операции |
||||||||||||
|
М0 |
М1 |
М2 |
М3 |
М4 |
М5 |
М0 |
М1 |
М2 |
М3 |
М4 |
М 5 |
||
|
Невротизация |
10/10 |
1 |
6 |
3 |
1 |
2 |
6 |
1 |
|||||
|
Невротизация + СВФ-ЖТ: |
|||||||||||||
|
добавочный – надлопаточный пучок локтевого – мышечно-кожный |
1/2 |
1 |
1 |
1 |
1 |
||||||||
|
добавочный – надлопаточный 3, 4, 5, межреберный локтевого – мышечнокожный |
1/1 |
1 |
1 |
||||||||||
|
добавочный – мышечно-кожный 3, 4, 5, межреберный – подмышечный |
1/1 |
1 |
1 |
||||||||||
|
добавочный – двигательные ветви шейного сплетения – корешок С5 |
1/1 |
1 |
1 |
||||||||||
|
3, 4, 5, межреберный – мышечно-кожный |
3/4 |
3 |
1 |
3 |
1 |
||||||||
|
добавочный – мышечно-кожный |
3/4 |
2 |
2 |
2 |
2 |
||||||||
Степень восстановления двигательной функции после невротизации плечевого сплетения в основной группе (с введением СВФ-ЖТ) и контрольной представлены в таблице 3. Оценку эффективности восстановления двигательной функции оценивали на сроках 12–18 и 24–36 месяцев.
Таблицы демонстрируют, что при невротизациях в основной группе мы получали М3–М5 на сроке 12–18 месяцев, тогда как в контрольной группе сравнения только на сроке 22–36 месяцев, при этом различия в восстановлении двигательной функции между группами были статистически значимыми через 12–18 месяцев (p < 0,0001) и не были значимыми через 22–36 месяцев (p = 0,7615).
В послеоперационном периоде оценивали электрофизиологические параметры, отражающие динамику функционального восстановления с подсчётом КДЕ в процентном отношении к интактной конечности. В основной группе первые признаки М-ответа регистрировались на сроке
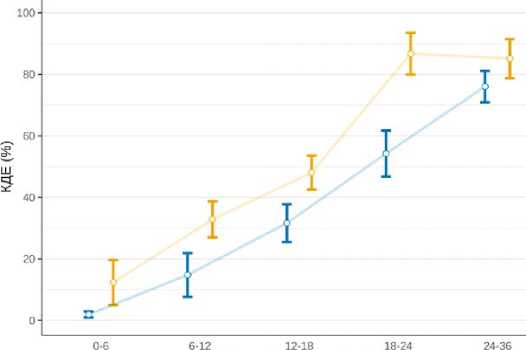
4–6 месяцев после операции и достигали показателей интактной конечности к 18–24 месяцам в отличии от группы контроля, где первые признаки М-ответа были зарегистрированы к 9–12 месяцам и достигали показателей интактной конечности к 24–36 месяцам. Исходя из полученных данных бы- ло подсчитано количество двигательных единиц (рис. 4). При сравнительном анализе нами было установлено статистически значимо большее относительное количество двигательных единиц на всех сроках наблюдения в основной группе (табл. 4).
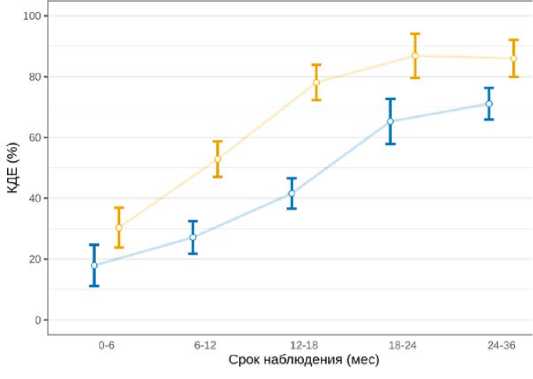
Срок наблюдения (мес)
Группа -6- Контрольная - Основная
Рисунок 3. Результаты электромиографического исследования пациентов после невролиза плечевого сплетения в основной (с введением СВФ-ЖТ) и контрольной группах на различных сроках тестирования
-
Figure 3. The results of an electromyographic study of patients after brachial plexus neurolysis in the main (with the introduction of SVF-VT) and control groups at different testing periods
Группа -•*■ Контрольная Основная
Рисунок 4. Результаты электромиографического исследования пациентов с невротизацией плечевого сплетения на различных сроках тестирования в основной и контрольной группах
-
Figure 4. The results of an electromyographic study of patients with brachial plexus neurotization at different testing periods in the main and control groups
Таблица 4. Результаты электромиографического исследования пациентов с невротизацией плечевого сплетения в контрольной и опытной (с введением СВФ-ЖТ) группах на разных сроках тестирования
Table 4. The results of an electromyographic study of patients with brachial plexus neurotization in the control and experimental (with the introduction of SVF-VT) groups at different testing periods
|
Срок наблюдения |
Группа |
p |
|
|
Контрольная |
Основная |
||
|
0–6 месяцев |
1,94 ± 1 |
12,36 ± 7,32 |
<0,0001 |
|
6–12 месяцев |
14,77 ± 7,13 |
32,86 ± 5,87 |
<0,0001 |
|
12–18 месяцев |
31,64 ± 6,14 |
48,06 ± 5,5 |
<0,0001 |
|
18–24 месяцев |
54,25 ± 7,48 |
86,77 ± 6,77 |
<0,0001 |
|
24–36 месяцев |
76,06 ± 5,11 |
85,13 ± 6,32 |
0,0001 |
Несмотря на существенные сроки между травмой и оперативным вмешательством, которые составили от 7 до 13 месяцев, обширность зоны повреждения, сопровождающаяся фиброзными изменениями пара- и интранвральной ткани, использование клеток СВФ-ЖТ в качестве симуля- тора нейрорегенерации позволило ускорить и качественно улучшить регенераторный процесс, о чем свидетельствуют представленные результаты лечения.
В данном исследовании мы продемонстрировали клиническую эффективность интраоперационного применения клеток СВФ-ЖТ, однако механизм терапевтического действия остаётся открытым вопросом. Для понимания молекулярных возможностей действий между нервной тканью и компонентами СВФ-ЖТ необходимы дополнительные исследования молекулярных механизмов, лежащих в основе терапевтического действия СВФ-ЖТ, являющиеся фундаментальными в регенераторной медицине.
Выводы
Метод применения СВФ-ЖТ в комбинации с хирургическим методом лечения повреждений плечевого сплетения способствует ускоренной нейрорегенерации повреждённых тканей, в значительной степени повышает приживаемость аутонервного трансплантата, стимулируя его реваскуляризацию, восстановление чувствительной и двигательной активности и тем самым повышает эффективность восстановительных реконструктивных операций.
Список литературы Восстановление повреждённого плечевого сплетения при помощи клеток стромально-васкулярной фракции аутожировой ткани
- Петрова Д.Ю., Подгайский В.Н., Недзьведь М.К., Анищенко С.Л., Мечковский С.Ю., Зафранская М.М. Возможность восстановления повреждённых периферических нервов при трансплантации мезенхимальных стволовых клеток. Международные обзоры: клиническая практика и здоровье. 2014;4:5-7.
- Kim I., Bang S.I., Lee S.K., Park S.Y., Kim M., Ha H. Clinical implication of allogenic implantation of adipogenic differentiated adipose-derived stem cells. Stem Cells Transl. Med. 2014;3(11):1312-1321. PMID: 25273542.
- Stoltz J.F., de Isla N., Li Y.P., Bensoussan D., Zhang L., Huselstein C., Chen Y. et al. Stem cells and regenerative medicine: myth or reality of the 21th century. Stem Cells Int. 2015;734731:19. PMID: 26300923.
- PMID: 26300923
- Johal K.S., Lees V.C., Reid A.J. Adipose-derived stem cells: selecting for translational success. Regen. Med. 2015;10(1):79-96. PMID: 25562354.
- Minteer D.M., Marra K.G., Rubin J.P. Adipose stem cells: biology, safety, regulation, and regenerative potential. Clin. Plast. Surg. 2015;42(2):169-179. PMID: 25827561.
- Vapniarsky N., Arzi B., Hu J.C., Nolta J.A., Athanasiou K. Concise review: human dermis as an autologous source of stem cells for tissue engineering and regenerative medicine. Stem Cells Transl. Med. 2015;4(10):1187-1198. PMID: 26253713.
- PMID: 26253713
- Watt F.M., Hogan B.L. Out of Eden: stem cells and their niches. Science. 2000;287(5457):1427-1430. PMID: 10688781.
- PMID: 10688781
- Lopatina T., Kalinina N., Karagyaur M., Stambolsky D., Rubina K., Revischin A. et al. Adipose-derived stem cells stimulate regeneration of peripheral nerves: BDNF secreted by these cells promotes nerve healing and axon growth de novo. PLoS One. 2011;6(3):e17899-17911. PMID: 21423756.
- PMID: 21423756


