Возбудители колибактериоза сельскохозяйственной птицы - носители генов, ассоциированных с вирулентностью экстраинтестинальных и кишечных Escherichia coli
Автор: Поспелова Ю.С., Erjavec Stari M., Кузнецова М.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная микробиология, патология, терапия
Статья в выпуске: 2 т.57, 2022 года.
Бесплатный доступ
С расширением объемов производства в птицеводстве и интенсификацией отрасли возрастает угроза распространения колибактериоза среди сельскохозяйственной птицы, поэтому существует острая необходимость в мониторинге птичьих патогенных Escherichia coli (avian pathogenic Escherichia coli , APEC), изучении генетического разнообразия последних и выявлении штаммов, представляющих опасность для здоровья человека. Определение генов, ассоциированных с вирулентностью, и степени специфической адгезии может быть полезным в комплексной оценке эпидемической и эпизоотической значимости штаммов E. coli , выделенных от сельскохозяйственных животных. В настоящей работе по результатам комплексного молекулярного скрининга штаммов E. coli , выделенных от птиц во время вспышек колибактериоза, на наличие у них генов различных патотипов эшерихий впервые показано, что штаммы характеризовались высоким потенциалом патогенности и могли быть носителями генов сразу нескольких патотипов, при этом детерминанты кишечных патогенных E. coli (IPEC) встречались чаще других. Позитивный адгезивный профиль по ряду генов положительно коррелировал с уровнем адгезии штаммов к эритроцитам кур ( Gallus gallus L.) и человека. Цель работы - дать генотипическую характеристику штаммов E. coli , выделенных от сельскохозяйственной птицы с колибактериозом, а также оценить взаимосвязь между адгезивным генотипом и специфической адгезией к эритроцитам. В работе использовали 28 штаммов E. coli с уникальным генотипом согласно ERIC-ПЦР, выделенных в 2016-2018 годах из разных органов (исключая кишечник) цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом. С помощью полимеразной цепной реакции (ПЦР) по конечной точке детектировали гены вирулентности ( n = 28), характерные для четырех условных групп: гены, обеспечивающие патогенность бактерий вида E. coli , встречающиеся у различных патотипов, гены патогенных для птиц E. coli (APEC), кишечных патогенных E. coli (IPEC: EPEC/ETEC/EHEC/EaggEC) и уропатогенных E. coli (UPEC). Протоколы для всех типов ПЦР применяли в их авторских вариантах. Амплификацию проводили на термоциклере DNA Engine Dyad Thermal Cycler («Bio-Rad», США). Визуализацию полос и документирование данных осуществляли с использованием системы гель-документации Gel-Doc XR («Bio-Rad», США). При определении адгезии бактерий к эритроцитам клеточным субстратом служили формалинизированные эритроциты человека 0(I) группы Rh(+) и птичьи эритроциты. Адгезивные свойства клеток оценивали с помощью индекса адгезивности микроорганизма (среднее число бактерий, прикрепившихся к одному эритроциту, участвующему в адгезии). Показано, что культуры были носителями множественных генов вирулентности, характерных для различных патотипов E. coli (APEC, UPEC, IPEC). По генетическому профилю изученные штаммы эшерихий имели большее сходство со штаммами, вызывающими острые кишечные инфекции у человека, чем с уропатогенными E. coli . Наличие специфических маркерных генов позволило идентифицировать большинство штаммов как APEC, которые могут содержать детерминанты патогенности, в частности токсины, характерные для патотипа IPEC (за исключением генов шигаподобных токсинов и энтерогемолизинов). На основании кластерного анализа генетических профилей культуры были отнесены к трем условным группам: патогенные для птиц и человека (наличие одновременно 2-6 генов, связанных с АРЕС, и 2-6 генов, связанных с ExPEC или IPEC; 24 штамма), патогенные для птиц и не патогенные для человека (наличие 2-6 генов, связанных с APEC, и 0-1 гена, связанного с ExPEC или IPEC; 2 штамма) и непатогенные (0-1 ген из любой группы, APEC, ExPEC, IPEC, 2 штамма). Выявлено, что 75 % штаммов, выделенных как патогенные для птиц и человека, характеризовались высокими частотами встречаемости генов вирулентности, острова патогенности SHI-2, а также генов бета-лактамаз расширенного спектра и участков интегронов 1-го класса. Специфическая адгезия штаммов E. coli была более выражена в отношении куриных эритроцитов, чем человеческих. При этом, независимо от типа эритроцитов, высокая адгезивная активность бактерий коррелировала с большей выживаемостью в сыворотке крови хозяина (iss+ генотип) и способностью лизировать эритроциты (hlyF+ генотип). Полученные данные о молекулярных и адгезивных свойствах возбудителей колибактериоза птиц позволяют оценить их зоонозный потенциал и эпизоотическую значимость, а также могут служить основой для усовершенствования системы мониторинга колибактериоза в птицеводческих хозяйствах.
Патогенные для птиц escherichia coli, гены вирулентности, специфическая адгезия, зоонозный потенциал
Короткий адрес: https://sciup.org/142235677
IDR: 142235677 | УДК: 579.6:579.25 | DOI: 10.15389/agrobiology.2022.2.356rus
Текст научной статьи Возбудители колибактериоза сельскохозяйственной птицы - носители генов, ассоциированных с вирулентностью экстраинтестинальных и кишечных Escherichia coli
Патогенные для птиц Escherichia coli (avian pathogenic Escherichia coli , APEC) — животный патотип эшерихий, обнаруженный в кишечной микробиоте у некоторых видов птиц и вызывающий внекишечные инфекции у иммунокомпрометированных особей (1). Штаммы APEC становятся основной причиной колибактериоза — синдрома, связанного с аэросаккулитом, перикардитом, а часто и сепсисом у сельскохозяйственной птицы (2, 3). Вспышки заболевания на птицеводческих предприятиях приводят к сокращению производства яиц на 2-3 % и смертности поголовья до 30 %, что влечет за собой экономические потери (4). По экспертным оценкам, в любой момент времени колибактериоз имеют не менее 30 % особей всех коммерческих стад в США (5). В России колибактериоз составляет от 60 до 88 % всех инфекций сельскохозяйственной птицы (6).
Согласно современной классификации, популяция APEC входит в группу внекишечных патогенных E. coli (extraintestinal pathogenic E. coli , ExPEC), к которой относят также уропатогенные E. coli (uropathogenic E. coli , UPEC), ассоциированные с неонатальным менингитом E. coli (neonatal meningitis-causing E. coli , NMEC), сепсис-ассоциированные E. coli (sepsis-associated E. coli , SEPEC) и другие патотипы (2, 5). Использование молекулярных подходов для идентификации факторов вирулентности эшерихий значительно расширило знания о патогенетических механизмах APEC-инфекции (7). Согласно гипотезе, предложенной L.K. Nolan с соавт. (3), патотип АPEС обусловлен наличием специфических маркерных генов. Определить штамм в эту группу позволяет присутствие минимального набора генетических детерминант: ompT (протеаза наружной мембраны), iutA (рецептор аэробактина), iss (фактор выживаемости в сыворотке), iroN (рецептор энтерохелина) (3, 5). Кроме того, в развитие колибактериоза вовлечены разнообразные гены вирулентности, кодирующие адгезины, токсины, факторы защиты, системы получения железа, а также аутотранспортеры и белок IbeA, что и определяет множество проявлений (форм) инфекций птиц, возникающих в результате экспрессии различных комбинаций детерминант вирулентности (6).
V.G. Maturana с соавт. (8) пришли к выводу, что штаммы APEC представляют не однородную группу, а в зависимости от комбинации детерминант патогенности подразделяются на подгруппы-субпатотипы, каждый из которых связан с определенным инфекционным синдромом. Исследования L. Mageiros с соавт. (9) показали, что штаммы патотипа APEC возникают из повсеместно распространенных комменсальных кишечных бактерий, в том числе за счет горизонтального переноса генов, экспрессирующих факторы патогенности, позволяя дивергентным клонам вызывать инфекцию птицы. Установлено, что большинство APEC содержат высококонсервативный кластер сцепленных с плазмидами генов вирулентности, встречающийся у относительно небольшого количества фекальных изолятов E. coli от здоровых птиц (AFEC) (10).
Исследования последних лет позволили предположить, что штаммы APEC могут представлять опасность для здоровья людей (11, 12). С одной стороны, описана возможность трансмиссии APEC через продукты питания, в том числе мясо птицы (13), с другой — выявленная гомология последовательностей ДНК между APEC и другими патотипами ExPEC показывает, что они тесно связаны филогенетически (10). Так, у внекишечных штаммов E. coli, патогенных для человека, в геноме детектирован ген iss, который экспрессирует фактор, отвечающий за выживаемость бактерий в сыворотке крови. Ген локализован на большой плазмиде вирулентности ColV, типичной для штаммов E. coli, патогенных для птиц, что указывает на возможную передачу плазмиды и, следовательно, обмен генами вирулентности между штаммами E. coli человека и птиц (10, 14). Результаты, полученные K.E. Rodriguez-Siek с соавт. (15) и T.J. Johnson с соавт. (16, 17), подтверждают тесную связь между культурами APEC и UPEC/MNEC. Отмечено появление и распространение гибридных и гетеропатогенных штаммов E. coli, несущих соответственно паттерны генов ExPEC и представителей кишечных патогенных E. coli (intestinal pathogenic E. coli, IPEC) или двух и более патотипов IPEC (18, 19). Наличие сходных ассоциированных с вирулентностью генов, обнаруженных в штаммах IPEC/ExPEC и APEC, подтверждает, что последние могут либо сами выступать в качестве зооантро-понозных патогенов, либо служить резервуаром детерминант вирулентности для E. coli, обусловливающих инфекции у человека (12, 20).
Для установления связи между присутствием определенных факторов патогенности APEC и их проявлением в биотопах хозяина используют различные биологические системы, в том числе экспериментальную инфекцию (21, 22). Подтверждена роль плазмиды pColV в вирулентности для птиц и, возможно, человека: трансконъюганты (комменсальный штамм с pAPEC-O2-ColV) вызывали гибель куриных эмбрионов и инфекцию мочевыводящих путей у мышей, а также хорошо росли в человеческой моче (23), тем не менее способность APEC вызывать болезни у людей окончательно не доказана.
В настоящей работе по результатам комплексного молекулярного скрининга штаммов E. coli , выделенных от птиц во время вспышек колибак-териоза, на наличие у них генов трех патотипов эшерихий (APEC, UPEC, IPEC) впервые показано, что штаммы характеризовались высоким патогенным потенциалом и могли быть носителями генов сразу всех патотипов, при этом детерминанты IPEC встречались чаще других. Впервые установлено, что позитивный адгезивный профиль по ряду генов положительно коррелирует с уровнем адгезии штаммов к эритроцитам кур и человека.
Цель работы — дать генотипическую характеристику штаммов Escherichia coli , изолированных от сельскохозяйственной птицы с колибактери-озом, а также оценить взаимосвязь между адгезивным генотипом и специфической адгезией к эритроцитам.
Ìåòîäèêà. В работе использовали 28 штаммов E. coli с уникальным генотипом согласно ERIC-ПЦР, выделенных в 2016-2018 годах из разных органов (исключая кишечник) цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом (24). Штаммы депонированы в Ex коллекции культур (the Ex culture collection) кафедры биологии биотехнологического факультета Университета Любляны (Univerza v Ljubljani, Словения).
Определение принадлежности штамма к филогенетической группе, чувствительности к антибиотикам и наличия генов, кодирующих наиболее распространенные бета-лактамазы расширенного спектра (БЛРС), описано нами ранее (24). В выборке ( n = 28) с помощью полимеразной цепной реакции (ПЦР) по конечной точке детектировали гены вирулентности, характерные для четырех условных групп: гены, обеспечивающие патогенность бактерий вида E. coli , встречающиеся в различных патотипах, гены патогенных для птиц E. coli (APEC), кишечных патогенных E. coli (IPEC: EPEC/ETEC/EHEC/EaggEC) и уропатогенных E. coli (UPEC).
Для всех типов ПЦР использовали праймеры и протоколы предложивших их авторов. Амплификацию проводили на термоциклере DNA Engine Dyad Thermal Cycler («Bio-Rad», США). Визуализацию полос и документирование данных осуществляли с использованием системы гель-доку-ментации Gel-Doc XR («Bio-Rad», США).
Адгезию бактерий к эритроцитам (специфическая адгезия) определяли по методу В.И. Брилис и соавт. (38). Клеточным субстратом служили формалинизированные эритроциты человека 0(I) группы Rh(+) и птичьи эритроциты. Клетки предварительно дважды отмывали в 0,01 М фосфатнобуферной среде (ФБС) и стандартизовали до плотности 100 млн/мл. Взвесь микробных клеток, стандартизованную в ФБС до 2,0 по McFarland, и эритроцитов смешивали в равных количествах (0,1 мл) в пробирках типа Эп-пендорф, встряхивали в течение 20 мин при 37 °C, после чего готовили мазки на предметном стекле. Мазки высушивали при комнатной температуре, фиксировали метанолом в течение 10 мин и окрашивали 2 % метиленовым синим.
Подсчитывали число микробных клеток, прикрепившихся к одному эритроциту, для не менее чем 25 эритроцитов. Адгезивные свойства клеток оценивали с помощью индекса адгезивности микроорганизма (ИАМ): среднее число бактерий, прикрепившихся к одному эритроциту, участвующему в процессе адгезии. Микроорганизмы считали неадгезивными при ИАМ < 1,75, низкоадгезивными — при 1,76-2,5, среднеадгезивными — при 2,51-4,0, высокоадгезивными — при ИАМ > 4,0.
Статистическую обработку данных проводили в программах Microsoft Excel 2013 и Statistica v. 6.0 («StatSoft, Inc.», США). Для оценки количественных показателей рассчитывали медиану и квартили — Me (Q1-Q3). Связь между признаками выявляли при помощи непараметрического коэффициента ранговой корреляции Спирмена (Rs). Достоверность различий двух зависимых выборок оценивали с помощью W -критерия Уилкок-сона (Wilcoxon signed-rank test), независимые выборки сравнивали с использованием U -критерия Манна-Уитни (Mann-Whitney U -test). Классификацию штаммов проводили методом иерархической кластеризацией (tree cluster analyses; мера расстояния — евклидово расстояние). Для сравнения качественных признаков применяли %2 (с поправкой Йейтса) или точный F -критерий Фишера ( F -test). При p < 0,05 делали вывод о наличии статистически значимой разницы между сравниваемыми выборками.
Результаты. Среди 28 индивидуальных штаммов E. coli были обнаружены носители как общих для всех патотипов генов вирулентности, так и генов, характерных для представителей групп АРЕС, UPEC и IPEC (табл. 1).
Исследованные штаммы эшерихий имели высокий общий вирулентный потенциал. Ген fimH , кодирующий фимбриальный адгезин, несли 92,8 % штаммов, ген капсулообразования kpmsT — 82,1 %, ген белка наружной мембраны с протеазной активностью ompT — 71,4 %, ген системы захвата и транспорта железа iroN — 67,8 %. Почти у половины штаммов (46,4 %) мы выявили все перечисленные гены, у 32,1 % — три гена, у 14,3 % — два гена, по одному штамму несли один ген и ни одного из перечисленных генов. Отдельно стоит отметить, что 53,6 % штаммов имели ген позитивного регулятора конъюгации traJ .
Среди генов, наиболее часто характеризующих патотип АРЕС, самым распространенным оказался ген специфического птичьего гемолизина hlyF (82,1 %), следующим был птичий адгезин Yqi (yqi) — 60,7%, iss несли 57,1 % штаммов, iutA — 42,8 %. Четверть штаммов имели все четыре гена, 21,4 % — три гена, 25,0 % — два гена, 21,4 % — один ген и только два штамма не имели ни одного гена из указанной группы. Наличие специфических маркерных генов позволило идентифицировать большинство штаммов эшерихий как APEC.
1. Детектированные гены вирулентности у штаммов APEC (avian pathogenic Escherichia coli ), выделенных от цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом ( n = 28, 2016-2018 годы)
|
Ген |
Патотип |
Фактор вирулентности и его функция |
Ссылка |
|
fimH |
UPEC, NMEC, |
Универсальный фимбриальный адгезин |
(25) |
|
ompT |
SEPEC, APEC |
Поверхностный белок с протеазной активностью |
(26) |
|
kpsMTII |
Ген формирования капсулы 2 типа |
(27) |
|
|
iroN traJ |
Рецепторный белок системы захвата и транспорта железа Позитивный регулятор конъюгативного переноса плазмиды |
(28) |
|
|
hlyF |
APEC |
Специфический птичий гемолизин F |
(29) |
|
Iss |
Фактор, повышающий выживаемость клетки в сыворотке крови |
(10) |
|
|
iutA |
Гомолог адгезина |
(30) |
|
|
yqi |
Специфический птичий адгезин |
(21) |
|
|
beA |
EPEC, ETEC, |
Инвазивный протеин |
(27) |
|
Iha |
EHEC, EaggEC |
Адгезин |
(31) |
|
eaeA stx 1 stx2 estI estII ehxA eltA east1 subAB |
Интимин Шигатоксин Термостабильный энтеротоксин Энтерогемолизин Термолабильный энтеротоксин Энтероаггреративный термостабильный энтеротоксин Цитотоксин субтилаза |
(32) |
|
|
hlyA |
Альфа-гемолизин |
(33) |
|
|
papGII |
UPEC |
Фимбриальный адгезин, связывает рецептор Gal-alpha1-4Gal, об- |
(30) |
|
papGIII papC sfaDE afa/ |
наруженный на эпителиальных клетках, выстилающих верхние мочевыводящие пути Белок-носитель наружной мембраны, участвует в экспорте и сборке субъединиц пилей через внешнюю мембрану Нефимбриальный адгезин Гемагглютинины уропатогенной кишечной палочки, опосредуют |
(27) |
|
|
draBC upaG |
прилипание к верхним мочевыводящим путям Опосредует агрегацию, образование биопленок и адгезию для |
(34) |
|
|
usp |
ряда белков внеклеточного матрикса; опосредует адгезию к эпителиальным клеткам мочевого пузыря Т24 человека Уропатогенный специфический протеин, колицин |
(35) |
Примечание. UPEC — uropathogenic E. coli , NMEC — neonatal meningitis-causing E. coli , SEPEC — sepsis-associated E. coli , APEC — avian pathogenic E. coli , EPEC — enteropathogenic E. coli , ETEC — enterotoxigenic E. coli , EHEC — enterohemorrhagic E. coli , EaggEC — enteroaggregative E. coli , ExPEC — extraintestinal pathogenic E. coli .
В представленной выборке штаммов отсутствовали гены шигаподоб-ного токсина ( stx1 / 2 ), гены основного фактора адгезии EHEC интимина ( eaeA ) и энтерогемолизина ( exhA ). При этом 75 % культур были носителями гена subAB , кодирующего цитотоксин субтилазу, характерный для шига-токсин-продуцирующих штаммов E. coli . Широко представлены были носители генов других энтеротоксинов из группы ETEC. Гены термостабильных энтеротоксинов estI / II были детектированы соответственно у 42,8 и 82,1 % штаммов, больше половины штаммов (60,7 %) несли ген энтероаг-регативного термостабильного энтеротоксина ( eastI ), термолабильный энтеротоксин ( eltI ) был найден у 14,3 % культур. Кроме того, 75 % АРЕС имели ген адгезина iha , относящийся к факторам патогенности диареегенных E. coli. Девятнадцать штаммов (67,8 %) несли четыре и более из перечисленных генов, шесть (24,1 %) — от одного до трех генов, три штамма не имели генов этой группы.
Из группы генов, наиболее характерных для уропатогенных штаммов E. coli , были обнаружены только upaG (67,8 %) и usp (7,1 %).
При сравнении распространенности анализируемых маркерных генов в птичьих штаммах оказалось, что гены патогенности, общие для всех патотипов E. coli , в выборке встречались чаще, чем гены APEC ( W -test: p = 0,029)
или UPEC ( W -test: p < 0,01); APEC встречались чаще, чем UPEC ( W -test: p < 0,01); гены IPEC имели схожую частоту встречаемости в сравнении с генами, общими для всех групп, но значительно превышали частоту APEC и UPEC ( W -test: p < 0,01) (рис. 1).
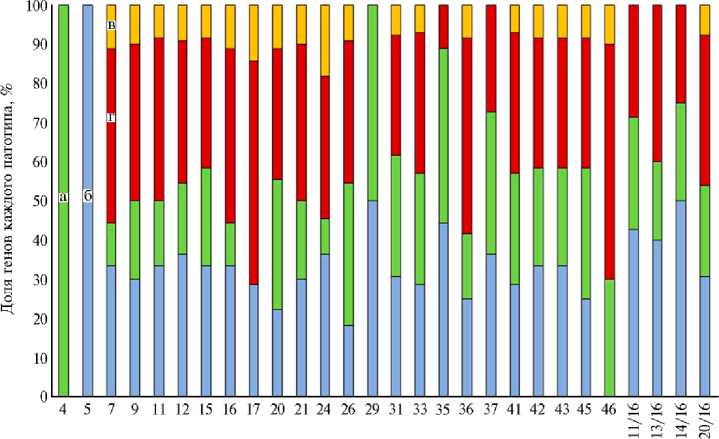
Штамм АРЕС
Рис. 1. Соотношение генов, общих для всех патотипов (б) , APEC (avian pathogenic Escherichia coli ) (а) , UPEC (uropathogenic E. coli ) (в) и IPEC (intestinal pathogenic E. coli ) (г) в штаммах APEC (avian pathogenic Escherichia coli ), изолированных от цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом ( n = 28, 2016-2018 годы) .
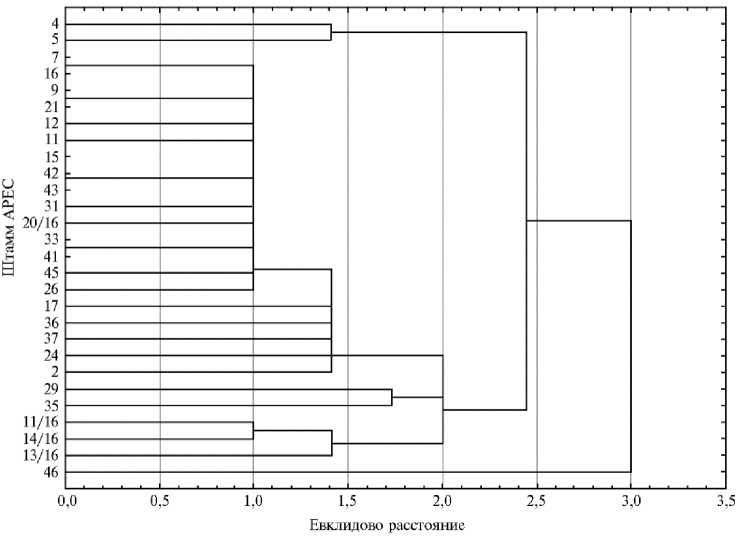
Рис. 2. Результаты кластерного анализа (Cluster analysis, Statistica v.6.0) распределения генов патогенности среди штаммов APEC (avian pathogenic Escherichia coli ), изолированных от цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом ( n = 28, 20162018 годы) .
По результатам кластерного анализа наличия генов патогенности были выделены три условных группы штаммов (рис. 2): патогенные для птиц и человека (наличие одновременно 2-6 генов, связанных с АРЕС, и 2-6 генов, связанных с ExPEC или IPEC) (24 штамма); патогенные для птиц и не патогенные для человека (наличие 2-6 генов, связанных с APEC, и 0-1 гена, связанного с ExPEC или IPEC) (2 штамма); непатогенные (0-1 ген из любой группы, APEC, ExPEC, IPEC) (2 штамма). Штаммы с филогруппой В1 в 85,7 % были отнесены в первую группу. Исходя из полученных ранее данных (24), группа штаммов, выделенных как патогенные для птиц и человека, характеризовалась высокой частотой встречаемости не только генов вирулентности, но и генов БЛРС, таких как СТХ (57,1 % штаммов) и ТЕМ (71,4 % штаммов). Кроме того, 42,8 % представителей этой группы имели ген traJ (60 % от общей частоты встречаемости гена в выборке) и 28,5 % — участки интегронов 1-го класса (75 % от общей частоты встречаемости в выборке).
Для определения связи между присутствием генов, ассоциированных с вирулентностью и антибиотикоустойчивостью, культуры распределили в группы сравнения: 0-2 и 3-4 гена (для генов общей вирулентности и маркеров APEC) и 0-3 и 4-6 генов (для маркеров IPEC). АРЕС, имеющие 0-2 гена из группы общей вирулентности в 42,85 % случаев были устойчивы к пяти и более антибиотикам, в то время как штаммы с 3-4 генами — в 57,14 % случаев. Для генов, характеризующих группу APEC, разница была еще более значимой: 42,85 % устойчивых к пяти и более антибиотикам среди носителей 0-2 генов и 64,28 % — среди носителей 3-4 генов. Интересно, что для генов группы IPEC соотношение было обратным: штаммы с 0-3 генами были устойчивы к пяти и более антибиотикам в 66,66 % случаев, а штаммы с большим числом генов — только в 47,36 %. Такая тенденция сохранялась для любой комбинации числа имеющихся генов и антибиотиков, к которым у штамма выработана устойчивость. Следует также отметить, что корреляция между указанными признаками была значима только для генов группы APEC (Rs = 0,426), а для генов IPEC полностью отсутствовала (Rs = -0,041). Преобладающая часть изученных нами штаммов, согласно ИАМ, была отнесена к низкоадгезивной группе, независимо от типа используемых эритроцитов (60,71 % культур в тесте с куриными эритроцитами и 85,71 % культур — с человеческими эритроцитами), при этом корреляции между показателями ИАМ не выявляли (Rs = 0,046) (рис. 3).
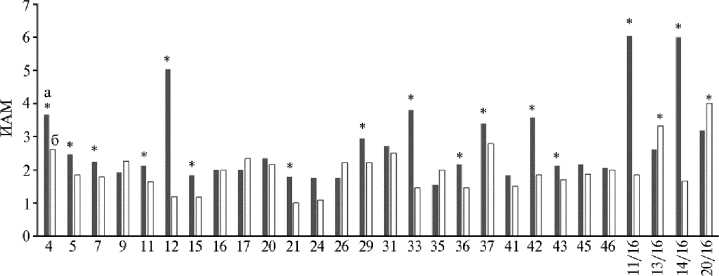
Штамм
Рис. 3. Индекс адгезивности микроорганизма (ИАМ) у штаммов APEC (avian pathogenic Escherichia coli ), изолированных от цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом, в отношении куриных (а) и человеческих (б) эритроцитов ( n = 28, 20162018 годы) .
* Различия между вариантами с разными типами эритроцитов статистически значимы при р ≤ 0,05 ( W -test).
Для большей части штаммов APEC адгезивная активность в отношении куриных и человеческих эритроцитов достоверно различалась. Клетки 15 штаммов (53,57 %) лучше прикреплялись к поверхности куриных эритроцитов, двух штаммов (7,14 %) — к человеческим эритроцитам, и у 11 культур (39,29 %) показатели адгезии не различались. Средний показатель ИАМ — Me(Q1-Q3) составил соответственно 2,21(1,96-3,25) и 1,87(1,612,24), для птичьих и человеческих эритроцитов и оказался ниже в последнем случае (р = 0,0057). В группе штаммов, патогенных для птиц и человека согласно генотипу, степень адгезии к эритроцитам птиц, как и в общей выборке, была все еще достоверно выше, чем к эритроцитам человека ( W -test: p = 0,007), что определялось большим тропизмом АРЕС к эритроцитам птицы.
При анализе связи между числом генов вирулентности и степенью адгезии к двум типам эритроцитов были получены зависимости, аналогичные таковым для антибиотикорезистентности. Если в группах генов вирулентности, общих для всех патотипов, и генов APEC индексы адгезии были примерно одинаковыми у штаммов с разным числом детектированных генов, то внутри группы генов IPEC степень адгезии к обои типам эритроцитов оказалась выше у штаммов с меньшим числом генетических детерминант (табл. 2). Отдельно были проанализированы показатели адгезивной активности клеток бактерий с генотипами iss - и iss +, а также hlyF - и hlyF +, дающими штаммам с позитивным генотипом преимущество выживания при системной коли-инфекции и обеспечивающими повреждение эритроцитов. Выявлена тенденция к увеличению показателей ИАМ у iss + штаммов: 2,88(1,85-3,40) против 2,14(2,00-2,47) и 2,07(1,67-2,23) против 1,83(1,472,27) при адгезии соответственно на человеческих и птичьих эритроцитах. Аналогично показатели ИАМ у hlyF + штаммов были выше в обоих моделях, при этом в отношении куриных эритроцитов эта разница оказалась статистически значимой: 2,35(1,93-2,27) против 2,00(2,00-2,07) при р ≤ 0,01.
2. Степень специфической адгезии штаммов APEC (avian pathogenic Escherichia coli ), изолированных от цыплят-бройлеров ( Gallus gallus L.) кросса Ross 308 с генерализованным колибактериозом, в зависимости от генотипа ( n = 28, 2016-2018 годы)
|
Группа |
ИАМ |
|
|
0-2 гена 1 |
3-4 гена |
|
|
Гены, встречающиеся в различных патотипах E. coli |
2,35 (2,00-2,54) |
2,16 (2,00-3,410) |
|
2,23 (2,07-2,47)* |
1,79 (1,47-2,00) |
|
|
Гены группы АРЕС (avian pathogenic E. coli ) |
2,20 (2,00-3,40) |
2,24 (2,00-3,13) |
|
1,82 (1,51-2,20) |
2,00 (1,75-2,23) |
|
|
0-3 гена |
4-6 генов |
|
|
Гены группы IPEC (intestinal pathogenic E. coli ) |
2,94 (2,47-3,66) * |
2,00 (1,46-2,98) |
|
2,15 (1,86-2,60)* |
1,79 (1,47-2,11) |
|
Примечание. ИАМ — индекс адгезивности микроорганизма. Над чертой — ИАМ в отношении кури- ных эритроцитов, под чертой — ИАМ в отношении человеческих эритроцитов.
* Различия между штаммами с разным числом генов статистически значимы при р ≤ 0,05 ( U -test).
Патотип АРЕС считается относительно новым в классификации E. coli , и, несмотря на активное изучение его представителей во всем мире, вопросы об автономности этой экологической группы и ее зоонозном потенциале остаются открытыми. Каждый из описанных экстра- и интраин-тестинальных патотипов представляет собой группу серотипов, объединенных определенными факторами вирулентности. Тем не менее следует отметить, что из-за пластичности генома E. coli не удается окончательно идентифицировать субпатотипы эшерихий, поскольку некоторые штаммы сочетают в себе основные характеристики вирулентности различных групп и считаются потенциально более вирулентными гибридными вариантами
(18). Филогенетический анализ позволил установить, что APEC имеют значительное генетическое сходство с доминантными патогенами ExPEC человека и, кроме того, могут быть источником ColV-локализованных генов или даже целых плазмид для других штаммов ExPEC (10). L. Zhao с соавт. (37) вывили, что различные гены UPEC и APEC имели сходную тенденцию к экспрессии в эксперименте с перекрестным заражением мышей и птиц. Посредством моделирования неонатального менингита у крыс показано, что некоторые штаммы APEC способны вызывать менингит у млекопитающих, и, возможно, человека, а штаммы NMEC вызывают колисептицемию у птиц. Эти данные подтверждают гипотезу о том, что APEC обладают зоонозным потенциалом (38). В настоящее время исследования биоразнообразия эшерихий направлены, с одной стороны, на поиск филогенетического родства между представителями APEC и штаммами других патотипов, с другой — на оценку их потенциальной патогенности (в том числе эпидемической опасности) для человека. Учитывая, что все штаммы E. coli в нашем исследовании выделены из паренхиматозных органов (селезенка, печень, почки), легких и внутреннего содержимого костей погибшей птицы, они были расценены нами как патотип APEC и взяты для дальнейшего детального изучения генотипа.
Известно, что не существует ни одного фактора патогенности ExPEC, связанного исключительно с конкретным заболеванием или макроорганизмом, при этом способность условно-патогенных эшерихий вызывать инфекционный процесс в различных биотопах иммунокомпетентных хозяев опосредована наличием определенных детерминант вирулентности. По данным J.R. Johnson с соавт. (39), штамм можно считать ExPEC, если он содержит два или более из следующих генов вирулентности: pap (Р-фим-брии), sfa / foc (S/F1C-фимбрии), afa / dra (Dr, связывающий адгезины), iutA (рецептор аэробактина) и kpsM II (синтез капсулы группы 2). Структура распределения генов ExPEC (см. табл. 2) позволила ассоциировать с этой группой штаммы E. coli , выделенные при колибактериозе сельскохозяйственной птицы, за исключением двух культур. Чтобы классифицировать штамм как принадлежащий к группе APEC, согласно T.J. Johnson с соавт. (5), необходимо присутствие в его геноме не менее двух маркерных генов. Строго к патотипу APEC были отнесены 25 (89,3 %) культур. Аналогичным образом R.R. Spurbeck с соавт. (40) предложили набор из четырех генов для идентификации штаммов ExPEC с уропатогенным потенциалом. В нашем исследовании из группы генов, наиболее характерных для уропатогенных штаммов E. coli, были обнаружены только upaG и usp , которые часто встречаются в геноме APEC (41, 42).
Сравнение генетических и фенотипических характеристик APEC и IPEC остается обширной областью изучения с точки зрения выявления ге-теропатогенных и гибридных штаммов эшерихий (18). В России выявлен новый штамм Å. coli серотипа О101:Н33, проявляющий свойства и несущий гены, характерные одновременно для энтерогеморрагических и энтероток-сигенных штаммов Å. coli: stx2a, eaeγ, ehxA и est1 (19). Описаны также гибридные штаммы, филогенетически расположенные между шига-токсин-продуцирующими E. coli и UPEC. Показано, что они обладают факторами патогенности, характерными для обеих патогрупп, и способны вызвать как диарею, так и инфекцию мочевыводящих путей (43). Единичные работы посвящены сравнению генотипов птичьих патогенов и возбудителей острых кишечных инфекции человека (44). В нашем исследовании в представленной выборке штаммов отсутствовали гены шигаподобного токсина (stx1/2), тем не менее 75 % культур были носителями гена subAB, кодирующего ци- тотоксин субтилазу, характерный для шига-токсинпродуцирующих штаммов E. coli — STEC (45). Известно, что STEC синтезируют два разных типа цитотоксинов, а именно собственно StxI/II и цитотоксин субтилазу (SubAB), которые сходны по структуре и состоят из одной субъединицы A и пентамера субъединицы B. Цитотоксин субтилаза вызывает различные клеточные эффекты, включая ингибирование синтеза белка, подавление активации ядерного фактора-каппа B, апоптотическую гибель клеток и образование стрессовых гранул (46). Внутрибрюшинное введение мышам очищенного цитотоксина субтилазы приводило к обширному микроваскулярному тромбозу, а также к некрозу мозга, почек и печени и было фатальным для животных. Пероральное заражение животных штаммом E. coli K-12 с клонированными генами subA и subB вызывало резкую потерю массы у мышей. Эти данные свидетельствуют о том, что цитотоксин субтилаза может вносить вклад в патогенез заболеваний человека и стать новым токсическим маркером вирулентности среди E. coli, полученных от животных.
Горизонтальный перенос генов — важный механизм эволюции бактерий, который обусловливает сложность и пластичность их геномов. Известно, что условно-патогенные и патогенные E. coli могут происходить из комменсальных штаммов после приобретения ассоциированных с вирулентностью генов, которые обычно находятся хромосоме в определенных регионах, называемых островами патогенности (pathogenicity island, PAI) (9, 47). PAI могут включать гены белков системы секреции III типа, токсинов, факторов инвазии и систем захвата железа, по которым PAI можно идентифицировать (48). В нашем исследовании мы проверяли два гена, детерминирующих PAI, — eaeA (ген, кодирующий у штаммов EPEC и EHEC основной фактор адгезии интимин в острове патогенности LEE, locus enterocyte effacement) и iutA (ген, кодирующий рецептор аэробактина в острове патогенности SHI-2, Shigella pathogenicity island 2). Ген eaeA , маркирующий локус сглаживания энтероцитов, обнаружен не был, тогда как iutA , указывающий на наличие одного из островов патогенности шигелл и обозначенный как SHI-2 PAI, выявлен у 42,8 % культур, что также свидетельствует об их потенциальной патогенности для человека. Например, 75 % iutA + изолятов несли 10 и более генов вирулентности и были устойчивы к 5 и более антибиотикам, в то время как iutA - удовлетворяли этим критериям только в 50,0 и 33,3 % случаев. Кроме того, более половины всех штаммов имели участки конъюгативных плазмид, 60 % из которых были отнесены в группы патогенных для птиц и человека, что указывает на возможность эффективного распространения детерминант патогенности посредством горизонтального переноса.
Плазмиды рColV уже давно ассоциируются с вирулентностью E. coli несмотря на то, что их одноименный признак — продукция бактериоцина ColV не считается признаком вирулентности (10). Учитывая, что гены iss , ompT , hlyF , repA (RepFIB replication protein) и traJ , кодирующие последовательности предполагаемых областей вирулентности и переноса pAPEC-O2-ColV, обнаруживались в нашей коллекции APEC с высокой частотой, можно предполагать, что они были носителем этой плазмиды. Тем не менее следует отметить, что патогенность APEC напрямую не коррелирует с наличием других плазмид, как в некоторых патотипах E. coli (49). Например, предполагаемые плазмидные гены были широко распространены как среди APEC, так и среди комменсальных штаммов E. coli кур, в последнем случае среднее число плазмидных генов на изолят было даже больше, чем среди APEC (9).
Для выявления патогенности штамма для человека используют ко- личественный метод определения адгезии бактерий на эритроцитах (36). Способность бактерий E. coli прикрепляться к эритроцитам и агглютинировать их может определяться чувствительными к маннозе фимбриями 1-го типа. Они представляют собой наиболее распространенный тип бактериальных адгезинов и экспрессируются как комменсальными, так и патогенными штаммами энтеробактерий. Несмотря на общую первичную специфичность этих фимбрий к маннозе, существует разнообразие в степени адгезии между разными видами, а также между разными изолятами одного вида. Так, FimH большинства штаммов фекальной E. coli не обеспечивает прочного связывания с рецепторами, которые содержат концевые остатки мономаннозы (Man1), однако некоторые варианты FimH уропатогенной E. coli обладают относительно высокой способностью связывания Man1 из-за наличия функциональных точечных мутаций в различных положениях в молекуле FimH (50). Кроме того, маннозорезистентные адгезины, обозначенные как Afa/Dr адгезины, распознающие антиген системы групп крови Кромера, фактор ускорения распада комплемента или CD55 (сomplement decay-accelerating factor; DAF) в качестве рецептора, были обнаружены в изолятах IPEC и UPEC. Интересно, что адгезин AfaE, экспрессируемый в изолятах E. coli от различных животных, не распознает DAF человека, тогда как afaE8-подтип, впервые идентифицированный в изолятах E. coli от животных, впоследствии был ассоциирован с уропатогенной E. coli человека (51).
По-видимому, естественное появление разнообразных вариантов ад-гезинов может отражать продолжающуюся адаптивную молекулярную эволюцию E. coli по усовершенствованию механизмов закрепления в биотопах разнообразных хозяев. В связи с этим нами проведена оценка адгезивного фенотипа APEC с использованием различных эритроцитов для доказательства возможного избирательного преимущества клеток-мишеней. Преобладающая часть изученных нами штаммов отнесена к низкоадгезивной группе независимо от типа эритроцитов, при этом средний показатель ИАМ при использовании птичьих эритроцитов оказался выше, чем человеческих, что напрямую связано с источником происхождения штаммов. Тем не менее у 11 штаммов степень адгезии не зависела от типа эритроцитов, а у двух культур была достоверно выше на человеческих, чем на птичьих клетках. Следует также подчеркнуть, что показатели адгезивной активности бактерий с генотипом iss + и hlyF + были выше, чем в группе штаммов, не несущих эти гены, что дает им преимущество при развитии системной коли-инфекции.
Таким образом, подавляющее большинство штаммов Escherichia coli, выделенных из органов цыплят-бройлеров с генерализованным колибакте-риозом, были охарактеризованы как патогенные для птиц и человека, что свидетельствует о потенциале APEC как резервуара факторов вирулентности для возбудителей инфекций человека. В их геноме присутствовали одновременно гены вирулентности, характерные для нескольких патотипов (с преобладанием гибридных патотипов APEC/IPEC), при этом многие штаммы APEC по генетическому профилю имели сродство с группой диареегенных эшерихий. Эпидемически опасные для человека, они могут реализовывать свой патогенный потенциал в большей степени за счет генов токсино-образования и генетических детерминант, связанных с общей вирулентностью, чем за счет факторов адгезии, и без связи с профилем антибиотико-чувствительности. Специфическая адгезия штаммов E. coli была более выражена в отношении куриных эритроцитов, чем человеческих. При этом, независимо от типа эритроцитов, высокая адгезивная активность бактерий коррелировала с большей выживаемостью в сыворотке крови хозяина (iss+ генотип) и возможностью лизиса эритроцитов (hlyF+ генотип). Полученные данные о молекулярных и адгезивных свойствах возбудителей колибактери-оза птиц позволяют оценить их зоонозный потенциал и эпизоотическую значимость, а также могут служить основой для усовершенствования системы мониторинга колибактериоза в птицеводческих хозяйствах.
Список литературы Возбудители колибактериоза сельскохозяйственной птицы - носители генов, ассоциированных с вирулентностью экстраинтестинальных и кишечных Escherichia coli
- Dho-Moulin M., Fairbrother J.M. Avian pathogenic Escherichia coli (APEC). Veterinary Research, 1999, 30(2-3): 299-316.
- Kunert Filho H.C., Brito K.C.T., Cavalli L.S., Brito B.G. Avian Pathogenic Escherichia coli (APEC) — an update on the control. In: The battle against microbial pathogens: basic science, technological advances and educational programs /A. Méndez-Vilas (eds.), Formatex Research Center, Spain, 2015.
- Nolan L.K., Barnes H.J., Vaillancourt J.P., Tahseen A., Logue C.M. Colibacillosis. In: Disease of Poultry, 13th Edition / D.E. Swayne (eds.), John Wiley & Sons, Inc., USA, 2013.
- Solà-Ginés M., Cameron-Veas K., Badiola I., Dolz R., Majó N., Dahbi G., Viso S., Mora A., Blanco J., Piedra-Carrasco N., González-López J.J., Migura-Garcia L. Diversity of multi-drug resistant avian pathogenic Escherichia coli (APEC) causing outbreaks of colibacillosis in broilers during 2012 in Spain, PLoS ONE, 2015, 10(11): e0143191 (doi: 10.1371/journal.pone.0143191).
- Johnson T.J., Wannemuehler Y., Doetkott C., Johnson S.J., Rosenberger S.C., Nolan L.K. Identification of minimal predictors of avian pathogenic Escherichia coli virulence for use as a rapid diagnostic tool Journal of Clinical Microbiology, 2008, 46(12): 3987-3996 (doi: 10.1128/JCM.00816-08).
- Джаилиди Г.А., Пономаренко Ю.Ю., Лозаберидзе А.Е. Анализ эпизоотического состояния птицеводства в Российской Федерации. Ветеринария Кубани, 2014, 2: 25-27.
- Dziva F., Stevens M.P. Colibacillosis in poultry: unravelling the molecular basis of virulence of avian pathogenic Escherichia coli in their natural hosts. Avian Pathology, 2008, 37(4): 355-366 (doi: 10.1080/03079450802216652).
- Maturana V.G., de Pace F., Carlos C., Pires M.M., de Campos T.A., Nakazato G., Stheling E.G., Logue C.M., Nolan L.K., da Silveira W.D. Subpathotypes of avian pathogenic Escherichia coli (APEC) exist as defined by their syndromes and virulence traits. The Open Microbiology Journal, 2011, 5: 55-64 (doi: 10.2174/1874285801105010055).
- Mageiros L., Méric G., Bayliss S.C., Pensar J., Pascoe B., Mourkas E., Calland J.K., Yahara K., Murray S., Wilkinson T.S., Williams L.K., Hitchings M.D., Porter J., Kemmett K., Feil E.J., Jolley K.A., Williams N.J., Corander J., Sheppard S.K. Genome evolution and the emergence of pathogenicity in avian Escherichia coli. Nature Communication, 2021, 12(1): 765 (doi: 10.1038/s41467-021-20988-w).
- Johnson T.J., Siek K.E., Johnson S.J., Nolan L.K. DNA Sequence of a ColV plasmid and prevalence of selected plasmid-encoded virulence genes among avian Escherichia coli strains. Journal of Bacteriology, 2006, 188: 745-758 (doi: 10.1128/JB.188.2.745-758.2006).
- Manges A.R. Escherichia coli and urinary tract infections: the role of poultry-meat. Clinical Microbiology and Infection, 2016, 22(2): 122-129 (doi: 10.1016/j.cmi.2015.11.010).
- Vincent C., Boerlin V.P., Daignault D., Dozois C.M., Dutil L., Galanakis C., Reid-Smith R.J., Tellier P.P., Tellis P.A., Ziebell K., Manges A.R. Food reservoir for Escherichia coli causing urinary tract infections. Emerging Infectious Diseases, 2010, 16(1): 88-95 (doi: 10.3201/eid1601.091118).
- Bergeron C., Prussing C., Boerlin P., Daignault D., Dutil L., Reid-Smith R.J., Zhanel G.G., Manges A.R. Chicken as reservoir for extraintestinal pathogenic Escherichia coli in humans, Canada. Emerging Infectious Diseases, 2012, 18(3): 415-421 (doi: 10.3201/eid1803.111099).
- Johnson T.J., Jordan D., Kariyawasam S., Stell A.L., Bell N.P., Wannemuehler Y.M., Alarcón C.F., Li G., Tivendale K.A., Logue K.M., Nolan L.K. Sequence analysis and characterization of a transferable hybrid plasmid encoding multidrug resistance and enabling zoonotic potential for extraintestinal Escherichia coli. Infection and Immunity, 2010, 78(5): 1931-1942 (doi: 10.1128/IAI.01174-09).
- Rodriguez-Siek K.E., Giddings C.W., Doetkott C., Johnson T.J., Fakhr M.K., Nolan L.K. Comparison of Escherichia coli isolates implicated in human urinary tract infection and avian colibacillosis. Microbiology, 2005, 151(6): 2097-2110 (doi: 10.1099/mic.0.27499-0).
- Johnson T.J., Kariyawasam S., Wannemuehler Y., Mangiamele P., Johnson S.J., Doetkott C., Skyberg J.A., Lynne A.M., Johnson J.R., Nolan L.K.The genome sequence of avian pathogenic Escherichia coli strain O1:K1:H7 shares strong similarities with human extraintestinal pathogenic E. coli genomes. Journal of Bacteriology, 2007, 189(8): 3228-3236 (doi: 10.1128/JB.01726-06).
- Johnson T.J., Wannemuehler Y., Johnson S.J., Stell A.L., Doetkott C., Johnson J.R., Kim K.S., Spanjaard L., Nolan L.K. Comparison of extraintestinal pathogenic Escherichia coli strains from human and avian sources reveals a mixed subset representing potential zoonotic pathogens. Applied and Environmental Microbiology, 2008, 74(22): 7043-7050 (doi: 10.1128/AEM.01395-08).
- Santos A.C.M., Santos F.F., Silva R.M., Gomes T.A.T Diversity of hybrid- and hetero-pathogenic Escherichia coli and their potential implication in more severe diseases. Frontiers in Cellular and Infection Microbiology, 2020, 10: 339 (doi: 10.3389/fcimb.2020.00339).
- Онищенко Г.Г., Дятлов И.А., Светоч Э.А., Воложанцев Н.В., Баннов В.А., Карцев Н.Н., Борзенков В.Н., Фурсова Н.К., Шемякин И.Г., Богун А.Г., Кисличкина А.А., Попова А.В., Мякинина В.П., Теймуразов М.Г., Полосенко О.В., Кафтырева Л.А., Макарова М.А., Матвеева З.Н., Гречанинова Т.А., Григорьева Н.С., Кича Е.В., Забалуева Г.В., Кутасова Т.Б., Коржаев Ю.Н., Башкетова Н.С., Бушманова О.Н., Сталевская А.В., Чхинджерия И.Г., Жебрун А.Б. Молекулярно-генетическая характеристика шига-токсинпродуцирующих Escherichia coli, выделенных при вспышке пищевой инфекции в Санкт-Петербурге в 2013 году. Вестник РАМН, 2015, 70(1): 70-81.
- Bélanger L., Garenaux A., Harel J., Boulianne M., Nadeau E., Dozois C.M. Escherichia coli from animal reservoirs as a potential source of human extraintestinal pathogenic E. coli. FEMS Immunology and Medical Microbiology, 2011, 62(1): 1-10 (doi: 10.1111/j.1574-695X.2011.00797.x).
- Antao E.M., Ewers C., Gurlebeck D., Preisinger R., Homeier T., Li G., Wieler L.H. Signature-tagged mutagenesis in a chicken infection model leads to the identification of a novel avian pathogenic Escherichia coli fimbrial adhesion. PLoS One, 2009, 4(11): e7796 (doi: 10.1371/journal.pone.0007796).
- Li G., Laturnus C., Ewers C., Wieler L.H. Identification of genes required for avian Escherichia coli septicemia by signature-tagged mutagenesis. Infection and Immunity, 2005, 73(5): 28182827 (doi: 10.1128/IAI.73.5.2818-2827.2005).
- Skyberg J.A., Johnson T.J., Johnson J.R., Clabots C., Logue C.M., Nolan L.K. Acquisition of avian pathogenic Escherichia coli plasmids by a commensal E. coli isolate enhances its abilities to kill chicken embryos, grow in human urine, and colonize the murine kidney. Infection and Immunity, 2006, 74(11): 6287-6292 (doi: 10.1128/IAI.00363-06).
- Kuznetsova M.V., Gizatullina J.S., Nesterova L.Yu., Starčič Erjavec M. Escherichia coli isolated from cases of colibacillosis in Russian poultry farms (Perm krai): sensitivity to antibiotics and bacteriocins. Microorganisms, 2020, 8(5): 741 (doi: 10.3390/microorganisms8050741).
- Guiral E., Bosch J., Vila J., Soto S.M. Prevalence of Escherichia coli among samples collected from the genital tract in pregnant and nonpregnant women: relationship with virulence. FEMS Microbiology Letters, 2011, 314(2): 170-173 (doi: 10.1111/j.1574-6968.2010.02160.x).
- Subedi M., Luitel H., Devkota B., Bhattarai R.K., Phuyal S., Panthi P., Shrestha A., Chaudhary D.K. Antibiotic resistance pattern and virulence genes content in avian pathogenic Escherichia coli (APEC) from broiler chickens in Chitwan, Nepal. BMC Veterinary Research, 2018, 14: 113 (doi: 10.1186/s12917-018-1442-z).
- Johnson J.R., Stell A.L. Extended virulence genotypes of Escherichia coli strains from patients with urosepsis in relation to phylogeny and host compromise. Journal of Infectious Disease, 2000, 181(1): 261-272 (doi: 10.1086/315217).
- Maslennikova I.L., Kuznetsova M.V., Toplak N., Nekrasova I.V., Žgur Bertok D., Starčič Erjavec M. Estimation of the bacteriocin ColE7 conjugation-based “kill”—“anti-kill” antimicrobial system by real-time PCR, fluorescence staining and bioluminescence assays. Letters in Applied Microbiology, 67(1): 47-53 (doi: 10.1111/lam.12884).
- Moulin-Schouleur M., Répérant M., Laurent S., Brée A., Mignon-Grasteau S., Germon P., Rasschaert D., Schouler C. Extraintestinal pathogenic Escherichia coli strains of avian and human origin: link between phylogenetic relationships and common virulence patterns. Journal of Clinical Microbiology, 2007, 45(10): 3366-3376 (doi: 10.1128/JCM.00037-07).
- Yamamoto S., Terai A., Yuri K., Kurazono H., Takeda Y., Yoshida O. Detection of urovirulence factors in Escherichia coli by multiplex polymerase chain reaction. FEMS Immunology and Medical Microbiology, 1995, 12(2): 85-90 (doi: 10.1111/j.1574-695X.1995.tb00179.x).
- Chapman T.A., Wu X.-Y., Barchia I., Bettelheim K.A., Driesen S., Trott D., Wilson M., Chin J.C.C Comparison of virulence gene profiles of Escherichia coli strains isolated from healthy and diarrheic swine. Applied and Environmental Microbiology, 2006, 72(7): 4782-4795 (doi: 10.1128/AEM.02885-05).
- Orden J.A., Horcajo P., de la Fuente R., Ruiz-Santa-Quiteria J.A., Domínguez-Bernal G., Carrión J. Subtilase cytotoxin-coding genes in verotoxin-producing Escherichia coli strains from sheep and goats differ from those from cattle. Applied and Environmental Microbiology, 2011, 77(23): 8259-8264 (doi: 10.1128/AEM.05604-11).
- Kerényi M., Allison H.E., Bátai I., Sonnevend A., Emödy L., Plaveczky N., Páll T. Occurrence of hlyA and sheA genes in extraintestinal Escherichia coli strains. Journal of Clinical Microbiology, 1998, 43(6): 2965-2968 (doi: 10.1128/JCM.43.6.2965-2968.2005).
- O’Hara R.W., Jenks P.J., Emery M., Upton M. Rapid detection of extra-intestinal pathogenic Escherichia coli multi-locus sequence type 127 using a specific PCR assay. Journal of Medical Microbiology, 2019, 68(2): 188-196 (doi: 10.1099/jmm.0.000902).
- Nakano M., Yamamoto S., Terai A., Ogawa O., Makino S., Hayashi H., Nair G.B., Kurazono H. Structural and sequence diversity of the pathogenicity island of uropathogenic Escherichia coli which encodes the USP protein. FEMS Microbiology Letters, 2001, 205(1): 71-76 (doi: 10.1111/j.1574-6968.2001.tb10927.x).
- Брилис В.И., Брилен Т.А., Ленцнер Х.П. Методика изучения адгезивного процесса микроорганизмов. Лабораторное дело, 1986: 210-212.
- Zhao L., Gao S., Huan H., Xu X., Zhu X., Yang W., Gao Q., Liu X. Comparison of virulence factors and expression of specific genes between uropathogenic Escherichia coli and avian pathogenic E. coli in a murine urinary tract infection model and a chicken challenge model. Microbiology, 2009, 155(5): 1634-1644 (doi: 10.1099/mic.0.024869-0).
- Tivendale K.A., Logue C.M., Kariyawasam S., Jordan D., Hussein A., Li G., Wannemuehler Y., Nolan L.K. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E. coli strains and are able to cause meningitis in the rat model of human disease. Infection and Immunity, 2010, 78(8): 3412-3419 (doi: 10.1128/IAI.00347-10).
- Johnson J.R., Murray A.C., Gajewski A., Sullivan M., Snippes P., Kuskowski M.A., Smith K.E. Isolation and molecular characterization of nalidixic acid-resistant extraintestinal pathogenic Escherichia coli from retail chicken products. Antimicrobial Agents and Chemotherapy, 2003, 47(7): 2161-2168 (doi: 10.1128/AAC.47.7.2161-2168.2003).
- Spurbeck R.R., Dinh Jr. P.C., Walk S.T., Stapleton A.E., Hooton T.M., Nolan L.K., Kim K.S., Johnson J.R., Mobley H.L.T. Isolates that carry vat, fyuA, chuA, and yfcV efficiently colonize the urinary. InfectionandImmunity, 2012, 80(12): 4115-4122 (doi: 10.1128/IAI.00752-12).
- Sarowska J., Futoma-Koloch B., Jama-Kmiecik A., Frej-Madrzak M., Ksiazczyk M., Bugla-Ploskonska G., Choroszy-Krol I.Virulence factors, prevalence and potential transmission of extraintestinal pathogenic Escherichia coli isolated from different sources: recent reports. Gut Pathogens, 2019, 11: 10 (doi: 10.1186/s13099-019-0290-0).
- Li T., Castañeda C.D., Arick M.A., Hsu C., Hsu C., Kiess A.S., Zhang L. Complete genome sequence of multidrug-resistant avian pathogenic Escherichia coli strain APEC-O2-MS1170. Journal of Global Antimicrobial Resistance, 2020, 23: 401-403 (doi: 10.1016/j.jgar.2020.11.009).
- Toval F., Schiller R., Meisen I., Putze J., Kouzel I.U., Zhang W., Karch H., Bielaszewska M., Mormann M., Müthing J., Dobrindt U. Characterization of urinary tract infection-associated shiga toxin-producing Escherichia coli. Infection and Immunity, 2014, 82(11): 4631-4642 (doi: 10.1128/IAI.01701-14).
- Dziva F., Hauser H., Connor T.R., van Diemen P.M., Prescott G., Langridge G.C., Eckert S., Chaudhuri R.R., Ewers C., Mellata M., Mukhopadhyay S., Curtiss R., Dougan G., Wieler L.H., Thomson N.R., Pickard D.J., Stevens M.P. Sequencing and functional annotation of avian pathogenic Escherichia coli serogroup O78 strains reveal the evolution of E. coli lineages pathogenic for poultry via distinct mechanisms. Infection and Immunity, 2013, 81(3): 838-849 (doi: 10.1128/IAI.00585-12).
- Булгакова Н.Ф. Идентификация с помощью метода ПЦР гена цитотоксина субтилазы среди штаммов шига-токсигенных Еscherichiacoli, выделенных от людей, крупного рогатого скота, свиней (Польша). Ветеринария. Реферативный журнал, 2007, 3: 759.
- Tsutsuki H., Ogura K., Moss J., Yahiro K. Host response to the subtilase cytotoxin produced by locus of enterocyte effacement-negative shiga-toxigenic Escherichia coli. Microbiology and Immunology, 2020, 64(10): 657-665 (doi: 10.1111/1348-0421.12841).
- Naderi G., Haghi F., Zeighami H., Hemati F., Masoumian N. Distribution of pathogenicity island (PAI) markers and phylogenetic groups in diarrheagenic and commensal Escherichia coli from young children. Gastroenterol Hepatol Bed Bench, 2016, 9(4): 316-324.
- Yoon S.H., Park Y., Kim J.F. PAIDB v2.0: exploration and analysis of pathogenicity and resistance islands. Nucleic Acids Research, 2015, 43(D1): D624-D630 (doi: 10.1093/nar/gku985).
- Johnson T.J., Nolan L.K. Pathogenomics of the virulence plasmids of Escherichia coli. Microbiology and Molecular Biology Reviews, 2009, 73(4): 750-774 (doi: 10.1128/MMBR.00015-09).
- Thomas W.E., Trintchina E., ForeroM., Vogel V., Sokurenko E.V. Bacterial adhesion to target cells enhanced by shear force.Cell, 2002, 109(7): 913-923 (doi: 10.1016/s0092-8674(02)00796-1).
- Le Bouguénec C., Servin A.L. Diffusely adherent Escherichia coli strains expressing Afa/Dr adhesins (Afa/Dr DAEC): hitherto unrecognized pathogens. FEMSMicrobiologyLetters, 2006, 256: 185-194 (doi: 10.1111/j.1574-6968.2006.00144.x).


