Воздействие экологических факторов на изменение ряда физиолого-биохимических параметров вегетативных органов березы
Автор: Баландайкин М.Э.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Экология
Статья в выпуске: 6, 2013 года.
Бесплатный доступ
Проведено исследование влияния разнообразных стресс-факторов (фитопатологического, антропотехногенного и др.) на динамику некоторых физиолого-биохимических показателей жизнедеятельности деревьев. Отображена специфика ответной реакции Betula L на стресс, порождаемый действием разнообразных биоэкологических факторов.
Базидиомицет, береза повислая (betula pendula roth.), водородный показатель, аскорбиновая кислота, пигменты
Короткий адрес: https://sciup.org/14083068
IDR: 14083068 | УДК: 632.928
Текст научной статьи Воздействие экологических факторов на изменение ряда физиолого-биохимических параметров вегетативных органов березы
Введение. Качественный состав фоторецепторной системы фотосинтеза листового аппарата, уровень содержания вторичных метаболитов в морфологических структурах высших автотрофов имеют определяющее значение в жизни последних, а потому служат надежными критериями оценки стабильности развития растительного организма. Норма реакции, предопределенная эволюцией, обусловливает пределы, в которых в зависимости от абиогенных и биогенных факторов среды допускается варьирование биохимических и физиологических параметров вегетативных органов растений. Вместе с тем пути биосинтеза и деструкции данных химических соединений в органеллах различны, различны и их функции, а также механизмы накопления.
У высших продуцентов, например, лишь хлорофилл a способен к преобразованию энергии, все остальные пигменты участвуют в процессах ее поглощения и миграции [11]. Магнийпорфирины осуществляют элективную фиксацию E света, депонирование ее в виде энергии электронного возбуждения, фотохимическое преобразование E возбужденного состояния в химическую энергию первичных фотовосстановленных и фотоокисленных соединений [6]. В процессе фотосинтеза каротиноиды выполняют ряд важнейших функций – антенную (дополнительные пигменты в процессе поглощения солнечной энергии), защитную (тушители триплетного хлорофилла и синглетного кислорода) и фотопротекторную (предохраняют реакционный центр от мощных потоков энергии при высоких интенсивностях света и стабилизируют липидную фазу тилакоидных мембран, защищая ее от переокисления) [5, 11]. Количественное содержание хлорофиллов и каротиноидов в листьях зависит от жизнедеятельности организма, его генетической природы. Следовательно, оно может быть использовано как физиологический показатель, характеризующий онтогенетические, возрастные и генетические особенности растений. Количество пигментов отражает и реакцию растительного организма на условия произрастания. Поэтому при физиологических исследованиях часто возникает необходимость проследить за динамикой содержания хлорофилла и каротиноидов в листьях [8].
Аскорбиновая кислота (АК) – уникальное полифункциональное соединение. Обладая способностью обратимо окисляться и восстанавливаться, она принимает участие в важнейших энергетических процессах растительной клетки – фотосинтезе и дыхании; является признанным антиоксидантом. Несомненно ее участие в процессах роста, цветения, вегетативной и репродуктивной дифференциации, в водном обмене, регуляции ферментативной активности, стимуляции реакций метаболизма, связанных с обменом нуклеиновых кислот и синтезом белка, в защитных реакциях растений [12]. В химическом отношении АК является лакто- ном 2,3-диэнол-l-гулоновой кислоты с эмпирической формулой H8C6O6 , M = 176, обладает сильными восстановительными свойствами. Окисление ее идет до дегидроаскорбиновой кислоты, лактоновое кольцо которой легко гидролизуется с образованием кислоты с открытой цепью – дигетогулоновой. В растительном организме легко осуществляется переход аскорбиновой кислоты в дегидроаскорбиновую и обратная реакция, поскольку в молекуле имеются две энольные группы [13].
Водные экстракты растений, содержащие АК, способны восстанавливать раствор синей краски 2,6-дихлорфенолиндофенола в бесцветное соединение (реакция Тильманса). Эта реакция и составляет основу большинства методов определения аскорбинового ассимилянта. В листовых пластинах березы аккумулируется до 2,8 % аскорбиновой кислоты [2], при перерасчете на сухой вес – 0,69–0,79 % витамина C.
Многие органические кислоты (ОК) являются исходными соединениями для биосинтеза аминокислот, сахаров, жиров, витаминов и некоторых других биологически активных соединений. Они могут использоваться в качестве энергетического материала при фотоавтотрофном дыхании растений. Количество кислот в растении одного вида непостоянно и зависит от возраста, условий местопроизрастания [1]. ОК в водных растворах диссоциируют на водородный ион и отрицательно заряженный остаток кислоты. Биологическое значение концентрации водородных ионов в растительных тканях очень велико. Многие ферментативные процессы в растениях регулируются реакцией среды, которая создается в результате поступления и образования различных веществ (минеральных солей, органических кислот). Скорость различных биохимических процессов управляется активной кислотностью среды. Именно поэтому точный метод определения концентрации водородных ионов в водных экстракциях из растительного материала хорошо подходит для изучения биохимических изменений, происходящих в вегетативных органах растений вследствие воздействия на них различных по происхождению биоэкологических факторов. По характеру и быстроте сдвигов в концентрациях водородных ионов можно судить об интенсивности окислительно-восстановительных и иных процессов в опытных образцах.
Цель и задачи исследований. В данной работе нам предстоит изучить характер влияния разнообразных стресс-факторов (фитопатологического, антропотехногенного и др.) на динамику некоторых физиолого-биохимических показателей жизнеспособности дерева. Так, исследованию будут подлежать особенности воздействия ряда биоэкологических факторов на содержание хлорофиллов типа a , b , их суммы, каротиноидов, аскорбиновой кислоты, соотношения пигментов в листовых пластинах, а также реакцию pH водных извлечений из листьев, древесины ветвей и стволов березы.
Объекты и методы исследований. Пигментный состав листьев березы определялся в соответствии с методическим решением из Практикума по физиологии растений [8]. Концентрации хлорофиллов a, b, a+b, каротиноидов рассчитывались по Реббелену с применением приемов волновой оптики. Также осуществлялся расчет эмпирических соотношений пигментов Chl a/Chl b и (Chl a + b )/car.
Содержание аскорбиновой кислоты в листовом аппарате устанавливалось по методу И.К. Мурри [7]. В основу потенциометрического анализа водных вытяжек была положена методика по определению общей кислотности органических кислот растений [1].
Измерение pH водных извлечений из листьев, чаги, древесины стволов и ветвей проводилось на pH-метре Checker-1 (Hanna, Италия) типа pHep+ с метрическим диапазоном от 0,00 до 14,00 pH и разрешением 0,01 pH (точность , +0,2 pH). PH-анализатор юстировался и тарировался по стандартным буферным растворам. Каждая проба замерялась по три раза, и определялось среднее показание прибора.
Листовые пластины для биохимического анализа отбирались из верхней третьей части кроны в сухую погоду в утренние часы, после высыхания росы. Сбор материала производился после остановки интенсивного роста листьев, начиная с июля , в Барышском лесничестве Ульяновской области. Каждая выборка содержала по 7 экземпляров деревьев.
Выборочные совокупности формировались из деревьев березы с разнообразных биотопов на территории лесничества, в которых факторы среды по-разному оказывали влияние на рассматриваемую породу. При этом концентрации основных фотосинтетических пигментов в листовых пластинках и величина pH водных гомогенатов из листьев определялись у березы повислой (Betula pendula Roth.), произрастающей в центральной части города Барыша с выраженным преобладанием аэрополлютантов в составе антропо-техногенных эмиссий токсикантов (но все же у здоровых экземпляров деревьев), на границе с многолетней невозобновившейся вырубкой, в полезащитной лесополосе и насаждении, где присутствовали деревья следующих категорий: инфицированные базидиомицетом Inonotus obliquus (Pers.) Pil. с разной степенью пораже- ния (оценивалась по меристическим параметрам чаги f. sterilis (Vanin) Nikol. и была сложена двумя стадиями: 1 – до достижения экзогенными бесплодными наростами средних размеров по литературным данным [10, 15] и 2 – свыше средних размерных характеристик), подрост березы бородавчатой, береза пушистая (Betula pubescens Ehrh.), а также здоровые экземпляры деревьев березы повислой, впоследствии служившие в качестве условного контроля при множественных сравнительных оценках совокупностей. Установление pH-реакции водных извлечений из прочих вегетативных органов и содержания аскорбиновой кислоты в листовых пластинах осуществлялось в подобном порядке выборок, однако в этом случае исключение составляло отсутствие дифференциации больных деревьев по стадиям развития чаги на стволе деревьев.
Так как в настоящем эксперименте число результатов измерений n < 15, то их принадлежность к нормальному распределению не проверялась [9]. Статистическая же обработка данных осуществлялась методом попарных сравнений, который допускает проведение математического анализа сравниваемых выборок по параметрам нормального распределения либо распределения Стьюдента в физиологических и биохимических исследованиях благодаря возможности сопоставления пар измерений [13].
Поскольку в биологических исследованиях зачастую считается достаточным 5%-й уровень значимости (вероятность ошибочной оценки P=0,05) [4], то здесь он в основном и подразумевался.
Средняя квадратичная ошибка различий, наблюдаемых между парными вариантами, вычислялась: m d = ^(( ^ d 2 /п ) - D 2)/( n - 1 ) , где d - различие между парными значениями сравниваемых величин; D – разница между средними величинами соотносимых совокупностей. Критерий достоверности рассчитывался по формуле: t = D/m d . Поправка Бонферрони учитывалась.
Результаты и их обсуждение. Эмпирические данные в разрезе рассматриваемых выборок по содержанию в листовых пластинах витамина C, реакции pH водных вытяжек из различных вегетативных органов березы занесены в таблицы 1 и 2 соответственно, по пигментообразовательной активности фотосинтетического аппарата (листьев) проиллюстрированы рисунками 1 и 2.
Фонд аскорбиновой кислоты в листьях березы, мг%
Таблица 1
|
Концентрация витамина C, мг% |
Больные деревья Betula pendula с насаждения |
Здоровые деревья |
|||||
|
Насаждение |
Прочие биотопы с участием Betula pendula |
||||||
|
Деревья с чагой 1 + 2 ст. |
Betula pendula |
Betula pubescens |
Подрост Betula pendula |
Betula pendula на границе с вырубкой |
Лесная полоса |
Центр г. Барыша |
|
|
X |
89,94 |
239,82 |
237,12 |
235,17 |
243,07 |
247,09 |
251,31 |
|
Sx |
5,7 |
3,8 |
7,3 |
3,9 |
5,7 |
5,3 |
4,3 |
|
t |
18,83 |
– |
0,33 |
0,73 |
0,47 |
1,10 |
1,72 |
Критическое значение t с поправкой Бонферрони (модификация критерия Стьюдента для множественных сравнений с контрольной группой) для анализа различий концентрации аскорбиновой кислоты в клетках мезофилла листовой пластинки составило 3,87 (0,0083, 6). В обобщающей трансформации оно было бы 5,02 (0,0024, 6), при простом парном сопоставлении – 2,45 (0,05; 6). Следовательно, достоверно относительно здоровой березы повислой с лесонасаждения по бюджету витамина C в листьях из всех обозначенных выборок отличается лишь опытная совокупность, представленная экземплярами деревьев со стерильными экзогенными наростами I. obliquus (t=18,83).
Таблица 2
|
Показатель |
Больные деревья Betula pendula с насаждения |
Здоровые деревья |
||||||
|
Насаждение |
Прочие биотопы с участием Betula pendula |
|||||||
|
Деревья с чагой 1 ст. |
Деревья с чагой 2 ст. |
Betula pendula |
Betula pubescens |
Подрост Betula pendula |
Betula pendula на границе с вырубкой |
Лесная полоса |
Центр г. Барыша |
|
|
Листья |
||||||||
|
pH |
5,12±0,17 |
5,92±0,28 |
5,05±0,01 |
5,12±0,01 |
4,88±0,02 |
4,99±0,08 |
4,92±0,01 |
4,90±0,12 |
|
t |
0,41 |
3,12 |
– |
4,89 |
7,10 |
0,74 |
9,17 |
1,25 |
|
Древесина ветвей |
||||||||
|
pH |
5,17±0,10 |
5,07±0,08 |
5,15±0,07 |
5,02±0,05 |
5,07±0,03 |
5,03±0,10 |
5,06±0,09 |
|
|
t |
0,78 |
– |
0,75 |
0,39 |
0,00 |
0,31 |
0,08 |
|
|
Древесина стволов |
||||||||
|
pH |
6,04±0,07 |
5,88±0,02 |
5,97±0,12 |
5,73±0,19 |
5,87±0,03 |
5,81±0,07 |
5,79±0,03 |
|
|
t |
2,20 |
– |
0,74 |
0,79 |
0,28 |
0,96 |
2,50 |
|
Величина pH водных извлечений из разных вегетативных органов березы
При анализе данных выборочных совокупностей на уровень pH общей кислотности водных экстракций из листьев, а также состав пигментной системы мезофилла из-за дифференциации больных деревьев с чагой по 2 условным стадиям развития последней для них по сравнению с прежним случаем изменятся значения поправки Бонферрони. Так, с полной поправкой t кр станет равным 5,33 (0,0018, 6), частичной – 4,00 (0,0071, 6), вовсе без нее – соответственно 2,45 (0,05, 6). И именно с этих позиций окажется возможной последующая интерпретация представленных статистических событий.
Таким образом, величина отрицательного десятичного логарифма активности водородных ионов в водном гомогенизированном растворе (извлечение из древесины ствола) у березы, представляющей центральный городской биотоп, достоверно ниже, чем у деревьев B. pendula из лесонасаждения (5,79±0,03 против 5,88±0,02). Деревья с чагой, находящейся на 2 ст. развития, и Betula pubescens по величине pH водных экстракций из листовых пластин превосходят повислую березу с насаждения, а экземпляры деревьев Betula pendula , создающие лесную полосу, и подрост березы повислой по значению аналогичного показателя, наоборот, ей уступают.
По отмене H0-предположения достоверными оказались различия концентраций пигментов в листовой паренхиме с березой из лесонасаждения у следующих категорий деревьев (рис. 1). У подроста березы повислой (Cхл.a=2,55±0,05 мг/г сыр.массы, рис. 1), деревьев, формирующих полезащитную лесополосу (C хл.a=2,31±0,05 мг/г сыр.массы), концентрация хлорофилла a выше, а у березы с чагой на второй условной стадии онтогенеза (C =1,29±0,10 мг/г сыр.массы) и деревьев, произрастающих в центральной части хл.a г. Барыша, с преобладанием аэрополлютантов в составе загрязнителей (Cхл.a=1,67±0,05 мг/г сыр.массы) ниже, чем у B. pendula, образующей древостой (Cхл.a=2,00±0,04 мг/г сыр.массы). По концентрации хлорофилла типа b и общему содержанию хлорофиллов береза с насаждения (C хл.b =1,22±0,05 мг/г сыр.массы и Cхл.a+b =3,21±0,08 мг/г сыр.массы) превалирует над деревьями, располагающимися в центре города ( Cхл.b =0,69±0,03 мг/г сыр.массы, Cхл.a+b =2,35±0,07 мг/г сыр.массы), и березой, инвазированной I. obliquus, имеющей стерильные экзогенные наросты мицелия гриба на стволе 2-й онтогенетической ст. ( C хл.b =0,79±0,07 мг/г сыр.массы, Cхл.a+b =2,08±0,12 мг/г сыр.массы). При использовании элементарного t-критерия Стьюдента для соотнесения всего лишь двух групп деревьев (а именно с 1-й стадией I. obliquus (Pers.) Pil. f. sterilis (Vanin) Nikol. и из лесонасаждения) концентрации молекул хлорофилла a в их листьях окажутся статистически различными (C =1,67±0,08 мг/г сыр.массы против C =2,00±0,04 мг/г сыр.массы), причем среднее хл.a хл.a ниже у пораженной патогеном березы. Достоверными станут и расхождения между C хл.a (t=2,56), C хл.b (t=3,73) и Cхл.a+b (t=4,27) деревьев с наростами чаги на 1-й и 2-й стадиях при употреблении последнего метода математического анализа (при этом tкр =2,45). Необходимо отметить, что у предпоследней совокупности наибольшее из всех соотношение Cхл.a+b / Cкар (6,69), наименьшая пропорция C хл.a / C (1,33). Зна- хл.a + b кар хл.a хл.b чения рассматриваемых показателей с увеличением времени воздействия I. obliquus на березу (с 1-й по 2-ю стадию; за исключением C хл.a / C ) понижаются (рис. 2).
хл . a хл . b
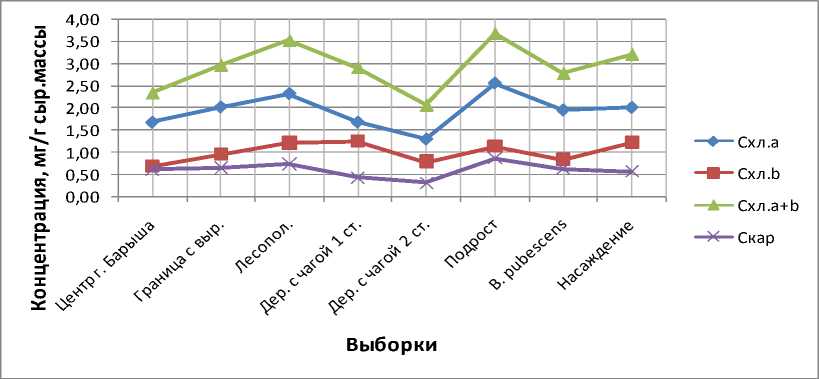
Рис. 1. Содержание хлорофиллов и каротиноидов в листьях березы
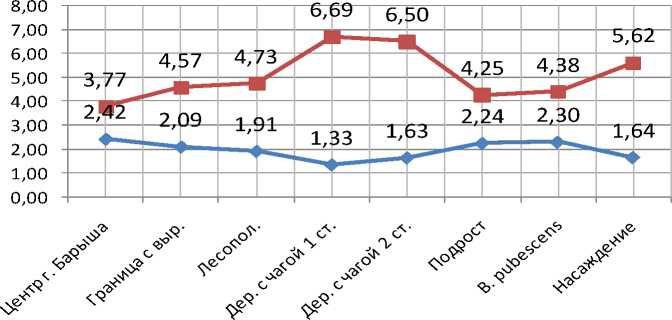
— ♦ — Cхл.a/Cхл.b
— ■ — Cхл.a+b/Cкар
Выборки
Рис. 2. Отношения концентраций хлорофилла a к b, а также суммы хлорофиллов (a+b) к содержанию каротиноидов в листьях деревьев всех экспериментальных совокупностей
Однако и неопровержение H 0 -гипотезы еще нельзя рассматривать как доказательство равенства между неизвестными параметрами совокупностей, из которых извлечены сравниваемые выборки [4].
Как следует из таблицы 1, C-витаминная активность подроста ниже аналогичной более высоких дере-вьев-доминантов, слагающих древостой. На подобное весьма часто указывается и в специальной литературе, когда отмечается, что концентрация АК больше бывает в мезофилле листьев верхних ярусов, чем нижних. По-видимому, это связано с различной интенсивностью фотосинтетического процесса на различной высоте насаждения. То есть, скорее всего, целесообразно рассматривать биосинтез, диссимиляцию аскорбиновой кислоты и ее дериватов с позиции предопределения их фотосинтезом.
Судя по рисунку 1, в листовых пластинах подроста, относительно все тех же самых господствующих деревьев березы повислой из лесонасаждения, больше бюджеты хлорофилла a , каротиноидов и общая концентрация хлорофиллов. Таким образом, прослеживается обратная корреляция между активностью пигмен-тообразования (хлорофилла типа a + каротиноидов) и индуцированием новообразования витамина C (однако хлорофилл b показывает положительный тренд). Прямая линейная зависимость скорости биосинтеза аскорбиновой кислоты от интенсивности фотосинтеза (например, допускающая рассматривать в качестве единого антистрессового фактора оба этих процесса) не обнаруживается и в случае сравнения данных показателей у березы с лесонасаждения и выборочной совокупности, представленной деревьями, входящими в состав урбоэкосистемы (г. Барыш). У деревьев, произрастающих в центре города, концентрации хлорофиллов a и b в листовой паренхиме березы ниже, а витамина C и каротиноидов выше, нежели у B. pendula , образующей древостой. Но ведь и в научной литературе описана нестрогая детерминация продуцирования АК фотосинтезом [12]. Так, например, в настоящее время сообщается не вызывающим сомнения тот факт, что одним из важнейших условий, определяющих биосинтез аскорбиновой кислоты, является свет. В зеленых растениях АК накапливается преимущественно на свету, поэтому ранее было оправдано связывать ее биосинтез с фотосинтезом. Однако исследование действия света различного спектрального состава на биосинтез АК показало, что спектры действия фотосинтеза и биосинтеза АК в отдельных областях не совпадают. В частности, показана высокая активность желто-зеленого света в процессе образования аскорбиновой кислоты. Отсутствует положительная корреляция в содержании фотосинтетических пигментов и способности растений накапливать АК. Все сказанное дает основание говорить об отсутствии прямой связи между фотосинтезом и биосинтезом АК, хотя полностью отрицать наличие контактов между этими процессами нельзя, так как углеводный субстрат для новообразования АК дает фотосинтез. Пул аскорбиновой кислоты в растениях определяется одновременно идущими процессами биосинтеза и использованием АК во многих процессах, в том числе и связанных с обоими энергодающими процессами – фотосинтезом и дыханием. Так, показано, что уровень АК на свету, с одной стороны, зависит от функционального состояния пластоцианина P 700 , с другой – от активности дыхательных ферментов – аскорбатоксидазы, полифенолоксидазы, цитохромоксида-зы и пероксидазы. Одним из факторов, определяющих светозависимое накопление АК у нормально пигментированных растений, является ингибирование светом большинства ферментов, ее окисляющих. Фонд АК в растениях на свету может пополняться не только за счет новообразования АК, но и путем фотовосстановления дегидроаскорбиновой кислоты в аскорбиновую в хлоропластах. Остается неясным, возможно ли восстановление дегидроаскорбиновой кислоты (ДАК) за счет восстановителя, образующегося в процессе окислительного фосфорилирования. Следовательно, уровень АК в растениях будет зависеть от направленности процессов в системе аскорбиновая кислота – дегидроаскорбиновая кислота. В связи с этим, характеризуя содержание АК в растениях и особенно метаболизм данного соединения, необходимо одновременно анализировать содержание не только аскорбиновой и дегидроаскорбиновой кислот, но и дикетогулоновой кислоты, образующейся при необратимой трансформации дегидроаскорбиновой кислоты в результате разрыва ее лактонового кольца (дикетогулоновая кислота растений практически не исследована). Таким образом, содержание АК в растениях определяется многими одновременно идущими процессами, и регуляция ее накопления требует согласованной их работы. Это имеет место не только при нормальном функционировании растений, но и в стрессовых условиях, которые обычно сопровождаются усилением биосинтеза и использования аскорбиновой кислоты [12]. Поэтому тенденция асинхронности полученных данных по содержанию витамина C с концентрациями основных фотосинтетических пигментов в листьях деревьев березы повислой, занимающих разное положение в древостое, формирующих различные биотопы и отличающихся по категориям состояния, с точки зрения биоэкологических особенностей их роста вполне оправдана.
Потенциометрия водных вытяжек из всех вегетативных органов березы показала превышение величины их pH у зараженных I. obliquus экземпляров деревьев над значением данного показателя здоровых. Причем, как следует из таблицы 2, с увеличением времени воздействия патологического агента на березу
(степени его развития на ней) уменьшается уровень кислотности водных извлечений из листьев. Вероятно, подобное последнему нельзя исключать и в иных растительных тканях. Означенная кислотная диспропорция определенно может свидетельствовать о характере действия механизмов ингибирования синтеза и перераспределения кислот в растительных клетках пораженной березы, отвечающих как за нормальное развитие ассимиляционного аппарата, так и за жизнедеятельность всего организма в целом. Однако в этом случае, безусловно, необходимо учитывать особенности химизма деструктивных ксилолитических процессов, происходящих в гниющих тканях и приводящих к распаду одних органических веществ и накоплению других, а также образованию совершенно новых соединений, которые впоследствии могут изменять реакцию среды. Все же для возможной флуктуации кислотности среды от нормы имеются свои придержки, поскольку большинство грибов имеет оптимум развития при слабокислой реакции среды (pH 5,0-6,0) [3]. Вышесказанное находит подтверждение в литературе [14], где указывается на то, что общим признаком болезней следует считать снижение количества органических веществ в больном растении по сравнению со здоровым, то есть снижение его биологической активности. Согласно рисункам 1, 2 и таблице 2, почти во всех случаях пигментообразовательная активность берез, так или иначе, прямо коррелирует с накоплением органических кислот в фотосинтетических и проводящих тканях. Исключение составляет асинхронное расположение в рассматриваемых рядах биотопа, представляющего центр города Барыша. Это лишь лишний раз подтверждает тесноту взаимосвязи многих процессов по ассимиляции и диссимиляции (как то: фотосинтез, образование мета-, амфиболитов, дыхание) указанных химических соединений.
Наблюдается также и то, что уровень содержания органических кислот в отдельных морфологических структурах дерева не инвариантен. Величина pH водных извлечений постепенно увеличивается от листьев к древесине ствола. Первое, по всей вероятности, связано с биологическими особенностями дерева, когда циркуляция и оборот большинства метаболитов не только интенсивнее происходят в листовых пластинах, нежели в других вегетативных органах растения, но и подчас фотосинтезирующий аппарат является единственным местом локализации превращений ряда ассимилянтов. Если величины pH водных экстракций из листьев (4,90±0,12) и древесины ветвей (5,06±0,09) березы повислой, произрастающей в центре города, находятся между значениями водородного показателя аналогичных извлечений подроста и деревьев B. pendula с лесонасаждения (табл. 2), то содержание аскорбиновой кислоты в листовой паренхиме березы из урбоэкосистемы заметно превосходит уровень витамина C как в мезофилле вторых, так и подроста (табл. 1). Следовательно, стимулирование либо, наоборот, подавление биосинтеза органических кислот, равно как и АК, можно рассматривать в качестве ответной реакции на многие поражения деревьев, произошедшие вследствие воздействия на них стрессоров абиотического и биотического порядков.
Связь биосинтеза аскорбиновой кислоты с реакциями анаболизма и катаболизма клетки, затрагивающими образование и распад некоторых органических кислот, детально описывается в монографии Г.Н. Чупахиной «Система аскорбиновой кислоты растений» [12]. В ней автор останавливается на анализе исследований, касающихся выявления специфичности использования растениями органических кислот как субстрата для образования АК. Утверждается, что наряду с углеводами в процессе биосинтеза АК могут использоваться соединения, содержащие более короткую углеродную цепочку, в частности некоторые органические кислоты, такие как щавелевая, янтарная, винная и α -кетоглутарозая. Причем использование их идет преимущественно на свету, а в случае с винной и α -кетоглутаровой кислотами – только на свету. Стимуляция накопления АК в присутствии экзогенной щавелевой и винной кислот объясняется исходя из того факта, что деградация АК в растениях идет с образованием данных кислот. А значит, при их избытке, когда возможно ингибирование процесса деструкции молекулы АК конечными продуктами реакции, снижаются ее потери. Стимуляцию синтеза АК экзогенными субстратами вообще, и органическими кислотами в частности, нельзя интерпретировать однозначно, как непосредственное использование этих соединений при новообразовании АК. Возможно опосредованное ускорение биосинтеза АК через стимуляцию других процессов, например цикла трикарбоновых кислот в случае с ОК – интермедиатами цикла.
По сравнению с B. pendula из насаждения у подроста в мезофилле меньше витамина C, однако ниже величина pH водных экстракций из листьев. Опять же это прежде всего говорит о разных путях биосинтеза различных кислот и условиях, требуемых для его осуществления, например наличие света. По всей видимости, здесь немаловажную роль играет и возраст дерева – в молодом возрасте активность проведения многих биохимических реакций в клетках значительно выше, чем в более зрелом.
Выводы
-
1. Из всех рассматриваемых факторов лишь фитопатологический достоверно оказывал воздействие на снижение содержания аскорбиновой кислоты в листьях Betula L. относительно здоровых деревьев. Он же приводил и к наименьшей концентрации витамина C в листовых пластинах в серии сравниваемых совокупностей; наибольшая была в листьях березы, испытывающей вредное воздействие со стороны выхлопов автотранспорта.
-
2. Уровень органической кислотности водных извлечений из вегетативных органов здоровой березы со всех биотопов превышал аналогичный показатель пораженных I. obliquus экземпляров деревьев. Причем с увеличением времени развития трутового гриба на стволе повышалась и величина pH водных экстракций из всех морфологических структур дерева. По абсолютному значению pH вытяжек из листьев Betula pu-bescens превосходила березу повислую из насаждения, а подрост и деревья, формирующие полезащитную лесную полосу, наоборот, ей достоверно уступали.
-
3. Содержание хлорофилла a в листовых пластинках было выше у подроста Betula pendula , березы, образующей полезащитную лесную полосу, относительно здоровых деревьев березы повислой из лесонасаждения и ниже по сравнению с ней же – у деревьев с чагой на второй условной стадии развития и экземпляров деревьев, произрастающих в центральной части г. Барыша, с преобладанием аэрополлютантов в составе ксенобиотиков.
-
4. Береза повислая из лесонасаждения по концентрации молекул хлорофилла типа b и C в ли-
- хл.a +
-
5. Почти во всех случаях пигментообразовательная активность берез, так или иначе, была прямо сопряжена с накоплением органических кислот в фотосинтетических и проводящих тканях, витамина C в листьях. Хотя динамики различных биохимических параметров и не обладали синхронизмом. Что, скорее всего, наблюдалось из-за взаимообусловленности механизмов биосинтеза ряда молекул, с одной стороны, а с другой – различия путей новообразования и распада органических соединений в клеточном матриксе и апо-пласте.
стовых пластинках значимо превосходила инфицированные I. obliquus экземпляры деревьев с чагой, находящейся на 2-й стадии развития, и березу с центральной части города Барыша.
Характер изменения рассмотренных нами физиолого-биохимических показателей вегетативных органов березы вследствие патогенеза, загрязнения воздуха ксенобиотиками и проч. позволяет впоследствии по нему оценивать стабильность развития, жизнеспособность деревьев, выявлять пораженные I. obliquus экземпляры питающего растения на ранних стадиях развития грибного инфекционного заболевания, в это время еще скрытого в силу специфики биологии возбудителя. Комплексная идентификация данных признаков, по-видимому, способна существенно повысить в целом общую информативность прогноза динамики продуктивности березовых насаждений, степени участия в ней отрицательных факторов среды, а следовательно, дать рекомендации по устранению таких воздействий либо нивелированию негативных последствий, антропогенной деятельности в том числе. Для снижения вероятности, рисков развития эпифитотий, причиной которых может служить трутовик скошенный, рекомендуется лесохозяйственному производству планировать березовые насаждения на территориях, отвечающих условиям испытания низких рекреационных нагрузок, а также крайне необходимо упорядочивать воздействие на лесные биогеоценозы последних, поскольку высокий уровень рекреационного воздействия вызывает существенные дестабилизирующие изменения экологического равновесия в лесных экосистемах, приводящие, в конечном итоге, к прогрессирующей деградации, распаду насаждений; изымать зараженные I. obliquus деревья в ходе проведения периодических санитарных рубок; избегать чрезмерного антропогенного воздействия на леса, и без того усугубляющего негативное влияние факторов окружающей среды на поддерживающую экологическую емкость и состояние лесных биоценозов и т. п.


