Возможность прогнозирования гематогенного метастазирования у больных немелкоклеточным раком легкого с учетом распространения опухоли по воздушным пространствам
Автор: Завьялова М.В., Дурова А.А., Завьялов А.В., Миллер С.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.24, 2025 года.
Бесплатный доступ
Введение. Распространение опухоли по воздушным пространствам (STAS) длительное время рассматривали как признак, связанный с высоким риском местного рецидива после сегментарной резекции легкого у больных немелкоклеточным раком легкого (НМРЛ). В настоящее время актуальным является исследование биологического значения STAS, в том числе его роли в гематогенном метастазировании НМРЛ. Цель исследования – изучение возможности прогнозирования гематогенного метастазирования у больных НМРЛ с учетом STAS. Материал и методы. Оценивался операционный материал от 88 больных НМРЛ T1–3N0–1M0, стадии IА–IIIA, проходивших лечение в отделении торакальной онкологии НИИ онкологии Томского НИМЦ в период с 2014 по 2019 г. Больные были прооперированы в объеме лобэктомии или пульмонэктомии с ипсилатеральной медиастинальной лимфодиссекцией. Из них 69 пациентам проводилась адъювантная химиотерапия по схеме карбоплатин + паклитаксел. Исследовались ткань первичного опухолевого узла, прилежащая ткань легкого и все удаленные лимфоузлы. Гистологическое и иммуногистохимическое исследование выполнялось по стандартной методике. В исследование включались только случаи с аденокарциномой и с плоскоклеточным раком. Срок наблюдения за больными с момента постановки диагноза составил 5 лет. Для построения математических моделей использовался метод логистической регрессии. Результаты. На основании оценки клинико-морфологических параметров разработана математическая модель для прогнозирования вероятности гематогенного метастазирования только у больных аденокарциномой легкого, включающая такие параметры, как критерии Т, N, степень дифференцировки опухоли, стелющийся тип структур, пролиферативная активность опухоли, STAS. Степень достоверности модели составила χ2=664,730; р<0,001; чувствительность – 99 %, специфичность – 88 %. Без учета STAS специфичность модели составляла всего 60 %. Для плоскоклеточного рака эффективную прогностическую модель построить не удалось. Проведенная адъювантная химиотерапия не влияла на полученные результаты. Заключение. Выполненное исследование продемонстрировало значительную роль учета STAS в прогнозировании риска гематогенного метастазирования у больных аденокарциномой легкого. Исследование роли STAS в гематогенном метастазировании перспективно для понимания механизмов данной формы опухолевой прогрессии.
Немелкоклеточный рак легкого, распространение опухоли по воздушным пространствам, гематогенные метастазы
Короткий адрес: https://sciup.org/140310572
IDR: 140310572 | УДК: 616.24-006.6-033.2-037 | DOI: 10.21294/1814-4861-2025-24-3-27-37
Текст научной статьи Возможность прогнозирования гематогенного метастазирования у больных немелкоклеточным раком легкого с учетом распространения опухоли по воздушным пространствам
Распространение опухоли по воздушным пространствам (spread through air spaces, STAS) за пределами края основного опухолевого узла впервые описано в 2015 г. K. Kadota et al. [1]. Позже было показано, что STAS является независимым прогностическим признаком снижения безрецидивной выживаемости при аденокарциноме и плоскоклеточном раке легкого [2]. Причем STAS чаще обнаруживали у пациентов пожилого возраста, мужского пола, с анамнезом курения, в случаях с преобладанием микропапиллярных и солидных структур в паренхиматозном компоненте аденокарциномы, с умеренной или низкой степенью дифференцировки новообразования, с лимфоваскулярной инвазией и инвазией в плевру, а также с более продвинутыми значениями T, N и стадии заболевания [3–7].
Последующие исследования подтвердили связь распространения опухоли по воздушным пространствам с клинико-патологическими параме- трами при немелкоклеточном раке легкого (НМРЛ). Продемонстрирована связь распространения опухоли по воздушным пространствам с локализацией новообразования в правой нижней доле, преимущественно микропапиллярным паттерном аденокарциномы, наличием лимфогенного метастазирования, соответствующего pN2. Феномен STAS предложили рассматривать в качестве неблагоприятного прогностического критерия НМРЛ и рекомендовали указывать его в гистологическом заключении при исследовании операционного материала [3, 6].
T.I. Akcam et al. показано, что увеличение частоты локорегионарных рецидивов и снижение уровня безрецидивной выживаемости связаны с наличием STAS, в то время как отдаленные метастазы чаще выявляются при наличии сосудистой и лимфоваскулярной инвазии. Следует отметить, что подобные результаты получены как при аденокарциноме, так и при плоскоклеточном раке легкого [8]. A. Hashinokuchi et al. продемонстри- ровали связь распространения опухоли по воздушным пространствам с более коротким сроком общей и безрецидивной выживаемости [9]. Таким образом, на данный момент до конца не изучен вопрос о роли STAS в возникновении гематогенного метастазирования рака легкого. Настоящее исследование направлено на изучение этого вопроса и на выяснение возможности использования информации о наличии STAS в прогнозировании гематогенного метастазирования при НМРЛ.
Цель исследования – изучение возможности прогнозирования гематогенного метастазирования у больных немелкоклеточным раком легкого с учетом распространения опухоли по воздушным пространствам.
Материал и методы
Исследовался операционный материал от 88 больных немелкоклеточным раком легкого стадии IA–IIIA (Т1–3N0–1M0), проходивших лечение в отделении торакальной онкологии НИИ онкологии Томского НИМЦ в период с 2014 по 2019 г. В исследование включали только случаи с центральным раком легкого, представленным инвазивной немуцинозной аденокарциномой или плоскоклеточным раком. Операция выполнялась в объеме пульмонэктомии или лобэктомии с ипсилатеральной медиастинальной лимфодиссекцией. После операции 69 больным НМРЛ IВ–IIIA стадии проводилась адъювантная химиотерапия по схеме карбоплатин + паклитаксел.
Оценивались операционный материал с изучением первичного опухолевого узла с прилежащей тканью легкого и все удаленные в соответствии с выполненным объемом операции лимфатические узлы. Материал фиксировался в 10–12 % растворе нейтрального формалина. Проводка материала осуществлялась с помощью автомата для гистологической проводки (Leica, Германия). Методом полного сканирования стекол (WSI) оцифровывали гистологические препараты. Использовалась автоматизированная система для сканирования микропрепаратов Aperio AT2 (Leica Biosystems, Германия). Для изучения оцифрованных срезов применялось программное обеспечение Aperio ImageScope 12.4.6.
Иммуногистохимическое исследование проводилось по стандартной методике с использованием иммуногистостейнера Bond-maX (Leica, Германия), с использованием антител к TTF (клон SPT24, Leica) и к р40 (клон ZR8, Cell Marque) для уточнения гистотипа, к Ki67 (клон SP6, Cell Marque) – для оценки пролиферативной активности опухоли, к CD3 (Polyclonal, Dako), CD4 (клон 4В12, Dako), CD8 (клон С8/144B, Dako), CD20 (клон L26, Dako), CD68 (клон 514Н12, Leica) – для изучения воспалительной инфильтрации опухоли, к PD-L1 (клон 22C3, DAKO) – для оценки PD-L1 статуса опухоли. Оценка экспрессии осуществлялась в оцифрованных методом WSI срезах с применением автоматизированной системы Pannoramic MIDI с программным обеспечением Slide Viver V2.8. и использованием многомодульной платформы Quant Center (3D HISTECH, Венгрия).
В паренхиматозном компоненте аденокарциномы выделяли шесть типов структур паренхиматозного компонента: стелющийся; ацинарный; папиллярный; микропапиллярный; солидный; одиночные опухолевые клетки. В паренхиматозном компоненте плоскоклеточной карциномы выделяли пять типов структур: ороговевающий; шиповатый; базалоидный; полиморфный; одиночные опухолевые клетки. Определялись наличие и процент разных типов структур в паренхиматозном компоненте новообразования как в случаях с аденокарциномой, так и в случаях с плоскоклеточной карциномой.
Оценивали степень дифференцировки опухоли: Grade 1 – высокая; Grade 2 – умеренная; Grade 3 – низкая. В случаях с аденокарциномой к Grade 1 относили опухоли со стелюшимся паттерном, к Grade 2 – с ацинарным и папиллярным паттерном, к Grade 3 – с микропапиллярным и солидным паттерном. В случаях с плоскоклеточной карциномой к Grade 1 относили опухоли с ороговением, к Grade 2 – опухоли, состоящие из полей, тяжей и ячеек, построенных атипичными клетками шиповатого типа без ороговения, к Grade 3 – опухоли, состоящие из полей, тяжей и ячеек, построенных атипичными клетками базалоидного или полиморфного типа без ороговения.
Выраженность стромы опухоли определялась по трехбалльной системе: 1 балл – слабо выражена, менее 30 % от ткани опухоли; 2 балла – умеренно выражена, составляет 30–70 % от ткани опухоли; 3 балла – выражена, составляет более 70 % ткани опухоли.
В ткани легкого, прилежащей к основному опухолевому узлу, определяли наличие фрагментов опухоли и отдельных опухолевых клеток. В случаях с их обнаружением констатировали наличие распространения опухоли по воздушным пространствам (рис. 1, 2).
Подсчитывалась доля опухолевых клеток с позитивной ядерной экспрессией Ki67 в опухолевой ткани. В строме первичного опухолевого узла определяли количество клеток воспалительного инфильтрата с позитивной экспрессией CD3, CD4, CD8, CD20, CD68 при ×400 в 10 полях зрения. Подсчитывали количество клеток воспалительного инфильтрата с позитивной экспрессией CD3, CD4, CD8, CD20, CD68, располагающихся между клетками паренхиматозных структур на 1000 опухолевых клеток.
Оценка экспрессии выполнялась при наличии в исследуемом срезе 100 и более опухолевых клеток путем выявления полного или частичного окрашивания PD-L1 на мембране опухолевых клеток.
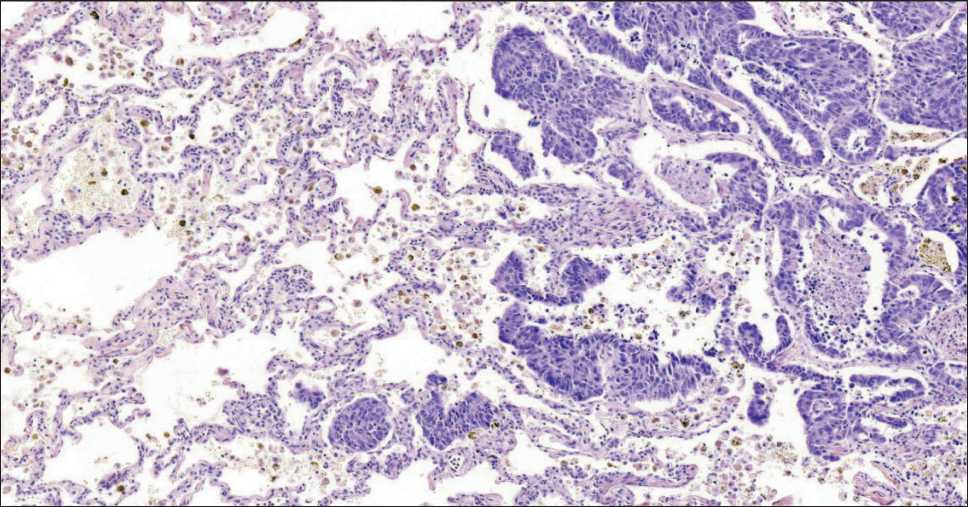
Рис. 1. Микрофото. Распространение опухоли по воздушным пространствам при аденокарциноме легкого. Окраска гематоксилином и эозином, ×100. Примечание: рисунок выполнен авторами
Fig. 1. Microphoto. Tumor spread through air spaces in lung adenocarcinoma. Hematoxylin and eosin staining, ×100.
Note: created by the authors
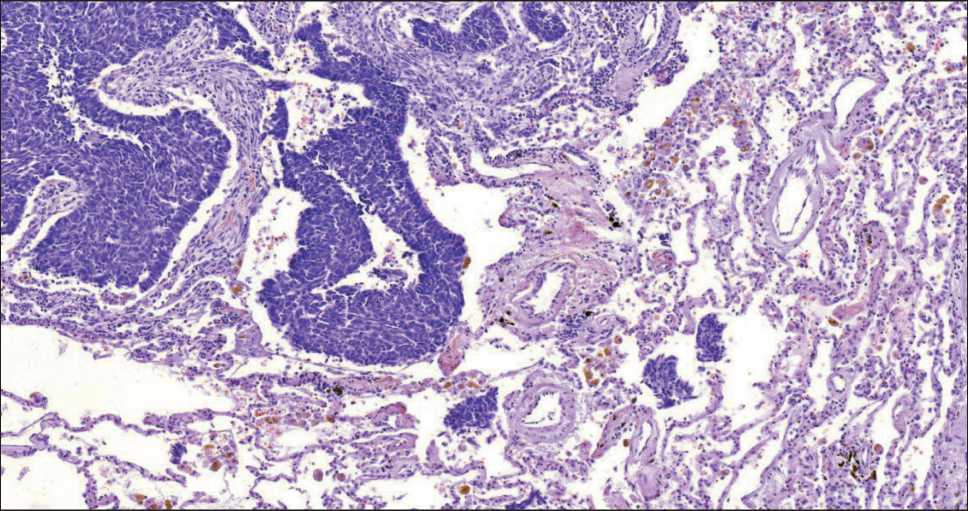
Рис. 2. Микрофото. Распространение опухоли по воздушным пространствам при плоскоклеточной карциноме легкого. Окраска гематоксилином и эозином, ×100. Примечание: рисунок выполнен авторами
Fig. 2. Microphoto. Tumor spread to air spaces in squamous cell carcinoma of the lung. Hematoxylin and eosin stain, ×100.
Note: created by the authors
Расчет выполнялся по формуле: Tumour Proportion Score (TPS) = % живых PD-L1(+) опухолевых клеток с полным или частичным окрашиванием мембраны любой интенсивности. При TPS<1 % экспрессию считали негативной; при TPS 1–49 % – слабопозитивной; при TPS≥50 % – высокой экспрессией PD-L1. В качестве контроля использовалась ткань миндалины. Позитивным контролем считали выявление сильно позитивной реакции в эпителии крипт, слабой или умеренно позитивной реакции в макрофагах герминативных центров и негативной реакции в эндотелии, фибробластах и поверхностном эпителии.
Срок наблюдения за больными с момента постановки диагноза составил 5 лет. Анализировались истории болезни и амбулаторные карты больных.
Наличие на момент обращения или возникновения в процессе динамического наблюдения отдаленных метастазов оценивалось УЗИ, СКТ, МРТ, ПЭТ.
В зависимости от гистотипа было сформировано 2 группы больных: с аденокарциномой (n=39) и с плоскоклеточным раком (n=49). Частота встречаемости распространения опухоли по воздушным пространствам у больных с аденокарциномой и с плоскоклеточным раком не различалась (33 и 37 %; р=0,740) (табл. 1).
Статистическая обработка результатов проводилась с применением пакета программ STATISTICA 10.0. Критерий χ2 использовался для сравнения частоты выявления признаков. Критерий Шапиро– Вилка применялся для проверки нормальности распределения. При ненормальном распреде-
Òàблицà 1/Table 1
Êлиниêî-мîðфîлîгичåñêàя õàðàêтåðиñтиêà бîльныõ ÍМÐЛClinical and morphological characteristics of patients with NSCLC лении оценка достоверности различий медиан количественных признаков для сравнения двух независимых групп осуществлялась с помощью непараметрического критерия Манна–Уитни, сравнение нескольких независимых групп выполнялось с помощью теста Краскела–Уоллиса. Для построения математических моделей использовался метод логистической регрессии. Значимыми считали различия при р<0,05.
Результаты
Изучение гематогенного метастазирования в зависимости от клинико-морфологических параметров в группе больных с аденокарциномой легкого показало, что при наличии гематогенных метастазов реже обнаруживается стелющийся тип структур в паренхиматозном компоненте первичного опухолевого узла. Другие параметры значимо не различались (табл. 2).
|
Параметры/Parameters |
Аденокарцинома/Adenocarcinoma (n=39) |
Плоскоклеточный рак/ Squamous cell carcinoma (n=49) |
р |
|
Возраст/Age |
60,0 [56,0; 64,0] |
60,0 [53,0; 65,0] |
0,821 |
|
Пол/Gender |
|||
|
Мужчины/Men |
28 (72 %) |
46 (94 %) |
0,005 |
|
Женщины/Women |
11 (28 %) |
3 (6 %) |
|
|
Критерий T/T criterion |
|||
|
Т1 |
20 (51 %) |
8 (16 %) |
|
|
Т2 |
10 (26 %) |
24 (49 %) |
0,002 |
|
Т3 |
9 (23 %) |
17 (35 %) |
|
|
Критерий N/N criterion |
|||
|
N0 |
22 (56 %) |
27 (55 %) |
0,902 |
|
N1 |
17 (44 %) |
22 (45 %) |
|
|
Стадия/Stage |
|||
|
IA (T1cN0M0) |
13 (33 %) |
6 (13 %) |
|
|
IB (T2aN0M0) |
5 (13 %) |
9 (18 %) |
0,093 |
|
IIB (T1cN1M0, T2aN1M0, 3N0M0) |
16 (41 %) |
29 (59 %) |
|
|
IIIA (T3N1M0) |
5 (13 %) |
5/49 ( %) |
|
|
Операция/Surgery |
|||
|
Лобэктомия/Lobectomy |
38 (97 %) |
47 (96 %) |
0,697 |
|
Пульмонэктомия/Pulmonectomy |
1 (3 %) |
2 (4 %) |
|
|
Grade |
|||
|
Grade 1 |
11 (28 %) |
2 (4 %) |
|
|
Grade 2 |
17 (44 %) |
33 (67 %) |
0,005 |
|
Grade 3 |
11(28 %) |
14 (29 %) |
|
|
STAS |
|||
|
Нет/No |
26 (67 %) |
31 (63 %) |
0,740 |
|
Есть/Yes |
13 (33 %) |
18 (37 %) |
|
|
PD-L1 |
|||
|
TPS<1 % |
27 (69 %) |
30 (61 %) |
|
|
TPS 1–49 % |
5 (13 %) |
10 (21 %) |
0,622 |
|
TPS≥50 % |
7 (18 %) |
9 (18 %) |
|
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
|||
|
Нет/No |
13 (33 %) |
6 (12 %) |
0,017 |
|
Есть/Yes |
26 (67 %) |
43 (88 %) |
|
|
Рецидивы/Recurrence |
|||
|
Нет/No |
36 (92 %) |
47 (96 %) |
0,467 |
|
Есть/Yes |
3 (8 %) |
2 (4 %) |
|
|
Гематогенные метастазы/Hematogenous metastases |
|||
|
Нет/No |
34 (87 %) |
41 (84 %) |
0,645 |
|
Есть/Yes |
5 (13 %) |
8 (16 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
Òàблицà 2/Table 2
Êлиниêî-мîðфîлîгичåñêиå пàðàмåтðы в ñлóчàяõ ñ îтñóтñтвиåм или нàличиåм гåмàтîгåнныõ мåтàñтàзîв ó бîльныõ àдåнîêàðцинîмîé лåгêîгî
Clinical and morphological parameters in lung adenocarcinoma patients with or without hematogenous metastases
|
Параметры/Parameters |
Гематогенные метастазы/Hematogenous metastases |
р |
|
|
Нет/No (n=34) |
Есть/Yes (n=5) |
||
|
Возраст/Age |
59,0 [55,0; 64,0] |
63,0 [61,0; 63,0] |
0,166 |
|
Пол/Gender |
|||
|
Мужчины/Men |
24 (71 %) |
4 (80 %) |
0,662 |
|
Женщины/Women |
10 (29 %) |
1 (20 %) |
|
|
Критерий T/T criterion |
|||
|
Т1 |
18 (54 %) |
2 (40 %) |
|
|
Т2 |
8 (23 %) |
2 (40 %) |
0,731 |
|
Т3 |
8 (23 %) |
1 (20 %) |
|
|
Критерий N/N criterion |
|||
|
N0 |
20/34 (59 %) |
2/5 (40 %) |
0,428 |
|
N1 |
14/34 (41 %) |
3/5 (60 %) |
|
|
Стадия/Stage |
|||
|
IA (T1cN0M0) |
11 (32 %) |
2 (40 %) |
|
|
IB (T2aN0M0) |
5 (15 %) |
0 (0 %) |
0,791 |
|
IIB (T1cN1M0, T2aN1M0, T3N0M0) |
14 (41 %) |
2 (40 %) |
|
|
IIIA (T3N1M0) |
4 (12 %) |
1 (20 %) |
|
|
Операция/Surgery |
|||
|
Лобэктомия/Lobectomy |
34 (100 %) |
4 (80 %) |
0,008 |
|
Пульмонэктомия/Pulmonectomy |
0 (0 %) |
1 (20 %) |
|
|
Стелющийся тип структур в опухоли/Lepidic type of structures in the tumor |
|||
|
Нет/No |
10 (29 %) |
4 (80 %) |
0,028 |
|
Есть/Yes |
24 (71 %) |
1 (20 %) |
|
|
Ацинарный тип структур в опухоли/Acinar type of structures in the tumor |
|||
|
Нет/No |
2/34 (6 %) |
0/5 (0 %) |
0,693 |
|
Есть/Yes |
32/34 (94 %) |
5/5 (100 %) |
|
|
Папиллярный тип структур в опухоли/Papillary type of structures in the tumor |
|||
|
Нет/No |
25 (74 %) |
4 (80 %) |
0,731 |
|
Есть/Yes |
9 (26 %) |
1 (20 %) |
|
|
Микропапиллярный тип структур в опухоли/Micropapillary type of structures in the tumor |
|||
|
Нет/No |
25 (74 %) |
5 (100 %) |
0,181 |
|
Есть/Yes |
9 (26 %) |
0 (0 %) |
|
|
Солидный тип структур в опухоли/Solid type of structures in the tumor |
|||
|
Нет/No |
15 (44 %) |
2 (40 %) |
0,862 |
|
Есть/Yes |
9 (26 %) |
3 (60 %) |
|
|
Отдельные опухолевые клетки/Discrete tumor cells |
|||
|
Нет/No |
20 (59 %) |
3 (60 %) |
0,960 |
|
Есть/Yes |
14 (41 %) |
2 (40 %) |
|
|
Процент типа структур |
в опухоли/Percentage of structure type |
in tumor, Ме [Q1; Q3] |
|
|
Стелющийся/Lepidic |
30,0 [20,0; 40,0] |
10,0 [10,0; 20,0] |
0,179 |
|
Ацинарный/Acinar |
50,0 [10,0; 87,5] |
80,0 [30,0; 88,0] |
0,641 |
|
Папиллярный/Papillary |
20,0 [10,0; 40,0] |
40,0 [40,0; 40,0] |
1,000 |
|
Микропапиллярный/Micropapillary |
10,0 [5,0; 20,0] |
- |
- |
|
Солидный/Solid |
70,0 [20,0; 98,0] |
30,0 [1,0; 68,0] |
0,251 |
|
Отдельные опухолевые клетки/ Discrete tumor cells |
2,5 [2,0; 10,0] |
1,5 [1,0; 2,0] |
0,266 |
|
Grade |
|||
|
Grade 1 |
10 (29 %) |
1 (20 %) |
|
|
Grade 2 |
14 (42 %) |
3 (60 %) |
0,730 |
|
Grade 3 |
10 (29 %) |
1 (20 %) |
|
Îêîнчàниå тàблицы 2/End of Table 2
Выраженность стромы опухоли/Tumor stroma
|
<30 % 30–70 % >70 % |
17 (50 %) 15 (44 %) 2 (6 %) |
4 (80 %) 1 (20 %) 0 (0 %) |
0,440 |
|
STAS |
|||
|
Нет/No |
22 (65 %) |
4 (80 %) |
0,498 |
|
Есть/Yes |
12 (35 %) |
1 (20 %) |
|
|
PD-L1 |
|||
|
TPS<1 % |
23 (68 %) |
4 (80 %) |
|
|
TPS 1-49 % |
5 (15 %) |
0 (0 %) |
0,655 |
|
TPS≥50 % |
6 (17 %) |
1 (20 %) |
|
|
%Ki67, Ме [Q1; |
Q3] 28,3 [12,4; 54,5] |
26,7 [10,8; 74,8] |
0,721 |
|
Количество клеток воспалительного инфильтрата |
в строме опухоли/ |
||
|
Number of inflammatory infiltrate cells in the tumor stroma, Ме [Q1; Q3] |
|||
|
CD3+ |
181,5 [103,0; 321,0] |
321,0 [187,0; 457,0] |
0,266 |
|
CD4+ |
29,0 [12,0; 105,0] |
15,0 [0,0; 29,0] |
0,449 |
|
CD8+ |
106,5 [67,0; 147,0] |
147,0 [116,0; 201,0] |
0,345 |
|
CD20+ |
54,0 [22,0; 171,0] |
77,0 [28,0; 209,0] |
0,721 |
|
CD68+ |
88,0 [11,0; 193,0] |
3,3 [3,3; 110,0] |
0,366 |
|
Количество клеток воспалительного инфильтрата в |
паренхиме опухоли/ |
||
|
Number of inflammatory infiltrate cells in the tumor parenchyma, Ме [Q1; Q3] |
|||
|
CD3+ |
12,0 [9,0; 51,0] |
12,0 [6,0; 17,0] |
0,785 |
|
CD4+ |
0,0 [0,0; 0,0] |
0,0 [0,0; 0,0] |
0,689 |
|
CD8+ |
0,0 [0,0; 9,0] |
4,0 [2,0; 9,0] |
0,449 |
|
CD20+ |
0,0 [0,0; 0,0] |
0,0 [0,0; 0,0] |
0,614 |
|
CD68+ |
0,0 [0,0; 6,0] |
0,0 [0,0; 0,0] |
0,629 |
|
Адъювантная химиотерапия/Adjuvant chemotherapy |
|||
|
Нет/No |
11 (32 %) |
2 (40 %) |
0,735 |
|
Есть/Yes |
23 (68 %) |
3 (60 %) |
|
|
Рецидивы/Recurrence |
|||
|
Нет/No |
32 (94 %) |
4 (80 %) |
0,269 |
|
Есть/Yes |
2 (6 %) |
1 (20 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
У больных с плоскоклеточным раком легкого с гематогенными метастазами определялось большее количество CD3+ лимфоцитов в воспалительном инфильтрате как стромы, так и паренхимы первичного опухолевого узла. Другие параметры значимо не различались (табл. 3).
По результатам исследования выполнялось построение математических моделей для прогнозирования гематогенного метастазирования с использованием таких клинико-морфологических параметров, как возраст, пол пациентов, значение критерия Т, значение критерия N, стадия заболевания, степень дифференцировки первичной опухоли, наличие и процент в случаях с аденокарциномой в паренхиматозном компоненте первичного опухолевого узла стелющегося, ацинарного, папиллярного, микропапиллярного, солидного типа структур, одиночных опухолевых клеток, наличие и процент в случаях с плоскоклеточным раком в паренхиматозном компоненте первичного опухолевого узла ороговевающего, шиповатого, базалоидного, полиморфного типа структур, оди-
ночных опухолевых клеток, наличие и вид распространения опухоли по воздушным пространствам, количество CD3+,CD4+,CD8+,CD20+ лимфоцитов, CD68+ макрофагов воспалительного инфильтрата стромы и паренхимы первичного опухолевого узла, коэффициент CD4+/CD8+ лимфоцитов воспалительного инфильтрата стромы и паренхимы первичного опухолевого узла, процент экспрессии Ki67 в ткани первичной опухоли, экспрессия PD-L1 в паренхиме первичной опухоли, наличие адъювантной химиотерапии.
В результате пошагового анализа лишь для группы больных с аденокарциномой удалось разработать математическую модель для прогнозирования вероятности гематогенного метастазирования. В математическую модель вошли такие показатели, как наличие распространения опухоли по воздушным пространствам, критерий T, критерий N, наличие стелющегося типа структур в паренхиматозном компоненте опухоли, степень дифференцировки первичного опухолевого узла. При расчете модели использовался количественный признак – процент
Òàблицà 3/Table 3
Êлиниêî-мîðфîлîгичåñêиå пàðàмåтðы в ñлóчàяõ ñ îтñóтñтвиåм или нàличиåм гåмàтîгåнныõ мåтàñтàзîв ó бîльныõ плîñêîêлåтîчным ðàêîм лåгêîгî
Clinical and morphological parameters in squamous cell lung cancer patients with or without hematogenous metastases
|
Параметры/Parameters |
Гематогенные метастазы/Hem Нет/No (n=41) |
atogenous metastases Есть/Yes (n=8) |
р |
|
Возраст/Age |
59,0 [53,0; 65,0] |
61,0 [55,5; 63,5] |
0,903 |
|
Пол/Gender |
|||
|
Мужчины/Men |
38 (93 %) |
8 (100 %) |
0,429 |
|
Женщины/Women |
3 (7 %) |
0 (0 %) |
|
|
Критерий T/T criterion |
|||
|
Т1 |
5 (12 %) |
3 (38 %) |
|
|
Т2 |
22 (54 %) |
2 (24 %) |
0,152 |
|
Т3 |
14 (34 %) |
3 (38 %) |
|
|
Критерий N/N criterion |
|||
|
N0 |
21 (51 %) |
6 (75 %) |
0,216 |
|
N1 |
20 (49 %) |
2 (25 %) |
|
|
Стадия/Stage |
|||
|
IA (T1cN0M0) |
4 (10 %) |
2 (25 %) |
|
|
IB (T2aN0M0) |
8 (20 %) |
1 (13 %) |
|
|
IIB (T1cN1M0, T2aN1M0, T3N0M0) |
24 (58 %) |
5 (62 %) |
0,486 |
|
IIIA (T3N1M0) |
5 (12 %) |
0 (0 %) |
|
|
Операция/Surgery |
|||
|
Лобэктомия/Lobectomy |
39 (95 %) |
8 (100 %) |
0,524 |
|
Пульмонэктомия/Pulmonectomy |
2 (5 %) |
0 (0 %) |
|
|
Ороговевающий тип структур в опухоли/Keratinizing type of structures in the tumor |
|||
|
Нет/No |
35 (85 %) |
5 (62 %) |
0,360 |
|
Есть/Yes |
6 (15 %) |
2 (38 %) |
|
|
Шиповатый тип структур в опухоли/Spinous type of structures in the tumor |
|||
|
Нет/No |
10 (24 %) |
1 (12 %) |
0,461 |
|
Есть/Yes |
31 (76 %) |
7 (78 %) |
|
|
Базалоидный тип структур в опухоли/Вasaloid type of |
structures in the tumor |
||
|
Нет/No |
24 (58 %) |
4 (50 %) |
0,545 |
|
Есть/Yes |
15 (42 %) |
4 (50 %) |
|
|
Полиморфный тип структур в опухоли/Polymorphic type of structures in the tumor |
|||
|
Нет/No |
16 (39 %) |
5 (62 %) |
0,266 |
|
Есть/Yes |
23 (61 %) |
3 (38 %) |
|
|
Отдельные опухолевые клетки/Discrete tumor cells |
|||
|
Нет/No |
16 (39 %) |
4 (50 %) |
0,563 |
|
Есть/Yes |
25 (61 %) |
4 (50 %) |
|
|
Процент разного типа структур в опухоли, количество |
больных, Ме [Q1; Q3] |
||
|
Ороговевающий/Keratinizing |
7,5 [2,0; 30,0] |
20,5 [1,0; 40,0] |
1,000 |
|
Шиповатый/Spinous |
80,0 [30,0; 99,0] |
90,0 [50,0; 98,0] |
0,910 |
|
Базалоидный/Вasaloid |
80,0 [30,0; 99,0] |
55,5 [11,5; 99,0] |
0,764 |
|
Полиморфный/Polymorphic |
20,0 [5,0; 85,0] |
2,0 [1,0; 25,0] |
0,108 |
|
Отдельные опухолевые клетки/ Discrete tumor cells |
5,0 [1,0; 10,0] |
1,5 [1,0; 5,5] |
0,343 |
|
Grade |
|||
|
Grade 1 |
1 (2 %) |
1 (12,5 %) |
|
|
Grade 2 |
27 (66 %) |
6 (75 %) |
0,272 |
|
Grade 3 |
13 (32 %) |
1 (12,5 %) |
|
|
Выраженность стромы опухоли/Tumor stroma |
|||
|
<30 % |
17/41 (41 %) |
6 (75 %) |
|
|
30–70 % |
20/41 (49 %) |
2 (25 %) |
0,199 |
|
>70 % |
4/41 (10 %) |
0 (0 %) |
|
Îêîнчàниå тàблицы 3/End of Table 3
|
STAS |
|||
|
Нет/No |
25/41 (61 %) |
6/8 (75 %) |
0,452 |
|
Есть/Yes |
16/41 (39 %) |
2/8 (25 %) |
|
|
PD-L1 |
|||
|
TPS<1 % |
25 (62 %) |
5 (62 %) |
|
|
TPS 1–49 % |
8 (19 %) |
2 (25 %) |
0,869 |
|
TPS≥50 % |
8 (19 %) |
1 (13 %) |
|
|
%Ki67, Ме [Q1; Q3] |
54,8 [26,0; 69,7] |
44,7 [33,7; 67,9] |
0,989 |
Количество клеток воспалительного инфильтрата в строме опухоли/ The number of inflammatory infiltrate cells in the tumor stroma, Ме [Q1; Q3]
|
CD3+ |
345,0 [234,0; 678,0] |
874,5 [497,0; 1020,0] |
0,013 |
|
CD4+ |
395,0 [97,0; 488,0] |
296,5 [39,0; 496,5] |
0,626 |
|
CD8+ |
300,0 [202,0; 408,0] |
354,0 [112,5; 522,0] |
0,829 |
|
CD20+ |
159,0 [86,0; 298,0] |
117,5 [89,0; 175,0] |
0,636 |
|
CD68+ |
205,0 [82,0; 306,0] |
304,0 [194,0; 405,5] |
0,076 |
Количество клеток воспалительного инфильтрата в паренхиме опухоли/ The number of inflammatory infiltrate cells in the tumor parenchyma, Ме [Q1; Q3]
|
CD3+ |
87,0 [33,0; 190,0] |
203,0 [123,5; 282,0] |
0,015 |
|
CD4+ |
0,0 [0,0; 18,0] |
9,0 [0,0; 21,0] |
0,946 |
|
CD8+ |
85,0 [30,0; 202,0] |
36,5 [7,0; 82,0] |
0,256 |
|
CD20+ |
0,0 [0,0; 0,0] |
0,0 [0,0; 2,0] |
0,685 |
|
CD68+ |
6,0 [0,0; 33,0] |
14,5 [7,5; 25,5] |
0,379 |
Адъювантная химиотерапия/Adjuvant chemotherapy
|
Нет/No Есть/Yes |
4 (9 %) 37 (91 %) |
2 (25 %) 6 (75 %) |
0,229 |
|
Рецидивы/Recurrence |
|||
|
Нет/No |
40 (98 %) |
7 (87 %) |
0,188 |
|
Есть/Yes |
1 (2 %) |
1 (13 %) |
|
Примечание: таблица составлена авторами.
Note: created by the authors.
значительную роль учета STAS в прогнозировании риска гематогенного метастазирования у больных аденокарциномой легкого без метастатического поражения лимфоузлов средостения (N2). Изучение


