Возможности аутофлуоресцентной эндоскопии в первичной диагностике предраковых изменений, рака гортани и гортаноглотки
Автор: Тараскина И.О., Черемисина О.В., Панкова О.В., Мухамедов М.Р., Ананина О.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.22, 2023 года.
Бесплатный доступ
Цель исследования - оценка диагностической эффективности AFI-эндоскопии у больных с предопухолевыми заболеваниями и первичным раком гортани и гортаноглотки. материал и методы. Представлены результаты оценки диагностической эффективности использования уточняющей эндоскопической методики - аутофлуоресценции (AFI) у 101 пациента с патологией гортани и гортаноглотки: I группа - 53 больных с хроническими гиперпластическими заболеваниями, II группа - 48 больных раком гортани или гортаноглотки.
Видеоларингоскопия, аутофлуоресценция (afi), хронические заболевания гортани и гортаноглотки, предопухолевые изменения, первичный рак гортани и гортаноглотки
Короткий адрес: https://sciup.org/140303565
IDR: 140303565 | УДК: 616.22+616.321]-006.6-072.1 | DOI: 10.21294/1814-4861-2023-22-5-38-48
Текст научной статьи Возможности аутофлуоресцентной эндоскопии в первичной диагностике предраковых изменений, рака гортани и гортаноглотки
Актуальность
На долю рака гортани (РГ) приходится порядка 40 % случаев среди злокачественных новообразований опухолей головы и шеи, а также РГ составляет 1 % всех случаев рака в мире [1, 2]. В 2021 г. в Российской Федерации распространенность РГ составила 29,2 на 100 тыс. населения. При этом выявляемость РГ I–II стадии составляет менее половины первичных случаев – 41,6 % , РГ III стадии – 32,9 %, РГ IV стадии – 25,1 %. Рак гортани встречается преимущественно у мужчин в возрасте 40–60 лет [3]. В отношении рака горта-ноглотки (РГГ) подобные статистические данные в литературе не приводятся в связи с меньшей встречаемостью, кроме того, обычно данные об уровне заболеваемости РГГ объединяют с показателями злокачественных новообразований, поражающих другие отделы глотки (носоглотка, ротоглотка).
В настоящее время не вызывает сомнений тот факт, что большая часть злокачественных новообразований, в том числе и опухоли верхних дыхательных путей, развивается на фоне хронической предопухолевой патологии. В отношении рака гортани и гортаноглотки к группе повышенного онкологического риска можно отнести пациентов с хроническим гиперпластическим ларингитом (ХГЛ), папилломатозом и дискератозом, данные хронические заболевания в сочетании с диспла-стическими изменениями high grade, которые ранее стратифицировались как дисплазия II–III степени, составляют группу облигатного предрака [4–6].
Несвоевременная диагностика РГ и РГГ, в том числе обусловленная малосимптомным течением заболевания на ранней стадии либо поздним обращением пациентов, приводит к тому, что на долю распространенных форм этих злокачественных новообразований приходится до 60 % случаев, что обусловливает неблагоприятный прогноз даже в условиях современных методов комбинированного лечения [7, 8]. В нашей стране в 2021 г. показатель одногодичной летальности при РГ составлял 21,8 %, при злокачественных опухолях глотки (С10–13) – 35,8 % [3]. Программ скрининга по РГ и РГГ не разработано, значительно затрудняет раннюю диагностику предраковых процессов и злокачественных новообразований гортани и гортаноглотки отсутствие до настоящего времени эндоскопической классификации предопухолевых изменений и ранних форм рака данных локализаций.
Одним из важнейших инструментальных методов диагностики патологических изменений гортани является видеоларингоскопия в белом свете (англ. White Light Imaging, WLI) с помощью гибких видеоэндоскопов, в ходе которой можно выявить тот или иной патологический процесс, определить его размеры и границы распространенности, а также произвести забор материала для верификации. Однако эндоскопическая диагностика поражений гортани в последние годы претерпела значительные изменения благодаря внедрению технологии изображения HD-качества, а также различных дополнительных методик визуализации, к которым относятся осмотр в режимах узкого спектра и аутофлуоресценции (англ. Autofluorescence Imaging, AFI). Применение комбинации данных методик позволяет улучшить качество диагностики [9, 10].
В основе AFI-эндоскопии лежит анализ различий между интенсивностью флуоресценции нормальной и патологически измененной слизистой оболочки [11]. Аутофлуоресцентное эндоскопическое исследование позволяет провести сравнительную оценку изменений слизистой оболочки, четко отделить границы неизмененной слизистой от патологического процесса. Применение комбинации методов эндоскопического осмотра в WLI и AFI повышает качество диагностики, позволяет провести дифференциальную диагностику, а также прицельно произвести забор биопсийного материала для морфологического исследования [12].
Цель исследования – оценка диагностической эффективности AFI-эндоскопии у больных с предопухолевыми заболеваниями и первичным раком гортани и гортаноглотки.
Материал и методы
В исследование включен 101 пациент с патологией гортани или гортаноглотки, которым требовалась уточняющая эндоскопическая диагностика. В зависимости от диагноза направления пациенты были разделены на 2 группы:
– I группу составили 53 больных с хроническими гиперпластическими процессами гортани и гортаноглотки;
– II группу – 48 больных с диагнозом направления подозрение на рак гортани или гортаноглотки.
В группу больных с хроническими заболеваниями гортани вошли 29 (54,7 %) больных с ХГЛ, 7 (13,2 %) – с сочетанным поражением (ХГЛ и дискератоз), 9 (16,9 %) – с единичными папилломами, 8 (15,1 %) больных с очаговой гиперплазией слизистой оболочки гортаноглотки. II группу составили 40 (83,3 %) пациентов с раком гортани и 8 (16,7 %) – с раком гортаноглотки (РГГ). Среди пациентов в I группе было 44 (83,0 %) мужчины и 9 (16,1 %) женщин, во II группе – 42 (85,7 %) мужчины и 6 женщин (14,3 %). Средний возраст больных, включенных в исследование, составил 55,1 ± 4,9 года (31–78 лет), из них в возрастном интервале 31–40 лет в I группе было 10 (18,8 %), во II группе – 7 (14,6 %); 41–50 лет – 16 (30,2 %) и 11 (22,9 %); 51–60 лет – 18 (33,9 %) и 16 (33,3 %); 61–70 лет – 9 (16,9 %) и 12 (25,0 %) пациентов соответственно, в возрасте старше 70 лет – 2 (4,2 %) пациента во II группе.
Эндоскопические исследования проводились с использованием видеобронхоскопов BF260 фирмы Olympus Medical Systems Corp. (Япония) на видеоэндоскопическом комплексе LUCERA с последовательным применением стандартного режима WLI и режима аутофлуоресценции. При стандартной видеоларингоскопии (ВЛС) в белом свете проводили осмотр слизистой оболочки гортани и гортаноглотки, выявляли наличие или отсутствие участков гиперплазии, дискератоза, различных экзофитных образований (папиллома, опухоль), оценивалась воспалительная и/или опухолевая инфильтрация слизистой оболочки, деформация структур гортани, характер слизистой оболочки, выявлялись признаки воспаления (гиперемия, отечность, утолщение слизистой оболочки). При ларингоскопии в режиме AFI определяли интенсивность свечения на нормальной слизистой оболочке и всех патологических участках, выявленных при осмотре. При осмотре в режиме AFI неизмененная слизистая оболочка имеет равномерное слабое или средней интенсивности зеленое свечение, патологические участки – умеренное или выраженное сиреневое свечение, анализ его интенсивности позволяет провести дифференциальную диагностику обнаруженных на слизистой оболочке изменений. Биопсийный материал, полученный при ВЛС, подвергался стандартному гистологическому исследованию.
Для статистического анализа полученных данных применялись стандартные методы медикобиологической статистики с использованием пакета программ «Statistica for Windows» (версия 10.0).
Результаты
При стандартной видеоларингоскопии у 53 пациентов, отнесенных к I группе, в 22 (41,5 %) случаях диагностирован/подтвержден ХГЛ, в 4 (7,5 %) – сочетанная хроническая патология (ХГЛ и дис-кератоз), в 7 (13,2 %) – единичные папилломы. Аналогичная ситуация отмечена при эндоскопическом исследовании у 5 (9,4 %) больных с очаговой гиперплазией слизистой оболочки гортаноглотки. В 15 случаях при стандартной ВЛС у больных I группы возникли диагностические трудности при оценке эндоскопической картины. В частности, при осмотре у 3 (5,6 %) больных с диагнозом направления ХГЛ и дискератоз в очагах дискератоза слизистая оболочка была резко уплотнена, носила бугристый характер, сами очаги были плотно спаяны с подлежащими структурами гортани. У 7 (13,2 %) пациентов с диагнозом направления ХГЛ при эндоскопии были обнаружены очаги резкого уплотнения и неровной мелкобугристой слизистой оболочки (рис. 1). В 2 (3,7 %) случаях, у больных с диагнозом направления папиллома, последняя была плотно спаяна с подлежащими структурами (рис. 2) и имела очаги инфильтрации. У 3 (3,7 %) пациентов в гортаноглотке слева впервые были выявлены множественные разнокалиберные очаги гиперплазии слизистой оболочки с втяжениями в центре. Эти изменения слизистой оболочки, выявленные у 15 пациентов, не являются характерными для хронических заболеваний гортани и гортаноглотки.
Во II группе (n=48) при стандартной видеоларингоскопии у 39 (81,2 %) пациентов диагноз направления рак гортани или гортаноглотки был подтвержден, при этом полученные диагностические данные, а также оценка распространенности первичной опухоли не вызывали сложности в интерпретации. В 9 (18,8 %) случаях, напротив, отмечены диагностические трудности в оценке результатов эндоскопического исследования. У 4 (8,3 %) больных с диагнозом направления рак гортани затруднения в интерпретации были обусловлены как наличием некротических масс
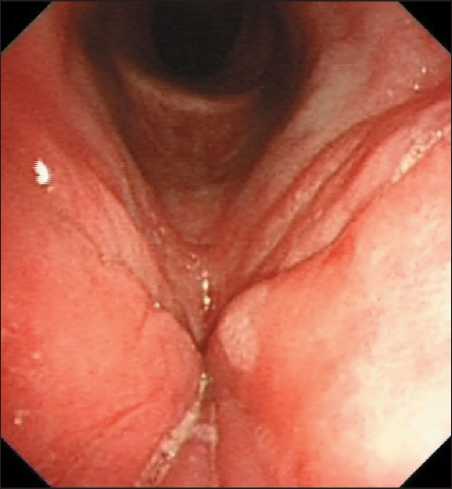
Рис. 1. Пациент С. Эндофото. Видеоларингоскопия в белом свете. Хронический гиперпластический ларингит. Очаги уплотнения и неровной слизистой оболочки. Примечание: эндофото выполнено авторами
Fig.1. Patient S. Endoscopic image. White-light laryngoscopy. Сhronic hyperplastic laryngitis. Areas of thickening and uneven mucous membrane.
Note: created by the authors
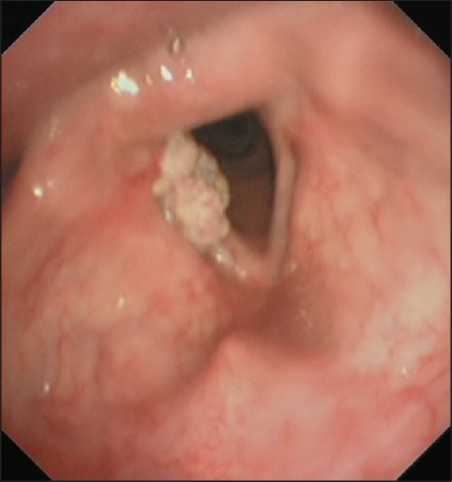
Рис. 2. Пациент К. Эндофото. Видеоларингоскопия в белом свете. Папиллома гортани, плотно спаянная с подлежащими структурами. Примечание: эндофото выполнено авторами Fig.2. Patient K. Endoscopic image. White-light laryngoscopy. Laryngeal papilloma, tightly adherent to underlying tissues. Note: created by the authors
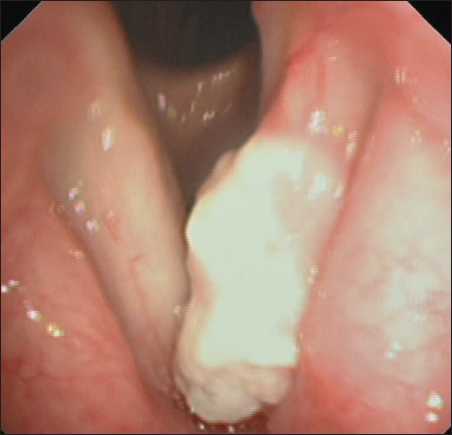
Рис. 3. Пациент У. Эндофото. Видеоларингоскопия в белом свете. Опухоль левой голосовой складки, покрытая некротическими массами. Примечание: эндофото выполнено авторами
Fig. 3. Patient U. Endoscopic image. White-light laryngoscopy. Tumor of the left vocal fold covered with necrotic masses. Note: created by the authors
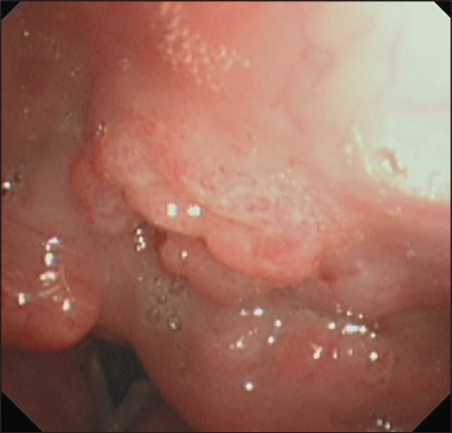
Рис. 4. Пациент Н. Эндофото. Видеоларингоскопия в белом свете. Опухоль гортаноглотки, по данным исследования создается впечатление об обширном распространении. Примечание: эндофото выполнено авторами
Fig.4. Patient N. Endoscopic image. White-light laryngoscopy. Tumor of the hypopharynx. The tumor appears to be widespread.
Note: created by the authors
на поверхности патологического очага (рис. 3), выраженным воспалительным компонентом по периферии патологического участка, так и локализацией опухоли в «трудных» для полноценной визуализации зонах гортани, к которым относятся передняя комиссура, подскладочный отдел. У пациентов с диагнозом направления рак гортано-глотки диагностические затруднения возникли в 5 (10,4 %) случаях при определении распространенности первичной опухоли (рис. 4). Затрудняли визуальную оценку истинных границ опухолевого поражения следующие факторы: деформация и/ или воспаление структур гортани и гортаноглотки, наличие очагов папилломатоза, некроза.
Таким образом, при ВЛС в белом свете первичный диагноз неопухолевой патологии подтвержден у 38 (71,7 %) пациентов I группы. В 15 (28,3 %) случаях заподозрены участки малигнизации, что не позволяло сделать однозначное заключение по результатам стандартного эндоскопического исследования в белом свете. Во II группе диагностические трудности возникли у 4 (8,3 %) больных с диагнозом направления рак гортани и у 5 (10,4 %) пациентов с диагнозом направления рак гортано-глотки. При раке гортани затруднения в интерпретации данных при оценке характера первичной патологии были обусловлены как наличием некротических масс на поверхности патологического очага, выраженным воспалительным компонентом по периферии патологического участка, так и локализацией опухоли в «трудных» для полноценной визуализации зонах (передняя комиссура, подскладочный отдел гортани). Диагностические затруднения при раке гортаноглотки возникли при определении истинных границ распространенности первичной опухоли за счет наличия деформации структур органа и/или явлений воспаления, очагов папилломатоза, некроза.
Вторым этапом комплексного эндоскопического обследования был осмотр гортани и гортано-глотки в режиме аутофлуоресценции. При этом у пациентов I группы в 25 (47,1 %) случаях во всех осмотренных зонах, в том числе и на поверхности патологических изменений, наблюдалось зеленое свечение (рис. 5), в 9 (16,9 %) случаях – слабое сиреневое свечение, что позволило подтвердить диагноз направления и предварительное эндоскопическое заключение после стандартной ВЛС о наличии хронических гиперпластических изменений со стороны слизистой оболочки гортани и гортаноглотки (табл. 1).
У 19 (35,8 %) пациентов с хронической патологией гортани и гортаноглотки отмечено сиреневое свечение более выраженной интенсивности (табл. 1), из них у 4 (7,5 %) пациентов с ХГЛ, у 3 (5,7 %) – при сочетании ХГЛ и дискератоза, у 3 (5,7 %) – с папилломой, у 2 (3,8 %) пациентов с очаговой гиперплазией слизистой оболочки гортаноглотки наблюдалось умеренное сиреневое свечение (n=12, 22,6 %). Выраженное сиреневое свечение зарегистрировано у 7 (13,2 %) больных I группы, из них у 4 (7,5 %) пациентов с ХГЛ, у 3 (5,7 %) – с сочетанным поражением гортани (ХГЛ + дискератоз). Умеренное или выраженное сиреневое свечение на отдельных участках слизистой оболочки при ВЛС в режиме AFI у больных с хронической гиперпластической патологий гортани и гортаноглотки позволяет предположить наличие предопухолевых (диспластических) изменений эпителия (рис. 6), что в дальнейшем подтвердилось при морфологическом исследовании биопсийного материла.
Во II группе у пациентов с диагнозом направления рак гортани или гортаноглотки при AFI-видеоларингоскопии в 39 (81,2 %) случаях, не вызывавших затруднений при стандартной ВЛС, в режиме AFI наблюдалось выраженное сиреневое свечение (табл. 1). Таким образом, у всех больных выявленные патологические изменения имели прямые признаки злокачественной опухоли, были расценены как первичный рак гортани и гортано-глотки, границы которых четко определялись и совпали по данным WLI- и AFI-ларингоскопии. У 9 (18,8 %) пациентов с диагностическими трудностями, возникшими при интерпретации данных
Таблица 1/Table 1
Характеристика выраженности аутофлуоресценции при ВЛС у больных с патологией гортани Intensity of autofluorescence during video laryngoscopy in patients with laryngeal lesions
Группы больных/Patients
|
Интенсивность аутофлуоресценции/ Intensity of autofluorescence |
Хронические заболевания гортани/ гортаноглотки (I группа, n=53)/ Chronic laryngeal/Hypoparyngeal diseases (Group I, n=53) |
Рак гортани/ гортаноглотки (II группа, n=48)/ Laryngeal/Hypoparyngeal cancer (Group II, n=48) |
|
Зеленое свечение/Green |
25 (47,1 %) |
3 (6,3 %) |
|
Слабое сиреневое свечение/Mild violet |
9 (16,9 %) |
2 (4,2 %) |
|
Умеренное сиреневое свечение/ Medium violet |
12 (22,6 %) |
4 (8,3 %) |
|
Выраженное сиреневое свечение/ Intense violet |
7 (13,2 %) |
39 (81,2 %)* |
Примечание: * – значимые различия между сравниваемыми группами (р<0,0001); таблица составлена авторами.
Note: * – significant differences between the groups (р<0,0001); created by the authors.
стандартной ВЛС, анализ результатов осмотра в режиме аутофлуоресценции выполнен в зависимости от локализации первичного процесса. При этом установлено, что из 4 (8,3 %) больных раком гортани в 3 (6,3 %) наблюдениях зафиксировано умеренное сиреневое AFI-свечение, что позволило трактовать выявленные изменения в пользу пер- вичного рака гортани, в 1 (2,1 %) зарегистрировано слабое сиреневое свечение, что явилось недостаточным условием для установки эндоскопического диагноза рака гортани, диагностические трудности были обусловлены наличием некроза на поверхности опухоли (рис. 7). У 5 (10,4 %) пациентов с раком гортаноглотки при затруднении определения
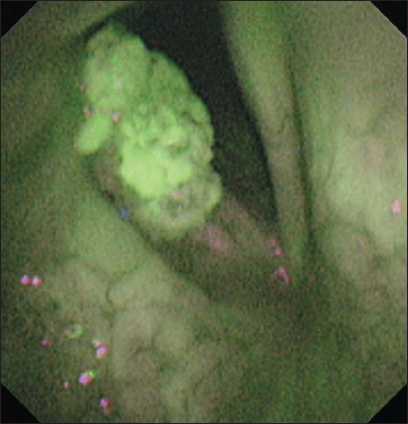
Рис. 5. Пациент К. Эндофото. Видеоларингоскопия в режиме AFI. Папиллома гортани, плотно спаянная с подлежащими структурами. При аутофлуоресценции на поверхности образования определяется зеленое свечение. При гистологическом исследовании биопсийного материала диспластических изменений не выявлено. Примечание: эндофото выполнено авторами
Fig. 5. Patient K. Endoscopic image. Laryngoscopy with AFI. Laryngeal papilloma tightly adherent to the underlying structures. A green light is detected on the surface of the lesion. Histological examination of the biopsy specimen did not reveal any dysplastic changes. Note: created by the authors
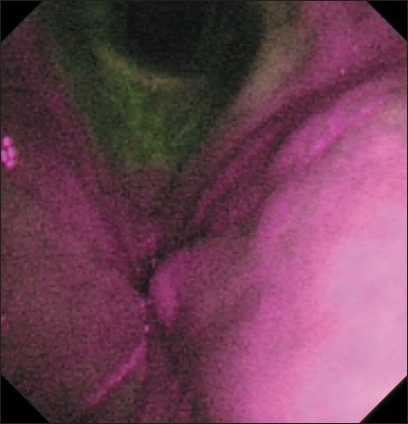
Рис. 6. Пациент С. Эндофото. Видеоларингоскопия в режиме AFI. Хронический гиперпластический ларингит. При аутофлуоресценции слизистой оболочки гортани определяется выраженное сиреневое свечение. При гистологическом исследовании биопсийного материала – дисплазия high grade. Примечание: эндофото выполнено авторами
Fig. 6. Patient S. Endoscopic image. Laryngoscopy with AFI. Сhronic hyperplastic laryngitis. Autofluorescence of the laryngeal mucosa reveals an intense violet fluorescence. Histological examination of biopsy specimen showed high grade dysplasia. Note: created by the authors
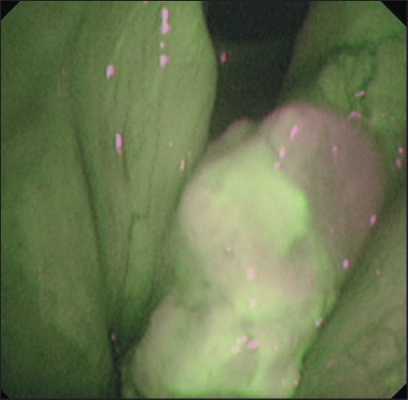
Рис. 7. Пациент У. Эндофото. Видеоларингоскопия в режиме AFI. Опухоль левой голосовой складки, покрытая некротическими массами, за счет которых на поверхности новообразования отсутствует патологическое свечение. Примечание: эндофото выполнено авторами
Fig. 7. Patient U. Endoscopic image. Laryngoscopy with AFI. Tumor of the left vocal fold covered with necrotic masses, due to which there is no pathological light on the surface of the tumor.
Note: created by the authors
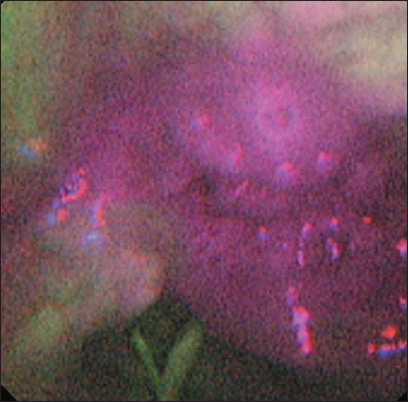
Рис. 8. Пациент Н. Эндофото. Опухоль гортаноглотки. Видеоларингоскопия в режиме AFI, при исследовании определены истинные границы опухолевого процесса. Примечание: эндофото выполнено авторами
Fig. 8. Patient N. Endoscopic image. Tumor of the hypopharynx. Laryngoscopy with AFI reveals the true extent of the tumor. Note: created by the authors
истинных границ опухоли при стандартном эндоскопическом осмотре применение режима AFI во всех случаях позволило четко диагностировать проксимальную и дистальную границы опухолевой инфильтрации по умеренному (n=1, 2,1 %) или выраженному (n=4, 8,3 %) сиреневому свечению (рис. 8).
При статистическом анализе частоты AFI-симптомов установлено, что выраженное сиреневое свечение значимо чаще наблюдалось при раке гортани или гортаноглотки по сравнению с группой больных с ХЗГ (p<0,0001). Полученные данные позволяют утверждать, что выраженное сиреневое свечение при AFI-эндоскопии в комплексе с другими эндоскопическими проявлениями является важным дополнительным признаком, позволяющим сделать однозначное заключение о наличии рака гортани или гортаноглотки.
Пациентам сравниваемых групп по окончании комбинированного эндоскопического обследования выполнялся забор биопсийного материала для морфологического исследования с учетом результатов AFI-видеоларингоскопии, позволившей выбрать наиболее значимые «зоны интереса». В итоге, по данным морфологического анализа у 24 (45,3 %) пациентов I группы подтвержден диагноз хронической гиперпластической патологии гортани и гортаноглотки, в том числе у 12 (22,6 %) больных с ХГЛ, у 6 (11,3 %) – с очаговой гиперплазией слизистой оболочки гортаноглотки, у 5 (9,4 %) – с папилломой и у 1 (1,9 %) больного с ХГЛ и дис-кератозом. У 29 (54,4 %) больных выявлены предо-пухолевые изменения слизистой оболочки гортани или гортаноглотки различной степени тяжести: в 8 (15,1 %) случаях диагностирована дисплазия low grade, в 21 (39,6 %) – дисплазия high grade.
При анализе диагностических проявлений дисплазии различной степени тяжести в режиме AFI-видеоларингоскопии установлено, что в 3 из 8 случаев с дисплазией low grade наблюдалось нормальное (зеленое) свечение, в 4/8 – слабое сиреневое свечение, в 1/8 – умеренное сиреневое свечение. Полученные результаты, вероятнее всего, обусловлены минимальными диспластическими изменениями в ларингеальном эпителии, которые в большинстве наблюдений не вызывали значимых изменений параметров аутофлуоресценции. При диспластических процессах high grade (n=21), которые в настоящее время рассматриваются как предрак, в большинстве случаев была зафиксирована аутофлуоресценция большей интенсивности, при этом чаще всего наблюдалось умеренное сиреневое свечение, которое было отмечено у 11/21 больных, выраженное сиреневое свечение зафиксировано у 7/21 пациентов (табл. 2). В 3 случаях при наличии диспластических изменений high grade при ВЛС в режиме AFI выявлено зеленое или слабое сиреневое свечение. Таким образом, дополнительное применение AFI-ларингоскопии позволило диагностировать предраковые изменения слизистой оболочки гортани и гортаноглотки в 18/21 (85,7 %) случаях. Причиной диагностических ошибок при использовании режима AFI в выявлении дисплазии high grade является то обстоятельство, что, по данным наших предыдущих исследований [13], наличие нормальной (зеленое свечение) и малоинтенсивной патологической (слабое сиреневое свечение) аутофлуоресценции может быть обусловлено наличием диспласти-ческих изменений умеренной степени тяжести и/или недавно существующих очагов дисплазии эпителия. В итоге показатели диагностической эффективности стандартной ВЛС в белом свете у больных с предраковыми изменениями (дисплазия high grade) слизистой оболочки гортани и горта-ноглотки составили: чувствительность – 50,0 %, специфичность – 96,0 %, точность – 71,7 %. Дополнительное применение режима AFI увеличило эти параметры до 85,7 % (p<0,05), 96,9 % (p>0,05) и 92,5 % (p<0,05) соответственно. Следует отметить, что значимые различия между данными режимами ВЛС получены при оценке значения диагностической чувствительности и диагностической точности исследования.
Таблица 2/Table 2
Характер аутофлуоресценции при ВЛС у больных с хроническими заболеваниями гортани/ гортаноглотки в зависимости от наличия предопухолевых изменений слизистой оболочки
Intensity of autofluorescence during video laryngoscopy in patients with chronic laryngeal/hypopharyn-geal diseases depending on the presence of mucosal premalignant lesions
|
Интенсивность аутофлуоресценции/ Intensity of autofluorescence |
Без дисплазии/ No dysplasia |
Дисплазия low grade/ Low grade dysplasia |
Дисплазия high grade/ High grade dysplasia |
|
Зеленое свечение/Green |
20 (37,7 %)* |
3 (5,7 %) |
2 (3,7 %) |
|
Слабое сиреневое свечение/Mild violet |
4 (7,5 %) |
4 (7,5 %) |
1 (1,9 %) |
|
Умеренное сиреневое свечение/ Medium violet |
0 (0 %) |
1 (1,9 %)* |
11 (20,8 %)* |
|
Выраженное сиреневое свечение/ Intense violet |
0 (0 %) |
0 (0 %) |
7 (13,2 %)* |
|
Всего /Total |
24 (45,3 %) |
8 (15,1 %) |
21 (39,6 %) |
Примечание: * – значимые различия между сравниваемыми группами (р<0,0001); таблица составлена авторами.
Note: * – significant differences between the groups (р<0,0001); created by the authors.
При статистическом анализе частоты AFI-симптомов в зависимости от результатов морфологического заключения установлено, что в I группе имеются статистически значимые отличия между подгруппой пациентов без предопухолевых изменений, у которых значимо чаще (p<0,0001) наблюдалось зеленое свечение, и больных с ХЗГ, ассоциированных с дисплазией high grade, у которых в большинстве случаев регистрировалось сиреневое свечение (табл. 2). На следующем этапе мы проанализировали зависимость выраженности предопухолевых изменений от интенсивности патологической аутофлуоресценции. Было установлено, что умеренное и выраженное сиреневое свечение значимо чаще наблюдается у больных с дисплазией high grade (p<0,0001) по сравнению с подгруппой без диспластических изменений. Аналогичная закономерность выявлена при подгрупповом анализе у больных ХЗГ с дисплазией low grade и дисплазией high grade в отношении параметра «выраженное сиреневое свечение» (p=0,0455). При статистическом анализе результатов AFI-видеоларингоскопии в сравниваемых группах также установлено, что выраженное сиреневое свечение значимо чаще наблюдалось у больных раком гортани и гортаноглотки по сравнению с пациентами I группы с хронической гиперпластической патологией (p<0,0001) (табл. 2). Таким образом, полученные данные позволяют утверждать, что наличие выраженного сиреневого свечения при аутофлуоресцентной эндоскопии является достоверным симптомом тяжелых дис-пластических изменений или злокачественной опухоли в гортани и гортаноглотке, что во всех случаях было подтверждено при морфологическом исследовании материала, полученного при таргетной биопсии.
Обсуждение
В настоящее время эндоскопическое исследование с применением режима аутофлуоресценции достаточно широко применяется в клинической практике при диагностике различных предопухо-левых изменений и злокачественных новообразований. Однако это в основном относится к таким нозологиям, как рак бронхо-легочной системы и опухоли желудочно-кишечного тракта [9, 12, 14]. Несмотря на высокую эффективность методики и неудовлетворительные результаты диагностики раннего рака гортани и других отделов верхних дыхательных путей, AFI-видеоларингоскопия применяется редко. Помимо организационных проблем и низкой обеспеченности российских клиник подобным эндоскопическим оборудованием, это во многом связано и с небольшим количеством публикаций, описывающих диагностические преимущества ВЛС в режиме AFI, которые представлены исключительно зарубежными авторами, в отечественной литературе мы не нашли подоб- ных работ. Так, в метаанализ китайских авторов, опубликованный в 2021 г., были включены результаты только 23 исследований по применению AFI-видеоларингоскопии при предраке и раннем раке гортани [15]. Метаанализ демонстрирует высокую чувствительность ВЛС в режиме AFI, равную 0,91 (95 % ДИ: 0,89–0,93; χ2=43,78, p=0,0025), специфичность – 0,80 (95 % ДИ: 0,77–0,82; χ2=130,64, p=0,000) и диагностическую точность – 0,887 ± 0,018. Тогда как аналогичные показатели рутинной ВЛС в белом свете составили 0,74 (95 % ДИ: 0,70–0,77; χ2=52,40, p=0,000), 0,89 (95 % ДИ: 0,87–0,90; χ2=299,22, p=0,000) и 0,767 ± 0,027 соответственно.
Нами впервые в отечественной практике показаны преимущества применения AFI-видеоларингоскопии в диагностике рака и предковых изменений слизистой оболочки гортани и гортаноглотки. Включение данной уточняющей методики в алгоритм эндоскопического обследования верхних дыхательных путей также позволило значимо увеличить такие показатели диагностической эффективности, как чувствительность метода – до 85,7 %, точность – до 92,5 %. Как и в метаанализе китайских авторов [15], в полученных нами результатах обращает на себя внимание сопоставимая специфичность методик ВЛС в белом свете и в режиме AFI – 96,0 vs 96,9 %, что, впрочем, вполне ожидаемо для диагностических методик непосредственной визуализации патологических изменений. Кроме того, нами показана высокая информативность таких эндоскопических симптомов при AFI-видеоларингоскопии, как выраженное сиреневое свечение, которое значимо чаще наблюдается при плоскоклеточном раке гортани и гортаноглотки (р=0,0000) и при диспластических изменениях, соответствующих high grade (р=0,455). Полученные данные позволяют рассматривать этот признак в качестве полноценного критерия малигнизации процесса, а также использовать его в комплексе с другими диагностическими данными при отборе больных с хронической патологией гортани и гортаноглотки в группы повышенного онкологического риска.
Сходные результаты получены в немецком проспективном исследовании, которое включало 152 пациента с поражением гортани. Авторы также выполняли аутофлуоресцентную эндоскопию после обычной ВЛС в белом свете, непосредственно перед выполнением эксцизионной биопсии для верификации. Эффективность выявления ранней карциномы гортани и ее предшественников при использовании AFI-технологии показала более высокую чувствительность (98 vs 88 %) и точность (97 vs 90 %) при сопоставимой специфичности (97 vs 93 %) по сравнению со стандартной видеоларингоскопией [16].
Поскольку в нашем исследовании контингент больных составляли пациенты не только с патологией гортани, но и гортаноглотки, мы попытались сопоставить полученные результаты с данными исследований, в которых применялась аутофлуоресцентная эндоскопия при опухолевой патологии других отделов верхних дыхательных путей. В большинстве публикаций показаны аналогичные результаты. Так, в исследовании D.R. Ingrams et al. при оценке эффективности дифференциальной диагностики при доброкачественных, диспласти-ческих и злокачественных изменениях слизистой оболочки полости рта показано, что чувствительность эндоскопических AFI-технологий составила 90 %, специфичность – 91 % и точность – 91 % соответственно [17]. E.P. Koch et al. также показали более высокую чувствительность (97 %) и специфичность (95,8 %) использования AFI-эндоскопии для диагностики патологических состояний ротовой полости и глотки. Положительная прогностическая ценность метода составила 41 %, отрицательная прогностическая ценность – 75–80 % [18]. С другой стороны, по данным X. Luo et al., аутофлуоресценция не была высокоспецифичной при дифференциальной диагностике дисплазии и рака, поскольку потеря флуоресценции наблюдалась в 87,5 % при доброкачественных изменениях слизистой оболочки, что приводило к снижению специфичности методики до 12,5 % [19].
Заключение
Основным эндоскопическим симптомом дисплазии high grade и злокачественного процесса в гортани и гортаноглотке является выраженное сиреневое свечение, выявляемое в режиме AFI. Комплексная видеоларингоскопия с уточняющей методикой аутофлуоресцентной эндоскопии позволила не только выявить патологические изменения на слизистой оболочке гортани и гортаноглотки, но и определить их злокачественный потенциал, а также определить участки для таргетной биопсии. Показатели диагностической эффективности стандартной ВЛС в диагностике хронических гиперпластических процессов, ассоциированных с предопухолевыми изменениями гортани и горта-ноглотки, составили: чувствительность – 50,0 %, специфичность – 96,0 %, точность – 71,7 %, применение аутофлуоресцентной эндоскопии позволило увеличить эти параметры до 87,5, 96,9 и 92,5 % соответственно (p<0,05).
Наглядно показано преимущество применения AFI-видеоларингоскопии в диагностике первичного рака гортани и гортаноглотки. При стандартной ВЛС в белом свете у 9 (18,8 %) больных раком гортани и гортаноглотки отмечены трудности в дифференциальной диагностике рака гортани (n=4) и при оценке истинной распространенности рака гортаноглотки (n=5). В 3 из 4 диагностически сложных случаев применение режима AFI при комплексной ВЛC позволило подтвердить диагноз рака гортани и в 5 случаях определить истинные границы рака гортаноглотки.
Список литературы Возможности аутофлуоресцентной эндоскопии в первичной диагностике предраковых изменений, рака гортани и гортаноглотки
- Siegel R.L., Miller K.D., Jemal A. Cancer statistics, 2020. CA Cancer J Clin. 2020; 70(1): 7–30. doi: 10.3322/caac.21590.
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209–49. doi: 10.3322/caac.21660.
- Злокачественные новообразования в России в 2020 году (заболеваемость и смертность). Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М., 2021. 250 с. [Malignant tumors in Russia in 2020 (morbidity and mortality). Ed. by A.D. Kaprin, V.V. Starinsky, A.O. Shakhzadova. Moscow, 2021. 250 p. (in Russian)].
- Черемисина О.В., Чойнзонов Е.Л., Панкова О.В., Меньшиков К.Ю. Хронический гиперпластический ларингит как критерий формирования группы риска по раку гортани. Российская оториноларингология. 2013; 2(63): 84–9. [Cheremisina O.V., Choinzonov E.L., Pankova O.V., Menshikov K. Yu. Chronic hypeplastic laryngitis as a criterion for defining groups at high risk of laryngeal cancer. Russian Otorinolaryngology. 2013; 2(63): 84–9. (in Russian)].
- Винокурова С.В., Катаргин А.Н. Вирус папилломы человека и заболевания верхних дыхательных путей: рак головы и шеи и респираторный папилломатоз. Голова и шея. 2023; 11(1): 62–73. [Vinokurova S.V., Katargin A.N. Human papillomavirus and upper respiratory diseases: head and neck cancer and respiratory papillomatosis. Head and Neck. 2023; 11 (1): 62–73. (in Russian)]. doi: 10.25792/HN.2023.11.1.62–7.
- Zidar N., Gale N. Update from the 5th Edition of the World Health Organization Classification of Head and Neck Tumors: Hypopharynx, Larynx, Trachea and Parapharyngeal Space. Head Neck Pathol. 2022; 16(1): 31–9. doi: 10.1007/s12105-021-01405-6.
- Чойнзонов Е.Л., Старцева Ж.А., Мухамедов М.Р. Спивакова И.О., Черемисина О.В., Грибова О.В., Кульбакин Д.Е., Суркова П.В. Локальная гипертермия в комбинированном лечении рака гортани и гортаноглотки. Сибирский онкологический журнал. 2014; (5): 5–9. [Choynzonov Е.L., Startseva Z.А., Mukhamedov М.R., Spivakova I.O., Cheremisina O.V., Gribova O.V., Kulbakin D.E., Surkova P.V. Local hyperthermia in combined modality treatment of laryngeal and laryngopharyngeal cancer. Siberian Journal of Oncology. 2014; (5): 5–9. (in Russian)].
- Baird B.J., Sung C.K., Beadle B.M., Divi V. Treatment of early-stage laryngeal cancer: A comparison of treatment options. Oral Oncol. 2018; 87: 8–16. doi: 10.1016/j.oraloncology.2018.09.012.
- Барчук А.А., Арсеньев А.И., Левченко Е.В., Барчук А.С., Щербаков А.М., Мацко Д.Е., Желбунова Е.А., Нефедов А.О., Канаев С.В., Тарков С.А., Аристидов Н.Ю., Гагуа К.Э. Аутофлуоресцентная бронхоскопия и спектрометрия в диагностике центрального рака легкого. Вопросы онкологии. 2011; 57(4): 448–53. [Bartchuk A.A., Arsenyev A.I., Levchenko Ye.V., Bartchuk A.S., Sherbakov A.M., Matsko D.Ye., Zhelbunova Ye.A., Nefedov A.O., Kanayev S.V., Tarkov S.A., Aristidov N.Yu., Gagua K.E. Use of autofluorescence bronchoscopy and spectrometry in diagnosis of central lung cancer. Problems in Oncology. 2011; 57(4): 448–53. (in Russian)].
- Liu Z., Zhang Y., Li Y.P., Ma J., Shi F., Zhao D.F., Li J.M., Zhang Y.Z. Clinical relevance of using autofluorescence bronchoscopy and white light bronchoscopy in different types of airway lesions. J Cancer Res Ther. 2016; 12(1): 69–72. doi: 10.4103/0973-1482.147731.
- Lazim N.M., Kandhro A.H., Menegaldo A., Spinato G., Verro B., Abdullah B. Autofluorescence Image-Guided Endoscopy in the Management of Upper Aerodigestive Tract Tumors.Int J Environ Res Public Health. 2022; 20(1): 159. doi: 10.3390/ijerph20010159.
- van der Heijden E.H., Hoefsloot W., van Hees H.W., Schuurbiers O.C. High definition bronchoscopy: a randomized exploratory study of diag-nostic value compared to standard white light bronchoscopy and autofluo-rescence bronchoscopy. Respir Res. 2015; 16(1): 33. doi: 10.1186/s12931-015-0193-7.
- Былин М.В., Черемисина О.В., Панкова О.В., Афанасьев С.Г., Добродеев А.Ю. Эффективность комплексной эндоскопической диагностики первичного и первично-множественного рака легкого. Поволжский онкологический вестник. 2017; 2(29): 8–15. [Bylin M.V., Cheremisina O.V., Pankova O.V., Afanasyev S.G., Dobrodeev A.Yu. Efficacy of comprehensive endoscopic diagnosis of primary and multiple primary lung cancer. Oncology Bulletin of Volga Region. 2017; 2(29): 8–15. (in Russian)].
- Falk G.W. Autofluorescence endoscopy. Gastrointest Endosc Clin N Am. 2009; 19(2): 209–20. doi: 10.1016/j.giec.2009.02.004.
- Ge M.W., Ni H.T., Huang J.W., Fan Z.H., Shen W.Q., Chen H.L. Diagnostic value of autofluorescence laryngoscope in early laryngeal carcinoma and precancerous lesions: A systematic review and meta-analysis. Photodiagnosis Photodyn Ther. 2021; 35. doi: 10.1016/j.pdpdt.2021.102460.
- Fostiropoulos K., Arens C., Betz C., Kraft M. [Noninvasive imaging using autofluorescence endoscopy: Value for the early detectionof laryngeal cancer]. HNO. 2016 Jan; 64(1): 13–8. doi: 10.1007/s00106-015-0095-5.
- Ingrams D.R., Dhingra J.K., Roy K., Perrault D.F. Jr., Bottrill I.D., Kabani S., Rebeiz E.E., Pankratov M.M., Shapshay S.M., Manoharan R., Itzkan I., Feld M.S. Autofluorescence characteristics of oral mucosa. Head Neck. 1997; 19(1): 27–32. doi: 10.1002/(sici)1097-0347-(199701)19:1<27::aid-hed5-3.0.co;2-x.
- Koch F.P., Kaemmerer P.W., Biestergeld S., Kunkel M., Wagner W. Effectiveness of autofluorescence to identify suspicious oral lesions – A prospective, blinded clinical trial. Clin Oral Investig. 2011; 15: 975–82. doi: 10.1007/s00784-010-0455-1.
- Luo X., Xu H., He M., Han Q., Wang H., Sun C., Li J., Jiang L., Zhou Y., Dan H., Feng X., Zeng X., Chen Q. Accuracy of autofluorescence in diagnosing oral squamous cell carcinoma and oral potentially malignant disorders: A comparative study with aero-digestive lesions. Sci Rep. 2016; 6. doi: 10.1038/srep29943.


