Возможности де-эскалации неоадъювантной терапии у больных с Her2-позитивным раком молочной железы
Автор: Дешкина Т.И., Болотина Л.В., Голубев П.В., Габуния И.Э., Рубан М.С., Феденко А.А., Каприн А.Д.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 3 т.13, 2023 года.
Бесплатный доступ
Возможности де-эскалации неоадъювантной терапии у больных с HER2-Рак молочной железы занимает лидирующее позиции в структуре онкологической заболеваемости и смертности у женщин во всем мире. В каждом пятом случае выявляется гиперэкспрессия HER2/neu, что является неблагоприятным прогностическим маркером и ассоциируется с более агрессивным течением опухолевого процесса. Однако активное внедрение таргетной терапии за последние 20 лет позволило изменить естественную историю этого заболевания. В тоже время общепринятые режимы неоадъювантной химиотерапии в комбинации с таргетной терапией сложно назвать оптимальными в виду их неудовлетворительной переносимости. Очевидно, что существует определенная категория пациенток, не нуждающаяся в назначении столь токсичных схем лечения. В данной обзорной статье мы хотим представить свой взгляд на возможность де-эскалации объема неоадъювантной терапии у больных с HER2-позитивным раком молочной железы.
Рак молочной железы, неоадъювантная терапия, her2-позитивный статус, деэскалация
Короткий адрес: https://sciup.org/140303409
IDR: 140303409 | DOI: 10.18027/2224-5057-2023-13-3-29-36
Текст обзорной статьи Возможности де-эскалации неоадъювантной терапии у больных с Her2-позитивным раком молочной железы
Рак молочной железы (РМЖ) занимает лидирующее позиции в структуре онкологической заболеваемости и смертности у женщин во всем мире. Учитывая визуальную локализацию опухоли и активное внедрение программ скрининга, большинство случаев РМЖ выявляется на ранних стадиях: I–II стадия — 72,5 %, III — 19%, и только 27,1% пациенток впервые обращаются к врачу с генерализованным опухолевым процессом [1].
У 15–20% больных при проведении иммуногистохимического исследования выявляется гиперэкспрессия рецептора к эпидермальному фактору роста HER2/neu [2], что является неблагоприятным прогностическим маркером и ассоциируется с более агрессивным течением опухолевого процесса [3]. Однако активное внедрение таргет-ной терапии за последние 20 лет позволило изменить естественную историю этого заболевания, и в настоящее время 5-летняя опухоль-специфическая выживаемость у больных с HER2-позитивным РМЖ оказалась сопоставима с показателями пациенток с люминальным HER2-негатив-ным подтипом [4].
Согласно современным клиническим рекомендациям, при HER2-позитивном РМЖ, начиная уже с ранних стадий заболевания (сT2N0M0), лечение необходимо начинать с проведения неоадъювантной химиотерапии (НАХТ) [5,6]. Достижение полного патоморфологического регресса опухоли ассоциируется с более чем двукратным снижением риска прогрессирования и смерти от онкологической пато- логии: HR = 0,37 для показателей безрецидивной выживаемости (БРВ) и 0,34-для общей выживаемости (ОВ) [7–10]. Отсутствие же полного или почти полного патоморфоза (RCB II–III) является показанием для коррекции последующей адъювантной терапии (замена трастузумаба на трасту-зумаб-эмтанзин), что также сопровождается существенным улучшением отдаленных результатов лечения [11].
В настоящее время «золотым стандартом» неоадъювантной терапии при HER2 позитивном РМЖ является комбинация цитостатиков с анти-HER2 препаратами. Не вызывает сомнений необходимость добавления трастузумаба к НАХТ: данный подход обеспечивает повышение частоты полных патоморфологических ответов опухоли (pCR) и улучшение отдаленных результатов лечения.
В рандомизированном исследовании 2 фазы NOAH (n = 235) добавление трастузумаба к антрациклин- и так-сан-содержащей химиотерапии привело к повышению pCR с 19 до 38%, что закономерно транслировалось в увеличение показателей 5-летней БРВ с 43 до 58%. Наиболее интересным моментом в данной работе, непосредственно доказывающем вклад таргетной терапии в улучшение отдаленных результатов лечения, стала информация о том, что пациентки даже с полным патоморфологическим регрессом опухоли, которым проводилась только НАХТ, все равно имели более низкие цифры БРВ по сравнению с больными, которые получали трастузумаб (HR = 0,29) [12].
В мета-анализе 2012 года, объединившем данные почти 2000 больных с HER2-позитивным РМЖ, включение трастузумаба в схему НАХТ позволило увеличить частоту полных патоморфологических регрессов опухоли с 23 до 40%. Этот показатель стал своеобразным суррогатным маркером последующего улучшения показателей БРВ и ОВ [13].
Включение пертузумаба в схемы неоадъювантной терапии позволило улучшить локо-регионарный ответ, однако это негативным образом отразилось на токсичности проводимого лекарственного лечения: повысился процент гастроинтестинальных и гематологических нежелательных явлений.
В рандомизированном исследовании 2 фазы NeoSphere 417 пациенток с HER2-позитивным РМЖ были разделены на 3 группы: 1-я группа получала НАХТ комбинацией доцетаксел + трастузумаб + пертузумаб, 2-я группа — доцетаксел + трастузумаб или доцетаксел + пертузумаб, в 3-й группе проводилась только двойная таргетная блокада трастузумабом и пертузумабом. После выполнения операции всем больным назначалась АХТ и трастузумаб до года: в 1 и 2-й группе пациентки получали режим FEC, в 3-й группе, помимо антрациклинов, также назначался доцетаксел. Уровень pCR в исследовании составил 46% для больных, получавших химиотерапию с двойной тар-гетной блокадой, 29 и 24% —у пациенток из группы доцетаксела в комбинации с трастузумабом или пертузумабом, и только 16,9% —у больных после двойной таргетной блокады без химиотерапии. И хотя нумерологически было отмечено улучшение показателей 5-летней БРВ для комбинации химиотерапии с трастузумабом и пертузумабом (HR = 0,69), исследование не обладало достаточной статистической мощностью, чтобы эта цифра оказалась достоверной. Что касается безопасности, авторы отмечают лишь повышение частоты развития диареи 1–2 степени при назначении пертузумаба. Риск развития других нежелательных явлений (в т. ч. кардиологических) не возрастал [14].
В исследовании GeparSepto сравнивалась эффективность неоадъювантной терапии с использованием двойной таргет-ной блокады в зависимости от выбранного химиотерапевтического агента (паклитаксел против Nab-паклитаксела). В классическом варианте FEC + 12 еженедельных введений паклитаксела на фоне таргетной терапии трастузумабом и пертузумабом частота полных патоморфологических регрессов равнялась 54%. При использовании Nab-паклитаксела эта цифра оказалась несколько выше и составила 62%, однако различие не было статистически достоверным [15].
Целью рандомизированного исследования 2 фазы TRYPHAENA стало сравнение кардиотоксичности в зависимости от времени начала таргетной терапии (одновременно с антрациклинами или после окончания их введения), а также оценка частоты полных патоморфологических регрессов опухоли в 3 группах (FECHP-THP, FEC-THP и TCHP). Исследование не было спланировано для прямого сравнения эффективности лечения между тремя режимами, поэтому мы можем руководствоваться лишь косвенными данными: уровень pCR составил 56 и 55% для комбинаций
FECHP-THP и FEC-THP и 64% — для схемы TCHP. Кардиотоксичность между двумя антрациклин-содержащими режимами существенно не отличалась и оказалась чуть менее выражена при назначении безантрациклинового режима. Однако проявления гематологической токсичности однозначно были более выраженными при назначении TCHP: частота фебрильной нейтропении при отсутствии профилактики КСФ возросла в 2 раза и составила 17%, анемия 3 степени и тромбоцитопения встречалась в 17 и 12% случаев, диарея 3 и более степени — в 12% случаев против 4–5% для антрациклин-содержащих режимов [16].
Принимая во внимание вышеизложенные данные, возникает закономерный вопрос: возможна ли дэ-эскалация режимов неоадъювантной терапии у больных с HER2-пози-тивным РМЖ без потери её эффективности?
В голландском исследовании TRAIN-2 авторы попытались ответить на вопрос о необходимости включения антрациклинов в схему НАХТ. Пациенткам с ранним и местно-распространенным РМЖ II–III стадии проводился один из альтернативных вариантов неоадъювантной терапии: первая группа получала 3 курса по схеме FEC-90 с последующим переключением на 6 циклов паклитаксела 80 мг/м 2 в дни 1 и 8 в комбинации с карбоплатином AUC6 в 1 день или AUC3 в дни 1 и 8, каждые 21 день. Во второй группе проводилось 9 циклов паклитаксела и карбоплатина по той же схеме. Всем пациенткам одновременно с химиотерапией (в т. ч. и антрациклин-содержащей) назначалась двойная таргетная блокада трастузумабом и пертузумабом. Первичной конечной точкой в исследовании стал уровень pCR. Оценка токсичности производилась у всех пациентов, получивших хотя бы один цикл химиотерапии. При анализе результатов лечения уровень pCR оказался сопоставим в обеих группах (67% и 68%). Показатели 3-летней безре-цидивной и общей выживаемости также не различались. Гематологическая токсичность в виде нейтропении 3 и более степени и фебрильной нейтропении была несколько выше при назначении НАХТ с антрациклинами (60 против 54% и 10 против 1% соответственно). При этом нарушение сократительной функции сердца было редким явлением для обеих групп (1 % и 0%). Таким образом, авторы делают вывод о том, что исключение антрациклинов из режима НАХТ является приемлемым вариантом при условии проведения двойной таргетной блокады [17].
Гипотеза о возможности полного отказа от НАХТ в пользу таргетных препаратов выдвигалась неоднократно, но ни одно из проведенных исследований в этом направлении не увенчалось успехом. Двойная таргет-ная блокада с использованием комбинации лапатиниба с трастузумабом в исследованиях TBCRC006/023 (18,19), и SOLTI-PAMELA [20] позволила достичь полного патомор-фологического регресса опухоли лишь в 28–30% случаев. Еще менее воодушевляющие результаты были получены в исследовании NeoSphere: в когорте пациенток, которым назначалась только таргетная терапия трастузумабом и пертузумабом уровень pCR составил лишь 16,8% [14].
Отдельную популяцию составляют пациентки с люминальным HER2-позитивным РМЖ. Проведение неоадъювантной терапии у этой категории больных заведомо менее эффективно, поэтому активно изучается возможность замены химиотерапии на неоадъювантную гормонотерапию. Назначение ингибиторов ароматазы в комбинации с трастузумабом и пертузумабом (исследование PerELISA) существенно уступает по эффективности комбинации химиотерапии и таргетной терапии, даже у больных с ранним ответом на гормонотерапию (снижение индекса Ki67 на 20% от исходного через 2 недели после приема летрозола): уровень pCR составил лишь 20,5% в группе гормонотерапии по сравнению с 81,3% у пациенток, которые не ответили на гормонотерапию и которым в последующем неоадъювантно вводился паклитаксел [21].
В небольшом пилотном исследовании II фазы NA-PHER2, пациенткам с люминальным HER2-позитивным РМЖ проводилась неоадъювантная гормонотерапия фулвестран-том и палбоциклибом в комбинации с двойной таргетной блокадой трастузумабом и пертузумабом. Первичной конечной точкой стала оценка изменения биологических характеристик опухоли: уровень Ki-67 и процент апоптоза опухолевых клеток через 2 недели после начала гормонотерапии и перед выполнением операции. Вторичные конечные точки — ЧОО и уровень pCR. Полученные результаты можно представить следующим образом: среднее значение Ki-67 через 2 недели после начала гормонотерапии
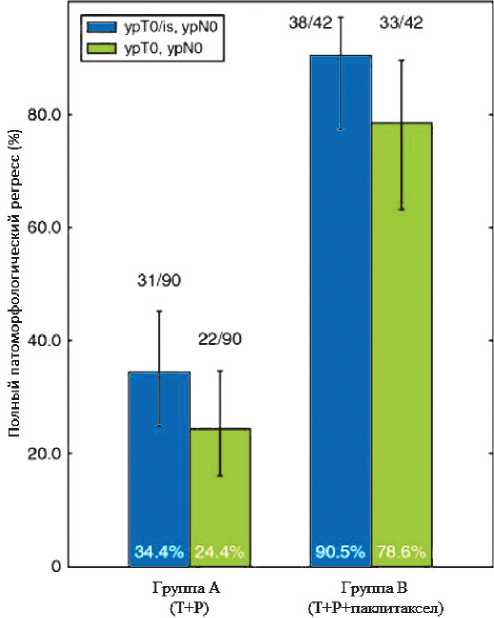
Рисунок 1. Исследование WSG-ADAPT:
Уровень pCR в группе А и В.
снизилось с 31,9% до 4,3%. Частота объективных ответов составила 97%, уровень pCR — 27% [22]. Небольшой размер выборки и отсутствие информации об отдаленных результатах лечения не позволяют делать выводы о значении данного подхода в качестве варианта неоадъювантной терапии у больных с гормон-зависимым HER2-позитив-ным РМЖ, но, однозначно, подобный метод заслуживает дальнейшего изучения.
Попытка отказа от классических цитостатиков в пользу трастузумаб-эмтанзина изучалась в исследовании KRISTINE, результаты которого были опубликованы в 2018 г. В исследуемой группе пациенткам назначалась комбинация пертузумаба с трастузумаб-эмтанзином. В контрольной группе лечение проводилось с использованием стандартного режима ТСНР. Результаты оказались формально негативными: уровень pCR в исследуемой группе был на 11% ниже по сравнению с контрольной группой (44,4% и 55,7%). Что касается безопасности, исследуемый режим показал себя гораздо менее токсичным: частота нежелательных явлений 3–4 степени была зарегистрирована лишь в 13% случаев по сравнению с 64% в контрольной группе, серьезные нежелательные явления были зарегистрированы в 5% и 29% случаев соответственно [23,24]. Таким образом, данный подход можно рассматривать для пациенток, которым в силу возраста или соматического статуса не может быть предложено проведение высокотоксичной неоадъювантной терапии по схеме ТСНР.
В небольшом рандомизированном исследовании 2 фазы WSG-ADAPT (n = 134), окончательные результаты которого были представлены на ASCO в 2021 году, пациенткам с нелюминальным HER2-позитивным РМЖ проводилась неоадъювантная терапия с включением трастузумаба и пертузумаба ± паклитаксел в течение 12 недель перед операцией. После хирургического лечения пациенткам проводилась АХТ согласно национальному стандарту: 4 EC — 12 Р (для группы Т + Р) и трастузумаб до года. Больным с полным патоморфологическим ответом АХТ не проводилась. Следует отметить, что большинство больных, включенных в это исследование, имели Т1–2 стадию заболевания, и только у 57% больных были выявлены метастазы в регионарных лимфоузлах. Первичной конечной точкой в исследовании был уровень pCR (ypT0/is ypN0), который достиг 90,5% в группе, получавшей неоадъю-вантый паклитаксел + Т + Р против 34,4 % в группе пациенток, которым проводилась только таргетная терапия Т + Р (рис. 1). При этом гипотеза о том, что уровень pCR у больных с ранним ответом на таргетную терапию (за который принималось снижение Ki-67 на 40% от исходного уровня) будет сопоставим с группой пациенток, получавших комбинацию паклитаксела с анти-HER2 препаратами, не подтвердилась. Частота полных патоморфологических регрессов составила: 90,5% в группе Т + Р + паклитаксел против 44,7% в группе Т+ Р c ранним ответом против 8,3% в группе Т + Р, не ответившей на таргетную терапию [25]. Пятилетняя безрецидивная выживаемость составила 98% и 87% в пользу пациентов, получавших химиотаргетную те-
После 2 циклов
После 6 или 8 циклов
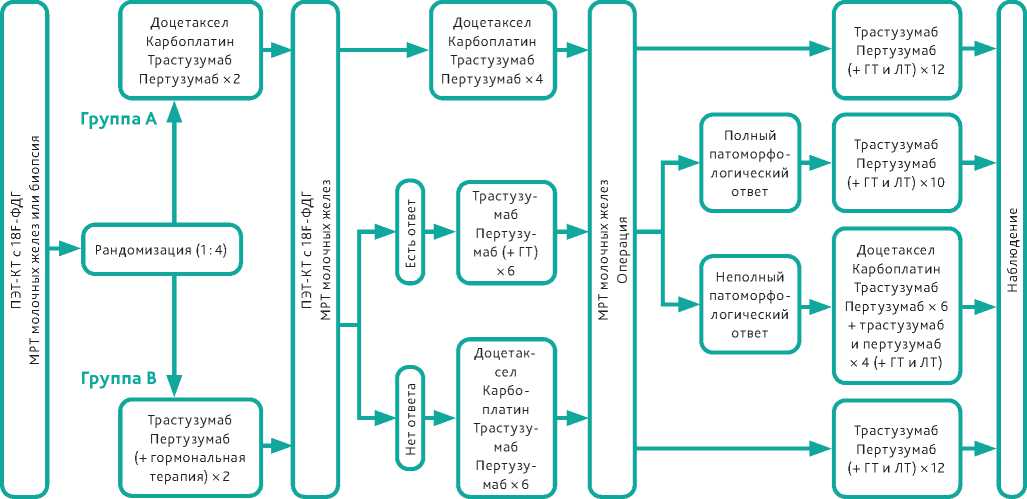
Рисунок 2. Дизайн исследования PHERGain.
рапию (HR = 0,32). Достижение pCR коррелировало с улучшением показателей БРВ вне зависимости от схемы лечения, которую получали пациентки (98% против 82%) [26]. Однозначно, частота полных патоморфологических регрессов выглядит несколько завышенной для обеих групп, что, вероятно, связано как с небольшим размером выборки, так и включением в работу пациенток только с нелюминальным подтипом РМЖ, поэтому эти результаты нуждаются в проверке в более крупных исследованиях 3 фазы, которые сейчас ведутся (COMPASS и DECRESCENDO). Однако, уже сейчас создается впечатление, что для пациенток с локализованным опухолевым процессом вполне может оказаться достаточным проведение де-эскалированного варианта химиотерапии в комбинации с двойной таргет-ной блокадой трастузумабом и пертузумабом.
Наиболее интересный вариант де-эскалации неоадъю-ватной терапии с учетом метаболического ответа опухоли на проведенное лекарственное лечение представлен европейскими учёными в 2021 году. В рандомизированное исследование PHERGain [27] включались пациентки с люминальным и нелюминальным HER2-позитивным РМЖ с I– IIIA стадией заболевания (размер опухоли > 1,5 см, рис. 2).
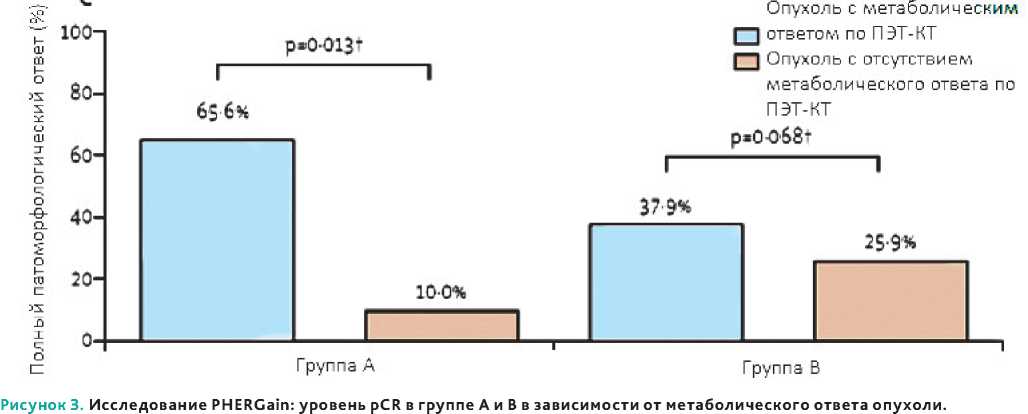
Перед началом лечения и после 2 циклов терапии пациенткам выполнялась ПЭТ-КТ с 18F-ФДГ. В группе А больным проводилось 6 курсов стандартной НАХТ по схеме TCHP вне зависимости от результатов ПЭТ-КТ. В группе В после 2 циклов таргетной терапии по схеме трастузумаб + пертузумаб (плюс гормонотерапия ингибиторами ароматазы или тамоксифеном для люминального подтипа) дальнейшая тактики лечения определялась метаболическим ответом опухоли по данным ПЭТ-КТ. Пациенткам, ответившим на терапию (снижение SUV на 40% и более во всех таргетных очагах), проводилось ещё 6 курсов лечения по прежней схеме. Больным без метаболического ответа назначалась НАХТ по схеме TCHP (также 6 циклов). Операция выполнялась через 2–6 недель после введения последней дозы лекарственных препаратов. Первичными конечными точками в исследовании стали уровень pCR у больных с метаболическим ответом в группе В и 3-летняя БРВ в группе В. С 2017 по 2019 годы 71 пациентка была рандомизирована в группу А и 285 пациенток — в группу В. В группе В в 80% случаев был зарегистрирован метаболический ответ опухоли после 2 циклов таргетной терапии. В этой популяции больных частота pCR в последующем достигла 37,9 %. В этой же группе у пациенток без метаболического ответа, которым в последующем проводилась химиотерапия, уровень pCR составил лишь 25,9%. Для сравнения, в группе А у пациенток с метаболическим ответом опухоли (86% больных) уровень pCR составил 65,6% против 10% у больных без метаболического ответа (рис. 3). В связи с незначительной медианой наблюдения отдаленные результаты лечения пока не известны. Что касается токсичности, однозначное преимущество получили пациентки из группы В: отказ от введения цитостатиков у части из них позволил существенно снизить частоту развития гематологических нежелательных явлений: нейтропения 3–4 степени снизилась с 24% до 4%, фебрильная нейтропения — с 21 % до 4%. Таким образом, авторы делают заключение о том, что после получения результатов по БРВ, подобная стратегия оценки раннего ответа опухоли на проведенное лечение позволит выделить категорию больных с ранними стадиями HER2-позитивного РМЖ, не нуждающихся в назначении химиотерапии.
В заключение можно сказать, что на сегодняшний день не вызывает сомнений необходимость проведения неоадъювантной терапии у больных с HER2-позитивным раком молочной железы, начиная с самых ранних стадий заболевания. Однако общепринятые режимы химиотерапии в комбинации с таргетной терапией сложно назвать оптимальными в виду их неудовлетворительной переносимости. Очевидно, что существует определенная категория пациенток, не нуждающаяся в назначении столь токсичных схем химиотерапии. Поэтому дальнейшие исследования возможностей по де-эскалации неоадъювантной терапии у больных с HER2-позитивным РМЖ представляют перспективное направление для изучения, важность которого сложно переоценить.
Список сокращений
HR — Отношение рисков
FEC — эпирубицин 75–100 мг/м 2 + циклофосфамид 500– 600 мг/м 2 + 5-фторурацил 500 мг/м 2
FECHP — эпирубицин 75–100 мг / м 2 + циклофосфамид 500 мг/м 2 + 5-фторурацил 500 мг/м 2 + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) + пертузумаб 420 мг (нагрузочная доза 840 мг)
THP — доцетаксел 75 мг/м 2 + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) + пертузумаб 420 мг (нагрузочная доза 840 мг)
ТСНР — доцетаксел 75 мг/м 2 + карбоплатин AUC6 + трастузумаб 6 мг/кг (нагрузочная доза 8 мг/кг) + пертузумаб 420 мг (нагрузочная доза 840 мг).
Список литературы Возможности де-эскалации неоадъювантной терапии у больных с Her2-позитивным раком молочной железы
- Состояние онкологической помощи населению России в 2021 г, под редакцией А. Д. Каприна, В. В. Старинского, А. О. Шахзадовой. Москва 2022 г, с. 23-25.
- Cronin KA, Harlan LC, Dodd KW, Abrams JS, Ballard-Barbash R. Population-based estimate of the prevalence of HER-2 positive breast cancer tumors for early stage patients in the US. Cancer Invest. 2010 Nov ; 28 (9) : 963-8. https://doi.org/10.3109/07357907.2010.496759. PMID: 20690807 ; PMCID: PMC5094051.
- Slamon, D. J. ; Clark, G. M. ; Wong, S. G. ; Levin, W. J. ; Ullrich, A. ; McGuire, W. L. Human breast cancer : Correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987, 235, 177-182.
- Slamon, D. J. ; Leyland-Jones, B. ; Shak, S. ; Fuchs, H. ; Paton, V. ; Bajamonde, A. ; Fleming, T. ; Eiermann, W. ; Wolter, J. ; Pegram, M. ; et al. Use of Chemotherapy plus a Monoclonal Antibody against HER2 for Metastatic Breast Cancer That Overexpresses HER2. New Engl. J. Med. 2001, 344, 783-792.
- Клинические рекомендации «Рак молочной железы» Общероссийский национальный союз «Ассоциация онкологов России» • Общероссийская общественная организация «Российское общество клинической онкологии» • Общероссийская общественная организация «Российское общество онкомаммологов», 2021 г.
- Тюляндин С. А., Жукова Л. Г., Королева И. А., Пароконная А. А., Семиглазова Т. Ю., Стенина М. Б. и соавт. Практические рекомендации по лекарственному лечению рака молочной железы. Злокачественные опухоли : Практические рекомендации RUSSCO #3s2, 2021 (том 11). 09.
- Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer : the CTNeoBC pooled analysis [published correction appears in Lancet. 2019 Mar 9 ; 393 (10175) : 986]. Lancet. 2014 ; 384 (9938) : 164-172. https://doi.org/10.1016/S0140-6736(13)62422-8.
- von Minckwitz G, Untch M, Blohmer JU, et al. Definition and impact of pathologic complete response on prognosis after neoadjuvant chemotherapy in various intrinsic breast cancer subtypes. J Clin Oncol. 2012 ; 30 (15) : 1796-1804. https://doi.org/10.1200/JCO. 2011.38.8595.
- Untch M, Fasching PA, Konecny GE, et al. Pathologic complete response after neoadjuvant chemotherapy plus trastuzumab predicts favorable survival in human epidermal growth factor receptor 2-overexpressing breast cancer : results from the TECHNO trial of the AGO and GBG study groups. J Clin Oncol. 2011 ; 29 (25) : 3351-3357. https://doi.org/10.1200/ JCO.2010.31.4930.
- Broglio KR, Quintana M, Foster M, et al. Association of Pathologic Complete Response to Neoadjuvant Therapy in HER2-Positive Breast Cancer With Long-Term Outcomes : A Meta-Analysis. JAMA Oncol. 2016 ; 2 (6) : 751-760. https://doi.org/10.1001/jamaoncol. 2015.6113.
- von Minckwitz G, Huang CS, Mano MS, et al. Trastuzumab Emtansine for Residual Invasive HER2-Positive Breast Cancer. N Engl J Med. 2019 ; 380 (7) : 617-628. https://doi.org/10.1056/NEJMoa1814017.
- Gianni L, Eiermann W, Semiglazov V, et al. Neoadjuvant and adjuvant trastuzumab in patients with HER2-positive locally advanced breast cancer (NOAH) : follow-up of a randomised controlled superiority trial with a parallel HER2-negative cohort [published correction appears in Lancet Oncol. 2018 Dec ; 19 (12) : e667]. Lancet Oncol. 2014 ; 15 (6) : 640-647. https://doi.org/10.1016/S1470-2045(14)70080-4.
- Cortazar P, Zhang L, Untch M, et al. Pathological complete response and long-term clinical benefit in breast cancer : the CTNeoBC pooled analysis [published correction appears in Lancet. 2019 Mar 9 ; 393 (10175) : 986]. Lancet. 2014 ; 384 (9938) : 164-172. https://doi.org/10.1016/S0140-6736(13)62422-8.
- Gianni L, Pienkowski T, Im YH, et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere) : a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 ; 13 (1) : 25-32. https://doi.org/10.1016/S1470-2045(11)70336-9.
- Untch M, Jackisch C, Schneeweiss A, et al. NAB-Paclitaxel Improves Disease-Free Survival in Early Breast Cancer : GBG 69-GeparSepto. J Clin Oncol. 2019 ; 37 (25) : 2226-2234. https://doi.org/10.1200/JCO. 18.01842.
- Schneeweiss A, Chia S, Hickish T, et al. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer : a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 2013 ; 24 (9) : 2278-2284. https://doi.org/10.1093/ annonc/mdt182.
- van Ramshorst MS, van der Voort A, van Werkhoven ED, et al. Neoadjuvant chemotherapy with or without anthracyclines in the presence of dual HER2 blockade for HER2-positive breast cancer (TRAIN-2) : a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2018 ; 19 (12) : 1630-1640. https://doi.org/10.1016/S1470-2045(18)30570-9.
- Rimawi MF, Mayer IA, Forero A, et al. Multicenter phase II study of neoadjuvant lapatinib and trastuzumab with hormonal therapy and without chemotherapy in patients with human epidermal growth factor receptor 2-overexpressing breast cancer : TBCRC 006. J Clin Oncol. 2013 ; 31 (14) : 1726-1731. https://doi.org/10.1200/JCO. 2012.44.8027.
- Rimawi MF, Niravath P, Wang T, Rexer BN, Forero A, et al. ; Translational Breast Cancer Research Consortium. TBCRC023 : A Randomized Phase II Neoadjuvant Trial of Lapatinib Plus Trastuzumab Without Chemotherapy for 12 versus 24 Weeks in Patients with HER2-Positive Breast Cancer. Clin Cancer Res. 2020 Feb 15 ; 26 (4) : 821-827. https://doi.org/10.1158/1078-0432.CCR-19-0851. Epub 2019 Oct 29. PMID: 31662331.
- Llombart-Cussac A, Cortés J, Paré L, Galván P, Bermejo B, Martínez N, Vidal M, Pernas S, López R, Muñoz M, Nuciforo P, Morales S, Oliveira M, de la Peña L, Peláez A, Prat A. HER2-enriched subtype as a predictor of pathological complete response following trastuzumab and lapatinib without chemotherapy in early-stage HER2-positive breast cancer (PAMELA) : an open-label, single-group, multicentre, phase 2 trial. Lancet Oncol. 2017 Apr ; 18 (4) : 545-554. https://doi.org/10.1016/S1470-2045(17)30021-9. Epub 2017 Feb 24. PMID: 28238593.
- Guarneri V, Dieci MV, Bisagni G, et al. De-escalated therapy for HR + / HER2 + breast cancer patients with Ki67 response after 2-week letrozole : results of the PerELISA neoadjuvant study. Ann Oncol. 2019 ; 30 (6) : 921-926. https://doi.org/10.1093/annonc/mdz055.
- Gianni L, Bisagni G, Colleoni M, Del Mastro L, Zamagni C, Mansutti M, Zambetti M, Frassoldati A, De Fato R, Valagussa P, Viale G. Neoadjuvant treatment with trastuzumab and pertuzumab plus palbociclib and fulvestrant in HER2-positive, ER-positive breast cancer (NA-PHER2) : an exploratory, open-label, phase 2 study. Lancet Oncol. 2018 Feb ; 19 (2) : 249-256. https://doi.org/10.1016/S1470-2045(18)30001-9. Epub 2018 Jan 8. PMID: 29326029.
- Hurvitz SA, Martin M, Symmans WF, et al. Neoadjuvant trastuzumab, pertuzumab, and chemotherapy versus trastuzumab emtansine plus pertuzumab in patients with HER2-positive breast cancer (KRISTINE) : a randomised, open-label, multicentre, phase 3 trial. Lancet Oncol. 2018 ; 19 (1) : 115-126. https://doi.org/10.1016/S1470-2045(17) 30716-7.
- Hurvitz SA, Martin M, Jung KH, et al. Neoadjuvant Trastuzumab Emtansine and Pertuzumab in Human Epidermal Growth Factor Receptor 2-Positive Breast Cancer : Three-Year Outcomes From the Phase III KRISTINE Study. J Clin Oncol. 2019 ; 37 (25) : 2206-2216. https://doi.org/10.1200/JCO. 19.00882.
- Nitz UA, Gluz O, Christgen M, et al. De-escalation strategies in HER2-positive early breast cancer (EBC) : final analysis of the WSG-ADAPT HER2 +/HR- phase II trial : efficacy, safety, and predictive markers for 12 weeks of neoadjuvant dual blockade with trastuzumab and pertuzumab ± weekly paclitaxel [published correction appears in Ann Oncol. 2022 Mar ; 33 (3) : 355]. Ann Oncol. 2017 ; 28 (11) : 2768-2772. https://doi.org/10.1093/annonc/mdx494.
- Nitz U, Gluz O, Graeser M, et al. De-escalated neoadjuvant pertuzumab plus trastuzumab therapy with or without weekly paclitaxel in HER2-positive, hormone receptor-negative, early breast cancer (WSG-ADAPT-HER2 + / HR-) : survival outcomes from a multicentre, open-label, randomised, phase 2 trial. Lancet Oncol. 2022 ; 23 (5) : 625-635. https://doi.org/10.1016/S1470-2045(22)00159-0.
- Pérez-García JM, Gebhart G, Ruiz Borrego M, et al. Chemotherapy de-escalation using an 18F-FDG-PET-based pathological response-adapted strategy in patients with HER2-positive early breast cancer (PHERGain) : a multicentre, randomised, open-label, non-comparative, phase 2 trial. Lancet Oncol. 2021 ; 22 (6) : 858-871. https://doi.org/10.1016/S1470- 2045 (21) 00122-4.


