Возможности диффузионно-взвешенных изображений в дифференциальной диагностике злокачественной и доброкачественной медиастинальной лимфаденопатии
Автор: Sudarkina Anna V., Dergilev Alexandr P., Gorbunov Nikolay A., Kozlov Vadim V., Fokina Yulia A., Klimova Irina P., Yagubkin Pavel A.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Введение. Медиастинальная лимфаденопатия может быть обусловлена широким спектром доброкачественных и злокачественных заболеваний. Определение характера лимфаденопатии играет ключевую роль в выборе тактики лечения и оценке прогноза заболевания. Цель исследования - изучить возможности диффузионно-взвешенных изображений (ДВИ) с оценкой измеряемого коэффициента диффузии (ИКД) в дифференциальной диагностике злокачественных и доброкачественных форм медиастинальной лимфаденопатии. Материал и методы. В исследование включено 48 пациентов с наличием как минимум одного увеличенного медиастинального лимфоузла по результатам компьютерной томографии. Исследование проводилось на магнитно-резонансном томографе с напряженностью поля 1,5 Тл с получением традиционных изображений и синхронизированных с дыханием ДВИ. У каждого пациента выбирался один из наиболее крупных солидных лимфоузлов, в котором оценивалось среднее значение ИКД. Значения ИКД сравнивались с результатами гистологического исследования (у 41 пациента), комплексного клинико-лучевого обследования и динамического наблюдения. Для статистической обработки результатов исследования использовались t-критерий Стьюдента, U-критерий Манна - Уитни, ROC-анализ. результаты. У 27 пациентов установлено злокачественное поражение лимфоузлов (метастазы, лимфома), у 21 - доброкачественные изменения (саркоидоз, реактивная гиперплазия, туберкулез).
Диффузионно-взвешенные изображения, дви, измеряемый коэффициент диффузии, икд, медиастинальная лимфаденопатия
Короткий адрес: https://sciup.org/140254442
IDR: 140254442 | УДК: 616.428-079.4 | DOI: 10.21294/1814-4861-2020-19-4-33-40
Текст научной статьи Возможности диффузионно-взвешенных изображений в дифференциальной диагностике злокачественной и доброкачественной медиастинальной лимфаденопатии
Медиастинальная лимфаденопатия (МЛАП) может быть выявлена при широком спектре заболеваний, включая воспалительные и опухолевые процессы. Частота случайно выявленной МЛАП составляет 0,15–8,1 % [1–3]. Наиболее частыми доброкачественными причинами увеличения лимфатических узлов (ЛУ) средостения являются гранулематозное воспаление (саркоидоз, туберкулез) и реактивная гиперплазия [1–5]. Злокачественными процессами, вовлекающими медиастинальные лимфоузлы, являются лимфома и метастатическое поражение [1–4]. Определение характера МЛАП играет решающую роль в формировании тактики лечения и оценке прогноза заболевания.
Наиболее распространенным методом визуализации медиастинальных ЛУ является компьютерная томография (КТ), при которой патологически измененными считаются лимфоузлы, превышающие 1 см по наименьшему диаметру. Вероятность зло- качественного поражения ЛУ возрастает с увеличением размера, однако широко варьирует, по данным разных авторов, составляя 9–42 % для ЛУ диаметром 1–1,5 см, 19–75 % – для ЛУ диаметром 1,62 см и 27–100 % при диаметре ЛУ>2 см [6]. Таким образом, размерный критерий не является надежным в определении характера изменений.
Методы ядерной медицины (позитронная эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография) в визуализации злокачественного поражения лимфоузлов характеризуются высокой чувствительностью, но низкой специфичностью вследствие повышенного метаболизма с гиперфиксацией радиофармпрепарата как при опухолевых, так и при воспалительных и гранулематозных процессах [2, 3, 7–11]. Магнитно-резонансная томография (МРТ) с получением диффузионно-взвешенных изображений (ДВИ) позволяет количественно оценивать диффузию молекул воды в биологиче- ских тканях in vivo. Злокачественные процессы характеризуются повышением сигнала от опухолевых очагов на ДВИ с высоким b-фактором по сравнению с фоновыми тканями. В ряде исследований показаны отличия вычисляемого по ДВИ измеряемого коэффициента диффузии (ИКД) при доброкачественных и злокачественных процессах в различных органах с более низкими значениями ИКД при злокачественных опухолях (за счет ограничения диффузии в опухолевой ткани вследствие высокой пролиферативной активности клеток с сужением межклеточных пространств, увеличения ядерно-цитоплазматического отношения, накопления макромолекул с повышением вязкости жидких сред) по сравнению с доброкачественными процессами [12–15].
Цель исследования – изучение возможностей ДВИ с анализом ИКД в дифференциальной диагностике злокачественной и доброкачественной МЛАП.
Материал и методы
В исследование включено 48 пациентов (33 мужчины, 15 женщин) в возрасте от 28 до 79 лет (средний возраст – 58 ± 14 лет). Критериями включения являлись наличие увеличенных лимфоузлов по результатам КТ, отсутствие предшествующей химиотерапии либо лучевой терапии при уже верифицированном опухолевом процессе. МРТ проводилась на высокопольном томографе с индукцией магнитного поля 1,5 Тл, в протокол исследования включены традиционные Т1-, Т2-взвешенные изображения, изображения в режиме TIRM (Turbo Inversion-Recovery Magnitude) и ДВИ. Получение ДВИ осуществлялось в аксиальной плоскости при синхронизации сбора данных с ритмом дыхания с использованием диафрагмального триггера. Основные параметры ДВИ: время повторения – 2400–6500 мс (автоматически регулировалось аппаратом в зависимости от частоты дыхания пациента), время эхо – 88 мс, поле обзора – 300×380 мм, матрица – 192×154, толщина среза – 6 мм, число усреднений – 2, количество b-факторов диффузионной взвешенности – 2 (50, 900 с/мм2), методика подавления сигнала от жира – SPAIR (SPectral Attenuated Inversion Recovery). Использована опция параллельного сканирования с фактором ускорения 2 в направлении фазового кодирования.
При анализе изображений у каждого пациента определялся наиболее крупный из свободно лежащих ЛУ без признаков некроза в структуре. На ДВИ с b=50 выбирался срез с наибольшей площадью лимфоузла, на котором задавалась область интереса произвольной формы, максимально охватывающая лимфоузел с исключением краев во избежание эффекта частичного объема. Затем область интереса копировалась на ИКД-карту, автоматически рассчитываемую аппаратом на основе
ДВИ с разными b-факторами, для оценки среднего значения ИКД в лимфоузле.
Верификация генеза МЛАП осуществлялась на основании гистологического исследования у 41 пациента, по данным комплексного клиниколучевого обследования и динамического наблюдения без морфологического подтверждения – у 7 пациентов.
Статистическая обработка результатов проводилась с использованием программы MedCalc. Оценка нормальности распределения количественных данных (возраст пациентов, размер ЛУ, значения ИКД) в доброкачественной и злокачественной группах осуществлялась с помощью критерия Шапиро – Уилка, для сравнения групп по количественным признакам в зависимости от характера распределения данных использовались t-критерий Стьюдента либо U-критерий Манна – Уитни. Для оценки диагностической эффективности ДВИ проводился ROC-анализ.
Результаты и обсуждение
На основании результатов гистологического исследования в 27 случаях установлен злокачественный характер поражения лимфоузлов, из них метастазы рака легкого выявлены у 19 больных (плоскоклеточный рак – 11, аденокарцинома – 4, мелкоклеточный рак – 3, крупноклеточный рак – 1), метастазы мезотелиомы плевры – у 1, метастазы рака молочной железы – у 1, лимфома – у 6 больных (лимфома Ходжкина – 4, неходжкинская лимфома – 2). Доброкачественный характер МЛАП гистологически верифицирован у 14 пациентов: саркоидоз – в 11, реактивная гиперплазия – в 3 случаях. У пациента с пневмонией на основании клинико-лабораторных данных и регресса изменений при проведении контрольной КТ установлена реактивная гиперплазия лимфоузла. У 4 пациентов (1 – со склеродермией, 2 – с хронической обструктивной болезнью легких, 1 – с ревматоидным артритом и хронической сердечной недостаточностью) предположен реактивный характер изменений лимфоузлов на основании отсутствия динамики при ретроспективном анализе архива КТ-изображений за 3–4 года, отсутствия онкологических заболеваний в анамнезе и по данным 12-летнего последующего наблюдения. У 2 пациентов с туберкулезом легких, подтвержденным клинико-лабораторными данными, также предположен доброкачественный характер МЛАП.
Средний возраст пациентов со злокачественной МЛАП составил 62 ± 9,9 года, с доброкачественной МЛАП – 52,3 ± 16,9 года; различия статистически значимы (р=0,0165). Средний размер (измеренный по короткой оси) исследованных лимфоузлов со злокачественными и доброкачественными изменениями составил 23 ± 10,2 мм и 15,4 ± 4,2 мм соответственно (р=0,0004). Среднее значение
ИКД при злокачественной МЛАП составило 1,02 ± 0,29×10-3мм2/с (минимальное – 0,63; максимальное – 1,64), при доброкачественной МЛАП – 1,57 ± 0,32×10-3мм2/с (минимальное – 0,84; максимальное – 2,11); различия ИКД при злокачественной и доброкачественной МЛАП статистически значимы (р<0,0001) (рис. 1). При проведении ROC-анализа установлено пороговое значение ИКД, составившее ≤1,3×10-3 мм2/с (95 % ДИ 1,06–1,64), позволяющее выявлять злокачественное поражение лимфоузлов с чувствительностью, равной 81,5 %, и специфичностью – 85,7 %; площадь под кривой составила 0,89 (95 % ДИ 0,77–0,96), р<0,0001 (рис. 2). Лимфоузлы при злокачественной МЛАП в большинстве случаев характеризовались высоким сигналом на ДВИ и низким сигналом на ИКД-картах (рис. 3, 4), в то время как при доброкачественных изменениях ДУ не дифференцировались на ДВИ и имели высокий сигнал на ИКД-картах (рис. 5, 6).
Проведенное исследование показало высокую информативность ДВИ с оценкой ИКД лимфоузлов в дифференциальной диагностике МЛАП. В ряде аналогичных исследований также показаны значимые отличия ИКД при доброкачественных и злокачественных формах МЛАП [16–18]. Средние значения ИКД при злокачественной и доброкачественной МЛАП, по данным A.A. Razek et al., составили у взрослых 1,06 ± 0,3×10-3 мм2/с и 2,39 ± 0,7×10-3 мм2/с [16], у детей – 0,99 ± 0,18×10-3 мм2/с и 1,35 ± 0,26×10-3 мм2/с соответственно [17]. Эти же показатели в исследовании F.E. Ustabasioglu et al. составили 1,03 ± 0,25×10-3мм2/с и 1,57 ± 0,56×10-3мм2/с [18]. Такой разброс значений ИКД при доброкачественной МЛАП в разных исследованиях может быть обусловлен разнородностью обследованных, различиями используемых параметров сканирования и способов сбора данных при получении ДВИ.
При использовании определенного в нашем исследовании оптимального порогового значения ИКД (≤1,3×10-3 мм2/с) для диагностики злокачественной МЛАП в 5 случаях получены ложноотрицательные результаты – ИКД находился выше порогового значения у 2 пациентов с лимфомой Ходжкина (1,46–1,5×10-3 мм2/с) и у 3 пациентов с метастазами аденокарциномы легкого (1,42–1,64×10-3 мм2/с), при этом средние значения ИКД при лимфомах и метастатическом поражении составили 1,1 ± 0,32×10-3 мм2/с и 1 ± 0,29×10-3 мм2/с соответственно и значимо не отличались (p=0,52), как и в исследованиях других авторов [16–19]. В работах других авторов также описываются ложноотрицательные результаты при метастазах мукоэпидермоидного рака с ИКД 1,61×10-3 мм2/с [16] и у пациентов с метастазами аденокарциномы легкого со значениями ИКД 1,8 ± 0,67×10-3мм2/с [19], что, возможно, обусловлено высокой степенью дифференцировки и
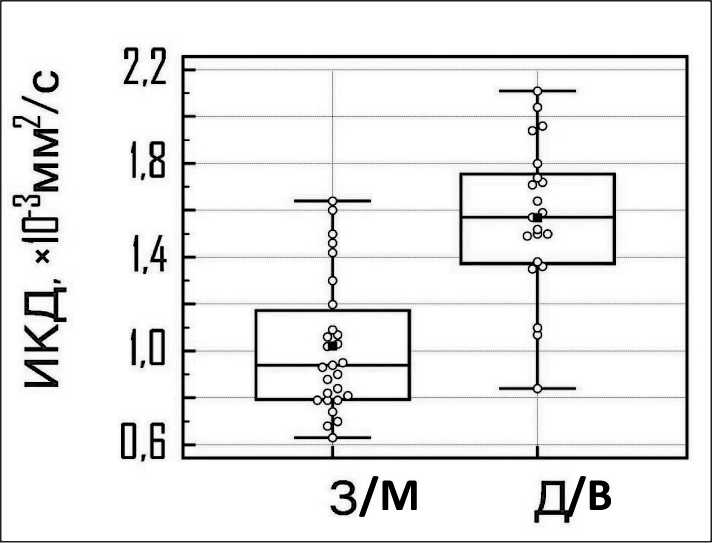
Рис. 1. Диаграмма размаха значений ИКД при злокачественной (З) и доброкачественной (Д) МЛАП. Среднее значение ИКД при злокачественной МЛАП значимо ниже, чем при доброкачественной (p<0,0001)
Fig. 1. Box and whisker plot of ADC values in malignant (M) and benign (B) lymphadenopathy. The mean ADC value in malignant lymphadenopathy is significantly lower than that of benign lymphadenopathy (p<0.0001)
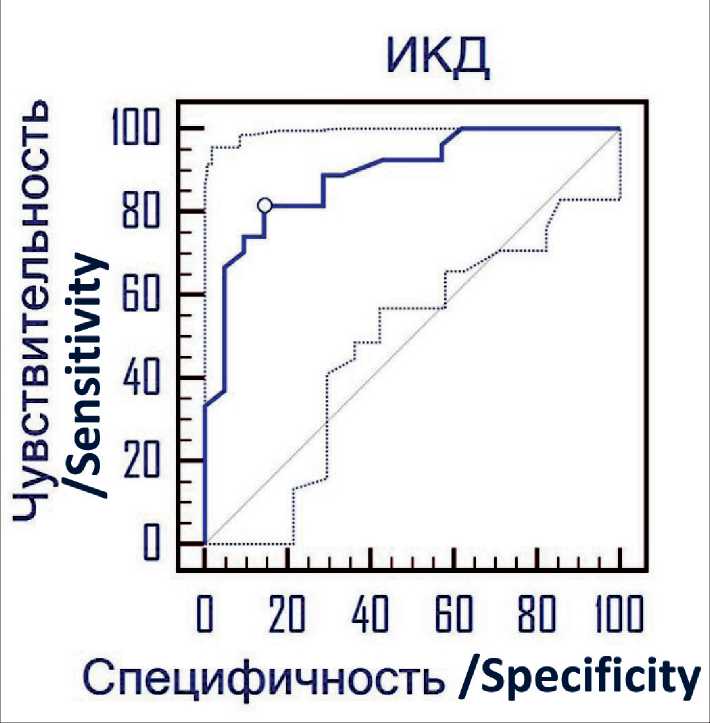
Рис. 2. ROC-кривая значений ИКД всех ЛУ при доброкачественной и злокачественной МЛАП. Пороговое значение ИКД для выявления злокачественной МЛАП ≤1,3×10-3 мм2/с, площадь под кривой – 0,89
Fig. 2. ROC-curve of ADC values of all benign and malignant lymph nodes. Cut-off value of ADC for detection of malignancy ≤1.3×10-3mm2/s, AUC – 0.89
низкой пролиферативной активностью опухоли [14].
В исследовании M. Sun et al. по результатам ДВИ всего тела у 74 пациентов с лимфомой значения ИКД целевых очагов варьировали в диапазоне 0,32–2,20×10-3 мм2/с (однако не освещены значения ИКД медиастинальных ЛУ). Также авторами от-
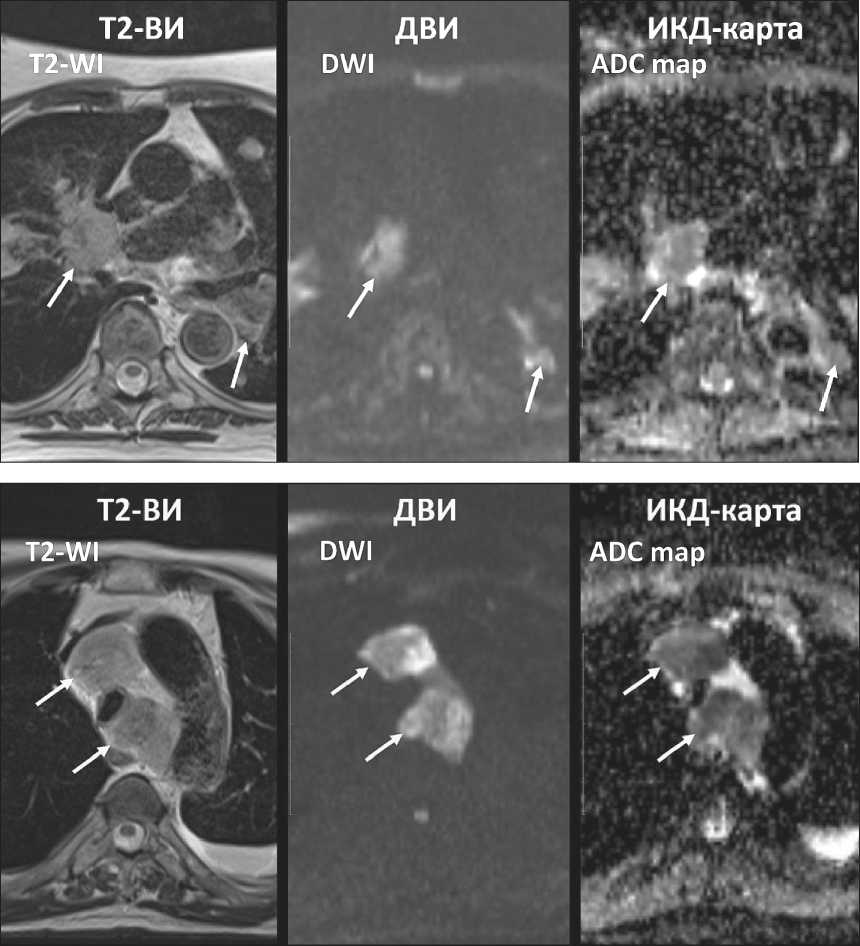
Рис. 3. МР-томограммы средостения пациента с неходжкинской лимфомой с поражением легких и медиастинальных лимфоузлов. ЛУ (обозначены стрелками) имеют высокий сигнал на ДВИ и низкий сигнал на ИКД-карте вследствие ограничения диффузии, ИКД – 1,02×10-3 мм2/с
-
Fig. 3. MR images of mediastinum in a patient with non-Hodgkin’s lymphoma affecting lungs and mediastinal lymph nodes. Lymph nodes (arrows) have bright signal on DWI and dark signal on ADC map due to diffusion restriction, ADC – 1.02×10-3 mm2/s
Рис. 4. МР-томограммы средостения пациента с метастазами мелкоклеточного рака легкого в медиастинальные лимфоузлы. ЛУ (обозначены стрелками) имеют высокий сигнал на ДВИ и низкий сигнал на ИКД-карте вследствие ограничения диффузии, ИКД – 0,84×10-3 мм2/с
-
Fig. 4. MR images of mediastinum in a patient with metastases of small-cell lung cancer in mediastinal lymph nodes. Lymph nodes (arrows) have bright signal on DWI and dark signal on ADC map due to diffusion restriction, ADC – 0.84×10-3 mm2/s
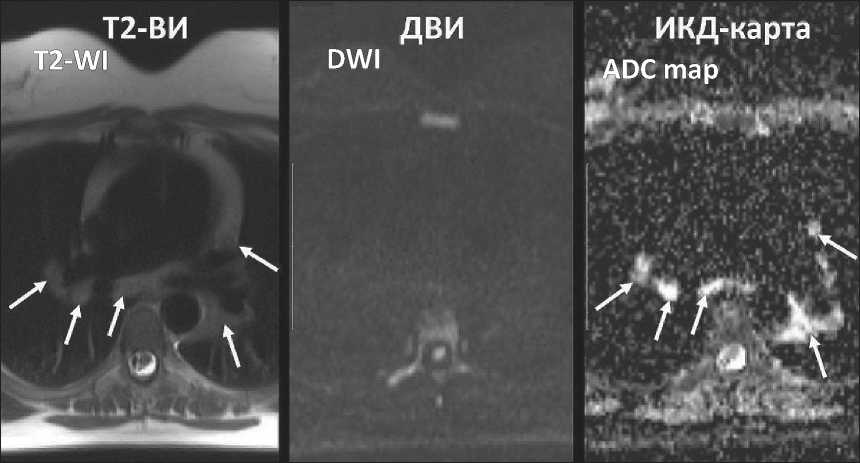
Рис. 5. МР-томограммы средостения пациента с саркоидозом I ст. ЛУ (обозначены стрелками) не визуализируются на ДВИ и имеют высокий сигнал на
ИКД-карте, ИКД – 1,57×10-3мм2/с Fig. 5. MR images of mediastinum in a patient with sarcoidosis, stage I. Lymph nodes (arrows) are not visualized on DWI and have bright signal on ADC map, ADC – 1.57×10-3mm2/s
мечена обратная корреляция ИКД и Ki67 при лимфоме, таким образом, высокий ИКД характерен для опухолей с низкой пролиферативной активностью [20]. Это может объяснить полученные нами высокие значения ИКД у 2 пациентов с лимфомой, кроме того, у пациента с лимфомой Ходжкина I стадии с наибольшим ИКД в группе пациентов с лимфомой наблюдалась полная ремиссия с без-рецидивным периодом 3 года.
В 3 случаях нами получены ложноположительные результаты. У пациентки с саркоидозом (длительность заболевания 8 лет без какого-либо лечения) ИКД составил 1,1×10-3 мм2/с. При этом оцениваемый ЛУ характеризовался менее выраженным по сравнению со злокачественными процессами повышением сигнала на ДВИ с высоким b-фактором, а низкий ИКД в данном случае, вероятно, обусловлен формированием фиброза на
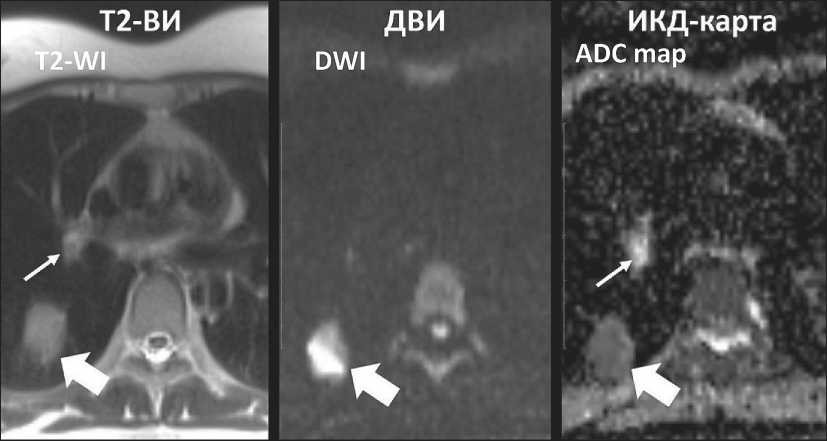
Рис. 6. МР-томограммы средостения пациентки с метастазом плоскоклеточного рака шейки матки в правое легкое и реактивной гиперплазией бронхопульмонального лимфоузла. ЛУ в корне правого легкого (обозначен стрелкой) не визуализируется на ДВИ и имеет высокий сигнал на ИКД-карте, гистологически верифицирована реактивная гиперплазия, ИКД – 1,72×10-3 мм2/с. Метастаз в легком (обозначен жирной стрелкой) имеет высокий сигнал на ДВИ и низкий сигнал на ИКД-карте вследствие ограничения диффузии, ИКД – 0,86×10-3 мм2/с
Fig. 6. MR images of mediastinum in a patient with metastasis of squamous cell carcinoma of uterine cervix in right lung and reactive hyperplasia of hilar lymph node. Right hilar lymph node (arrow) is not visualized on DWI and has bright signal on ADC map, reactive hyperplasia is histologically confirmed, ADC – 1.72×10-3 mm2/s. Metastasis in the lung (bold arrow) has bright signal on DWI and dark signal on ADC map due to diffusion restriction, ADC – 0.86×10-3 mm2/s
фоне длительного течения заболевания. У остальных 10 пациентов с саркоидозом, включенных в исследование в период манифестации заболевания, значения ИКД находились в диапазоне от 1,35 до 2,04×10-3 мм2/с; среднее значение ИКД при саркоидозе составило 1,53 ± 0,25×10-3 мм2/с.
Второй ложноположительный результат отмечался у пациента с туберкулезом (ИКД 1,07×10-3 мм2/с), при этом у второго из включенных в исследование пациентов с туберкулезом ИКД соответствовал доброкачественному процессу (1,49×10-3 мм2/с). У третьего пациента с ложноположительным результатом при реактивной гиперплазии лимфоузла на фоне воспалительной псевдоопухоли легкого ИКД в лимфоузле составил 0,84×10-3 мм2/с. У остальных 7 пациентов с реактивной гиперплазией лимфоузлов ИКД находился в диапазоне от 1,5 до 2,11×10-3 мм2/с, средний ИКД при реактивной гиперплазии составил 1,69 ± 0,39×10-3 мм2/с.
Исследование показало значимые отличия ИКД при лимфоме и саркоидозе (р=0,007), на что также указывают другие авторы [16, 19]. Поскольку ПЭТ не позволяет дифференцировать лимфому и активный саркоидоз ввиду повышенного метаболизма глюкозы при обоих состояниях [8–11, 21], можно предположить перспективность использования ДВИ для дифференциальной диагностики этих заболеваний.
Исследование имело ряд недостатков. Во-первых, в исследование вошло ограниченное ко- личество нозологий. Во-вторых, измерение ИКД проводилось в наиболее крупных ЛУ, поскольку вероятность вовлечения их в патологический процесс максимальна, при этом оцененные лимфоузлы не во всех случаях являлись целевыми при заборе материала для морфологической верификации. Кроме того, в нашем исследовании не проводилось прямое сопоставление с ПЭТ, что позволило бы сравнить диагностические возможности ДВИ и ПЭТ при МЛАП. Несмотря на перечисленные недостатки, результаты исследования показывают, что ДВИ с оценкой ИКД могут быть использованы в качестве дополнительного метода дифференциальной диагностики при МЛАП.
Заключение
ДВИ являются перспективным методом неинвазивной дифференциальной диагностики лимфаденопатии средостения, не требующим проведения внутривенного контрастирования и не связанным с воздействием ионизирующего излучения. Для уточнения возможностей метода целесообразно расширение группы обследуемых за счет увеличения числа нозологий, более детальное изучение подгрупп пациентов с диагностическими ошибками (в первую очередь при туберкулезе и метастазах аденокарциномы), а также оценка ИКД в неувеличенных лимфоузлах для ранней диагностики злокачественного процесса.
Список литературы Возможности диффузионно-взвешенных изображений в дифференциальной диагностике злокачественной и доброкачественной медиастинальной лимфаденопатии
- Потанин А.В., Визель И.Ю., Потанин В.П., Визель А.А. Инва-зивная диагностика при синдромах внутригрудной лимфаденопатии и диссеминации. Вестник современной клинической медицины. 2011; 4(3): 56а-60. [Potanin A.V., Vizel l.Yu., Potanin VP., Vizel A.A. Invasive diagnosis at intrathoracic syndromes of lymphadenopathy and disseminations. The Bulletin of Contemporary Clinical Medicine. 2011; 4(3): 56a-60. (in Russian)]. doi: 10.20969/vskm.2011.4(3).56-60.
- Stigt J.A., Boers J.E., Oostdijk A.H., van den Berg J.W., Groen H.J. Mediastinal incidentalomas. J Thorac Oncol. 2011 Aug; 6(8): 1345-9. doi: 10.1097/JTO.0b013e31821d41c8.
- Munden R.F., Carter B.W., Chiles C., MacMahon H, Black W.C., Ko J.P., McAdams H.P., Rossi S.E., Leung A.N., Boiselle P.M., Kent M.S., Brown K., Dyer D.S., Hartman T.E., Goodman E.M., Naidich D.P., Kazer-ooni E.A., Berland L.L., Pandharipande P.V. Managing Incidental Findings on Thoracic CT: Mediastinal and Cardiovascular Findings. A White Paper of the ACR Incidental Findings Committee. J Am Coll Radiol. 2018 Aug; 15(8): 1087-1096. doi: 10.1016/j.jacr.2018.04.029.
- Evison M., Crosbie P.A., Morris J., Martin J., Barber P. V., Booton R. A study of patients with isolated mediastinal and hilar lymphadenopathy undergoing EBUS-TBNA. BMJ Open Respir Res. 2014 May 31; 1(1): e000040. doi: 10.1136/bmjresp-2014-000040.
- Nin C.S., de Souza V.V., doAmaralR.H., Schuhmacher N.R., Alves G.R., Marchiori E., Irion K.L., Balbinot F., Meirelles G. S., Santana P., Gomes A. C., Hochhegger B. Thoracic lymphadenopathy in benign diseases: A state of the art review. Respir Med. 2016 Mar; 112: 10-7. doi: 10.1016/j. rmed.2016.01.021.
- de Langen A.J., Raijmakers P., Riphagen I., PaulM.A., Hoekstra O.S. The size of mediastinal lymph nodes and its relation with metastatic involvement: a meta-analysis. Eur J Cardiothorac Surg. 2006 Jan; 29(1): 26-9. doi: 10.1016/j.ejcts.2005.10.002.
- Wang^ H., Li Q.K., Auster M., Gong G. PET and CT features differentiating infectious/inflammatory from malignant mediastinal lymph-adenopathy: A correlated study with endobronchial ultrasound-guided transbronchial needle aspiration. Radiol Infect Dis. 2018; 5(1): 7-13. doi: 10.1016/j.jrid.2018.01.002.
- Чернов В.И., Дудникова Е.А., ГольдбергВ.Е., Кравчук Т.Л., Данилова А.В., ЗельчанР.В., МедведеваА.А., СинилкинИ.Г., Брагина О.Д., Попова Н.О., Гольдберг А.В. Позитронная эмиссионная томография в диагностике и мониторинге лимфопролиферативных заболеваний. Медицинская радиология и радиационная безопасность. 2018; 63(6): 41-50. [Chernov V.l., Dudnikova E.A., Goldberg V.E., Kravchuk T.L., Danilova A.V., Zelchan R.V., Medvedeva A.A., Sinilkin I.G., Bragina O.D., PopovaN.O., GoldbergA.V. Positron Emission Tomography in the Diagnosis and Monitoring of Lymphomas. Medical Radiology and Radiation Safety. 2018; 63(6): 41-50. (in Russian)]. doi: 10.12737/article_5c0b8d 72a8bb98.40545646.
- ЧанчиковаН.Г., ДудниковаЕ.А., КарловаЕ.А., СавельеваА.С., Силкина О.А., Зельчан Р.В., Синилкин И.Г., Брагина О.Д., МедведеваАА., Чернов В.И. Возможности ПЭТ/КТ с 'Т-ФДГ в диагностике и стади-ровании лимфом. Вопросы онкологии. 2019; 65(1): 147-153. [Chan-chikovaN.G., DudnikovaE.A., KarlovaE.A., SavelyevaA.S., Silkina O.A., Zelchan R.V., Sinilkin I.G., Bragina O.D., Medvedeva A.A., Chernov V.l. Possibilities of 18F-FDG PET/CT in the diagnosis and staging of lymphomas. Problems in Oncology. 2019; 65(1): 147-153. (in Russian)].
- ЧерновВ.И., ДудниковаЕ.А., ГольдбергВ.Е., Кравчук Т.Л., Данилова А.В., ЗельчанР.В., МедведеваА.А., СинилкинИ.Г., Брагина О.Д., БелевичЮ.В., КоролеваЕ.С. Однофотонная эмиссионная компьютерная томография в диагностике и мониторинге лимфопролифератив-ных заболеваний. Медицинская радиология и радиационная безопасность. 2019; 64(3): 58-63. [Chernov V.l., DudnikovaE.A., Goldberg V.E., Kravchuk T.L., Danilova A. V, Zelchan R. V., Medvedeva A.A., Sinilkin I. G., Bragina O.D., Belevich Yu.V., Koroleva E.S. Single-photon emission computed tomography in the diagnosis and monitoring of lymphoproliferative diseases. Medical Radiology and Radiation Safety. 2019; 64(3): 58-63. (in Russian)]. doi: 10.12737/article_5cf3dfefe60b13.90120976.
- ЧерновВ.И., ДудниковаЕ.А., ЗельчанР.В., Кравчук Т.Л., Данилова А.В., Медведева А.А., Синилкин И.Г., Брагина О.Д., ГольдбергВ.Е., Гольдберг А.В., Фролова И.Г. Однофотонная эмиссионная компьютерная томография с 99mtc-1-тио-d-глюкозой в диагностике и ста-дировании злокачественных лимфом: первый опыт использования. Сибирский онкологический журнал. 2018; 17(4): 81-87. [Chernov V.I., Dudnikova E.A., Zelchan R.V., Kravchuk T.L., Danilova A.V., Medvede-va A.A., Sinilkin I.G., Bragina O.D., Goldberg V.E., Goldberg A.V., Frolo-va I.G. The first experience of using 99mtc-1-thio-d-glucose for single-photon emission computed tomography imaging of lymphomas. Siberian Journal of Oncology. 2018; 17(4): 81-87. (in Russian)]. doi: 10.21294/1814-4861-2018-17-4-81-87.
- Malayeri A.A., ElKhouliR.H., Zaheer A., JacobsM.A., Corona-Villalobos C.P., Kamel I.R., Macura K.J. Principles and applications of diffusion-weighted imaging in cancer detection, staging, and treatment follow-up. Radiographics. 2011 Oct; 31(6): 1773-91. doi: 10.1148/ rg.316115515.
- Bonekamp S., Corona-Villalobos C.P., Kamel I.R. Oncologic applications of diffusion-weighted MRI in the body. J Magn Reson Imaging. 2012 Feb; 35(2): 257-79. doi: 10.1002/jmri.22786.
- Luna A., Sánchez-Gonzalez J., Caro P. Diffusion-weighted imaging of the chest. Magn Reson Imaging Clin N Am. 2011 Feb; 19(1): 69-94. doi: 10.1016/j.mric.2010.09.006.
- HernethA.M., MayerhoeferM., SchernthanerR., Ba-SsalamahA., Czerny Ch., Fruehwald-Pallamar J. Diffusion weighted imaging: lymph nodes. Eur J Radiol. 2010 Dec; 76(3): 398-406. doi: 10.1016/j. ejrad.2010.08.016.
- Razek A.A., Elkammary S., Elmorsy A.S., ElshafeyM., Elhadedy T. Characterization of mediastinal lymphadenopathy with diffusion-weighted imaging. Magn Reson Imaging. 2011 Feb; 29(2): 167-72. doi: 10.1016/j. mri.2010.08.002.
- Razek A.A., Gaballa G., Elashry R., Elkhamary S. Diffusion-weighted MR imaging of mediastinal lymphadenopathy in children. Jpn J Radiol. 2015 Aug; 33(8): 449-54. doi: 10.1007/s11604-015-0434-1.
- Ustabasioglu F.E., Samanci C., Alis D., Samanci N.S., Kula O., Olgun D.C. Apparent Diffusion Coefficient Measurement in Mediastinal Lymphadenopathies: Differentiation between Benign and Malignant Lesions. J Clin Imaging Sci. 2017 Mar 6; 7: 12. doi: 10.4103/jcis. JCIS_84_16.
- Gümü$ta§ S., Inan N., Sarisoy H.T., Anik Y., Arslan A., Ciftfi E., Akansel G., Demirci A. Malignant versus benign mediastinal lesions: quantitative assessment with diffusion weighted MR imaging. Eur Radiol. 2011 Nov; 21(11): 2255-60. doi: 10.1007/s00330-011-2180-9.
- Sun M., Cheng J., Zhang Y., Bai J., Wang F., Meng Y., Li Z. Application of DWIBS in malignant lymphoma: correlation between ADC values and Ki-67 index. Eur Radiol. 2018; 28(4): 1701-1708. doi: 10.1007/ s00330-017-5135-y.
- Prabhakar H.B., Rabinowitz C.B., Gibbons F.K., O'Donnell W.J., ShepardJ.A., AquinoS.L. Imaging features of sarcoidosis on MDCT, FDG PET, and PET/CT. AJR. 2008 Mar; 190(3 Suppl): S16. doi: 10.2214/ AJR.07.7001.


