Возможности долгосрочного эффективного лечения идиопатической легочной гипертензии за счет замены силденафила на риоцигуат и применения последовательной комбинированной терапии: клинический случай
Автор: Мусашайхова С.А., Валиева З.С., Осокина А.К., Коробкова И.З., Грамович В.В., Данилов Н.М., Мартынюк Т.В.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Клинический случай
Статья в выпуске: 4, 2022 года.
Бесплатный доступ
Современная патогенетическая терапия идиопатической легочной гипертензии (ИЛГ) - тяжёлого жизнеугрожающего сердечно-сосудистого заболевания неустановленной этиологии, приводит к позитивному клиническому эффекту вследствие обратного ремоделирования сосудов микроциркуляторного русла легких. В клиническую практику в настоящее время внедрены высокоэффективные лекарственные препараты специфической терапии, воздействующие на основные мишени патогенеза. Представленный клинический случай пациентки с установленным в 2014 г. диагнозом ИЛГ с исходным функциональным классом III по классификации ВОЗ демонстрирует высокую долгосрочную эффективность и безопасность специфической терапии, основанной на применении на протяжении 5 лет стимулятора растворимой гуанилатциклазы риоцигуата после замены предшествующей терапии силденафилом с дальнейшей реализацией стратегии последовательной комбинированной терапии за счёт присоединения амбризентана и селексипага.
Идиопатическая легочная гипертензия, специфическая терапия, силденафил, риоцигуат, амбризентан, селексипаг, клинический случай
Короткий адрес: https://sciup.org/143179302
IDR: 143179302 | DOI: 10.38109/2225-1685-2022-4-74-81
Текст научной статьи Возможности долгосрочного эффективного лечения идиопатической легочной гипертензии за счет замены силденафила на риоцигуат и применения последовательной комбинированной терапии: клинический случай
Данная статья распространяется на условиях «открытого доступа», в соответствии с лицензией CC BY-NC-SA 4.0 («Attribution-NonCommercial-ShareAlike» / «Атрибуция-Некоммерчески-Сохранение Условий» 4.0), которая разрешает неограниченное некоммерческое использование, распространение и воспроизведение на любом носителе при условии указания автора и источника. Чтобы ознакомиться с полными условиями данной лицензии на русском языке, посетите сайт:
Authors’ contributions. All authors meet the ICMJE criteria for authorship, participated in the preparation of the article, the collection of material and its processing.
Conflict of Interest. All authors declare that there is no potential conflict of interest requiring disclosure in this article.
Information about ethics. This research was made in terms of The Declaration of Helsinki, approved by the independent Ethics Committee of Clinical Cardiology Institute named after A.L.Myasnikov, Federal State Budgetary Institution “National Medical Research Center of Cardiology named after acad. E.I. Chazov” of the Ministry of Health of Russia.
И SAINA170790@ICL0UD.C0M
This is an open access article distributed under the terms of the Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International (CC BY-NC-SA 4.0) License , which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited.
Идиопатическая легочная гипертензия (ИЛГ) – тяжелое жизнеугрожающее сердечно-сосудистое заболевание неустановленной этиологии, характеризующееся повышением легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА) вследствие выраженного ремоделирования мелких легочных артерий и артериол как причины развития дисфункции правого желудочка [1]. В основе патогенеза ИЛГ лежит эндотелиальная дисфункция, приводящая к развитию вазоконстрикции, тромбозов in situ, пролиферативным и воспалительным изменениям в сосудах микроциркуляторного русла легких.
До появления специфической терапии медиана выживаемости больных с ИЛГ, раннее называемой первичной легочной гипертензией, составляла 2,8 года [2]. С внедрением в клиническую практику высокоэффективных лекарственных препаратов патогенетического воздействия, в частности оказывающих влияние на сигнальный путь оксид азота (NO) – растворимая гуанилатциклаза (рГЦ) – циклический гуанозинмонофосфат (цГМФ), достигнуто значительное улучшение выживаемости этой категории больных [1,3].
До недавнего времени единственной терапевтической стратегией воздействия на указанный сигнальный путь являлось применение ингибиторов фосфодиэстеразы типа 5 (ИФДЭ-5), замедляющих деградацию цГМФ. В связи с доказанным снижением продукции цГМФ в лёгочных сосудах у пациентов с ЛГ в 20-60% случаев наблюдается не достижение оптимального ответа на терапию силденафилом [3-5]. Это способствовало созданию новых препаратов с целью улучшения биодоступности NO, которые в настоящее время успешно используются в клинической практике.
Первым стимулятором рГЦ для лечения легочной гипертензии явился риоцигуат, эффект которого связан с повышением биосинтеза цГМФ посредством как прямой стимуляции рГЦ, подобно NO, так и повышения чувствительности фермента в условиях низких концентраций эндогенного NO [4]. Риоцигуат является единственным представителем класса стимуляторов растворимой гуанилатциклазы, который одобрен для лечения легочной артериальной гипертензии (ЛАГ) и неоперабельной/ резидуальной хронической тромбоэмболической легочной гипертензии с 2013 года FDA, а с 2014 года – Европейским медицинским агентством и фармкомитетом МЗ РФ [1,5].
Существуют основные различия между механизмами действия риоцигуата и ИФДЭ-5:
-
1. риоцигуат оказывает положительные фармакологические эффекты как в присутствии NO, так и при его дефиците;
-
2. эффекты ИФДЭ-5 напрямую зависят от уровня NO, так как только в присутствии NO происходит активация рГЦ и катализа синтеза цГМФ [5,6].
Представляется клинический случай пациентки Г. 1964 года рождения с длительным ответом на специфическую моноте-
Тромбофлебит БПВ и МПВ справа, флебэктомия
Прогрессирование одышки, отеки голеней, учащенное сердцебиение
По данным Эхо-КГ: СДЛА 64 мм рт. ст.
В/п сцинтиграфия легких: Диффузное снижение перфузии в правом легком с наличием аваскулярных зон в верхних и нижних отделах
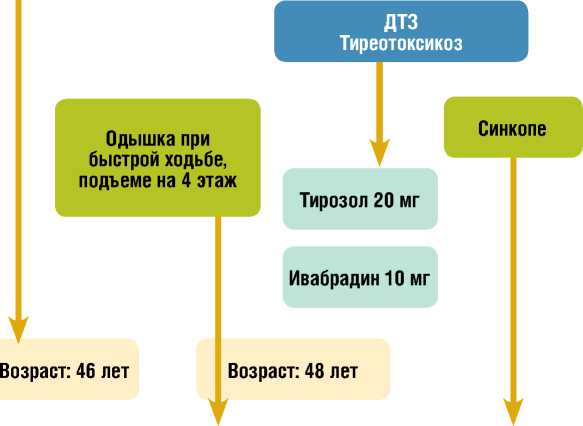
Возраст: 50 лет
Окт 2012
Май 2010
Август 2010
Май 2013
Одышка при ходьбе до 200 метров Отеки до колена Кашель

ХТЭЛГ? Фраксипарин 120 мг
Спиронолактон 25 мг
Июль 2014
Рисунок 1. Анамнез заболевания больной Г.Figure 1. Medical history of patient G.
Примечание/Note: ХТЭЛГ – хроническая тромбоэмболическая легочная гипертензия (chronic thromboembolic pulmonary hypertension); БПВ – большая подкожная вена (great saphenous vein); МПВ – малая подкожная вена (small subcutaneous vein); ДТЗ – диффузный токсический зоб (diffuse toxic goiter); СДЛА – систолическое давление в легочной артерии (systolic pulmonary artery pressure); ЭхоКГ – эхокардиография (transthoracic echocardiography); в/п сцинтиграфия – вентиляционно-перфузионная сцинтиграфия легких (ventilation perfusion lung scintigraphy).
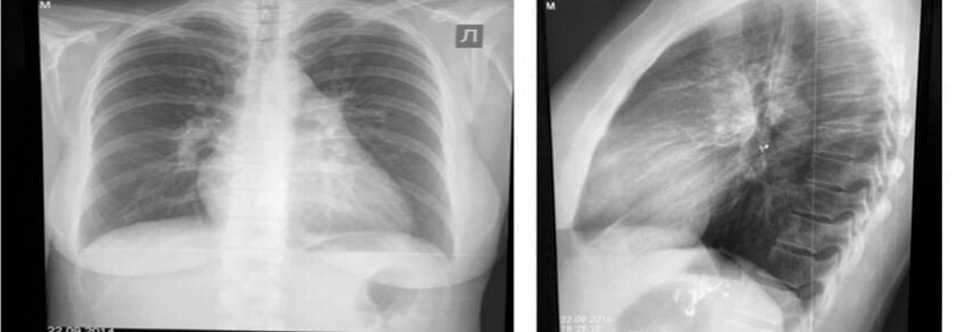
Рисунок 2. Рентгенография органов грудной клетки (август 2014 г.).
Figure 2. Chest X-ray (august 2014)
рапию риоцигуатом после замены предшествующей терапии силденафилом, у которой удалось успешно реализовать цели терапии при дальнейшем последовательном назначении комбинированной терапии. Больная наблюдается в ФГБУ «НМИЦ кардиологии им. акад. Е.И. Чазова» Минздрава России с августа 2014 г., когда была впервые госпитализирована для уточнения причины высокой легочной гипертензии.
Из анамнеза известно, что в мае 2010 г. пациентку впервые стала беспокоить отечность правой голени, которая появилась внезапно и сопровождалась болевыми ощущениями ноющего характера в правой икроножной мышце при минимальной физической нагрузке и в покое, а также покраснением кожных покровов правой голени и области голеностопного сустава. При обследовании был выявлен тромбофлебит большой и малой подкожных вен правой нижней конечности, хроническая венозная недостаточность. Проведена комбинированная правосторонняя флебэктомия (рис. 1).
Спустя 4 месяца больная впервые отметила появление одышки при умеренных, раннее привычных для нее, физических нагрузках. В 2012 г. отмечалось постепенное прогрессирование одышки, появление двусторонней отечности голеней и стоп, в 2013 г. однократно возникло синкопальное состояние при выполнении интенсивной физической нагрузки. В мае 2014 г. отмечала рецидивы синкопе, склонность к тахикардии и гипотонии. С целью контроля сердечного ритма лечащим врачом по месту жительства был назначен ивабрадин 10 мг/сутки. При
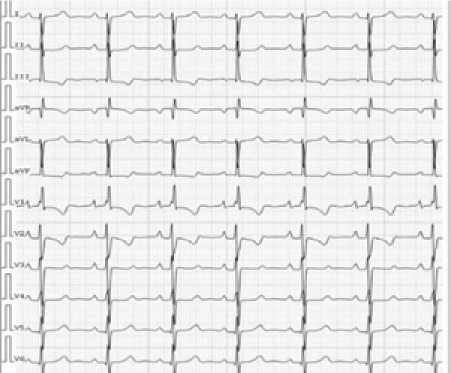
Рисунок 3 Электрокардиограмма (август 2014 г.)
Figure 3. Electrocardiogram (august, 2014)
проведении неинвазивных методов обследования был выявлен полисерозит (правосторонний плеврит, асцит). Проведено ультразвуковое исследование (УЗИ) щитовидной железы, по данным которого выявлен диффузный токсический зоб, тиреотоксикоз средней степени тяжести в стадии субкомпенсации (ТТГ = 0,01 мкМЕ/мл (в норме 0,3-4,2 мкМЕ/мл),T3 = 5,02 нмоль/л (в норме 1,2-3,1 нмоль/л); Т4 = 1,62 пмоль/л (в норме 3,1-6,8 пмоль/л)). Рекомендована терапия тирозолом.
В июле 2014 г. одышка приобрела выраженный характер, присоединились сухой непродуктивный кашель, общая слабость, утомляемость при умеренных физических нагрузках, прогрессирование отёков нижних конечностей. В связи с сохраняющимися симптомами, выполнена трансторакальная эхокардиография (ЭхоКГ): обнаружены признаки ЛАГ.
В сентябре 2014 г. пациентка впервые госпитализирована в ФГБУ «НМИЦ кардиологии» Минздрава России в тяжелом состоянии с жалобами на одышку при незначительной физической нагрузке, периодические эпизоды головокружения и обморочные состояния, отёки нижних конечностей, преимущественно в области голеностопных суставов. Индекс массы тела 25 кг/м2. Частота дыхательных движений 18 в минуту. При аускультации в лёгких выслушивалось дыхание с жёстким оттенком. При аускультации сердца выслушивались акцент и расщепление второго тона над легочной артерией (ЛА), систолический шум над мечевидным отростком. Со стороны органов пищеварения, мочевыделительной и нервной систем патологии не выявлено.
При рентгенографии органов грудной клетки: легочный рисунок на периферии легочных полей обеднён, выявляются признаки лёгочной артериальной гипертензии: расширен ствол лёгочной артерии и его главные ветви (коэффициент Мура 38% (в норме < 30%), коэффициент Люпи 40% (в норме < 30%). Увеличены правые отделы сердца, кардиоторакальный индекс 57% (в норме < 50%).
На электрокардиограмме (ЭКГ) (рис. 3): синусовый ритм с частотой сердечных сокращений (ЧСС) 72 удара в минуту. Отклонение электрической оси сердца право, ротационные сдвиги. Изменение предсердного компонента по типу р-pulmonale, признаки гипертрофии ПЖ. Неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ: признаки ЛАГ, дилатация правых отделов сердца с перегрузкой правого желудочка (ПЖ) давлением. Дилатация ЛА и ее ветвей. Относительная недостаточность трикуспидального клапана (ТК) 2 степени. Нарушение систолической и диастолической функции ПЖ (2 степени), диастолической функции левого желудочка (ЛЖ) (1 степени). Нижняя полая вена (НПВ) расширена до 2,6 см, неудовлетворительно коллабирует на вдохе. Определяется незначительное количество свободной жидкости в полости перикарда, асцит.
По данным вентиляционно-перфузионной сцинтиграфии легких (ВПСЛ) (рис. 4): нарушений вентиляции не выявлено, распределение радиофармпрепарата диффузно равномерное. Регистрируются краевые дефекты перфузии с нечеткими контурами в проекции 1-2 сегментов левого легкого.
В тесте 6-минутной ходьбы (Т6МХ) пациентка прошла 379 метров с выраженностью одышки (индекс Борга) 3 балла. В общем анализе крови (ОАК): гематокрит 33,3 (норма 37,047,0%), гемоглобин 10,14 (норма 12,00-16,00 г/дл), увеличение числа тромбоцитов 527 (норма 130-400 x 10*9/л). Обращало на себя внимание значительное увеличение NT-proBNP до 1850 пг/л (норма < 300 пг/л). При лабораторном исследовании крови антитела к ядерным антигенам (АNА) не выявлены. Заподозрена ХТЭЛГ, рекомендована терапия фраксипарином. Учитывая склонность к кровотечениям, наличие железодефицитной анемии, пациентке продолжена антикоагулянтная терапия эноксапарином натрия в профилактической дозе.
Через 4 мес. больная повторно госпитализирована в НМИЦ кардиологии в связи с нарастанием одышки. При ЭхоКГ отмечено увеличение СДЛА в ЛА до 85 мм рт.ст. (табл. 1), сохраняется повышение NT-proBNP на прежнем уровне (рис. 5).
Исходно при катетеризации правых отделов сердца (КПОС) среднее давление в легочной артерии (срДЛА) 47 мм рт. ст., легочное сосудистое сопротивление (ЛСС) 782 дин*сек/см^5, давление заклинивания в легочной артерии (ДЗЛА) 1 мм рт. ст., сердечный выброс 4,6 л/мин, проба на вазореактивность с ило-простом отрицательная; при селективной ангиопульмонографии тромботического поражения не выявлено (табл. 2). Таким образом, установлен диагноз «Идиопатическая легочная гипертензия. Функциональный класс III (ВОЗ). Легочное сердце: относительная недостаточность трикуспидального клапана 1-2 степени».
Учитывая сохранение жалоб на одышку при обычной физической нагрузке, субъективное ухудшение состояния и прогрессирование легочной гипертензии по данным ЭхоКГ и КПОС, инициирована ЛАГ-специфическая терапия силденафилом в дозе 10 мг 3 раза в сутки с последующей титрацией дозы до 20 мг 3 раза в сутки и рекомендациями возможного увеличения дозы до 120 мг в сутки.
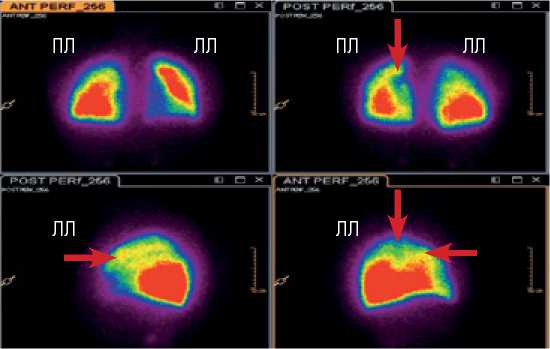
Рисунок 4. Вентиляционно-перфузионная сцинтиграфия легких (сентябрь 2014 г.)
Figure 3. Ventilation-perfusion lung scintigraphy (September, 2014)
В январе 2016 г. больная повторно госпитализирована в связи с выраженным ухудшением переносимости физических нагрузок, частыми сердцебиениями, пресинкопальными и синкопальными состояниями 2-3 раза в месяц. В Т6МХ отмечена отрицательная динамика со снижением дистанции до 319 метров с индексом по Боргу 4 балла; сатурация до начала ходьбы и после завершения Т6МХ составила 98% и 97%, соответственно. При ЭхоКГ по сравнению с данными от января 2015 г. без существенной динамики.
В связи с недостижением целей терапии в качестве возможной опции представлялась замена неэффективной терапии силденафилом на риоцигуат. После отмены силденафила на 24 часа начата титрация риоцигуата с дозы 1 мг 3 раза под контролем артериального давления. Переносимость в ходе дальнейшей титрации дозы препарата оставалась удовлетворительной, побочных явлений не отмечалось.
Пациентка в течение последующих четырех месяцев принимала терапию риоцигуатом в дозе 4,5-6 мг в сутки, что привело к значительному субъективному улучшению состояния. Положительная динамика подтверждена данными проведенных исследований (табл. 1-3).
В феврале 2017 г. во время госпитализации в ФГБУ «НМИЦ кардиологии» по данным проведенного комплексного обследования отмечена явная положительная динамика по всем показателям в результате проводимой терапии риоцигуатом 7,5 мг в сутки. По результатам ЭхоКГ отмечалось снижение СДЛА с 85 до 53 мм рт. ст., уменьшение площади правого предсердия (S ПП) с 18,5 до 16 см2, переднезаднего размера правого желудочка (ПЗР ПЖ) – с 3,4 см до 2,7 см, ствола ЛА – с 3,5 до 3 см, увеличение систолической экскурсии кольца трикуспидального клапана (TAPSE) – с 1,9 до 2,1 см, нормализация индекса эксцентричности левого желудочка и отсутствие перикардиального выпота. По данным рентгенографии органов грудной клетки выявлялось уменьшение рентгенометрических параметров: коэффициента Мура с 38% до 36%, коэффициента Люпи с 40% до 34%, кардиоторакального индекса с 57% до 50%. При Т6МХ отмечалось увеличение дистанции с 415 до 522 метров со снижением выраженности одышки с 4 до 3 баллов (рис. 6).
По данным спировелоэргометрии: VO2 peak увеличился в динамике с 9,2 до 11 мл/мин/кг, вентиляционный эквивалент VE/VСО2 снизился с 35 до 33. При КПОС достигнуто снижение СДЛА с 110 до 57 мм рт. ст., срДЛА – с 66 до 34 мм рт. ст., срДПП – с 11 до 2 мм рт. ст., ЛСС – с 1169 до 487 дин/с/см5, увеличение СВ – с 3,9 до 4,6 л/мин., СИ – с 2,2 до 2,6 л/мин/м2 по сравнению с данными от декабря 2015 г.
В апреле 2021 г. в связи с ухудшением переносимости физических нагрузок пациентка повторно госпитализирована в ФГБУ «НМИЦ кардиологии», у пациентки подтверждено клиническое ухудшение, которое потребовало коррекции терапии. В Т6МХ пройденная дистанция составила 450 метров (-115 м в сравнении с ноябрем 2018 г.) (рис. 5). При КПОС подтверждена отрицательная динамика (табл. 2), отмечено возрастание уровня NT-proBNP до 426 пг/мл (рис. 5).
Учитывая наличие факторов высокого риска летальности у больной с сохранной толерантностью к физическим нагрузкам принято решение об эскалации пероральной терапии за счет присоединения к риоцигуату 7,5 мг/сутки амбризентана 10 мг/ сутки и селексипага (титрация дозы до максимально переносимой 3200 мкг/сутки). Выбранная стратегия оказалась высокоэффективной, результаты контрольного обследования в сентябре 2021 г. убедительно свидетельствовали о достижении низкого риска летальности (табл. 1 и 2).
78 ЕВРАЗИЙСКИЙ КАРДИОЛОГИЧЕСКИЙ ЖУРНАЛ, 4, 2022
|
сен. 14 |
янв. 15 |
янв. 16 |
май 16 |
апр. 21 |
ноя. 21 |
|
|
NT-proBNP |
1850 |
1552 |
1786 |
296 |
426 |
78,3 |
Таблица 1. Динамика параметров трансторакальной эхокардиографии у больной Г.
Table 1. Echocardiography dynamics in patient G.
|
Параметры |
Сентябрь 2014 г. силденафил 60 мг/сут |
Январь 2015 г. силденафил 120 мг/сут |
Январь 2016 г. переход с силденафила на риоцигуат |
Май 2016 г. 4 мес. терапии риоцигуатом |
Апрель 2021 г. 5 лет терапии риоцигуатом |
Ноябрь 2021 г. Тройная терапия (риоцигуат, амризентан + селексипаг) |
Показатели в норме |
|
ЛП, см |
3,0 |
3,3 |
3,3 |
3,4 |
3,3 |
2,9 |
2,0-4,0 |
|
КДР ДЖ, см |
3,5 |
4,0 |
4,2 |
4,2 |
4,0 |
4,3 |
4,0-5,5 |
|
ФВ, % |
60 |
60 |
60 |
60 |
60 |
65 |
>60 |
|
ТМЖП, см |
1,0 |
1,0 |
0,9 |
1,0 |
1,0 |
1,0 |
0,7-1,1 |
|
ТЗСЛЖ, см |
1,0 |
1,0 |
0,9 |
1,0 |
1,0 |
1,0 |
0,7-1,1 |
|
Площадь ПП, см |
20 |
18,5 |
20 |
17,5 |
15,5 |
16,0 |
<18 |
|
ПЗР ПЖ, см |
3,4 |
3,4 |
3,2 |
2,7 |
2,7 |
3,0 |
<3,0 |
|
ТПСЖ ПЖ, см |
0,7 |
0,6 |
0,62 |
0,55 |
0,8 |
0,8 |
<0,5 |
|
TAPSE, см |
2,0 |
1,9 |
2,0 |
1,9 |
1,6 |
2,2 |
>1,6 |
|
СДЛА, мм рт. ст. |
75 |
85 |
98 |
73 |
49 |
37 |
<36 |
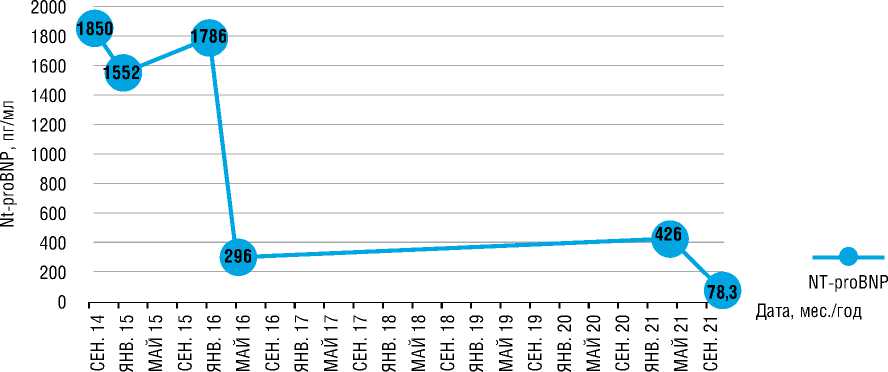
Рисунок 5. Динамика NT-proBNP у больной Г.
Figure 5. NT-proBNP dynamics of patient G.
Примечание/Note: ЛП – левое предсердие (left atrium); КДР – конечно-диастолический размер левого желудочка (end diastolic volume); ФВ ЛЖ – фракция выброса левого желудочка (left ventricle ejection fraction); ТМЖП – толщина межжелудочковой перегородки (intraventricular septum thickness); ТЗСЛЖ – толщина задней стенки левого желудочка (posterior wall thickness); S ПП – площадь правого предсердия (right atrial area); ПЗР ПЖ – передне-задний размер правого желудочка (basal right ventricular diameter); ТПСПЖ – толщина передней стенки правого желудочка (right ventricle free wall thickness); TAPSE – систолическая экскурсия кольца трикуспидального клапана (Tricuspid annular plane systolic excursion); СДЛА –систолическое давление в легочной артерии (systolic pulmonary arterial pressure).
ОБСУЖДЕНИЕ
В течение последних лет широко обсуждается вопрос о возможности оптимизации терапии за счёт замены препаратов, которые воздействуют на одну мишень патогенеза. Данный клинический случай демонстрирует эффективность стратегии переключения с ИФДЭ-5 силденафилом на риоцигуат у паци- ентки с ИЛГ и возможность достижения долгосрочного успеха при достижении суточной дозы 7,5 мг. У нашей больной на протяжении 5 лет приёма риоцигуата отмечалось не только улучшение ФК (ВОЗ) и переносимости физических нагрузок, но также гемодинамических параметров и показателей ремоделирования сердца.
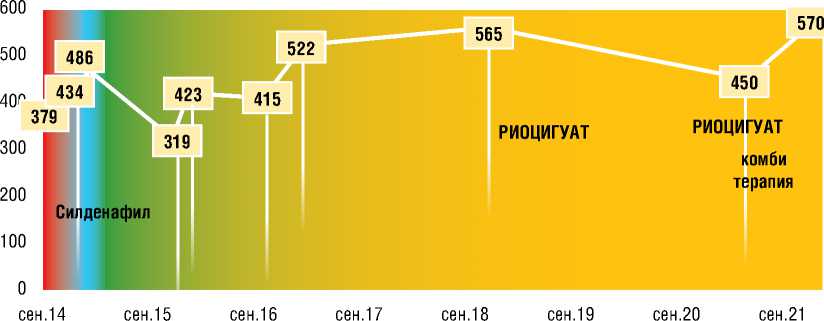
ДТ6МХ окт. 16
фев. 17 522
сен. 14
янв. 15
янв. 16
ноя.18
апр.21 450
ноя.21
янв. 15
дек.15 319
Рисунок 6. Динамика дистанции в тесте 6-минутной ходьбы больной Г.
Figure 6. The 6-minute minute walking distance dynamics of patient G.
Таблица 2. Показатели КПОС больной Г. в динамике
Table 2. Indicators of right heart catheterization of patient G. in dynamics
|
Параметры |
Январь 2015 г. терапия силденафилом |
Май 2016 г. 4 мес терапии риоцигуатом |
Февраль 2017г. 24 мес. терапии риоцигуатом |
Апрель 2021г. 5 лет терапии риоцигуатом |
Ноябрь 2021 г. 8 мес. тройной терапии (риоцигуат + амбризентан + селексипаг) |
Параметры в норме |
|
СДЛА/ ДДЛА/ срДЛА, мм рт. ст. |
110/43/66 |
78/25/39 |
57/21/34 |
91/32/52 |
55/27/39 |
15-30/4-15/ 9-18 |
|
Среднее давление в ПП, мм рт. ст. |
11 |
6 |
2 |
8 |
1 |
2-6 |
|
Давление ПЖ(систол/диастол/ средн.), мм рт. ст. |
107/8/20 |
99/11/4 |
52/0/4 |
104/6/16 |
52/5/7 |
15-35/0-1/ 10-12 |
|
Давление заклинивания ЛА, мм рт. ст. |
9 |
9 |
6 |
7 |
8 |
6-12 |
|
SaО2, % |
90 |
97 |
100 |
98 |
97 |
>95 |
|
SvО2, % |
60 |
67 |
75 |
67 |
80 |
60-80 |
|
СВ, л/мин |
3,9 |
4,1 |
4,6 |
3,9 |
7 |
4,0-8,0 |
|
СИ, л/мин*м^2 |
2,2 |
2,2 |
2,6 |
2,1 |
4 |
2,5-4,0 |
|
УО, мл |
70 |
70 |
69 |
52,1 |
97 |
>60 |
|
ЛСС, дин*сек/см^5 |
1169 |
500 |
487 |
923,1 |
354 |
<240 |
Примечание/Note: СДЛА – систолическое давление в легочной артерии (systolic pulmonary arterial pressure); ДДЛА – диастолическое давление в легочной артерии (dyastolic pulmonary arterial pressure); срДЛА – среднее давление в легочной артерии (mean pulmonary arterial pressure); среднее ДПП – давление в правом предсердии (mean right atrial pressure); ДПЖ – давление в правом желудочке (right ventricle pressure); ДЗЛА – давление заклинивания легочной артерии (pulmonary artery wedge pressure); SаO2 – сатурация артериальной крови (arterial oxygen saturation) SvO2 – сатурация венозной крови (mixed venous oxygen saturation); СВ – сердечный выброс (cardiac output); СИ – сердечный индекс (cardiac index); УО – ударный объем (stroke volume); ЛСС – легочное сосудистое сопротивление (pulmonary vascular resistance)
Долгосрочная клиническая эффективность риоцигуата доказана в исследовании PATENT-2 у 396 (98%) пациентов, завершивших III фазу исследования PATENT-1. В длительном открытом клиническом исследовании наблюдалось улучшение дистанции в Т6МХ, стойкое снижение NT-proBNP, улучшение ФК (ВОЗ) и ряда других показателей [7]. Выживаемость пациентов в исследовании PATENT-2 составила 97% (95% ДИ 95-98%) к концу 1 года исследования; 93% (95% ДИ 90-95%) к концу 2 года исследования. В исследовании PATENT-2 рио-цигуат продемонстрировал хорошую переносимость и благоприятный профиль эффективности как у ранее не леченных больных, так и у пациентов, которые получали предшествующую терапию антагонистами рецепторов эндотелина или простаноидами [7].
На фоне проводимой монотерапии риоцигуатом у нашей больной при оценке динамики ЭхоКГ отмечено уменьшение правых отделов сердца S ПП с 20 до 15 см2 и ПЗР ПЖ с 3,3 до 2,8 см, увеличение TAPSE c 1,37 до 1,7 см, возрастание фракции выброса ПЖ с 29,4 до 39%. Эти данные согласуются с результатами исследования Marra A.M. и соавт.: на фоне терапии риоцигуатом на протяжении 3-12 месяцев у 71 пациента с ЛАГ (45%) и хронической тромбоэмболической легочной гипертензией (55%) (исследование RIVER) к 6 месяцу лечения достигнуто уменьшение S ПП и ПЖ, скорости трикуспидальной регургитации, а через 12 месяцев – значительное уменьшение размеров правых отделов сердца и улучшение функции ПЖ [8].
Принимая во внимание отрицательную динамику и прогрессирование заболевания у нашей больной спустя 5 лет монотерапии риоцигуатом было принято решение о присоединении амбризентана и селексипага, что привело к клинически значимому улучшению.
Интересно, что в последние годы появляются исследования, посвященные оценке эффективности стартовой тройной комбинированной терапии. Так, в ретроспективном исследовании изучались эффективность и безопасность тройной пероральной комбинированной терапии мацитентаном, риоцигуатом и селексипагом у 26 пациентов с ЛАГ в среднем возрасте 38 лет (73,1% женщин), из которых девять пациентов принимали предшествующую ЛАГ-специфическую терапию. Среднее время от начала приёма первого ЛАГ-специфического препарата до назначения третьего препарата у пациентов, ранее не получавших лечение, составило 24 дня (межквартильный диапазон 12-47 дней). Четыре пациента (15,0%) прекратили приём одного из трёх ЛАГ-специфических препаратов по причине нежелательных явлений. 17 пациентов (65,4%) достигли максимальной дозы всех трех препаратов. СрДЛА, ЛСС и СВ улучшились на 29%, 65% и 82%, соответственно (средний период наблюдения 441 день), улучшение гемодинамических параметров наблюдалось и у пациентов, ранее не получавших лечение. В данном наблюдении тройная пероральная комбинированная терапия мацитентаном, риоцигуатом и селексипа-гом значительно улучшила клинические показатели и хорошо переносилась пациентами с ЛАГ. Эта комбинация может быть особенно многообещающей стратегией у пациентов с низким/ промежуточным риском летальности и, вероятно, у ряда молодых пациентов высокого риска с незначительно скомпромен-тированным функциональным статусом [9].
ЗАКЛЮЧЕНИЕ
Данный клинический случай демонстрирует возможность достижения длительного позитивного клинического ответа у больной ИЛГ с ФК III (ВОЗ) при переключении с терапии инги- битором ИФДЭ-5 силденафила на риоцигуат на протяжении 5 лет. Эта стратегия впервые предложена при неэффективности ИФДЭ-5 у пациентов ЛАГ с ФК III (ВОЗ) в российских клинических рекомендациях по диагностике и лечению ЛГ 2016 г. и утверждена в рекомендациях Евразийской ассоциации кардиологов 2019 г. [1]. В дальнейшем, в связи с ухудшением клинических, функциональных и гемодинамических параметров успешно реализована стратегия последовательной комбинированной терапии за счёт присоединения амбризентана и селексипага.
Список литературы Возможности долгосрочного эффективного лечения идиопатической легочной гипертензии за счет замены силденафила на риоцигуат и применения последовательной комбинированной терапии: клинический случай
- Чазова И.Е., Мартынюк Т.В., Валиева З.С., соавт. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский Кардиологический Журнал. 2020;(1):78-122.
- Chazova I.E., Martynyuk T.V., Valieva Z.S., et al. Eurasian clinical guidelines on diagnosis and treatment of pulmonary hypertension. Eurasian heart journal. 2020;(1):78-122. (In Russ).
- D'Alonzo G.E., Barst R.J., Ayres S.M., et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry. Ann Intern Med. 1991; 115(5): 343-9.
- Таран И.Н., Мартынюк Т.В., Наконечников С.Н., соавт. Инновация в медикаментозном лечении легочной гипертензии: стимулятор растворимой гуанилатциклазы - риоцигуат. Евразийский Кардиологический Журнал. 2015; 4:12-19.
- Taran I.N., Martynyuk T.V., Nakonechnikov S.N., Chazova I.Y. Innovation in pharmaceutical treatment of pulmonary arterial hypertension: stimulator of soluble gyanylate cyclase - riociguat. Eurasian heart journal. 2015;(4):12-19. (In Russ.).
- Чазова И.Е., Мартынюк Т.В. Риоцигуат - первый лекарственный препарат инновационного класса стимуляторов гуанилатциклазы для лечения больных легочной артериальной гипертензией. Системные гипертензии. 2013;10(4):70-75.
- Chazova I.E., Martynyuk T.V. Riociguatas the first innovative guanylatecyclase stimulators class drugs for pulmonary arterial hypertension patients treatment. Systemic Hypertension. 2013;10(4):70-75 (In Russ.).
- Шмальц А.А., Горбачевский С.В. Риоцигуат и силденафил в лечении легочной гипертензии: сходства и различия. Пульмонология. 2016; 26 (1): 85-91.
- Shmal'ts A.A., Gorbachevskiy S.V. Riociguat and sildenafil for pulmonary hypertension: similarity and difference. Pulmonologiya. 2016;26(1):85-91. (In Russ.).
- Hoeper M.M., Simonneau G., Corris P.A., et al. RESPITE: switching to riociguat in pulmonary arterial hypertension patients with inadequate response to phosphodiesterase-5 inhibitors. Eur Respir J. 2017;50:1602425.
- Rubin L.J., Galie N., Grimminger F., et al. Riociguat for the treatment of pulmonary arterial hypertension: a long-term extension study (PATENT-2). Eur Respir J. 2015;45(5):1303-1313.
- Marra A.M., Halank M., Benjamin N., et al. Right ventricular size and function under riociguat in pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension (the RIVER study). Respir Res. 2018; 19 (1): 258.
- Momoi M., Hiraide T., Shinya Y., et al. Triple oral combination therapy with macitentan, riociguat, and selexipag for pulmonary arterial hypertension. Ther Adv in Respir Disease. 2021; 15: 175346662199504.


