Возможности импедансной кардиографии в системе мониторинга безопасности при эндопротезировании крупных суставов
Автор: Михеева Светлана Анатольевна, Шевченко Владимир Петрович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2012 года.
Бесплатный доступ
Цель исследования – установить информационную ценность импедансной кардиографии при обеспечении мониторинга безопасности эндоротезирования крупных суставов нижних конечностей. Материал и методы. Мониторинг гемодинамического статуса на основе метода импедансной кардиографии (ИКГ) применен у 42 больных с повреждениями тазобедренных и коленных суставов при проведении операций тотального эндопротезирования крупных суставов нижних конечностей. Операции выполнялись в условиях комбинированной спинально-эпидуральной анестезии с седацией гипнотиком пропофолом или мидозаламом. Результаты. Установлено, что основными факторами, определяющими интраоперационный гемодинамический статус оперируемых больных, являются: метод анестезиологического обеспечения, фармакологические эффекты используемых для анестезиологической защиты препаратов, проводимая периоперационная инфузионно-трансфузионная терапия, степень отрицательного влияния костного цемента, продолжительность операции и объем кровопотери. Не зарегистрировано опасных отклонений гемодинамических параметров за пределы допустимых физиологических отклонений, что свидетельствовало об эффективности и адекватности анестезиологического и инфузионно-трансфузионного обеспечения выполняемых операций. ИКГ-мониторинг позволил оценить степень гидратации интерстициального пространства легких при травматичных операциях эндопротезирования, которые часто сопровождаются повышенной интраоперационной кровопотерей у больных с компрометированной сердечно-легочной системой. Применение метода ИКГ позволяет увеличить уровень безопасности оперируемых больных. Выводы. Метод ИКГ позволяет получить полезную, клинически значимую информацию о характере изменений системного кровообращения у пациентов, которым выполняют достаточно сложные операции эндопротезирования крупных суставов нижних конечностей.
Неинвазивный мониторинг гемодинамики, импедансная кардиография, эндопротезирование крупных суставов нижних конечностей
Короткий адрес: https://sciup.org/142121619
IDR: 142121619
Текст научной статьи Возможности импедансной кардиографии в системе мониторинга безопасности при эндопротезировании крупных суставов
Показатели гемодинамики – важный критерий для диагностики волемических нарушений, определения адекватности метода анестезии, оценки компенсаторных возможностей системы кровообращения. Сложность и актуальность этой задачи заключается в том, что операции эндопротезирования крупных суставов нижних конечностей относятся к категории особо травматичных, cопряженных с высокой вероятностью развития метаболических нарушений и нарушений со стороны легочно-сердечной системы при применении костного цемента для фиксации эндопротеза. Вместе с тем, этим операциям преимущественно подвергаются пациенты пожилого возраста, имеющие сопутствующую патологию. Скрытая дегидратация на фоне воздействия факторов операционного стресса законо- мерно приводит к гемоконцентрации, гипоперфузии тканей, нарушению реологических свойств крови и микроциркуляции. Указанные факторы увеличивают частоту тяжелых кардиальных периоперационных осложнений. Повышенная склонность к тромбооб-разованию и вероятность тромбоэмболии труднопреодолимы из-за низкой устойчивости больных к инфузионной нагрузке. Достаточно высокая травматичность операций эндопротезирования крупных суставов нижних конечностей требует углубленного подхода к мониторингу гемодинамики при выполнении подобных вмешательств. Снижение сердечного выброса и нарушение регуляции сосудистого тонуса у больных пожилого возраста предопределяют их большую чувствительность к перегрузке жидкостью [1].
Признается, что критериями, которые позволяют достаточно объективно определять объем инфузионной терапии, являются показатели преднагрузки, среднего артериального давления и сатурации смешанной венозной крови.
Дилюционные методики (пульмональная и транспульмональная термодилюция) в настоящее время считаются «золотым стандартом» волюметрического мониторинга центральной гемодинамики, позволяющие проводить динамический мониторинг сердечного выброса, контролировать преднагрузку на сердце, его сократительную способность, реакцию на объемную нагрузку, количество жидкости в интерстиции легких у больных, подвергаемых обширным хирургическим вмешательствам. Эти методики нашли достаточно широкое применение в кардиоанестезиологии, торакальной хирургии и интенсивной терапии [3]. Однако существенным недостатком методики пульмональной термодилюции является ее высокая инвазивность, связанная с необходимостью катетеризации легочной артерии и, следовательно, сопряженная с развитием серьезных осложнений [6]. Методика транспульмональной термодилюции, реализованная в мониторах PiCCO, технически более проста, для ее реализации требуются болюсные введения охлажденного раствора (термоиндикатора) в любую центральную вену и наличие снабженного термодатчиком артериального катетера. Вместе с тем, методика имеет и свои недостатки: она требует использования специальных одноразовых расходных материалов, положение термистора артериального катетера может оказывать значительное влияние на точность измерения, а частое проведение термодилюции приводит к введению в сосудистое русло значительного объема холодного термодилютанта [2].
Несмотря на то, что мониторинг гемодинамики является одной из важнейших составных частей обеспечения безопасности операционного периода, отмечается, что применение инвазивных методов оценки гемодинамического статуса является оправданным далеко не в каждом случае при выполнении плановых операций в травматологии-ортопедии [5]. Диагностические возможности существующих современных методов неинвазивной оценки гемодинамического статуса оперируемых являются недостаточно изученными и освещенными в литературе. В отечественных публикациях имеются лишь единичные сведения об использовании метода импедансной кардиографии (ИКГ) для оценки основных параметров центральной гемодинамики при выполнении сложных хирургических операций [4].
Таким образом, есть основания утверждать, что в настоящее время диагностические возможности неинвазивной оценки параметров системного кровообращения, которые позволили бы в режиме реального времени получить необходимую информацию о состоянии волемического статуса, сократимости сердца, состоянии интерстициального пространства легких, состоянии кровотока в нижних конечностях, недостаточно исследованы.
Цель исследования – установить информативную ценность импедансной кардиографии в целях обеспечения мониторинга безопасности эндопротезирования крупных суставов нижних конечностей.
МАТЕРИАЛ И МЕТОДЫ
Характеристика больных. Проанализированы результаты хирургического лечения 42 больных, которым производилось тотальное эндопротезирование крупных суставов нижних конечностей (КСНК) в отделении эндопротезирования Новосибирского НИИТО в 2010 году.
Критериями для включения пациентов в проводимое исследование было наличие дегенеративно-дистрофических заболеваний и травматических поражений тазобедренных суставов у больных в возрасте от 20 до 80 лет, средний возраст 56,8 года. Поводом для исключения из данного исследования было наличие анемии, сахарного диабета, а также хронических заболеваний в стадии субкомпенсации и декомпенсации, выявленных в процессе предоперационного обследования. Пациенты были разделены на две группы в зависимости от способа фиксации эндопротеза. В первой подгруппе (n=24) проводилось бесцементное эндопротезирование КСНК, во второй подгруппе (n=18) проводилось цементное эндопротезирование. Группы были сопоставимы по возрасту, массе тела, тяжести основной и сопутствующей патологии. Продолжительность выполненных операций в группах не имела достоверных различий и составила в среднем 73,7 мин. в группе бесцементного протезирования и 80,0 мин. – в группе цементного протезирования. Средний объем интраоперационной кровопотери в группах составил 509,0±78,0 мл (бесцементное протезиро- вание) и 255,0±42,0 мл (цементное протезирование) (р≤0,05).
Инфузионная терапия проводилась с использованием сбалансированных кристаллоидов и коллоидных растворов на основе препаратов крахмала и желатина. Перед проведением регионарной анестезии больным осуществляли инфузию кристаллоидов в объеме 1000 мл. В группе сравнения предоперационная инфузия кристаллоидов в среднем составляла 500 мл. Объем и качество инфузионно-трансфузионного обеспечения определялся на основе количественного учета объема и темпа кровопотери, физиологических потребностей в жидкости, контроля показателей гемодинамики, эритроцитов, гемоглобина, гематокрита, почасового диуреза. Во время хирургического вмешательства поддерживался режим умеренной гемодилюции (гематокрит 28,8±4,4 г/л). При цементном эндопротезировании с целью профилактики возможных осложнений внутривенно вводили гормоны и антигистаминные препараты. Применения компонентов донорской крови на этапах операции ни в одном случае не потребовалось. В послеоперационном периоде использовались те же растворы, что и на этапах операции. Тяжесть дооперационного функционального состояния определялась не только основным заболеванием. В анализируемых группах из 42 больных различная сопутствующая патология была установлена в 94 % случаев. Кардиальная патология на фоне ИБС была выявлена у 58 % пациентов, гипертоническая болезнь I-III ст. отмечалась у 81 % больных. Та или иная степень тяжести сопутствующей патологии у пациентов старше 65 лет регистрировалась во всех органах и системах. Кроме того, у всех больных пожилого и старческого возраста имелось сочетание сопутствующей сердечнососудистой патологии с патологией дыхательной или мочевыделительной систем, ЦНС либо с другими заболеваниями.
Наличие у большинства больных обеих групп клинически значимых полиорганных дисфункций определяло их физический статус по классификации ASA, соответствующий 2-3 функциональному классу.
Методика регионарной анестезии. Все больные были оперированы в условиях варианта комбинированной спинально-эпидуральной анестезии с использованием гипнотика пропофола с инфузией по целевой концентрации (ИЦК) с целью седации. Премедикация в группах включала внутримышечное введение дормикума (0,05 мг/кг) и антигистаминных препаратов.
Интраоперационный мониторинг безопасности. Обязательный мониторинг безопасности включал регистрацию АД, ЧСС, ЭКГ, SaO2, FiО2, ETCO2. У всех больных применен расширенный неинвазивный мониторинг показателей гемодинамики с использованием системы «NICCOMO» (Германия), использующей метод ИКГ. В основе метода ИКГ лежит определение синхронных пульсовых изменений потока и объема крови в грудной аорте, которые создают изменение электрического сопротивления (импеданса) грудной клетки переменному току. Изменения импеданса за определенный интервал времени используются для измерения или расчета основных гемодинамических параметров и их нормализованных значений. Одним из наиболее важных определяемых неинвазивно показа- телей является ударный объем сердца (УО). Как и большинство современных импедансных кардиографов, монитор «NICCOMO» использует для вычисления УО формулу Bernstein-Sramek. Учитывая физиологические отклонения величины УО из-за респираторного эффекта, монитор определяет УО по среднему значению за 16-30 сокращений сердца. Для осуществления метода требуется накожное наложение четырех двойных токоподающих и токопринимающих электродов. Две пары электродов накладываются на обе стороны шеи в проекции магистральных сосудов, две другие пары располагаются на грудной клетке с обеих сторон. У всех больных нами регистрировались УО, ударный индекс (УИ), сердечный выброс (СВ), сердечный индекс (СИ), индекс доставки к тканям кислорода (DO2), объем свободной внесосудистой жидкости (СВЖ) в легких, индекс свободной внесосудистой жидкости (ИСВЖ) в легких, системное сосудистое сопротивление (ССС), индекс системного сосудистого сопротивления (ИССС), параметры сократимости миокарда, в частности индекс скорости (ИС) и индекс HEATHER. Исследования проводили на этапах: 1 – исходно; 2 – начало операции; 3 – конец хирургической операции; 4 – спустя 1 сутки после операции.
Проведен статистический анализ полученных результатов с использованием программы «Statistica» фирмы «Микромед» с вычислением значений средних арифметических величин (М) и среднеквадратического отклонения (о). Достоверность различий внутри групп оценивали по t-критерию Стьюдента. Различия считали достоверными при p<0,05. Для определения корреляционной зависимости между показателями высчитывался коэффициент корреляции Пирсона (r). Проводили межгрупповое сравнение вариационных рядов.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
При поступлении больных в операционную показатели гемодинамики были стабильными, несмотря на регистрацию у большинства больных гипертонической болезни (68 %), что свидетельствовало об адекватности премедикации. Хирургическое вмешательство у всех больных было проведено в условиях регионарной анестезии. За счет симпатического блока в анестезированной зоне происходило плавное увеличение емкости сосудистого русла, однако вследствие достаточного объема предоперационной инфузионной терапии не регистрировалось снижения АДср (рис. 1).
По завершению хирургического доступа начинался основной этап операции. Проводилась остеотомия с последующей обработкой суставных поверхностей и костномозговой полости, установка компонентов эндопротеза. Этот период характеризовался выраженным увеличением темпа и объема кровопотери. Кровотечение из губчатого вещества и сосудов компактной кости носило медленно прогрессирующий характер. Показатели гемодинамики на этих этапах операции определялись качеством и своевременностью проведения инфузионно-трансфузионной терапии. В обеих группах на этом этапе отмечалась тенденция к снижению артериального давления (рис. 1).
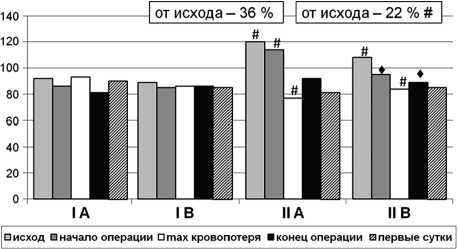
Рис. 1.Сравнение показателя среднего АД у пациентов I и II групп с цементным (А) и бесцементным (В) про-те-зированием: # – между пациентами I и II группы;
-
♦ – между значениями внутри групп
Достоверных различий между группами в интраоперационном периоде не было. В послеоперационном периоде наблюдалось достоверное различие уровня систолического АД при различных способах фиксации эндопротеза. Межгрупповое сравнение показало, что при бесцементной технике установки эндопротеза показатели гемодинамики оставались устойчивыми на протяжении всего пе- риоперационного периода (табл. 1).
Прямо противоположные тенденции были при цементном протезировании. Внедрение компонентов эндопротеза с использованием костного цемента на основе метилметакрилата вызывало снижение артериального давления до опасного уровня, несмотря на профилактическое внутривенное введение гормональных и антигистаминных препаратов. Нарушения гемодинамики отмечены в 13 случаях (72 %). Артериальная гипотония отмечена у 4 больных (22 %) интраоперационно и у 2 (11 %) больных в ближайшем послеоперационном периоде. При этом у всех больных потребовалось применение адреномиметических средств и повторное введение глюкокортикоидных гормонов.
Частота сердечных сокращений определялась исходным фоном, травматичностью хирургического вмешательства и адекватностью анестезиологической защиты, объемом кровопотери и качеством трансфузионной терапии. В нашем исследовании достоверных различий по средним показателям ЧСС и Sat О2 между данными сравниваемыми группами не было выявлено (табл. 2).
Показатели СИ на первом этапе исследования у больных в обеих группах наблюдений находились в пределах физиологических значений для исследуемого параметра (табл. 3). Осуществление хирургического вмешательства сопровождалось тенденцией к снижению данных показателей. Конец операции со- провождался достоверным снижением показателя СИ в группе бесцементного протезирования, который составил 2,7±0,2 л/мин. со снижением от исходных значений на 21 % (р≤0,05), но при этом он не выходил за рамки нижней границы допустимых функциональных отклонений. При цементном протезировании прослеживалась тенденция к снижению СИ. Наблюдались синхронные с СИ статистически значимые изменения СВ. Более значительное достоверное снижение показателей СВ и СИ к окончанию операции в первой группе определялось их большей интраоперационной кровопотерей. Зарегистрированная тенденция к снижению показателей СВ и СИ в обеих группах больных требовала продолжения темпа инфузионной поддержки и в ближайшем послеоперационном периоде. Была отмечена однонаправленность изменений УО и УИ в периоперационном периоде (табл. 3).
На этапах развития спинального блока показатели УО имели тенденцию к повышению в обеих группах за счет введения инфузионных растворов. Начало хирургического вмешательства сопровождалось тенденцией к умеренному снижению показателей УО в анализируемых группах, которые составили 78,8±6,4 мл у больных при бесцемент-ной фиксации и 71,3±6,8 мл при цементной фиксации, но находились в пределах физиологических значений для этих показателей.
Таблица 1
Нарушения гемодинамики при различных способах фиксации эндопротеза
|
Нарушения |
Этапы наблюдений |
Группа сравнения, бесцементная (n=29) |
Группа сравнения, цементная (n=21) |
Основная группа, бесцементная (n=24) |
Основная группа, цементная (n=18) |
|
Гипотензия больше |
во время операции |
14 % |
33 % |
8 % |
22 % |
|
10 мин. |
после операции |
17 % |
14 % |
0 % |
11 % |
|
Тахикардия |
во время операции |
10 % |
19 % |
8 % |
5,5 % |
|
после операции |
7 % |
38 % |
12,5 % |
22 % |
|
|
Аритмия |
после операции |
0 % |
14 % |
0 % |
0 % |
|
Ухудшение реполяризации |
после операции |
3,4 % |
24 % |
4 % |
11 % |
Таблица 2
Динамика показателей ЧСС и Sat О2
|
Этапы операций |
Показатели |
Бесцементное протезирование (n=24) |
Цементное протезирование (n=18) |
|
Исходно |
ЧСС (уд/мин) |
81,3±2,0 |
79,0±2,7 |
|
Sat O2 (%) |
97,3±0,4 |
98,6±0,2 |
|
|
Начало операции |
ЧСС (уд/мин) |
76,2±2,6 |
70,5±3,0 |
|
Sat O2 (%) |
97,8±0,4 |
99,2±0,1 |
|
|
Этап максимальной |
ЧСС (уд/мин) |
75,2±3,0 |
76,4±3,7 |
|
кровопотери |
Sat O2 (%) |
96,9±0,8 |
98,9±0,1 |
|
Конец операции |
ЧСС (уд/мин) |
74,8±2,3 |
76,2±2,8 |
|
Sat O2 (%) |
97,6±0,4 |
99,4±0,1 |
|
|
Первые сутки |
ЧСС (уд/мин) |
80,4±2,3 |
80,5±1,7 |
|
Sat O2 (%) |
98,2±0,2 |
99,1±0,1 |
Таблица 3
Некоторые параметры центральной гемодинамики на этапах исследования в группах наблюдений (M±r)
|
Этапы исследований |
Группы наблюдений |
Показатели |
|||
|
УО (мл) |
СИ (л/мин/м2) |
ИС (1/1000/сек) |
Индекс HEATHER (Ом/сек2) |
||
|
Исходно |
б/цем |
87,6±5,4 |
3,4±0,2# |
49,4±3,8 |
16,3±1,5 |
|
цем |
80,8±6,9 |
2,9±0,2 |
45,6±3,6 |
17,5±2,0 |
|
|
Начало операции |
б/цем |
88,4±5,3 |
3,2±0,2# |
39,8±2,2¤ |
12,8±0,9 |
|
цем |
83,5±6,6 |
2,7±0,2 |
36,9±1,9* |
13,2±1,6 |
|
|
Конец операции |
б/цем |
78,8±6,4 |
2,7±0,2¤ |
34,8±2,1¤ |
10,7±0,7 |
|
цем |
71,3±6,8 |
2,6±0,2 |
36,6±2,8* |
13,4±1,7 |
|
|
Первые сутки |
б/цем |
100,0±6,6¤# |
4,1±0,2¤# |
57,7±3,7¤# |
19,7±1,8¤ |
|
цем |
81,6±6,0 |
3,2±0,2* |
46,3±3,4* |
20,9±2,6* |
|
Примечание: # – р≤0,05, при сравнении значений между пациентами на различных этапах операции между группами цементного и бес-цементного протезирования; * – р≤0,05, при сравнении значений на различных этапах операции в группе цементного протезирования; ¤ – р≤0,05, при сравнении значений на различных этапах операции в группе бесцементного протезирования.
Индекс доставки кислорода (DO2) к тканям статистически значимо снижался на этапах исследования в обеих группах. Максимальное снижение DO2 на 23 % в сравнении с исходными значениями наблюдалось у больных при бесцементной фиксации в конце операции. Тогда же, к концу операции, установлено достоверное снижение показателя DO2 при цементной фиксации, что, несомненно, связано с токсичным действием метилметакрилата после установки протеза. Клинически значимых отклонений показателя DO2 на этапах исследований в группах в сравнении с соответствующими условно допустимыми отклонениями не зарегистрировано.
Параметры сократимости миокарда характеризовались однозначной направленностью на этапах хирургического вмешательства в обеих группах, которая свидетельствовала о постепенном и поэтапном снижении исследуемых показателей, что явилось следствием большей кровопотери при бесцементном протезировании и кардиодепрессив-ного эффекта метилметакрилата в группе цемент -ного протезирования. Но даже при максимальном снижении значений параметров сократимости, они не выходили за рамки существующих допустимых пределов (табл. 3). Зарегистрирована однонаправленность динамики показателя ИС в исследуемых группах. С начала операции наблюдалось поэтапное снижение ИС, более выраженное у больных при цементной фиксации (р≤0,05).
Были установлены сильные прямые корреляционные связи показателей DO2 у больных в обеих группах с динамикой СИ и УО. Коэффициент Пирсона составил для СИ R = 1,00, для индекса УО R = -0,82. Зарегистрированная динамика DO2 свидетельствует о том, что даже при небольшом снижении СВ происходит снижение доставки кислорода к тканям.
Отмечено, что при большом объеме проводимой инфузионно-трансфузионной терапии не было зарегистрировано накопления свободной внесосуди- стой жидкости в интерстициальном пространстве легких, ни в одном случае в послеоперационном периоде мы не наблюдали клинически срыва компенсации исходных гемодинамических и респираторных нарушений.
По современным представлениям о патогенезе развития нарушений со стороны легочно-сердечной системы при эндопротезровании, их возникновение связано с механической блокадой легочной микроциркуляции (фибрином, жировыми эмболами, агрегированными тромбоцитами) и цитотоксичностью ММА, которые приводят к гипоксической активации процессов ПОЛ, что имеет место при развитии имплантационного синдрома [2, 5, 6].
Анализ полученной нами в процессе ИКГ-мониторинга информации подтвердил, что даже при стабильных показателях артериального давления, пульса, сатурации имеет место достоверное снижение доставки кислорода к тканям и показателей сердечного выброса.
Установленная однонаправленность исследуемых показателей и отсутствие факта регистрации выхода исследуемых показателей за рамки физиологических отклонений свидетельствовали об эффективности примененного варианта анестезиологического обеспечения и адекватности инфузионно-трансфузионного обеспечения.
Таким образом, возможности метода ИКГ позволили нам изучить особенности гемодинамического статуса при выполнении операций тотального эндопротезирования крупных суставов нижних конечностей, выявить на начальном этапе нарушения доставки кислорода к тканям, установить степень гидратации интерстициального пространства легких и оценить адекватность инфузионно-трансфузионного обеспечения. Использование метода ИКГ в периоперционном периоде сложных ортопедических операций позволяет увеличить уровень безопасности оперируемых больных.


