Возможности использования биологически активных веществ растений в терапии рака лёгкого
Автор: Буслаев В.Ю., Минина В.И., Торгунакова А.В., Соболева О.А., Марущак А.В., Яковлева А.А.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 4 (94), 2022 года.
Бесплатный доступ
В настоящее время отмечается значительный интерес к возможности использования биологически активных веществ для решения задач не только профилактики, но и терапии заболеваний человека. Их богатым источником традиционно считаются лекарственные растения, обладающие высоким фармакологическим потенциалом. Терапевтические свойства биологически активных веществ растений были продемонстрированы на примере многих распространённых заболеваний человека. В данном систематическом обзоре обсуждается перспективность применения экстрактов растений в терапии рака лёгкого. Был осуществлен поиск научных статей с использованием баз данных Medline, Scopus, WoS, Pubmed. Их текст был опубликован в открытом доступе на английском языке. В результате анализа источников литературы был сделан вывод о значимом терапевтическом потенциале экстрактов растений и перспективности разработки новых стратегий лечения рака легкого, включающих биологически активные вещества наряду с классическими подходами (с химиотерапевтическими агентами, таргетными препаратами, облучением).
Биологически активные вещества, экстракты растений, рак лёгкого, молекулярные механизмы, терапевтические свойства
Короткий адрес: https://sciup.org/140301771
IDR: 140301771 | УДК: 615.03 | DOI: 10.20914/2310-1202-2022-4-115-123
Текст научной статьи Возможности использования биологически активных веществ растений в терапии рака лёгкого
В настоящее время рак лёгкого (РЛ) занимает первое место среди онкологических заболеваний по уровню смертности во всем мире. Каждый год регистрируется порядка
-
2,3 миллионов новых случаев и 1,8 миллионов летальных исходов [1]. К традиционным методам лечения РЛ относятся различные протоколы химиотерапии, вызывающие повреждения молекулы ДНК в опухолевых клетках и инициацию их апоптоза.
This is an open access article distributed under the terms of the Creative Commons Attribution 4.0 International License
Одновременно с этим повреждаются и нормальные, не трансформированные клетки организма, индуцируется образование вторичных опухолей. Поэтому поиск препаратов, способствующих снижению деструктивных эффектов противоопухолевой терапии, является приоритетной целью.
К перспективным направлениям относится получение биологически активных (БАВ) из растений и их дальнейшее использование в терапии. Комплексное использование данных препаратов с химиотерапевтическими агентами может повышать эффективность лечения онкологических заболеваний [2]. Полагают, что применение лекарственных растений также может быть эффективно при терапии РЛ [3]. Потенциальные механизмы антираковых свойств растительных экстрактов были исследованы и подтверждены с использованием методов клеточного культивирования, а также новых походов молекулярной биологии. Главным образом, они связаны с воздействием на определённые сигнальные пути в клетке [4]. Подробное исследование этих свойств необходимо для оптимизации использования БАВ с целью повышения эффективности терапии.
Терапевтические свойства БАВ можно рассмотреть на примере наиболее распространенных и широко применяемых растительных экстрактов. К ним относятся байкалин, байка-леин, ресвератрол, кверцетин и куркумин. Бай-калин является БАВ растительного происхождения, выделенным из корня шлемника байкальского (Scutellaria baicalensis). Данное растение из семейства яснотковых активно принялось для лечения различных патологий в китайской традиционной медицине. По своей химической структуре байкалин является липофильным флавоноидным гликозидом. Отмечены его антиоксидантные, нейропротектив-ные, противовоспалительные, противовирусные и противоопухолевые свойства [5]. Байкалеин относится к типичным флавоноидам, также полученным в результате экстракции из растений Scutellaria baicalensis. В настоящее время для данного вещества был определён разнообразный спектр терапевтических свойств, включая антиоксидативные, противовоспалительные и гепатопротективные свойства. Особое внимание уделяется исследованию противораковых свойств данного вещества [6].
Ресвератрол (3,5,4-тригидрокси-транс-стильбен) относится к растительным экстрактам, в больших количествах он содержится в винограде, шелковице, малине, арахисе.
Данное вещество известно своей нейропротек-тивной, фунгицидной и противовирусной активностью. Ресвератрол участвует в ингибировании пролиферации и воспалительных процессов на примере клеточных моделей эндометриоза [7]. Нейропротективные эффекты заключаются в предупреждении разрушения нервных клеток и снижении воспаления [8]. Противоопухолевые свойства ресвератрола отмечены на примере многих онкологических заболеваний.
Куркумин (диферулоилметан) – жёлтый пигмент, растительный экстракт, получаемый преимущественно из растений вида Curcuma longa. Физиологические эффекты экстракта заключаются в лечении диабета, стабилизации функции мозга, противоспалительной и анти-оксидативной активности. Вещество относится к полифенолам и способно участвовать в проведении сигналов в различных клетках, участвуя в модуляции определённых сигнальных путей [9].
Кверцетин относится к группе БАВ-флавоноидов, выделяемых из растений. С помощью лабораторных животных были показаны антиоксидативные эффекты кверцетина, которые могут применяться при лечении сердечно-сосудистой системы. Его применение связано с предупреждением развития хронических заболеваний сосудов и снижением артериальной гипертензии [10]. В последнее время активно разрабатываются подходы по использованию противовирусных свойств данного препарата.
В связи с этим целью данного систематического обзора было обобщение современных данных о возможности использовании данных растительных экстрактов в терапии рака лёгкого.
Материалы и методы
Поиск научных статей для систематического обзора проводился с использованием баз данных Medline, Scopus, Web of Science, Pubmed. Были использованы ключевые слова: molecular mechanisms, therapeutic features, plant extracts в сочетании с lung cancer.
Критерии включения. Для составления систематического обзора были использованы научные работы, опубликованные за последние 10 лет, текст которых был доступен на английском языке. Использовался текст, размещенный в ресурсах Medline, Scopus, Web of Science, Pubmed. В раздел «результаты» систематического обзора главным образом включались научные работы, рассматривавшие вопросы
Буслаев В.Ю. и др. Вестник ВГУИТ, 2022, Т. 84, №. 4, С. 115-123 применения растительных экстрактов при терапии РЛ. Также преимущественно отбирались научные работы с данными о молекулярнобиологических механизмах терапии РЛ с участием БАВ растений.
Критерии исключения. В систематический обзор не включались статьи, рассматривавшие эффекты действия фитохимических препаратов с использованием цитогенетических методов. В обзор не были включены научные статьи, опубликованные более 10 лет назад. В конечном итоге в систематический обзор было включено 38 статей. В шести статьях описывались эффекты действия байкалина, в 3 статьях – байкалеина, в 7 – ресвератрола, в 8 – куркумина, а также 9 – кверцетина.
Результаты
При использовании байкалина наблюдалось снижение резистентности клеток РЛ к цисплатину [11]. В исследовании были использованы клеточные линии А549 и А549/DPP, которые последовательно подвергались совместному воздействию двух веществ. В составе линии А549/DPP после обработки цисплатином, факторы МАRК2 и p-Akt характеризовались повышенной степенью своей экспрессии. Действие байкалина обуславливало снижение уровня синтеза мРНК этих киназ. Дозо-зависимые эффекты активности байка-лина способствовали снижению синтеза МАRК2 и p-Akt на уровне белка. Синергический эффект байкалина и цисплатина заключался в подавлении пролиферативной активности клеток РЛ и их инвазии через воздействие на эффекторные киназы. Было установлено, что эффективность терапии РЛ определяется особенностями репарационного потенциала раковых клеток. Недавнее исследование указало на возможность снижения резистентности опухолей РЛ к цисплатину при использовании бай-калина [12].
Хемопревентивные свойства ресвератрола были показаны на лабораторных животных с наличием легочного канцерогенеза [13]. Лабораторные животные (крысы) подвергались воздействию различных химических субстанций, после чего фиксировалось изменение определённых характеристик. Животные были разделены на пять исследуемых групп, подвергавшихся воздействию бенз[а]пирена, курку-мина, ресвератрола, а также куркумина и ресвератрола. Воздействие бенз[а]пирена приводило к повышению синтетической активности фермента, метаболизирующего ПАУ (арил-гидрокарбонгидроксилазы).
Гистологические исследования тканей лёгких позволили установить, что воздействие курку-мина и ресвератрола приводило к снижению процессов, ассоциированных с онкогенезом. Наблюдалось отсутствие ядерного полиморфизма, уменьшение размеров ядра и отсутствие повышенной вакуолизации.
Эффективность использования цисплатина при терапии немелкоклеточной формы РЛ может повышаться при условии добавления куркумина. Куркумин, в свою очередь, усиливает чувствительность опухоли к действию цисплатина, воздействуя на стрессорный сигнальный путь, ассоциированный с эндоплазматическим ретикулумом [14]. Для раскрытия этих механизмов клеточные линии А549/DDP и Н1299/DDP подвергались обработке цисплатином и куркумином. Далее осуществлялась оценка уровня синтеза факторов, задействованных в апоптозе, реакциях клеточного стресса (реализуемого с участием эндоплазматического ретикулума). К целевым факторам для исследования относились: каспазы 3 и 4, PARP, CHOP, GRР78, XBP-1 и ATF-6. Совместное применение куркумина и цисплатина на исследованных клетках позволило обнаружить тенденцию к подавлению их выживаемости. Факторы, задействованные в апоптозе и клеточном стрессе, характеризовались повышением своего синтеза как на уровне мРНК, так и на уровне белковых молекул. Сигнальный путь клеточного стресса, реализуемый белками эндоплазматического ретикулума, может активно использоваться как терапевтическая мишень.
При лечении мелкоклеточной формы РЛ рассматривается возможность применения адювантной терапии с участием ресвератрола. В данном исследовании были оценены свойства ресвератрола на примере клеточной линии мелкоклеточного РЛ Н446 [15]. В составе этой клеточной линии в процессе воздействия ресвератрола были оценены показатели экспрессии цитохрома С, работа сигнального пути РIК3К/Akt/c-Myc, а также особенности ядерной транслокации проапоптозного фактора AIF. Были также оценены показатели оксидативного стресса и мембранный потенциал митохондрий. В результате активности ресвератрола было зафиксировано повышение экспрессии цитохрома С, блокировка работы РIК3К/Akt/c-Myc, также инициировалась транслокация фактора AIF из цитоплазмы в ядро. Было обнаружено повышение оксидативного стресса и деполяризация ядерной мембраны, что вносило вклад в развитие апоптоза в клетках линии Н446.
Генетические особенности пациентов не позволяют эффективно применять химиотерапевтический препарат гефитиниб. Это связано с наличием большого количества мутаций в генах EGFR и KRAS. Для куркумина были отмечены молекулярные механизмы, которые позволяют подавлять резистентность опухолей к действию гефитиниба при запуске клеточной смерти, ассоциированной с аутофагией [16]. Клетки немелкоклеточной формы РЛ Н157 и Н1299, содержащие мутации дикого типа в генах EGFR и KRAS подвергались одиночному и совместному действию куркумина и ге-фитиниба. После обработки оценивалась активность EGFR, а также белка SР1 и ассоциированных с ним белков. Активность рецепторных тирозин-киназ была изучена для определения возможности реализации клеточной смерти по типу аутофагии. В результате совместного использования куркумина и гефи-тиниба была осуществлена блокировка активности EGFR, через подавление фактора SР1.
При изучении антираковых свойств и других фармакологических эффектов растительных экстрактов на клетках опухоли важно оценивать показатели клеток окружения опухоли. Окружение опухоли представляет собой популяцию, состоящую из столовых клеток, которая потенциально может предопределять уровень резистентности опухоли к химиотерапии. С целью тестирования ингибиторных свойств куркумина было проведено исследование с использованием клеток А459 лабораторных мышей [17]. Использовался материал окружения опухоли и клеток, не относящихся к данной популяции. В ходе анализа активности куркумина оценивались множественные параметры клеток: размер и вес опухоли, экспрессия факторов Notch, HIF-1 (индуцирующего гипоксию), а также фактора роста эндотелия (VEGF) и ядерного фактора NF-kВ. Эффекты куркумина определяли снижение показателей роста опухоли (снижался её вес и размер), на уровне мРНК экспрессия Notch и HIF-1 подавлялась. Также происходило снижение экспрессии VEGF и NF-kВ. Было установлено, что куркумин может подавлять рост опухоли путём ингибирования ангиогенеза, влияя на активность VEGF.
Кверцетин совместно с куркумином может контролировать ход посттрансляционных модификаций р53 и влиять на развитие канцерогенеза [18]. Антираковые эффекты в данном случае прослеживаются на примере РЛ, индуцированного бенз[а]пиреном. Было сформировано несколько групп лабораторных животных для исследования: контроль; группа, подвергнутая воздействию бенз[а]пиреном; куркуми-ном; кверцетином; а также бенз[а]пиреном, куркумином и кверцетином вместе. Активность куркумина и кверцетина была ассоциирована с повышением содержания ацетилированного р53, уровень которого подавлялся с участием бенз[а]пирена. Кроме того, курку-мин и кверцетин способствовали уменьшению уровня фосфорилированного р53. Повышенная активность каспаз 3 и 9 индуцировала апоптоз при условии воздействия куркумином и кверцетином. Активность фитохимических соединений способствовала улучшению гистологических показателей опухоли.
Ранее также были получены сведения о возможных протективных эффектах фитохи-мических свойств кверцетина относительно легочного канцерогенеза [19]. Активность курку-мина и кверцетина также была противопоставлена бенз[а]пирену. Лабораторные животные подвергавшиеся действию бенз[а]пирена имели повышенные показатели перекисного окисления липидов по причине усиленного синтеза активных форм кислорода. Активность цитохромов (450 и b5), метаболизирующих ксенобиотики, повышалась. Курку-мин и кверцитин способствовали снижению окислительных процессов в клетке и уменьшению активности компонентов биотрансформации ксенобиотиков. Формирование стабильного антиоксидативного статуса способствует эффективному снижению патологических процессов, связанных с РЛ.
Были оценены потенциальные протек-тивные свойства кверцетина не только как лекарственного препарата, но и пищевого компонента. Было сделано предположение о том, что пища, богатая содержанием кверцетина, может предупреждать риск развития РЛ [20]. В данном случае кверцетин проявляет свои свойства через регуляцию экспрессии определённых микроРНК. Исследования семейных случаев аденокарциномы лёгкого указало на возможность регуляции дифференциальной экспрессии микроРНК из группы let-7. Также были отмечены изменения показателей экспрессии молекул miR-146, miR-26, miR-17. Среди курящих пациентов было обнаружено 33 молекулы микроРНК, экспрессия которых значимо различалась в зависимости от состава употребляемой пищи. В итоге были установлены ключевые молекулы микроРНК, которые изменяли экспрессию в зависимости от уровня содержания кверцетина в пище.
Недавнее исследование показало возможность снижения карциногенных эффектов определённых химических веществ через реализацию специфических молекулярных механизмов [21]. В качестве канцерогена был выбран мышьяк, так как его употребление с питьевой водой может многократно увеличивать риски развития многих онкопатологий. Его прокарциногенные эффекты связаны с повышением оксидативного стресса, воздействием на систему репарации ДНК и последующими повреждениями в молекуле ДНК. В этом исследовании показана возможность снижения онкогенных свойств мышьяка. В качестве основного механизма активности препарата кверцетина было развитие апоптоза раковых клеток в дозо-зависимом режиме. Под его воздействием клетки опухоли, предварительно обработанные мышьяком, теряли способность к активной пролиферации. Дополнительно в составе раковых клеток последовательно индуцировались двойные разрывы в ДНК по причине повышения оксидативного стресса.
Продукция активных форм кислорода, в свою очередь, активировала каспазу-3, которая запускала механизмы программируемой клеточной смерти.
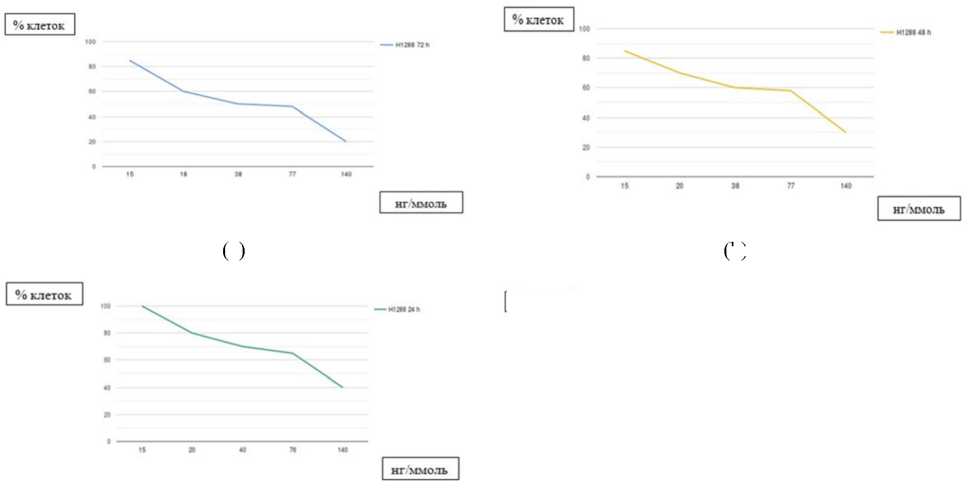
Эффективность использования растительных экстрактов в терапии РЛ во многих исследованиях была продемонстрирована в дозозависимом режиме. Действие байкалина на линии Н1299 и Н1650 характеризовалось цитотоксичностью и понижением выживаемости раковых клеток [22]. После воздействия определёнными концентрациями байкалина в разные промежутки времени был подсчитан процент жизнеспособных клеток (рисунок 1). Ресвератрол может усиливать активность цитокина TRAIL при развитии апоптоза раковых клеток в дозо-зависимом режиме [23]. Добавление разных концентраций ресвератрола (0; 12,5; 50 ммоль) при 12-часовом действии 100 нг/ммоль TRAIL обуславливало последовательное снижение жизнеспособности клеток линий А549 и HCC-15 (рисунок 2).
(a)
(b)
(c)
Рисунок 1. Дозо-зависимые эффекты байкалина на показатели выживаемости клеток Н1288; a) 24-часовое воздействие байкалина; b) 48-часовое воздействие байкалина; c) 72-часовое воздействие байкалина
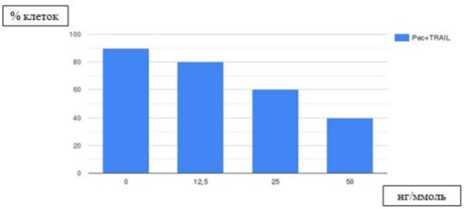
Рисунок 2. Ресвератрол (Рес.) обеспечивает усиление апоптоза, опосредованного активностью фактора TRAIL
Figure 1. Dose-devendent effects of baicalin on survialance parameters of Н1288 cells: a) 24-hour action of baicalin; b) 48-hour action of baicalin; c) 72-hour action of baicalin
Figure 2. Resveratrol (Res.) enhances apoptosis, caused by activity of TRAIL factor
С учётом разнообразных терапевтических свойств растительных экстрактов относительно развития РЛ, активно осуществляется оптимизация их использования в качестве лекарственных препаратов. На основе байка-лина производятся наномицеллы при добавлении дополнительных агентов (стеариновой кислоты и кополимера Pluoronic F-68).
При создании наномицелл необходимо учитывать определённые параметры: размеры, особенности поверхности, коллоидную стабильность и морфологию. Был осуществлён их дизайн, продемонстрирована эффективная цитотоксическая активность относительно клеточной линии РЛ А549 [24]. На примере ресвератрола была также показана возможность создания наночастиц с их последующим терапевтическим применением. Учитывая его физико-химические свойства, ресвератрол помещённый в подобные структуры успешно применяется в терапии многих онкопатологий, включая РЛ [25]. С использованием лабораторных мышей рассматривалась возможность интраназального применения ресвератрола для лечения РЛ [26]. Оптимизация использования куркумина в качестве терапевтического средства связана с созданием [27]. Активно рассматриваются способы синтеза наномицелл, наночастиц, углеродных нанотрубок, суспензий, в состав которых помещается куркумин. Возможность создания эффективных препаратов для терапии РЛ на основе кверцетина также рассматривается с применением нанолипосом [28].
Обсуждение
Многочисленные примеры противоопухолевого действия растительных БАВ на опухолевые клетки РЛ ставят вопрос о фундаментальных механизмах такого влияния. Подойти к пониманию этого вопроса позволяет использование высокопроизводительных технологий. Так, активно используются транскриптомные технологии, позволяющие установить изменение активности ключевых генов-регуляторов. Например, глобальное профилирование тран-скриптома клеток Н446 для изучения антираковых эффектов куркумина показало, что экспрессия генов, связанных с контролем клеточного цикла была подавлена, а для микроРНК miRNА-548аh-5р, напротив, было отмечено повышение активности [29].
Воздействие на молекулярные сигнальные пути, задействованные в онкогенезе, лежит в основе противораковых свойств БАВ растений и является наиболее эффективным механизмом борьбы с опухолями. Обобщая подобные работы, можно выделить несколько значимых молекулярных сигнальных путей (таблица 1). При изучении эффектов байкалина было установлено влияние на серин / треониновую киназу РDК1, которая участвует в миграции и усилении клеточной пролиферации. Как следствие, отмечается снижение выживаемости опухолевых клеток [30].
Таблица 1.
Молекулярные сигнальные пути, контролируемые БАВ растений
Table 1.
Molecular signaling pathways, controlled by biologically active compounds of plants
|
Растительный экстракт Plant extrac |
Молекулярный сигнальный путь Molecular signaling pathway |
Источник Ref |
||
|
Байкалин | Baikalin |
РDК1/AKT |
[30] |
||
|
Байкалеин | Baicalein |
TFAE-РI3К/Akt-ТWISТ1 |
[31] |
||
|
Ресвератрол | Resveratrol |
Notch-1 |
[33] |
||
|
Кверцетин | Quercetin |
Snail–АDАМ9 |
[36] |
||
Байкалеин наряду с вогонином и орокси-лином А входит в общую группу флавоноидных агликонов, экстрагированных из Scutellaria baicalensis . Совокупный эффект их действия заключается в уменьшении возможности инвазии и миграции клеток РЛ. На примере немелкоклеточной формы РЛ показаны ингибирующие свойства байкалеина, вогонина и ороксилина А относительно процесса эпителиально-мезенхимальной транзиции [31]. Была установлена возможность взаимодействия с путём РI3К/Akt, в особенности с ключевым фактором ТWISТ1. Использование байкалина вместе с другими терапевтическим растительными экстрактами может способствовать снижению риска метастазирования в случае образования немелкоклеточной формы РЛ. РI3К/Akt рассматривается как важный сигнальный путь, повышающий возможность выживаемости и резистентности клеток опухоли. В этой связи было разработано определённое количество его ингибиторов с целью повышения эффективности терапии немелкоклеточного РЛ [32]. Фактор TWIST как транскрипционный фактор обеспечивает работу эпителиально-мезенхимального перехода, который играет важную роль в онкогенезе. В частности, ТWISТ1 обеспечивает супрессию реакций апоптоза и клеточного старения.
Куркумин участвует в супрессии фактора ЕZН2 через микроРНК (miR) – let 7с и miR-101. Ингибирование ЕZН2 сопровождается подавлением экспрессии Notch-1-фактора [33]. Этот специфический сигнальный каскад создаёт основу для проявления противораковых свойств куркумина. На примере клеток РЛ в данном случае было отмечено замедление их роста, а также снижение возможности развития метастазирования. ЕZН2 является ключевым компонентом репрессирующего комплекса polycomb-белков у человека и участвует в триметилировании гистонового белка Н3К27. Notch-1-фактор работает как классический онкоген, участвуя в инициации развития опухоли, в то время как notch-2 относится к онкосупрессорам. Онкогенез под действием Notch-1 реализуется путём влияния на факторы Неs1 и Ras/MAPK [34; 35].
Свойства кверцетина могут быть использованы для борьбы с метастазированием РЛ. Данный фитохимический агент имеет способность к замедлению клеточной миграции и инвазии. Эти явления могут быть реализованы через воздействие на путь передачи сигналов от эпителия к мезенхиме, опосредованным фактором Snail [36]. Контроль инвазивной активности клеток немелкоклеточного РЛ (А549 и НСС827) происходил посредством усиления экспрессии факторов maspin и металлопротеиназы АDАМ9. Snail относится к семейству транскрипционных факторов с наличием «цинкового пальца» и является активатором Е-кад-герина и ключевым регулятором эпителиальномезенхимального перехода. Его участие в развитии опухолеобразования указывает на необходимость создания ингибиторов Snail [37]. Исследование клеток РЛ с использованием метода РНК-секвенирования позволило установить, что фактор АDАМ9 участвует в инициации развития метастазов [38]. Уменьшение его активности может приводить к снижению клеточной пролиферации и миграции, что важно в контексте терапии РЛ.
Заключение
В данном систематическом обзоре были рассмотрены возможности использования фи-тохимических агентов в терапии рака лёгкого.
В исследованиях, включенных в обзор, рассматривались разнообразные примеры и механизмы терапевтического действия растительных экстрактов. Главным образом, это может быть реализовано через различные сигнальные пути, задействованные в инициации злокачественной трансформации. Кроме того, была отмечена эффективность использования химиотерапевтических агентов совместно с растительными экстрактами. Эффекты были связаны со снижением токсического действия противоопухолевых веществ через целенаправленное воздействие на сигнальные пути. Создание и дизайн новых лекарственных препаратов из растений является основной задачей новых стратегий антираковой терапии. Учитывая широкий спектр действия фитохимических агентов, необходимо проведение дальнейшего изучения их противоопухолевых эффектов. Этот этап целесообразно реализовывать с использованием клеточных технологий.
Список литературы Возможности использования биологически активных веществ растений в терапии рака лёгкого
- Sung H., FerlayJ., Siegel R.L., Laversanne M., Soerjomataram I. Global cancer statistics 2020: GLOBOCAN estimates incidence and mortality worldwide for 36 cancers in 185 countries. CA: A cancer journal for clinicians. 2021.no.3.pp.209-248. https://doi.org/10.3322/caac.21660
- Pezzani R., Salehi B., Vitalini S., Iriti M. Synergistic Effects of Plant Derivatives and Conventional Chemotherapeutic Agents: An Update on the Cancer Perspective. Medicina. 2019. no. 4.pp.110-126. https://doi.org/10.3390/medicina55040110
- Chota A., George B.P., Abrahamse H. Potential Treatment of Breast and Lung Cancer Using Dicoma anomala, an African Medicinal Plant. Molecules. 2020.no.19.pp.1-17. https://doi.org/10.3390/molecules25194435
- Koroth J. et al. Investigation of anti-cancer and migrastatic properties of novel curcumin derivatives on breast and ovarian cancer cell lines. BMC Complement Altern Med. 2019. no.1.pp.273-289.
- de Oliveira M.R., Nabavi S.F., Habtemariam S., Erdogan Orhan I., Daglia M., Nabavi S.M. The effects of baicalein and baicalin on mitochondrial function and dynamics: A review. Pharmacol Res. 2015.pp.296-308.
- Lian H., Hui Y., Xiaoping T., Wei T., Jiyi X., Xiaolan Y. Baicalein suppresses the proliferation of human cervical cancer cells via Notch 1/Hes signaling pathway. J Cancer Res Ther. 2019..no.6.pp.1216-1220.
- Kolahdouz Mohammadi R., Arablou T. Resveratrol and endometriosis: In vitro and animal studies and underlying mechanisms (Review). Biomed Pharmacother. 2017.pp.220-228.
- Teertam S.K., Jha S., Prakash Babu P. Up-regulation of Sirt1/miR149-5p signaling may play a role in resveratrol induced protection against ischemia via p53 in rat brain. J Clin Neurosci. 2020.pp.402-411.
- Rodrigues F.C. et al.Developments in the anticancer activity of structurally modified curcumin: An up-to-date review. European Journal of Medicinal Chemistry. 2019. pp. 76-104. https://doi.org/10.1016/j.ejmech.2019.04.058
- Brüll V. et al. Effects of a quercetin-rich onion skin extract on 24 h ambulatory blood pressure and endothelial function in overweight-to-obese patients with (pre-)hypertension: a randomised double-blinded placebo-controlled cross-over trial. Br J Nutr. 2015.no.8.pp.1263-1277. https://doi.org/10.1017/S0007114515002950
- Xu Z., Mei J., Tan Y. Baicalin attenuates DDP (cisplatin) resistance in lung cancer by downregulating MARK2 and p-Akt. Int J Oncol. 2017.no.1.pp..93-100. DOIi:10.3892/ijo.2016.3768
- Yin Z. et al. Baicalin attenuates XRCC1mediated DNA repair to enhance the sensitivity of lung cancer cells to cisplatin. J Recept Signal Transduct Res. 2022.no.3.pp.215-224. https://doi.org/10.1080/10799893.2021.1892132
- Liu D., He B., Lin L., Malhotra A., Yuan N. Potential of curcumin and resveratrol as biochemical and biophysical modulators during lung cancer in rats. Drug Chem Toxicol. 2019. no.3.pp.:328-334. https://doi.org/10.1080/01480545.2018.1523921
- Wang J.Y. et al. Curcumin inhibits the growth via Wnt/β-catenin pathway in non-small-cell lung cancer cells. Eur Rev Med Pharmacol Sci. 2018, no.21.pp.7492-7499. https://doi.org/10.26355/eurrev_201811_16290
- Li W., Li C., Ma L., Jin F. Resveratrol inhibits viability and induces apoptosis in the smallcell lung cancer H446 cell line via the PI3K/Akt/cMyc pathway. Oncol Rep., 2020. https://doi.org/10.3892/or.2020.7747
- Chen P. et al. Curcumin overcome primary gefitinib resistance in non-small-cell lung cancer cells through inducing autophagy-related cell death. J Exp Clin Cancer Res. 2019; 38(1):254. https://doi.org/10.1186/s13046-019-1234-8
- Li X., Ma S., Yang P., et al. Anticancer effects of curcumin on nude mice bearing lung cancer A549 cell subsets SP and NSP cells. Oncol Lett. Published online September 24, 2018. https://doi.org/10.3892/ol.2018.9488
- Zhang P., Zhang X. Stimulatory effects of curcumin and quercetin on posttranslational modifications of p53 during lung carcinogenesis. Hum Exp Toxicol. 2018.no.6.pp.618-625. DOI; 10.1177/0960327117714037
- Liu Y., Wu Y.M., Zhang P.Y. Protective effects of curcumin and quercetin during benzo(a)pyrene induced lung carcinogenesis in mice. Eur Rev Med Pharmacol Sci. 2015.no.9.pp.1736-1743
- Lam T.K., Shao S., Zhao Y., et al. Influence of quercetin-rich food intake on microRNA expression in lung cancer tissues. Cancer Epidemiol Biomarkers Prev. 2012.no.12.pp.2176-2184. https://doi.org/10.1158/1055-9965.EPI12-0745
- Yang P., Li X., Wen Q., Zhao X. Quercetin attenuates the proliferation of arsenic-related lung cancer cells via a caspase-dependent DNA damage signaling. Mol Carcinog. 2022.no.7.pp.655-663. https://doi.org/10.1002/mc.23408
- Sui X et al. Baicalin Induces Apoptosis and Suppresses the Cell Cycle Progression of Lung Cancer Cells Through Downregulating Akt/mTOR Signaling Pathway. Front Mol Biosci. 2021; 7:602282. https://doi.org/10.3389/fmolb.2020.602282
- Rasheduzzaman M., Jeong J.K., Park S.Y. Resveratrol sensitizes lung cancer cell to TRAIL by p53 independent and suppression of Akt/NF-κB signaling. Life Sciences. 2018.no.208.pp.208-220. https://doi.org/10.1016/j.lfs.2018.07.035
- Jangid A.K. et al. Baicalin encapsulating lipid-surfactant conjugate based nanomicelles: Preparation, characterization and anticancer activity. Chemistry and Physics of Lipids. 2020.pp.104978. https://doi.org/10.1016/j.chemphyslip.2020.104978
- Annaji M., Poudel I., Boddu S.H.S, Arnold R.D, Tiwari A.K, Babu R.J. Resveratrol loaded nanomedicines for cancer applications. Cancer Reports. 2021.no.3.pp.1-21. https://doi.org/10.1002/cnr2.1353
- Monteillier A., Voisin A., Furrer P., Allémann E., Cuendet M. Intranasal administration of resveratrol successfully prevents lung cancer in A/J mice. Sci Rep. 2018.no.1.pp.14257. https://doi.org/10.1038/s41598-018-32423-0
- Wu Q., Ou H., Shang Y., Zhang X., Wu J., Fan F. Nanoscale Formulations: Incorporating Curcumin into Combination Strategies for the Treatment of Lung Cancer. Drug Des Devel Ther. 2021.pp.2695-2709. https://doi.org/10.2147/DDDT.S311107
- Zhou X., Liu H.Y., Zhao H., Wang T. RGD-modified nanoliposomes containing quercetin for lung cancer targeted treatment. Onco Targets Ther. 2018.pp.5397-5405. https://doi.org/10.2147/OTT.S169555
- Mo F., Xiao Y., Zeng H., et al. Curcumin-Induced Global Profiling of Transcriptomes in Small Cell Lung Cancer Cells. Front Cell Dev Biol. 2021.no.588.pp.299. https://doi.org/10.3389/fcell.2020.588299
- Chen J., Yuan C.B., Yang B., Zhou X. Baicalin Inhibits EMT through PDK1/AKT Signaling in Human Nonsmall Cell Lung Cancer. J Oncol. 2021.pp.4391581. https://doi.org/10.1155/2021/4391581
- Cao H.J., Zhou W., Xian X.L., et al. A Mixture of Baicalein, Wogonin, and Oroxylin-A Inhibits EMT in the A549 Cell Line via the PI3K/AKT-TWIST1Glycolysis Pathway. Front Pharmacol. 2021.pp.821485. https://doi.org/10.3389/fphar.2021.821485
- Sanaei M.J., Razi S., Pourbagheri-Sigaroodi A., Bashash D. The PI3K/Akt/mTOR pathway in lung cancer; oncogenic alterations, therapeutic opportunities, challenges, and a glance at the application of nanoparticles. Transl Oncol. 2022.pp.101364. https://doi.org/10.1016/j.tranon.2022.101364
- Wu G.Q., Chai K.Q., Zhu X.M, et al. Anti-cancer effects of curcumin on lung cancer through the inhibition of EZH2 and NOTCH1. Oncotarget. 2016.no.18.pp.26535-26550. https://doi.org/10.18632/oncotarget.8532
- Cenciarelli C., Marei H.E., Zonfrillo M, et al. The interference of Notch1 target Hes1 affects cell growth, differentiation and invasiveness of glioblastoma stem cells through modulation of multiple oncogenic targets. Oncotarget. 2017.no.11.pp.17873-17886. https://doi.org/10.18632/oncotarget.15013
- Mittal S., Sharma A., Balaji S.A., et al. Coordinate Hyperactivation of Notch1 and Ras/MAPK Pathways Correlates with Poor Patient Survival: Novel Therapeutic Strategy for Aggressive Breast Cancers. Molecular Cancer Therapeutics. 2014.no12.pp.3198-3209. https://doi.org/10.1158/1535-7163.MCT14-0280
- Chang J.H., Lai S.L., Chen W.S., et al. Quercetin suppresses the metastatic ability of lung cancer through inhibiting Snail-dependent Akt activation and Snail-independent ADAM9 expression pathways. Biochim Biophys Acta Mol Cell Res. 2017.no.10.pp. 1746-1758. https://doi.org/10.1016/j.bbamcr.2017.06.017
- Yang X., Han M., Han H. et al. Silencing Snail suppresses tumor cell proliferation and invasion by reversing epithelial-to-mesenchymal transition and arresting G2/M phase in non-small cell lung cancer. International Journal of Oncology. 2017.no.4.pp.1251-1260. https://doi.org/10.3892/ijo.2017.3888
- Sher Y.P, Liu J.P, Lo C.C, Kuo T.T, Liu S.J. ADAM9 as a target for lung cancer treatment. Annals of Oncology. 2019.no.78. https://doi.org/10.1093/annonc/mdz268.087


