Возможности использования комбинированных оральных контрацептивов и антиандрогенов в терапии синдрома поликистозных яичников у женщин позднего репродуктивного возраста
Автор: Семенова Ю.Б., Смирнов В.В., Шаповалова А.Б., Файзуллина Р.Р., Макеева Р.М., Хасанова Е.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Актуальность. Синдром поликистозных яичников является одним из наиболее распространённых эндокринных нарушений у женщин репродуктивного возраста и сопровождается нарушением менструального цикла, гиперандрогенией, инсулинорезистентностью. Для коррекции андрогении обычно используются комбинированные оральные контрацептивы или антиандрогенные препараты. Цель исследования: сравнить эффективность и безопасность применения антиандрогенов и комбинированных оральных контрацептивов в терапии синдрома андрогении при синдроме поликистозных яичников в позднем репродуктивном периоде. Объект и методы. Обследовано 44 женщины с синдромом поликистозных яичников в возрасте 35–45 лет. Первую группу составили 25 пациенток, получавшие терапию этинилэстрадиолом в сочетании с дроспиреноном. Вторую группу составили 19 пациенток, получавшие терапию ципротероном. Всем пациенткам были выполнены общеклинические исследования: общий анализ крови, общий анализ мочи, биохимическое исследование крови, оценка психологического состояния по шкале депрессии Бека, эхокардиография, суточное мониторирование артериального давления, определение уровня андрогенов, дигидротестостерона, тестостерона, Д–димера, гомоцистеина, маркеров резорбции и ресинтеза костной ткани в крови. Результаты. Результаты исследования показали, что уровни андрогенов у пациенток, получавших терапию комбинированными оральными контрацетивами и антиандрогенами оказались сопоставимы в обеих группах. У пациенток, принимающих комбинированные оральные контрацептивы, был выше уровень депрессии по шкале Бека, чаще встречалась артериальная гипертензия, а также отмечался более высокий уровень Д–димера, при этом отмечались более низкие показатели атерогенных фракций липидограммы и гомоцистеина. Пациентки, принимавшие антиандрогены, имели более высокий уровень печёночных трансаминаз. Выводы. Комбинированные оральные контрацептивы и антиандрогены продемонстрировали сопоставимую эффективность в коррекции лабораторных проявлений андрогении. Комбинированные оральные контрацептивы способствуют снижению сердечно-сосудистого риска за счёт снижения уровня атерогенных фракций липидограммы и гомоцистеина, но могут провоцировать развитие артериальной гипертензии. Терапия комбинированными оральными контрацептивами сопряжена с более высоким риском развития депрессивных состояний, поэтому целесообразно перед инициацией терапии проводить тестирование пациенток по шкале депрессии Бека. Терапия антиандрогенами приводит к более высокому риску гепатотоксичности, что сопровождается повышением уровня печёночных трансаминаз и требует регулярного лабораторного контроля этих показателей.
Синдром поликистозных яичников [D011085], комбинированные оральные контрацептивы [D003276], антиандрогены [D000730], гиперандрогения [D017588], этинилэстрадиол [D004997], дроспиренон [D004958], ципротерон [D003533], андростендион [D000735], дигидротестостерон [D013196], тестостерон [D013739], Д-димер [D015415], гомоцистеин [D006710], артериальная гипертензия [D006973], гепатотоксичность [D056486], остеопороз [D010024], липидный профиль [D008055]
Короткий адрес: https://sciup.org/143184992
IDR: 143184992 | УДК: 618.11-008.6-085:615.175.2:615.178 | DOI: 10.20340/vmi-rvz.2025.4.CLIN.4
Текст научной статьи Возможности использования комбинированных оральных контрацептивов и антиандрогенов в терапии синдрома поликистозных яичников у женщин позднего репродуктивного возраста
Синдром поликистозных яичников (СПЯ) является распространённым многофакторным эндокринным заболеванием у женщин репродуктивного возраста, требующим комплексного подхода к диагностике и лечению.
По данным различных исследований, распространённость СПЯ составляет от 4% до 15% среди женщин детородного возраста, и около 70% – среди женщин с бесплодием в зависимости от используемых диагностических критериев [1–3].
Наиболее часто для верификации диагноза используются Роттердамские критерии 2003 г., согласно которым заболевание диагностируется при наличии двух из трёх признаков: олиго- или анову-ляция; гиперандрогения (клиническая – гирсутизм, акне, аллопеция или лабораторная – повышение уровня андрогенов в крови); поликистозная трансформация яичников (при проведении УЗИ>20 фолликулов диаметром 2–9 мм в одном яичнике и/или увеличенный объём яичника >10 см3. При этом другие причины гиперандрогенизма и нарушений менструального цикла исключаются [4].
Одним из ключевых аспектов лечения СПЯ является коррекция гормональных нарушений и устранение симптомов, связанных с гиперандроге-нией. В фармакотерапии синдрома поликистозных яичников использование комбинированных оральных контрацептивов (КОК) и антиандрогенов является наиболее распространённым [5, 6].
Первой линией рекомендаций являются КОК с низкими дозами эстрогенов и прогестагенов, обладающие антиандрогенным действием. КОК регулируют менструальный цикл и снижают клиниколабораторные проявления андрогении [7]. Чаще всего используют препараты, содержащие этинил-эстрадиол в низкой дозе и дроспиренон или ци-протепрон – прогестагены с выраженным антиан-дрогенным действием. К преимуществам КОК относятся: регуляция менструального цикла, сниже- ние уровня андрогенов, профилактика гиперплазии эндометрия, контрацептивный эффект и снижение риска развития кист. Эти механизмы делают КОК универсальным средством для управления как симптомами СПЯ, так и возможными долгосрочными осложнениями [6, 8–10].
Тем не менее, терапия КОК имеет и свои отрицательные стороны [10, 11].
Так, у некоторых женщин КОК могут повышать риск развития артериальной гипертензии, так как эти препараты за счёт содержащихся в них эстрогенов активируют ренин-ангиотензиновую систему, что требует наблюдения за уровнем артериального давления во время терапии [12].
К нежелательным эффектам также относится гепатотоксичность, в некоторых случаях КОК могут способствовать развитию холестаза и других печёночных нарушений [13].
Нередко возникают такие побочные эффекты, как головные боли, тошнота, снижение либидо и настроения, мастодиния [14, 15].
Исследования показывают, что женщины, принимающие КОК, имеют немного более высокий риск развития рака молочной железы, по сравнению с теми, кто никогда не использовал эти препараты. Хотя этот риск является временным и после прекращения приема КОК приблизительно через 10 лет становится среднепопуляционным [16–18].
С другой стороны, приём эcтрогенсодержащих препаратов может снижать риск развития других видов злокачественных опухолей, таких как рак яичников и эндометрия, колоректальный рак, рак поджелудочной железы и лёгких [19, 20].
Исследования показывают, что приём КОК может привести к развитию депрессии из-за снижения уровня витамина B6, который необходим для синтеза серотонина. КОК также увеличивают уровень глюкуронидазы простагландиновой системы (ГСПГ), что вызывает снижение либидо и ухудшение качества жизни [21].
Приём КОК в позднем репродуктивном периоде может существенно влиять на систему свертывания крови. Эстрогены, содержащиеся в КОК, активизируют прокоагулянтную систему и стимулируют образование факторов свёртывания (VII, VIII, IX, X) и фибриногена в печени. В то же время они снижают уровень антикоагулянтов, таких как антитромбин III и протеин S, что способствует повышению свертываемости крови. Из-за этих изменений активизируется фибринолиз и увеличивается уровень Д–димера [22, 23].
В связи с этим назначение КОК требует особого внимания у женщин в позднем репродуктивном возрасте, особенно при наличии дополнительных факторов риска, таких как ожирение, варикозное расширение вен нижних конечностей, курение и наследственные тромбофилии.
КОК обладают рядом преимуществ в профилактике остеопороза, нормализации липидного профиля плазмы и снижения уровня маркеров воспаления, что делает их терапией выбора у женщин в позднем репродуктивном периоде [8, 24].
Антиандрогены могут применяться как альтернатива комбинированным оральным контрацептивам или дополнение к их терапии при СПЯ, особенно если пациенткам противопоказаны КОК или их эффективность недостаточна. В таких случаях чаще всего назначают такие препараты как флута-мид, бикалутамид или ципротерон. Преимущество антиандрогенов состоит в том, что указанные препараты блокируют андрогенные рецепторы и снижают выработку андрогенов, уменьшая клинические и лабораторные признаки андрогении. В отличие от КОК, которые снижают уровень свободных андрогенов за счёт повышения их связывания с глобулярным связывающим белком (ГСПГ), антиандрогены обладают непосредственным блокирующим действием на андрогенные рецепторы, что делает их более специфичными для лечения андрогенозависимых симптомов [7, 25, 26].
Преимуществом антиандрогенов является то, что они не увеличивают вероятность тромбообра-зования, артериальной гипертензии или рака молочной железы. Эти особенности делают их предпочтительным выбором в некоторых клинических ситуациях, требующих минимизации системных побочных эффектов [24–26].
С другой стороны, терапия антиандрогенами может сопровождаться побочными эффектами, главным образом связанными с гастроинтестинальным дискомфортом и нарушениями функции печени, такими как синдромы холестаза, цитолиза и печёночно-клеточной недостаточности [26].
В отличие от КОК антиандрогены не являются контрацептивами, и при их приёме необходимо использовать другие методы контрацепции, если женщина не планирует беременность. Приём антиандрогенов противопоказан женщинам, планирующим беременность в среднесрочной перспективе, так как потенциально эти препараты обладают тератогенным эффектом [25, 26].
При приёме антиандрогенов редко возможно возникновение парадоксальных андрогензависи-мых эффектов – в начале терапии возможно обострение акне и временная потеря волос (телогеновая аллопеция) [27].
Но всё же главной отрицательной чертой является тот аспект, что антиандрогены не нормализуют менструальный цикл и не решают проблемы анову-ляции, характерные для СПЯ [25, 28]. КОК же, напро- тив, нормализуют менструальный цикл и могут уменьшить риск гиперплазии эндометрия, что важно для женщин с нерегулярным месячным циклом [29].
Преимущества антиандрогенов перед КОК заключаются в том, что они напрямую блокируют андрогенные рецепторы и снижают уровень тестостерона, КОК же в основном подавляют выработку андрогенов за счёт ингибирования овуляции и повышения уровня глобулина, связывающего половые стероиды, однако они не блокирует андрогенные рецепторы.
Антиандрогены можно принимать отдельно, что особенно важно у пациенток с противопоказаниями к эстрогенам, например при риске тромбозов [22, 23, 29, 30].
Несмотря на широко распространённое использование этих методов терапии, сравнительная эффективность КОК и антиандрогенов в лечении различных проявлений СПЯ остаётся недостаточно изученной. Существующие исследования часто фокусируются на отдельных аспектах лечения, но комплексного анализа их сравнительной эффективности в клинической практике недостаточно.
Цель исследования: сравнение эффективности и безопасности применения антиандрогенов и КОК в терапии синдрома андрогении при СПЯ в позднем репродуктивном периоде.
Объект и методы
Обследовано 44 женщины с синдромом поликистозных яичников в возрасте 35–45 лет. Первую группу составили 25 пациенток (средний возраст 38,7±1,4 года), получавшие терапию КОК (этинил-эстрадиол в сочетании с дроспиреноном). Вторую группу составили 19 пациенток (средний возраст 39,6±2,4 года), получавшие терапию антиандрогенами (ципротерон в дозе 100 мг – 10 дней в месяц).
Всем пациенткам были выполнены общеклинические исследования: общий анализ крови, общий анализ мочи, биохимическое исследование крови (АЛТ АСТ, ГГТП, общий билирубин, липидограмма), оценка психологического состояния по шкале депрессии Бека, эхокардиография, суточное мониторирование артериального давления, определение уровня андрогенов (андростендиона (А4) и дигидротестостерона (ДГТ)), тестостерона. Определялись уровни Д–димера и гомоцистеина (как показателей риска системной эмболии и повышенного тромбообразования.
Обследование обеих групп пациенток включало определение маркеров резорбции и ресинтеза костной ткани в крови (показатели бета-кросс лапс и остеокальцин). Статистическая обработка полу- ченных данных выполнена при помощи стандартных методов и расчета t-критерия Стьюдента.
Из исследования были исключены пациентки с надпочечниковой андрогенией, гиперпролактинемией, нарушениями функции щитовидной железы, нарушениями углеводного обмена.
Результаты
Показатели по андростендиону (А4) – 6,5±1,4 и 7,0±1,2 нг/мл p>0,05; дигидротестостерону (ДГТ) – 191,3±26,4 и 178,2±34,9 пг/мл (р>0,05), общему тестостерону – 1,94±0,27 и 2,22±0,36 нмоль/л (р>0,05) оказались сопоставимы в обеих группах (рис. 1–3).
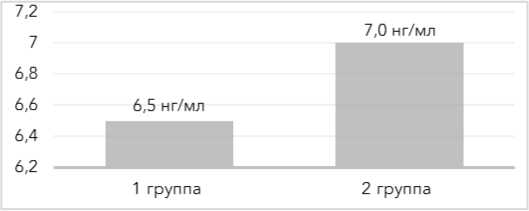
Рисунок 1. Уровни андростендиона (А4) у пациенток обеих групп
Figure 1. Androstenedione levels in patients of both groups
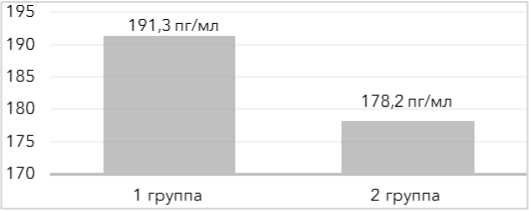
Рисунок 2. Уровни дигидротестостерона (ДГТ) у пациенток обеих групп
Figure 2 . Dihydrotestosterone (DHT) levels in patients of both groups
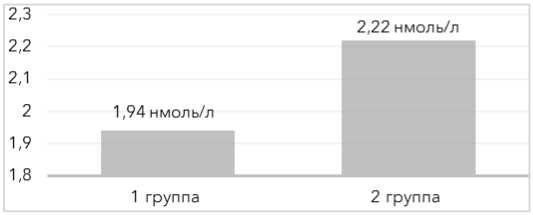
Рисунок 3. Уровни общего тестостерона у пациенток обеих групп Figure 3. Total testosterone levels in patients of both groups
Анализ частоты встречаемости артериальной гипертензии (АГ) в обследованных группах пациенток показал, что у пациенток 1-й группы достоверно чаще встречалась АГ – в 40,0% случаев против 21,1% у пациенток 2-й группы (р<0,01) (табл. 1).
Лабораторные показатели обследованных групп пациенток представлены в таблице 2.
Таблица 1. Частота встречаемости артериальной гипертензии в обследованных группах пациенток Table 2. The frequency of arterial hypertension in the examined groups of patients
|
Показатель |
Группы сравнения |
р |
|
|
| 1-я группа (n=25) |
| 2-я группа (n=19) | |
||
|
Артериальная гипертензия |
40,0% |
21,1% |
<0,01 |
|
Артериальная гипертензия 1 степени |
32,0% |
15,8% |
<0,01 |
|
Артериальная гипертензия 2 степени |
8% |
5,3% |
<0,05 |
Таблица 2. Клинико-лабораторная характеристика обследованных групп пациенток
Table 2. Clinical and laboratory characteristics of the examined groups of patients
|
Показатель |
Группы сравнения |
р |
|
|
1-я группа (n=25) |
2-я группа (n=19) |
||
|
Возраст, годы |
38,7±1,4 |
39,6±2,4 |
>0,05 |
|
Рост, см |
165±4,7 |
163±4,1 |
>0,05 |
|
Вес, кг |
70±4,1 |
62±5,4 |
<0,05 |
|
Д–димер, нг/мл |
211,5±35,1 |
143±27,1 |
<0,05 |
|
Гомоцистеин мкмоль /л |
5,7±1,6 |
11,7±1,5 |
<0,01 |
|
Остеокальцин, нг/мл |
27,3±4,3 |
12,1±6,1 |
<0,01 |
|
Бета-кросс лапс, нг/мл |
0,287±0,3 |
0,357±0,5 |
<0,05 |
|
АСТ, ммоль/л |
16,4±4,3 |
22,2±4,3 |
<0,05 |
|
АЛТ, ммоль/л |
18,9±6,1 |
28,4±6,1 |
<0,05 |
|
Холестерин, ммоль/л |
5,13±1,4 |
5,87±2,1 |
<0,05 |
|
Липопротеиды низкой плотности, ммоль/л |
2,51±0,2 |
3,45±0,2 |
<0,05 |
|
Триглицериды, ммоль/л |
1,81±0,1 |
2,33±0,2 |
<0,05 |
У пациенток обеих групп проведено анкетирование по шкале депрессии Бека. Пациентки, получавшие терапию комбинированными оральными контрацептивами показали средний балл 12,4±1,2, что соответствовало уровню субдепрессии, тогда как в группе пациенток, получавших терапию антиандрогенами, этот показатель был существенно ниже и соответствовал нормальным значениям – 7,2±1,4 (p<0,1).
Обсуждение
Основным преимуществом антиандрогенов перед КОК считается более выраженное снижение клинических и лабораторных проявлений андроге-нии, хотя наше исследование этого не продемонстрировало, по крайней мере в отношении её лабораторных критериев. У пациенток, принимающих комбинированные оральные контрацептивы, чаще встречается артериальная гипертензия, чем у пациенток, получающих терапию антиандрогенами, однако в большинстве случаев она носит умеренный характер и не приводит к значимым морфологическим изменениям миокарда (табл. 1).
Исследование показало, что пациентки, принимающие антиандрогены, имеют более высокий уровень печёночных трансаминаз, что свидетельствует о гепатотоксичности этих препаратов (табл. 2).
Эстрогены могут потенцировать действие прокоагулянтной и тормозить действие антикоагулянтной систем [22, 23]. Наше исследование продемонстрировало, что уровень Д–димера оказался значительно выше у пациенток, получающих терапию комбинированными оральными контрацептивами (211,5±35,1 против 143±27, при р<0,05) (табл. 1), что свидетельствует о более высоком риске тромбо-образования у этой когорты пациенток. С другой стороны, у пациенток на терапии КОК отмечается снижение уровня маркеров сердечно–сосудистого риска, включая гомоцистеин и потенциально атерогенные фракции липидограммы, такие как липопротеиды низкой плотности и триглицериды (табл. 2). Терапия комбинированными оральными контрацептивами способствует профилактике остеопороза, так как эстрогены, наряду с андрогенами, увеличивают количество рецепторов к кальцитонину в костной ткани. Антиандрогены не оказывают положительного влияния на костную ткань, а при длительном применении, напротив, могут повышать риск развития остеопороза [25, 27]. Проведённое исследование продемонстрировало, что терапия комбинированными оральными контрацептивами имеет преимущества в профилактике перименапа-узального остеопороза по сравнению с терапией антиандрогенами, что подтверждается более высокими уровнями остеокальцина и низкими уровнями бета-кросс лапс у пациенток первой группы (табл. 2).
Назначение комбинированных оральных контрацептивов у пациенток с СПЯ может иметь преимущество перед терапией антиандрогенами в том, что КОК обладают не только антиандроген-ными эффектами, но и регулируют менструальный цикл, обеспечивают контрацептивный эффект. Терапия антиандрогенами является эффективной альтернативой комбинированным оральным контрацептивам, в первую очередь, вследствие отсутствия эстроген- связанного риска, например при развитии артериальной гипертензии, наклонности к тромбообразованию и высоком риске развития рака молочной железы [8, 28, 29]. Антиандрогены же не оказывают значительного влияния на коагуляцию [22, 23, 28].
Выводы
Комбинированные оральные контрацептивы и антиандрогены демонстрируют сопоставимую эффективность в коррекции лабораторных проявлений андрогении, что подтверждает их равнозначную клиническую значимость в лечении гиперандрогенных состояний.
Комбинированные оральные контрацептивы в целом способствуют снижению сердечно– сосудистого риска за счёт снижения уровня атерогенных фракций липидограммы и гомоцистеина.
С другой стороны, могут провоцировать развитие артериальной гипертензии за счёт активации ре-нин–ангиотензиновой системы и способствовать наклонности к тромбообразованию.
Терапия комбинированными оральными контрацептивами сопряжена с более высоким риском развития депрессивных состояний. Поэтому целесообразно перед инициацией терапии КОК проводить тестирование пациенток по шкале депрессии Бека.
Терапия антиандрогенами приводит к более высокому риску гепатотоксичности, что сопрово-жается повышением уровня печёночных трансаминаз и требует регулярно лабораторного контроля этих показателей.


