Возможности использования технологий искусственного интеллекта в морфологической диагностике воспалительных заболеваний кишечника (обзор литературы)
Автор: Чурилова Е.Г., Казумова А.Б., Ахриева Х.М., Пачуашвили Н.В., Тертычный А.С.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 1 т.15, 2025 года.
Бесплатный доступ
Введение. Воспалительные заболевания кишечника (ВЗК), включая болезнь Крона (БК) и язвенный колит (ЯК), представляют собой хронические патологии желудочно-кишечного тракта иммуновоспалительного генеза. Основное внимание в работе уделено роли искуственного интеллекта (ИИ) в морфологической диагностике ВЗК, эндоскопической визуализации, прогнозировании исходов и мониторинге пациентов.
Болезнь крона [mesh id: d003424], язвенный колит [mesh id: d003093], воспалительные заболевания кишечника [mesh id: d015212], искусственный интеллект [mesh id: d001185], машинное обучение [mesh id: d065007], глубокое обучение [mesh id: d000082062], гисто-патология [mesh id: d006660], эндоскопия [mesh id: d004724], колоректальный рак [mesh id: d015179], нейронные сети искусственные [mesh id: d017209]
Короткий адрес: https://sciup.org/143184376
IDR: 143184376 | УДК: 616.348+616.36-07:004.8 | DOI: 10.20340/vmi-rvz.2025.1.MORPH.1
Текст обзорной статьи Возможности использования технологий искусственного интеллекта в морфологической диагностике воспалительных заболеваний кишечника (обзор литературы)
Competing interests. The authors declare no competing interests.
Funding. This research received no external funding.
Cite as: Churilova E.G., Kazumova A.B., Akhrieva Kh.M., Pachuashvili N.V., Tertychnyy A.S. Possibilities of using artificial intelligence technologies in the morphological diagnosis of inflammatory bowel diseases (literature review). Bulletin of the Medical Institute “REAVIZ”: Rehabilitation, Doctor and Health. 2025;15(1):22–29.
Болезнь Крона (БК) и язвенный колит (ЯК) относятся к категории воспалительных заболеваний кишечника (ВЗК) и представляют собой хронические заболевания органов желудочно-кишечного тракта иммуновоспалительного генеза, имеющие тенденцию к прогрессированию и осложнению течения при отсутствии ранней диагностики [1, 2]. На современном этапе ВЗК отличаются вариабельностью клинических проявлений, ростом доли пациентов с различными внекишечными проявлениями, высокой частотой рецидивов [3, 4].
Процесс диагностики БК и ЯК требует междисциплинарного подхода, включая гастроэнтерологов, эндоскопистов, радиологов и врачей-патологоанатомов [5]. «Золотой стандарт» диагностики ВЗК до сих пор не определён. Постановка диагноза ВЗК основана на сочетании анамнестических, клинических данных и выявлении типичных эндоскопических и гистопатологических особенностей. Важно отметить, что оценка гистологической активности колита в ко-лонобиоптатах имеет ключевое значение для постановки диагноза. [6]. Для обеспечения точной гистологической оценки рекомендуется брать биопсию из различных отделов кишечника для гистологического исследования во время эндоскопии [7].
Растущее число исследований подтверждает, что искусственный интеллект (ИИ) становится ценным инструментом в диагностике ВЗК. Количество областей внедрения ИИ в клиническую практику будет постоянно расширяться [8]. Технологии ИИ применяются врачами, ведущими пациентов с ВЗК, для точной морфологической оценки патологии тканей при гистологическом исследовании, в том числе при дифференциальной диагностике БК и ЯК, определения гистологической тяжести заболевания и наличия ремиссии [9]. Одним из наиболее важных осложнений ВЗК является его связь с повышенным риском развития колоректального рака (КРР), поэтому распространено применение ИИ в качестве динамического наблюдения [10]. Использование ИИ позволяет снизить процент врачебных ошибок, получить быстрое заключение, а также расширить возможности диагностического процесса [9]. Распространено применение ИИ для автоматического анализа изображений и принятия решений о лечении в режиме реального времени во время эндоскопии [8, 11].
Одной из важнейших областей применения ИИ, представляющей интерес для патологоанатомов, является морфологическая диагностика ВЗК, включающая в том числе прогнозирование рецидива и скрининг неоплазии толстой кишки, связанной с ВЗК.
Необходимо устранить имеющиеся в доступной литературе пробелы, прежде чем ИИ сможет превратиться в основной клинический инструмент врачей для диагностики ВЗК. Чтобы определить потенциальную ценность интеграции ИИ при ВЗК требуется обобщить данные текущих исследований.
Достижения в области ИИ потенцируют значительные изменения в медицине, и ожидается, что в ближайшем будущем методы ИИ обеспечат улучшение качества морфологической диагностики широкого спектра заболеваний [12]. Эффективная система ИИ позволяет проанализировать оцифрованные слайды, обобщить большое число примеров и получить общую функциональную зависимость, которая приводит прогноз в соответствии с данными о пациенте [1]. Обычное микроскопическое исследование связано с субъективной оценкой врача-морфолога, в то время как цифровой анализ, напротив, на основе искусственного интеллекта позволяет количественно измерять морфологические характеристики, преодолевая субъективность и сокращая время оценки [13].
Одним из методов применения ИИ является создание искусственных нейронных сетей. Применение нейронных сетей как инструмента для анализа клинических данных в диагностике ВЗК может изменить подходы к обнаружению и классификации этих заболеваний [14].
Технологии ИИ включают машинное обучение и глубокое обучение. Машинное обучение (ML) – это способность автоматически создавать математические алгоритмы на основе входных необработанных обучающих данных для принятия решений в новых обстоятельствах без наблюдения со стороны человека (обучение без учителя). Алгоритмы ML могут извлекать необходимые характеристики из существующих баз данных пациентов и сравнивать их с известными результатами, которые, в свою очередь, могут быть использованы для прогнозирования исхода болезни пациента [15, 16].
Глубокое обучение (DL) – это быстро развивающийся метод ML, который в последние годы стал доминирующим подходом. Процесс обучения называется глубоким, так как структура искусственных нейронных сетей состоит из нескольких входных, выходных и скрытых слоев. Каждый слой содержит единицы, преобразующие входные данные в сведения, которые следующий слой может использовать для определённой задачи прогнозирования. Свёрточные нейронные сети (CNN), созданные на основе нейронной сети человеческого мозга, могут обеспечить быстрое и точное распознавание изображений и анализ видеоматериалов [17]. Работа CNN обычно интерпретируется как переход от конкретных особенностей изображения к более абстрактным деталям, при этом сеть самонастраивается и отфильтровывает маловажные детали и выделяет существенные [11].
Поскольку персистирование гистологического воспаления является фактором риска клинического рецидива, а также движущей силой для развития КРР, методы выявления остаточного воспаления с помощью ИИ могут стать важным инструментом долгосрочного наблюдения за пациентами с ВЗК [20].
ИИ в эндоскопическом исследовании играет не менее важную роль. Эндоскопическая оценка с помощью биопсии слизистой оболочки остаётся неотъемлемым компонентом диагностики ВЗК [35]. Определение тяжести заболевания и раннее выявление неоплазии являются ключевыми факторами в обеспечении адекватного лечения пациентов [18].
В своей статье Pal P. и соавт. описали роль методов визуализации сверхвысокой чёткости – конфокальной лазерной эндомикроскопии (CLE) и эндоци-тоскопии (EC) в оценке гистологического воспаления и характеристике дисплазии в режиме реального времени [19]. Технологии искусственного интеллекта также могут помочь реализовать преимущества новых технологий эндоскопической визуализации, предназначенных для оказания помощи в гистологической оценке в режиме реального времени во время эндоскопии. Эндоцитоскопия – новая технология, в которой 520-кратный ультраувеличительный микроскоп соединён с эндоскопом, что позволяет проводить гистологическую оценку слизистой оболочки толстой кишки в режиме реального времени [20]. Результаты недавнего систематического обзора показали, что алгоритмы ИИ для прогнозирования эндоскопической или гистологической активности заболевания в ЯК выполнялись с общей чувствительностью и специфичностью 78% (медиана, диапазон 72–83, IQR 5.5) и 91% (медиана, диапазон 86–96, IQR 5) соответственно [21].
Maeda и др. использовали модель машинного обучения для определения тяжести гистологического воспаления с помощью эндоцитоскопических неподвижных изображений колоноскопии у пациентов с колитом, достигнув точности, чувствительности и специфичности 90%, 74% и 91% соответственно. Однако применимость эндоцитоскопической усиленной колоноскопии ограничена в реальной практике из-за увеличения затрат и процедурного времени [20].
Глубоким нейронным сетям, обученным на эндоскопических изображениях и гистологических отчётах, удалось идентифицировать пациентов в эндоскопической и гистологической ремиссии с такой точностью, что это потенциально может устранить необходимость забора и гистологического исследования биопсийного материала [22].
Активность – крайне важный морфологический критерий, который оценивается при исследовании колонобиоптатов при постановке диагноза «колит». Выраженность гистологической активности колита коррелируют с клиническими данными и эндоскопической картиной. Активность воспаления показывает, что имеет место активная стадия заболевания или период обострения ВЗК. Традиционно оценка активности в биоптатах ЖКТ осуществляется по присутствию в биоптате сегментоядерных лейкоцитов. В первую очередь, подразумевается наличие в воспалительном инфильтрате нейтрофильных лейкоцитов. Эозинофильные лейкоциты и базофилы обычно не берутся в расчет. Появление нейтрофильных лейкоцитов в слизистой оболочке безусловно рассматривается как проявление воспалительной реакции в любом отделе ЖКТ [6].
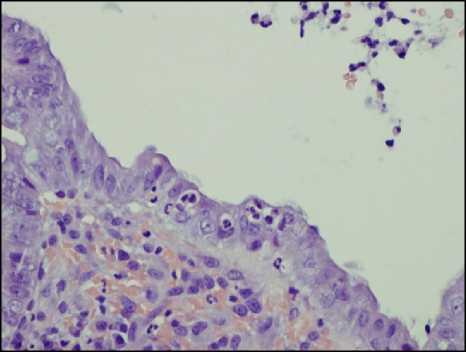
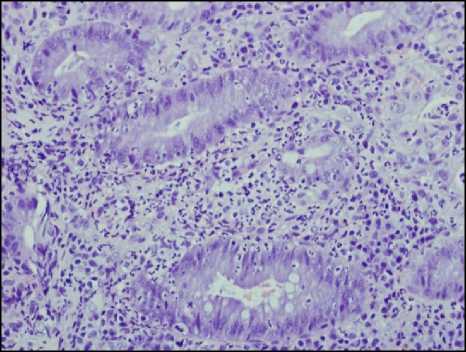
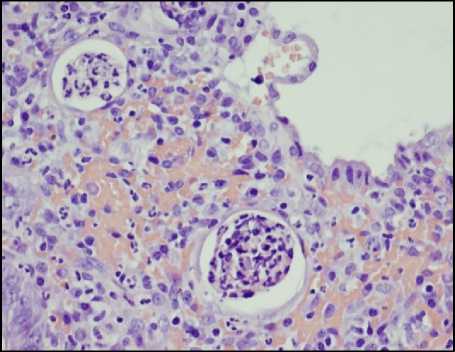
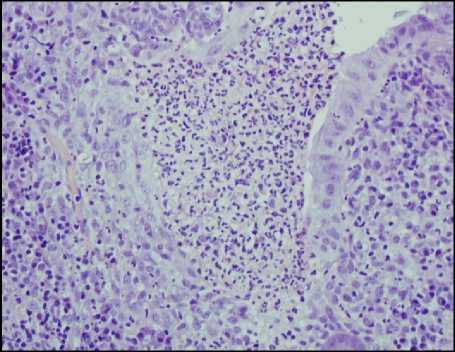
Считается, что первоначально лейкоциты появляются в собственной пластинке слизистой, проникая туда из капилляров, о чем свидетельствует обнаружение расширенных просветов капилляров с лейко-стазами. Затем лейкоциты проникают в клетки эпителия (рис. 1, а, б), после чего они могут проникать в просветы крипт и формировать скопления лейкоцитов в просвете или на поверхности слизистой оболочки. Скопления лейкоцитов в просвете крипт получили название крипт-абсцессов (рис. 1, в). Последующее разрушение покровного эпителия и эпителия крипт приводит к формированию эрозий (рис. 1, г), которые при их длительном существовании характеризуются образованием участков грануляционной ткани со скоплениями фибринозно-лейкоцитарного экссудата на поверхности дефектов. В участках эрозий могут дополнительно обнаруживаться участки фибриноидного некроза. При прогрессировании процесса эрозии могут переходить в язвы в случае распространения дефекта на подслизистую основу стенки кишки.
А
Б
В
Рисунок 1. Проявления гистологической активности в биоптатах слизистой оболочки толстой кишки: А – появление сегментоядерных лейкоцитов в клетках покровного эпителия; Б – инфильтрация сегментоядерными лейкоцитами эпителия крипт (криптит); В – скопление лейкоцитов в просвете крипт (формирование крипт-абсцессов); Г – разрушение крипт и формирование эрозии. Окраска гематоксилином и эозином. Ув. ×200
Figure 1. Manifestations of histological activity in colonic mucosal biopsies: A – Appearance of segmented nuclear leukocytes in the cells of the surface epithelium; Б – Infiltration of crypt epithelium by segmented nuclear leukocytes (cryptitis); В – Accumulation of leukocytes in the crypt lumen (formation of crypt abscesses); Г – Destruction of crypts and formation of erosions. Hematoxylin and eosin staining. Magnification ×200
Г
Приведённая последовательность событий подразумевает выделение определённых критических этапов активного воспалительного процесса, которые можно определить как его стадии или степень выраженности. К таким стадиям активности традиционно относят появление лейкоцитов в собственной пластинке слизистой (1 степень активности), появление лейкоцитов в эпителии (2 степень активности), формирование скоплений лейкоцитов в просвете крипт (3 степень активности), разрушение крипт и покровного эпителия с формированием эрозий и язв (4 степень активности).
На этой последовательности основаны большинство применяемых на сегодняшний день схем-шкал колита, в том числе наиболее известная шкала Гебоэса (ШГ). Схемы-шкалы, используемые для оценки активности колита, во многом повторяют друг друга. Но все они подразумевают выделение 3–4 степеней активности [23].
Несмотря на то, что шкале Гебоэса уже более 20 лет, она по-прежнему остаётся самой цитируемой. Все последующие попытки разработать новые шкалы, несмотря на их кажущееся упрощение, не приводили к улучшению их воспроизводимости. Так, новая шкала, получившая название «Индекс Нанси» (Nancy Index (NI), 2017), – это 4-уровненвая шкала, которая учитывает как признаки хронического воспаления, так и показатели активности [24]. В ней было выделено 4 степени изменений, которые получили следующие обозначения: 1 степень – хронический воспалительный инфильтрат без признаков активности; 2 степень – слабая активность; 3 степень – умеренная активность; 4 степень – выраженная активность с признаками изъязвления.
Индекс Робартс (Robarts Histopathologic Index (RHI), 2017) основан на шкале Гебоэса, варьирует от 0 до 33 и коррелирует с тяжестью гистологических изменений. Индекс Робартс показал хорошую воспроизводимость при оценке результатов ответа на терапию [25]. Индекс Робартс рассчитывается по формуле RHI = 1 × хронический воспалительный инфильтрат (0–3) + 2 × нейтрофилы собственной пластинки слизистой (0–3) + 3 × нейтрофилы в эпителии (0–3) + 5 × эрозии и изъязвления (0–3) (на основании соответствующих подклассов по шкале Гебоэса).
Не прекращаются попытки построения новых шкал, как и попытки модернизации имеющихся. Gui и др. разработали гистологический индекс для оценки воспалительной активности при ВЗК, адаптированный к эндоскопии и пригодный для применения в системе ИИ, – индекс гистологической ремиссии (PHRI) [26]. Этот индекс имеет следующие характеристики, которые представлены в таблице 1.
Таблица 1. Индекс гистологической ремиссии (PHRI)
Table 1. Histological remission index (PHRI)
Гистологическая характеристика Оценка в баллах
Нейтрофильная инфильтрация собственной пластинки0
Нет1
Есть
Нейтрофильная инфильтрация эпителия
Нет0
Есть в покровном эпителии1
Есть в эпителий крипт (криптит)1
Крипт-абсцессы1
Подсчёт баллов (сумма баллов, максимальное значение = 4)
В исследовании Iacucci M. и др. 535 оцифрованных биопсий были классифицированы в соответствии с PHRI, гистологическим индексом Робартса и гистологическим индексом Нэнси. Классификатор CNN был обучен отличать ремиссию от активной стадии процесса на подмножестве из 118 биопсий, обучающая выборка состояла из 42 биопсий, тестовая – из 375 биопсий. Результаты системы сравнивались с результатами, полученными при оценке врачом-патологоанатомом. Система различала гистологическую активность и ремиссию с чувствительностью и специфичностью 89% и 85% (PHRI), 94% и 76% (гистологический индекс Робартса), 89% и 79% (гистологический индекс Нэнси) соответственно. Модель предсказывала соответствующую эндоскопическую ремиссию и активность с точностью 79% и 82% соответственно для эндоскопического индекса тяжести НЯК и показателя виртуальной хромэндоскопии Паддингтона. Соотношение рисков обострения заболевания между группами гистологической активности и ремиссии в соответствии с PHRI, оцененным патологоанатомом, составило 3,56, а в соответствии с PHRI, оцененным ИИ, – 4,64 [27].
Рекомендуется регулярное наблюдение за дисплазией для раннего выявления и профилактики неоплазии у пациентов с ВЗК. Эндоскопия белого цвета со случайными биопсиями была традиционным методом для обнаружения дисплазии, однако появились новые технологии использования хромоэндоскопии на основе красителей. Один метаанализ показал, что хромоэндоскопия увеличивает выход дисплазии по сравнению с эндоскопией белого света (абсолютное увеличение риска = 6%). Тем не менее, обычная хромоэндоскопия является трудоёмким и зависимым от оператора методом, требующим адекватной подготовки кишечника и заживления слизистой оболочки. Текущие стратегии наблюдения включают эндоскопию высокой чёткости и хромоэндоскопию с индигокарминовым или метиленовым синим цветом, а также целенаправленные биопсии аномально появляющейся слизистой оболочки. Виртуальная хромоэн- доскопия считается подходящей альтернативой хромоэндоскопии красителя при использовании эндоскопии высокой чёткости [28].
Smolander J. и др. установили, что ИИ может улучшить способность отличать БК от ЯК. Разработаны классификаторы на основе глубокой нейронной сети и машины опорных векторов для автоматического расчёта морфологии ткани с помощью рамановской спектроскопии, которая может выявить те же морфологические характеристики, что и классическое окрашивание гематоксилином и эозином. В комбинации с подходами машинного обучения random forest и CNN модель отличала БК от ЯК с чувствительностью 89% и специфичностью 83,7% [29].
Kang L., Sarullo K. и др. разработали алгоритм глубокого обучения для количественного определения плотности клеток Панета (КП) при ВЗК. КП могут быть использованы в качестве биомаркера для прогноза заболевания. Тем не менее, количественная оценка КП требует времени, что является препятствием для клинического процесса. Глубокое обучение трансформировало разработку надёжных и точных инструментов для оценки сложных изображений. При валидации модели, по сравнению с опытными патологоанатомами, алгоритм показал хорошую производительность (RMSE = 1,148, r2 = 0,708). Текущие характеристики модели демонстрируют возможность разработки инструмента на основе глубокого обучения для измерения плотности КП в качестве прогностического биомаркера для будущей клинической практики [30].
В статье Бакулина И.Г. и соавт. описано исследование видеоколоноскопии, в ходе которой полученные цифровые изображения были подвергнуты фильтрации с использованием фильтра нелокального среднего и улучшению контраста методом адаптивной контрастно-ограниченной эквализации гистограммы. Были разработаны искусственные сети на основе сети VGG16: первая сеть определяла изменения слизистой толстой кишки, вторая – давала заключение о виде ВЗК. Сеть обнаруживала норму с точностью 88%, отличала класс БК от других классов (точность 92%). Общая точность метода составила 84,6%. Однако важным моментом является дальнейшая интеграция эндоскопических, клинико-лабораторных и морфологических показателей для создания комплексного программного продукта [31].
В 2019 году Pradhan и др. использовали нелинейную мультимодальную визуализацию для измерения биомолекулярных изменений в различных тканевых областях для оценки тяжести ВЗК в режиме реального времени. Они использовали модель глубокого обучения, называемую SegNet, для систематического сегментирования области крипт и слизистой оболочки и сравнили её производительность с клас- сическим подходом машинного обучения, основанным на простой задаче классификации пикселей. После обучения система SegNet достигла общего балла F1 (т.е. гармоническое среднее значение точности и отзыва – полезная метрика, обычно используемая для классификационных моделей при дисбалансе между классами) 0,75 и превзошла классический подход ML для сегментации крипт и слизистой оболочки [32].
Недавно Liu и др. опубликовали новое решение, направленное на достижение персонализированного лечения педиатрических пациентов с ЯК. Этот метод объединяет гистопатологические особенности, основанные на цифровой гистопатологии, с алгоритмами машинного обучения для прогнозирования реакций пациентов на определённые методы лечения. Выбрав подмножество из 18 характеристик гистомики, их модель достигла точности 0,90. Хотя эти результаты демонстрируют потенциал модели для точной классификации педиатрических пациентов, крайне важно устранить различия и предвзятости в моделях машинного обучения, связанные с расой, полом и социально-экономическим статусом, для стандартизированного применения в клинических условиях [33].
В 2022 году Европейское общество гастроинтестинальной эндоскопии (ESGE) описало рекомендации по определению эффективности колоноскопии при ВЗК, такие как эндоскопическая оценка активности заболевания с использованием валидированных показателей и колоноскопическое наблюдение за дисплазией. Следование этим рекомендациям существенно облегчается с помощью алгоритмов машинного и глубокого обучения. Они помогают врачам-эндоскопистам исключить ошибки при взятии образцов, провести качественную фотодокументацию для повышения полноты обследования, предотвратить образование «слепых» зон и упростить мониторинг показателей качества процедуры. Метод обнаружения пропущенных участков связан с измерением скорости выполнения исследования и оповещения эндоскописта в режиме реального времени и продемонстрировал согласие с врачом-рецензентом в 93% случаев. Однако существуют проблемы при анализе целых эндоскопических видеороликов – факторы подготовки кишечника к выполнению манипуляции, размытые изображения, травмы, связанные с биопсией, и другой шум, который необходимо отличать от частей видео, пригодных для оценки [34].
В Китае модель CNN была обучена оценивать подготовку кишечника каждые 30 секунд, количественно определять чёткость эндоскопического изображения, а также идентифицировать артефакты и восстанавливать повреждённые визуальные данные, поднимая качество видеокадров в наборе в среднем 25% [35].
Такое улучшение может оптимизировать как текущую повседневную практику врачей, так и обучение оценке ВЗК, что в итоге приведёт к повышению качества жизни пациентов.
Liu X., Reigle J. в своей работе оценили методологическое качество и риск предвзятости исследований по машинному обучению и глубокому обучению для моделей прогнозирования на основе изображений при ВЗК. Риск предвзятости был высок в моделях прогнозирования из-за недостаточного размера выборки [36].
Текущие проблемы в морфологической диагностике ВЗК открывают новые возможности для её пре- образования с помощью различных методов ИИ. Инструменты на основе ИИ позволяют проводить последовательные, объективные, точные и ускоренные гистологические оценки и улучшать качество морфологической диагностики ВЗК. Модели искусственного интеллекта будут постоянно совершенствоваться по мере адаптации этой технологии к массовому использованию. Алгоритмы глубокого обучения могут базироваться а больших объёмах данных, включая изображения гистологических срезов. Это позволяет значительно повысить точность диагностики по сравнению с традиционными методами, снижая вероятность человеческой ошибки.


