Возможности компьютерно-томографической пневмогастрографии в определении степени регресса местнораспространенного рака желудка после проведения неоадъювантной химиотерапии
Автор: Амелина Инна Дмитриевна, Карачун Алексей Михайлович, Нестеров Денис Валерьевич, Шевкунов Лев Николаевич, Артемьева Анна Сергеевна, Багненко Сергей Сергеевич, Трофимов Станислав Леонидович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Введение. Мультимодальный подход в лечении местнораспространенного рака желудка с добавлением дополнительных системных или местных методов (таких как химиотерапия и лучевая терапия) оправдан и способствует улучшению выживаемости пациентов за счет снижения риска рецидива. Развитие противоопухолевой терапии диктует необходимость разработки систем оценки ответа опухоли на новые методы лечения. Материал и методы. В исследование вошли 162 пациента с местнораспро-страненным раком желудка, получавшие лечение в Национальном медицинском исследовательском центре онкологии имени Н.Н. Петрова с 2015 по 2018 г Все пациенты были прооперированы в объеме субтотальной резекции желудка или гастрэктомии с лимфодиссекцией и предварительно прошли неоадъювантную полихимиотерапию. Возрастной диапазон составил 30-80 лет. Всем пациентам патоморфологически была определена степень ответа опухоли на проведенную химиотерапию с использованием четырехступенчатой патоморфологической системы степени ответа по классификации Японской ассоциации рака желудка (JGCA, 3rd English edition). Всем пациентам двукратно была проведена компьютерно-томографическая пневмогастрография: на этапе клинического стадирования перед неоадъювантной химиотерапией и после, непосредственно перед операцией. Для каждого пациента проанализировано 96 качественных и количественных биомаркеров визуализации опухоли и парагастральных лимфатических узлов. результаты. Точность определения степени ответа TRG-0/1 с помощью компьютерно-томографической пневмогастрографии составила 82,6 %, TRG-1/2 - 90 %, TRG-2/3 - 88 %. Обсуждение. Степень патоморфологического ответа опухоли на проведенное лечение является предиктором отдаленных результатов, однако может быть оценена только после анализа операционного материала, и данный маркер невозможно использовать при неоперабельных случаях и для корректировки химотерапевтического лечения. Изучение биомаркеров визуализации на основе количественных и качественных данных, отражающих гистопатологические особенности опухоли и лимфатических узлов, и их интеграция в клиническую практику могут помочь в определении степени ответа на проведенную терапию и оптимизации лечения. заключение. Предложенный алгоритм оценки степени ответа местнораспространенного рака желудка на химиотерапию (ctTRG) с помощью биомаркеров визуализации в рамках настоящего пилотного исследования является перспективным прогностическим маркером и требует дальнейшего изучения.
Рак желудка, неоадъювантная терапия, лечебный патоморфоз, степень регресса опухоли, биомаркеры визуализации, компьютерно-томографическая пневмогастрография
Короткий адрес: https://sciup.org/140261320
IDR: 140261320 | УДК: 616.33-006.6-08:615.28]-073.756.8 | DOI: 10.21294/1814-48612021-20-5-18-30
Текст научной статьи Возможности компьютерно-томографической пневмогастрографии в определении степени регресса местнораспространенного рака желудка после проведения неоадъювантной химиотерапии
Хирургический метод остается основным радикальным методом лечения, который увеличивает шансы на ремиссию заболевания [3], хотя у 20–30 % пациентов развивается прогрессирование
-
[4] . Более 88 % пациентов с прогрессированием заболевания имеют отдаленные метастазы [5]. Исходя из этого, используется мультимодальный подход с добавлением дополнительных системных или местных методов лечения (таких как химиотерапия (ХТ) и лучевая терапия (ЛТ)), которые могут помочь в улучшении выживаемости пациентов за счет снижения риска рецидива [6]. Преимущество хирургического лечения увеличивается на 13 %, когда оно интегрируется с мультимодальной терапией [7]. Пятилетняя выживаемость для оперированных больных РЖ, получавших неоадъювантную полихимиотерапию (НАПХТ), в среднем составляет 55,3 % с медианой выживаемости
78 мес [8]. J.C. Layke et al. [9] приводят данные о 5-летней выживаемости больных РЖ разных стадий в зависимости от проведенного лечения: при 0 стадии с выполнением гастрэктомии с лим-фодиссекцией 5-летняя выживаемость составила 90 %, при субтотальной резекции в комбинации с неоадъювантной ХТ/ХЛТ и/или адъювантной ХТ/ХЛТ выживаемость отличалась: при I стадии составила 58–78 %, при II стадии – 34 %, при III стадии – 8–20 %, при IV стадии – 7 %.
По данным литературы, НАПХТ/НАПХЛТ способствует повышению частоты радикальных гастрэктомий и субтотальных резекций до 89 %, не увеличивая риск послеоперационных осложнений и смертности по сравнению с только хирургией, частота ответов на НАПХТ составляет около 43 %, частота полных патоморфологических ответов достигает 10–25 % [10– 13]. Частота радикальных операций (R0) после проведения НАПХТ составляет 81,9–84 % против 66,7–74 % в сравнении с одной только операцией, частота стадии pN0 после проведения НАПХТ составляет 25,7–55,6 %, а без НАПХТ с проведением только операции – 16,9–29,2 % [14, 15].
Развитие противоопухолевой терапии диктует необходимость разработки систем оценки ответа опухоли на новые методы лечения (Tumor Regression Grade, TRG). Основной целью систем TRG является правильное прогнозирование, стратификация пациентов в попытке помочь в принятии клинических решений, повлиять на хирургическую тактику, выбор послеоперационной адъювантной терапии и определение интенсивности наблюдения [18].
В настоящее время нет общепринятой системы как патоморфологической оценки лечебного патоморфоза, так и оценки инструментальными методами диагностики при РЖ. Компьютерная томография (КТ) – метод выбора для клинического стадирования РЖ и оценки эффективности неоадъювантной терапии. Литературные данные основаны чаще всего на визуальном анализе рентгенологических признаков: уменьшение или исчезновение экзофитного или экзогастрального опухолевого компонента, уменьшение степени вовлечения окружающих органов, уменьшение размеров лимфатических узлов. Из количественных критериев применяется в основном определение толщины опухоли и реже – измерение объема/ площади опухоли (КТ-волюмометрия) и оценка плотности. Структурированного алгоритма оценки регресса опухолевого процесса после проведения неоадъювантной терапии с помощью КТ нет. Изучение биомаркеров визуализации на основе количественных и качественных данных, отражающих гистопатологические особенности опухоли, и их интеграция в клиническую практику могут помочь в определении степени ответа на терапию и оптимизации лечения [19].
КТ-пневмогастрография выполнялась на 64-сре-зовом рентгеновском компьютерном томографе натощак (голодание не менее 6 ч). Использовался неионный йодсодержащий контрастный препарат в объеме 1,5 мл на кг массы тела, который вводили в локтевую вену со скоростью 3,5 мл/с с помощью инжектора, с последующим введением физиологического раствора с той же скоростью. Сканирование проводилось сначала в артериальную, затем в портальную фазы. Параметры артериальной фазы: kV – 120, мAs – 250, толщина среза – 2 мм, интервал реконструкции – 1мм, Pitch – 1, задержка сканирования – Bolus tracking, позиция ROI – брюшная аорта, значение ROI – 150 HU.
Анализ биомаркеров визуализации проводился с помощью специализированного для статистической обработки данных языка программирования R с применением программных модулей для вычислительной и графической обработки данных – стандартных библиотек и библиотек random Forest [22], caret [23], pROC [24], ggplot2 [25], party [26], dplyr [27] и tidyr [28]. Прогностическая модель была построена методом дерева условного вывода (Conditional Inference Trees) с трехкратной 10-блочной перекрестной валидацией. При анализе диагностической эффективности методов исследования проводился ROC-анализ (Receiver Operator Characteristic – операционная характеристика приемника).
Результаты
В группе исследования в зависимости от степени патоморфологического ответа на НАПХТ пациенты распределились следующим образом: 14 (8,64 %) – с отсутствием ответа (рTRG-0), 95 (58,64 %) – со слабым ответом (рTRG-1), 42 (25,93 %) – со значительным ответом (рTRG-2), 11 (6,79 %) – с полным ответом (рTRG-3) (табл. 3).
Соотношение степени патоморфологического ответа с результатами биопсии, проведенной перед началом НАПХТ, и операционного материала отличалось (табл. 4, 5). Увеличение объема опухоли наблюдалось крайне редко – в 6 (3,7 %) случаях, в том числе и при отсутствии эффекта ХТ. Из графика (рис. 1) следует, что по степени изменения объема невозможно однозначно установить степень регресса, и это характерно для опухоли любого гистологического типа.
Чем выше была степень регресса, тем большее наблюдалось уменьшение объема опухоли (табл. 6). Тем не менее из графика (рис. 2) видно, что не существует порога изменения объема опухоли, позволяющего выделить отдельную категорию степени TRG. Если объем не меняется, то вряд ли имеет место полный регресс. Не определялось какой-либо четкой связи между степенью изменения объема, гистологическим типом опухоли и степенью регресса на фоне проведенной НАПХТ.
Для всех пациентов данного исследования проанализированы следующие КТ-характеристики (качественные и количественные биомаркеры визуализации) при различных степенях патомор-фологического регресса: максимальный размер таблица 1/table 1
клиническая характеристика пациентов clinical characteristics of patients
tumor regression grading (tRg) according to the classification of the Japan gastric cancer association (Jgca, 3rd english edition)
распределение пациентов в зависимости от степени патоморфологического ответа на нАПхтdistribution of patients depending on the pathomorphological response to Napct
|
Патоморфологические данные (биопсия)/ Pathomorphological biopsy findings |
рTRG-0 (JGCA) |
рTRG-1 (JGCA) |
рTRG-2 (JGCA) |
рTRG-3 (JGCA) |
|
G1 |
0 (0 %) |
8 (4,9 %) |
0 (0 %) |
0 (0 %) |
|
G2 |
3 (1,9 %) |
16 (9,9 %) |
8 (4,9 %) |
6 (3,7 %) |
|
G3 |
7 (4,3 %) |
36 (22,2 %) |
13 (8,0 %) |
4 (2,5 %) |
|
Mucinous |
0 (0 %) |
0 (0 %) |
0 (0 %) |
0 (0 %) |
|
SRCC |
2 (1,2 %) |
19 (11,7 %) |
16 (9,9 %) |
0 (0 %) |
|
PCC |
1 (0,6 %) |
2 (1,2 %) |
3 (1,9 %) |
0 (0 %) |
|
SRCC + PCC |
0 (0%) |
1 (0,6 %) |
1 (0,6%) |
0 (0 %) |
|
Mixed Ас |
1 (0,6 %) |
12 (7,4 %) |
1 (0,6 %) |
1 (0,6 %) |
|
0 |
0 (0 %) |
1 (0,6 %) |
0 (0 %) |
0 (0 %) |
Примечание: G1 – высокодифференцированная аденокарцинома; G2 – умереннодифференцированная аденокарцинома; G3 – низкодифференцированная аденокарцинома; Mucinous – муцинозная карцинома; SRCC – перстневидноклеточная карцинома; PCC – рак из плохо сцепленных клеток; Mixed Ас – смешанная аденокарцинома; 0 – не получено опухолевых клеток при проведении биопсии.
Notes: G1 – well differentiated adenocarcinoma, G2 – moderately differentiated adenocarcinoma; G3 – poorly differentiated adenocarcinoma; Mucinous – mucinous carcinoma; SRCC – signet ring cell carcinoma; PCC – poorly cohesive carcinoma; Mixed Ac cells – mixed adenocarcinoma; 0 – no tumor cells were obtained during biopsy.
таблица 5/table 5
соотношение степени патоморфологического ответа на нАПхт с патоморфологическими данными операционного материала correlation of the grade of pathomorphological response to Napct with pathomorphological findings of surgical specimens
|
Патоморфологические данные (операционный материал)/ Pathomorphological findings of surgical specimens |
рTRG-0 (JGCA) |
рTRG-1 (JGCA) |
рTRG-2 (JGCA) |
рTRG-3 (JGCA) |
|
G1 |
0 (0 %) |
5 (3,1 %) |
5 (3,1 %) |
0 (0 %) |
|
G2 |
2 (1,2 %) |
15 (9,3 %) |
4 (2,5 %) |
0 (0 %) |
|
G3 |
5 (3,1 %) |
29 (17,9 %) |
10 (6,2 %) |
0 (0 %) |
|
Mucinous |
0 (0 %) |
1 (0,6 %) |
1 (0,6 %) |
0 (0 %) |
|
SRCC |
2 (1,2 %) |
14 (8,6 %) |
6 (3,7 %) |
0 (0%) |
|
PCC |
3 (1,9 %) |
14 (8,6 %) |
9 (5,6 %) |
0 (0 %) |
|
SRCC + PCC |
1 (0,6 %) |
7 (4,3 %) |
4 (2,5%) |
0 (0 %) |
|
Mixed Ас |
1 (0,6 %) |
10 (6,2 %) |
3(1,9 %) |
0 (0 %) |
|
Complete response |
0 (0 %) |
0 (0 %) |
0 (0 %) |
11 (6,8 %) |
Примечание: G1 – высокодифференцированная аденокарцинома; G2 – умереннодифференцированная аденокарцинома; G3 – низкодифференцированная аденокарцинома; Mucinous – муцинозная карцинома; SRCC – перстневидноклеточная карцинома; PCC – рак из плохо сцепленных клеток; Mixed Ас – смешанная аденокарцинома; Complete response – полный патоморфологический регресс после проведения НАПХТ.
Notes: G1 – well differentiated adenocarcinoma; G2 – moderately differentiated adenocarcinoma; G3 – poorly differentiated adenocarcinoma;
SRCC – signet ring cell carcinoma; PCC – poorly cohesive carcinoma; Mixed Ac – mixed adenocarcinoma; Complete response – complete pathological regression after NAPCH.
таблица 6/table 6
соотношение изменения объема опухоли и степени патоморфологического ответа на нАПхт correlation between changes in tumor volume and the grade of pathomorphological response to Napct рTRG (JGCA)
рTRG-0 рTRG-1 рTRG-2 рTRG-3
|
Степень уменьшения объема (среднее значение)/ 0 % 11 % 22 % Tumor volume reduction rate (average) |
67 % |
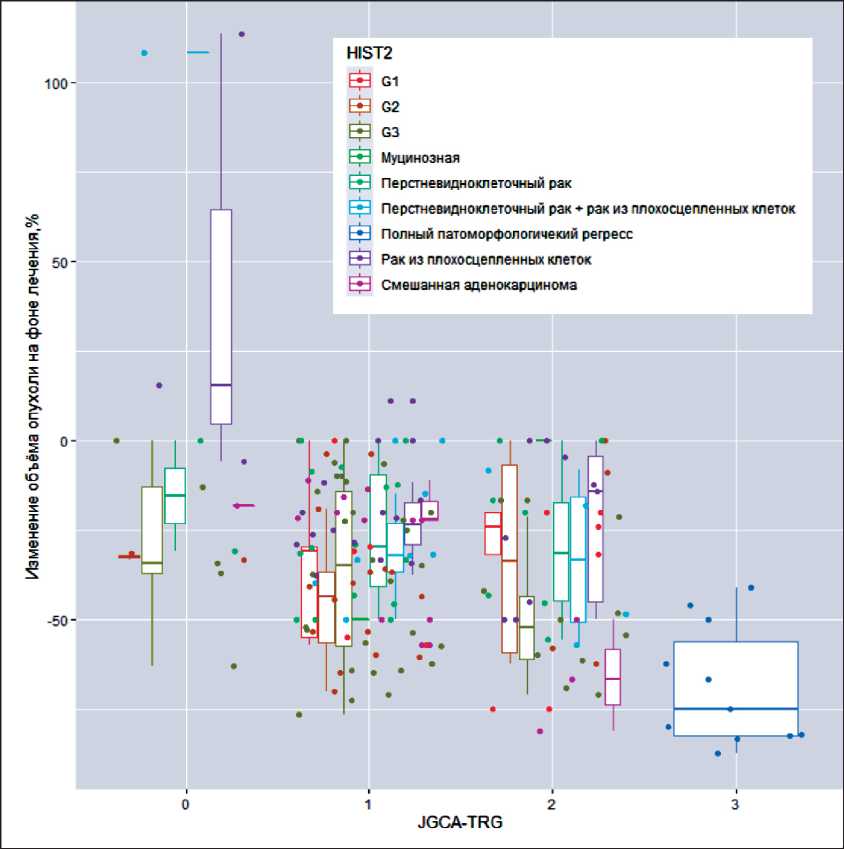
Рис. 1. Изменение объема (%) различных типов РЖ на фоне лечения в зависимости от степени патоморфологического регресса (рTRG (JGСA))
Fig. 1. Сhanges in the volume (%) of various types of gastric cancer during treatment, depending on the pathological tumor regression grade (рTRG (JGСA))
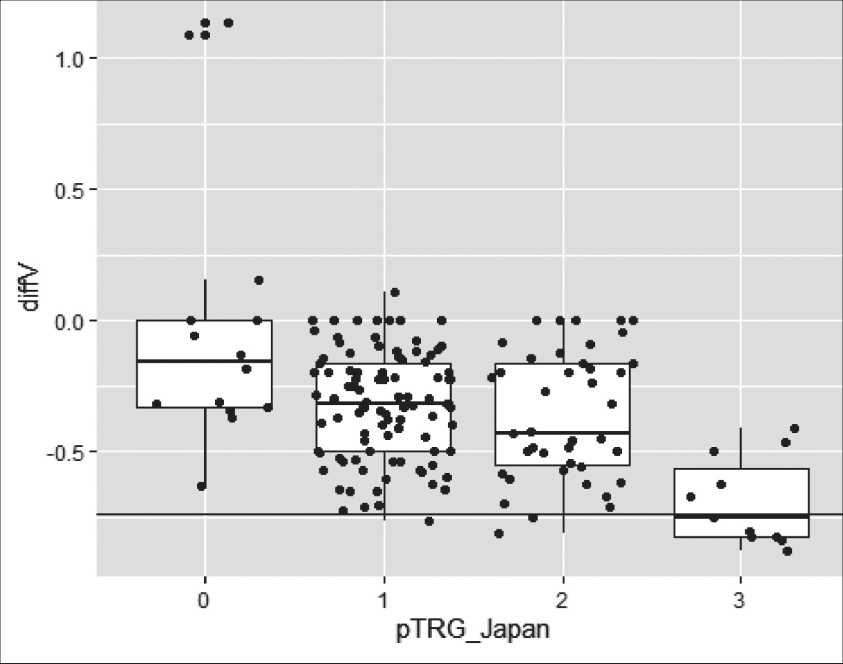
Рис. 2. Изменение объема опухоли в зависимости от степени патоморфологи-ческого регресса (рTRG (JGСA)) Fig. 2. Сhanges in the tumor volume depending on the pathological tumor regression grade (рTRG (JGСA))
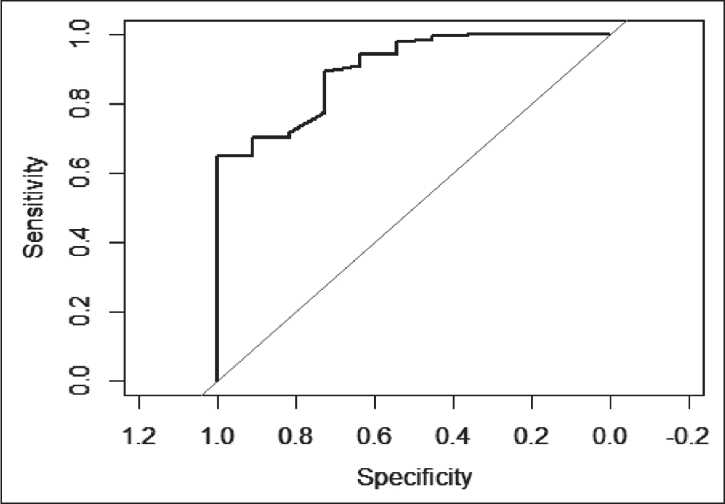
Рис. 3. ROС кривая для дифференцировки TRG-0,1,2 и TRG-3 по данным относительной разницы объема Fig. 3. ROС curve for differentiation of TRG-0,1,2 and TRG-3 according to the data of the relative difference in the tumor volume
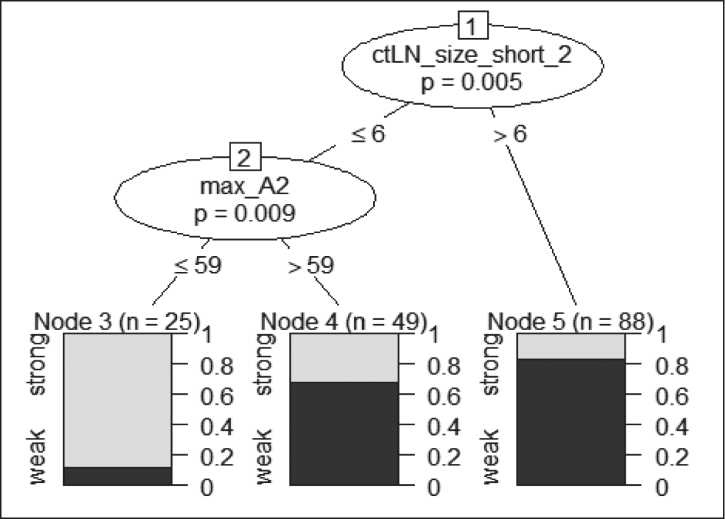
Рис. 4. Прогностическая модель, построенная методом дерева условного вывода (Сonditional Inference Trees) с трехкратной 10-блочной перекрестной валидацией с помощью языка программирования R и библиотеки caret. ctLN_size_short_2 – размер наибольшего парагастрального лимфатического узла по короткой оси после проведения НАПХТ по данным КТ-ПГГ;
-
*max_A2 – максимальная КТ-плотность опухоли в артериальную фазу сканирования при КТ-ПГГ, выполненной после проведения НАПХТ
Fig. 4. Сonditional Inference Trees predictive model with triple 10-block cross-validation using the R programming language and the caret library ctLN_size_short_2 – the size of the largest paragastric lymph node along the short axis after NAPСT according to СT-PGG; max_A2 – maximum СT-density of the tumor in the arterial phase of scanning with СT-PGG performed after NAPСT
Наиболее высокое значение было получено для разницы объемов в разделении TRG-0,1,2 и TRG-3 и в отношении размеров лимфатических узлов при разделении TRG-0,1,2 и TRG-3. Анализ диагностической эффективности показывает, что если опухоль уменьшилась меньше чем на 73,8 %, то с точностью 98,01 % может быть исключен вариант ответа TRG-3. Однако если степень уменьшения превышала 73,8 %, то категория TRG-3 может быть установлена с 67 % точностью. Если объем опухоли уменьшился на 73,8 %, то в 67 % случаев был зарегистрирован ответ рTRG-3, в 33 % – рTRG-0,1,2. Таким образом, согласно ROC-анализу, оптимальным порогом изменения объема для исключения TRG-3 является 73,8 %. При таком пороге специфичность составляет 54,5 %, чувствительность – 98,01 %, прогностическая значимость отрицательного ответа – 67 %.
В качестве прогнозируемой степени ответа мы выбрали степень патоморфоза TRG (JGCA), упрощенную до двух степеней: хороший ответ, куда входили TRG-2 и TRG-3, и плохой ответ, куда входили TRG-0 и TRG-1. На основании проанализированных данных построена прогностическая модель методом дерева условного вывода с трехкратной 10-блочной перекрестной валидацией с помощью языка программирования R и библиотеки caret (рис. 4).
Согласно полученной прогностической модели, если размер наибольшего парагастрального лимфатического узла по короткой оси после проведения НАПХТ превышал 6 мм, то имелся слабый ответ на лечение – TRG-0/1, если размер парагастраль-ного лимфатического узла по короткой оси после проведения НАПХТ был меньше или равен 6 мм и максимальная КТ-плотность опухоли в артериальную фазу при КТ-исследовании после НАПХТ была меньше или равна 59 HU, то определялся ответ категории TRG-2/3, если плотность опухоли была больше 59 HU, то – TRG-1/2 (рис. 5). Точность определения TRG-0/1 составила 82,6 %, TRG-1/2 – 90,0 %, TRG-2/3 – 88 %. Ошибки в определении TRG фиксировались в 18 % случаев (каждый 5-й случай), большая часть ошибок приходилась на рTRG2 (табл. 7).
Таким образом, если максимальный размер по короткой оси парагастрального лимфатического узла, измеренный при КТ-ПГГ после проведения НАПХТ, составляет >6 мм, то степень ответа по КТ таблица 7/table 7
сопоставление cttRg и ptRg comparison of cttRg and ptRg
|
TRG JGCA |
рTRG-0 |
рTRG-1 |
рTRG-2 |
рTRG-3 |
|
ctTRG-0/1 |
12,5 |
70,1 |
15,1 |
2,3 |
|
ctTRG-1/2 |
4,0 |
63,0 |
27,0 |
6,0 |
|
ctTRG-2/3 |
4,0 |
8,0 |
64,0 |
24,0 |
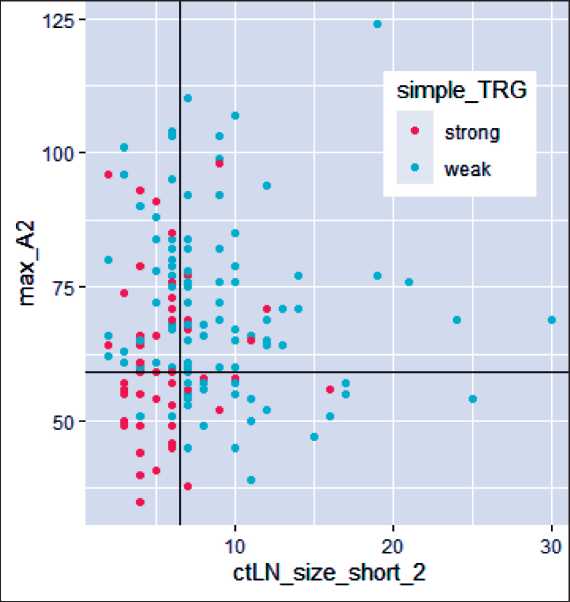
Рис. 5. Связь между максимальной плотностью опухоли в артериальную фазу сканирования при КТ-ПГГ после НАПХТ и размером парагастрального лимфатического узла по короткой оси после проведения НАПХТ при TRG-0/1 TRG-2/3 Fig. 5. Relationship between the maximum tumor density in the arterial phase of scanning with СT-PGG after NAPСT and the size of the paragastric lymph node along the short axis after NAPСT at TRG-0/1 TRG-2/3
возможно расценивать как ctTRG-0/1 с точностью 82,6 %. Если максимальный размер по короткой оси парагастрального лимфатического узла, измеренный при КТ-ПГГ после проведения НАПХТ ≤6 мм, то следующим этапом необходимо получить максимальные денситометрические показатели плотности опухоли в артериальную фазу сканирования при КТ-ПГГ после проведения НАПХТ. При показателях плотности опухоли >59 HU с точностью 90 % возможно расценивать степень регресса как ctTRG-1/2, если ≤59 HU – с точностью 88 % возможен ответ ctTRG 2/3. На основании вышеизложенного с помощью КТ-пневмогастрографии разработан оригинальный алгоритм оценки степени регресса МРРЖ после НАПХТ на этапе клинического стадирования [29].
Обсуждение
Степень патоморфологического ответа опухоли на лечение может быть оценена только после анализа операционного материала, данный маркер невозможно использовать при неоперабельных случаях и для корректировки лекарственной терапии. Однако для планирования тактики лечения необходимо понимать степень регресса опухоли, которая является предиктором отдаленных результатов. Пятилетняя выживаемость у пациентов с патоморфологическим ответом после комбинированного лечения достигает 83 %, а без ответа на НАПХТ – 31 % [30].
P. Achilli et al. [31] демонстрируют важное значение оценки радиологического ответа наряду с па-томорфологической оценкой TRG как предикторов прогноза безрецидивной и общей выживаемости. Медиана безрецидивной выживаемости в случае полного и субтотального патоморфологического регресса не была недостигнута за период 25,7 мес наблюдения, медиана общей выживаемости в таком случае составила 52,8 мес, для частичного или отсутствующего патоморфологического регресса медиана безрецидивной и общей выживаемости – 20,1 и 35,5 мес. Для рентгенологического полного и субтотального регресса медиана безрецидивной и общей выживаемости не была достигнута за период 36,6 мес наблюдения, при стабилизации и прогрессировании процесса составила 20,9 и 35,6 мес.
Изменение размеров опухоли является индикатором изменения количества опухолевых клеток и рентгенологическим биомаркером ответа на лечение [32]. Цитотоксическое химиотерапевтическое воздействие, направленное главным образом на устранение опухолевых клеток, может быть оценено с помощью изменения размера опухоли. J. Lu et al. [33] считают, что добавление такого критерия, как размер опухоли, к TNM-стадии увеличивает точность прогноза 5-летней выживаемости с 75,4 до 77,9 %. Однако цитостатики, останавливая опухолевый рост, не обязательно приводят к ликвидации опухолевых клеток и уменьшению размеров опухоли, поэтому любая комбинация количественных и качественных характеристик опухоли может быть использована в качестве биомаркеров визуализации ответа на лечение. Хотя изменение объема опухоли отражает изменение количества опухолевых клеток, в настоящее время нет рекомендаций по оценке ответа на лечение на основе данного биомаркера визуализации, и его значение остается спорным. Некоторые авторы считают, что изменение объема может быть результатом изменения соотношения неклеточных компонентов опухоли и жизнеспособных опухолевых клеток [34]. S.M. Lee et al. [35] сообщают о незначительной корреляции изменения объема РЖ с патоморфологической степенью регресса. Использование опции измерения объема/площади опухоли (КТ-волюмометрия) может быть полезно в определении степени регресса, когда изменение объема достигает 35,6 %, чувствительность и специфичность метода КТ составляют 100 и 58,8 %. Новые схемы терапии в определенных случаях могут вызвать парадокс увеличения размера опухоли после лечения, несмотря на благоприятный ответ, и наоборот, небольшое изменение морфологических признаков после определенных цитостатических препаратов может быть неправильно классифицировано как стабилизация процесса, несмотря на клиническое прогрессирование. Эта проблема может быть в некоторой степени решена путем комбинированной оценки количественных и качественных биомаркеров визуализации с добавле- нием таких критериев, как изменение плотности, что характеризует изменение ангиогенеза опухоли, определяет наличие некроза, фиброза. X. Ji et al. [36], оценивая плотность опухоли в артериальную фазу сканирования при проведении КТ, продемонстрировали, что кровоснабжение РЖ может быть предиктором ответа на ХТ. Хорошее кровоснабжение опухоли было связано со значительно лучшим клиническим и патологическим ответом на ХТ, чем плохое кровоснабжение, общая 3-летняя выживаемость была выше в первой группе – 78,57 % по сравнению со второй – 54,44 %. K. Liu et al. [37] рекомендуют адаптировать критерии Choi, используемые для оценки эффектов лечения гастроинтестинальных опухолей и заключающие в себе измерение не только линейных размеров, но и денситометриче-ских показателей плотности с помощью КТ в оценке степени регрессии РЖ после НАПХТ. Многие исследования демонстрируют положительные аспекты в применении КТ-перфузии с анализом параметров кровотока в опухоли, однако данный метод не стандартизован и имеет ряд ограничений. Например, в случае размера опухоли менее 2,8 см и более 6,5 см оценка становится затруднительной, артефакты из-за дыхания могут ограничивать качество изображений и получение результатов, также имеет место большая доза ионизирующего излучения [38]. J.T. Hallinan et al. [39] приводят данные об оценке кровотока с помощью КТ-перфузии, сообщая, что снижение значения кровотока может отражать как степень регресса на фоне НАПХТ, так и характеризовать высокий потенциал злокачественности опухоли. H.M. Lundsgaard et al. [40] сообщают о 69 % чувствительности и 58 % специфичности КТ-перфузии


