Возможности компьютерного моделирования опухолевого поражения легких при сравнении с данными ОФЭКТ/КТ с 99mТс-миби
Автор: Денисова Н.В., Гурко М.А., Минин С.М., Анашбаев Ж.Ж., Жеравин А.А., Самойлова Е.А., Красильников С.Э.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 2 т.22, 2023 года.
Бесплатный доступ
Целью исследования явились разработка и валидация программного комплекса (ПК) для имитационного компьютерного моделирования процедуры обследования методом ОФЭКТ/КТ пациентов с раком легких и оценки точности реконструкции опухолевых поражений. материал и методы. Была проведена сцинтиграфия органов грудной клетки пациента с периферическим плоскоклеточным раком верхней доли правого легкого на двухдетекторной гамма-камере GE Discovery NM/CT 670 DR (США) с использованием высокоразрешающих коллиматоров для энергии 140 КэВ и радиофармпрепарата (РФП) 99mТс-Технетрил (МИБИ, “Диамед”, Москва). Полученные данные подвергались компьютерной обработке с использованием специализированной системы Xeleris 4.0 фирмы “GE” (США). Создан ПК, который включает программу генерирования воксельного фантома («виртуальный пациент»), программу моделирования сбора «сырых» проекционных данных («виртуальный томограф») и программу реконструкции изображений на основе алгоритма OSEM (Ordered Subset Expectation Maximization). С целью валидации созданного ПК выполнено имитационное компьютерное моделирование клинического случая. Полуколичественный сравнительный анализ изображений основывался на оценке опухоль/ фон. Результаты. Наблюдается достаточно хорошая корреляция между клиническими «сырыми» данными, записанными с реального пациента, и проекционными данными, рассчитанными методом Монте-Карло с «виртуального пациента». Результаты сравнительного анализа показали, что на реконструированных изображениях оценка опухоль/фон занижена. заключение. Вопрос о точности реконструкции опухолевых поражений при использовании стандартных алгоритмов реконструкции OSEM не изучен. Этот вопрос важен при ведении пациентов с опухолевыми поражениями легких и требует изучения и систематизации. Разработанный ПК будет использоваться в последующих исследованиях для изучения ошибок и артефактов на изображениях опухолевых поражений, а также разработки подходов для их преодоления.
Компьютерное моделирование, математический фантом, воксельный фантом человека, итерационный алгоритм реконструкции, офэкт/кт, рак лёгкого
Короткий адрес: https://sciup.org/140300159
IDR: 140300159 | УДК: 616.24-006-073.756.8 | DOI: 10.21294/1814-4861-2023-22-2-14-25
Текст научной статьи Возможности компьютерного моделирования опухолевого поражения легких при сравнении с данными ОФЭКТ/КТ с 99mТс-миби
В мире рак легкого (РЛ) является наиболее распространенным злокачественным новообразованием с высокими показателями смертности. В России в структуре онкологических заболеваний мужчин рак легкого занимает 1-е место. С учетом этих данных развитие методов диагностики для обнаружения опухолевых поражений, планирования терапии и мониторинга ее эффективности является актуальной задачей современной медицины. Классификация TNM [1] базируется на оценке трех параметров: Т – размер и локализация первичной опухоли, N – вовлечение лимфатических узлов средостения, М – наличие отдаленных метастазов в другие органы, в том числе и в другое легкое. Ключевыми факторами диагностики РЛ являются: дифференцирование злокачественных и доброкачественных поражений, определение точного размера первичной опухоли, оценка распространенности опухолевого процесса (стадирование).
Для диагностики РЛ наиболее широко используется метод компьютерной томографии (КТ). Однако при наличии высокой чувствительности специфич- ность КТ органов грудной клетки остается довольно низкой, что диктует необходимость в изучении, внедрении и использовании новых современных технологий. Однофотонная эмиссионная компьютерная томография (ОФЭКТ) с Тс-МИБИ широко применяется для оценки перфузии миокарда левого желудочка, а в последнее десятилетие этот метод активно внедряется в клиническую практику диагностики опухолевых поражений легких. Анализ работ, посвященных применению метода ОФЭКТ/КТ с 99mТс-МИБИ в оценке опухолевого поражения легких [2–8], показывает, что исследования сильно отличались по величине дозы вводимого препарата (335–1000 МБк) и параметрам записи сырых данных (60–120 ракурсов, время экспозиции 10–30 сек, интервал времени между введением трассера и сканированием 5–40 мин). Практически отсутствует информация о характеристиках используемых алгоритмов реконструкции (число подмножеств subsets, номер итерации останова), от которых может сильно зависеть полученное решение. Полуколичествен-ный анализ изображений основывался на расчете коэффициентов, равных отношению активности в очаге к активности в выбранной области нормальной ткани и симметричных участках контралатерального легкого. Несмотря на вышеуказанные различия в протоколе обследований, полученные во всех работах результаты, особенно высокие значения специфичности, указывают на перспективность метода ОФЭКТ/КТ с Тс-МИБИ для диагностики рака легких. Однако многие вопросы требуют дальнейшего изучения и систематизации.
Среди важных вопросов стоит назвать выявление опухолевых очагов малых размеров, точное количественное определение активности в опухолевых очагах, стадирование опухолевого процесса, мониторинг эффективности противоопухолевой терапии. Остаются также нерешенными вопросы о точности оценки параметра «опухоль/фон», поскольку этот параметр является определяющим при дифференцировании злокачественных и доброкачественных поражений. Для получения ответов на эти вопросы необходимы исследования с заданным известным источником – фантомом, имитирующим накопление РФП в органах пациента, что позволит количественно оценивать точность реконструированных изображений. Такие исследования могут проводиться на клинических установках с использованием вещественных фантомов ( in vitro ), однако они ограничены высокой стоимостью и невозможностью изучить решения для разнообразных клинических случаев. Единственной альтернативой является метод компьютерного моделирования ( in silico ) с использованием вычислительных фантомов, имитирующих пациентов с разным телосложением и опухолевыми поражениями различной локализации и размера. Метод имитационного компьютерного моделирования («Virtual Clinical Trials») активно развивается в течение последних
20 лет в центрах высокотехнологичной ядерной медицины США, странах Европейского Союза, Японии и Китая [9]. В России такие исследования начали развиваться относительно недавно. В работе методом компьютерного моделирования было выполнено исследование ложного апикального дефекта на ОФЭКТ/КТ изображениях перфузии миокарда в ядерной кардиологии [10].
Целью исследования явились разработка и валидация программного комплекса (ПК) для имитационного компьютерного моделирования процедуры обследования методом ОФЭКТ/КТ пациентов с опухолевыми поражениями легких. Валидация развитого ПК выполнена путем сравнения результатов имитационного моделирования с клиническим случаем исследования пациента с периферическим плоскоклеточным раком верхней доли правого легкого на установке ОФЭКТ/КТ GE Discovery NM/CT 670 Pro.
Материал и методы
В отделении ФГБУ НМИЦ им. акад. Е.Н. Мешалкина пациенту Н., 63 года, с диагнозом: Периферический рак верхней доли правого легкого T3N1M0 IIIA st. ДН 2, проведено ОФЭКТ/КТ с 600 МБк 99mTc-МИБИ на аппарате ОФЭКТ/КТ GE Discovery NM/CT 670 с параметрами: матрица 128×128 пикселов, 30 с на кадр, оборот каждого детектора 180º. На серии томосцинтиграмм в верхней доле правого легкого определяется атипичная зона среднеинтенсивного повышенного накопления 99mTc-МИБИ, совпадающая с периферическим объемным образованием, размерами ~7×6×6 см, имеющая четкие и лучистые контуры, и центральная зона некроза, размерами ~7×6×6 см (рис. 1). Для выполнения компьютерного имитационного
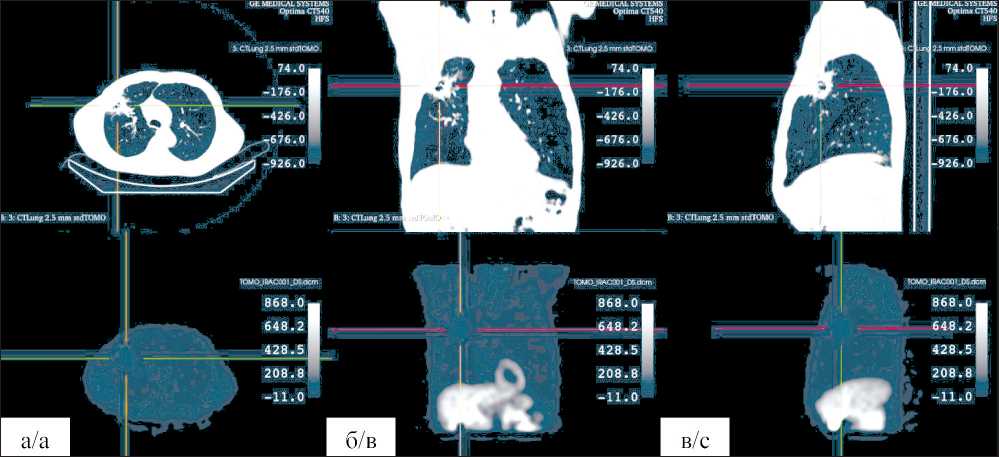
Рис. 1. КТ-снимки (сверху) и ОФЭКТ-изображения (снизу) пациента с периферическим плоскоклеточным раком верхней доли правого легкого. Аксиальное (а), коронарное (б) и сагиттальное (в) сечения КТ и ОФЭКТ 3D реконструированных изображений. Изображения получены в НМИЦ им. акад. Мешалкина на установке ОФЭКТ/КТ GE Discovery NM/CT 670
Fig. 1. CT scans (top) and SPECT images (bottom) of a patient with peripheral squamous cell carcinoma of the upper lobe of the right lung. Axial (a), coronary (b) and sagittal (c) sections of CT and SPECT 3D reconstructed images. The images were obtained at E. Meshalkin National Medical Research Center on the SPECT/CT GE Discovery NM/CT 670
моделирования процедуры обследования методом ОФЭКТ/КТ пациентов с опухолевыми поражениями легких в данной работе создан специализированный программный комплекс, состоящий из 3 базовых блоков: «виртуальный пациент», «виртуальный томограф», алгоритм реконструкции.
Вычислительный фантом – «виртуальный пациент»
В наших предыдущих работах для выполнения исследований в области ядерной кардиологии был развит математический стилизованный антропоморфный фантом – математическая модель торса (ММТ) [10–12]. Этот фантом был создан на основе уравнений аналитической геометрии и логических булевых операторов и использовался в качестве «виртуального пациента» в имитационном компьютерном моделировании исследования перфузии миокарда методом ОФЭКТ/КТ с Тс-МИБИ [10]. Однако математические стилизованные фантомы имеют ограничения в детальном анатомическом описании. Реалистичные виртуальные исследования требуют репрезентативных моделей пациентов с патологиями, особенно если имитационные исследования нацелены на конкретную задачу.
Нами представлена разработка нового поколения фантомов – персонифицированная воксельная модель торса (ВМТ) на основе КТ-изображений реального пациента. На рис. 1 представлены клинические ОФЭКТ- и КТ-изображения пациента с периферическим плоскоклеточным раком верхней доли правого легкого. Фактически вычислительный фантом ВМТ описывает анатомическое строение внутренних органов и патологических поражений конкретного пациента. Процесс создания фантома представляет собой сегментацию трехмерного изображения, т. е. процесс разбиения изображения на сегменты по определенным признакам с целью выделения интересующих участков. Использовались инструменты сегментации изображений, предоставляемые модулем Segment Editor, входящим в бесплатный программный пакет с открытым исходным кодом 3D Slicer [13].
Формирование фантома проходило в 2 этапа. На первом этапе проводилась сегментация КТ-снимков с выделением структур, различающихся по плотности тканей. Было выбрано 5 типов структур: воздух, легкие, кости, мягкие и жировые ткани. На рис. 2 представлен воксельный фантом – «виртуальный пациент», сгенерированный на основе КТ-изображений. Фантом задан на сетке 128×128×128 в декартовой системе координат. Размер стороны вокселя в плоскости поперечного сечения составлял 4,4 мм.
Для исследований в области ядерной медицины, в частности методом ОФЭКТ, необходима не анатомическая модель, а модель, описывающая трехмерное распределение радиофармпрепарата в органах «виртуального пациента» – 3D «карта накопления РФП». Кроме того, для учета ослабления
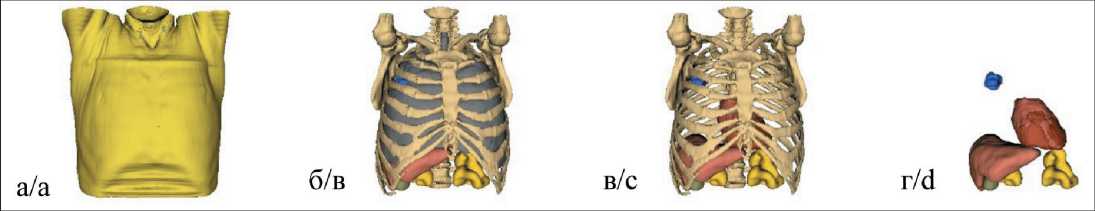
Рис. 2. Воксельный фантом ВМТ (воксельная модель торса), созданный на основе данных КТ пациента с опухолевым поражением правого легкого. Полный фантом (в одежде) (а), фантом с исключенными мягкими и жировыми тканями (б), с исключенными легкими (в) и без костной структуры (г). Фантом задан на сетке 128×128×128 в декартовой системе координат
Fig. 2. Voxel phantom of the VMT (Voxel Model of the Torso), based on CT data of a patient with a tumor of the right lung. Whole phantom (in clothes) (a), phantom with excluded soft and adipose tissue (b), with excluded lungs (c) and without bone structure (d). The phantom is set on a 128×128×128 grid in a Cartesian coordinate system
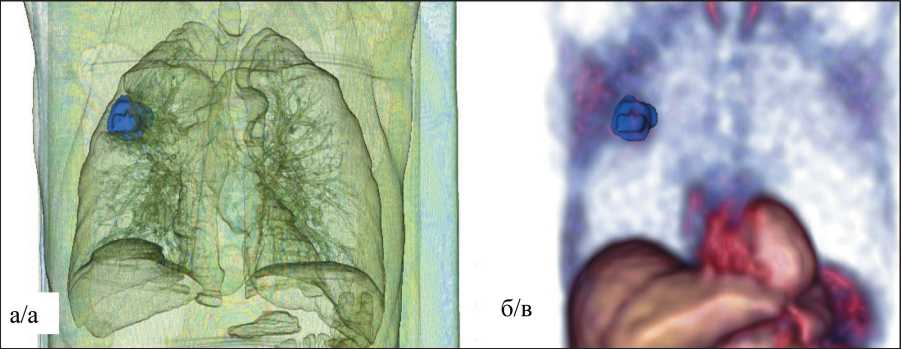
Рис. 3. Клинические изображения КТ (а) и ОФЭКТ (б) опухолевого поражения правого легкого Fig.3. CT (a) and SPECT (b) images of the right lung tumor
гамма-излучения в биологических тканях необходима 3D «карта ослабления». Поэтому на втором этапе выделяются области накопления радиофармпрепарата. Для решения этой задачи используются ОФЭКТ-изображения того же пациента с периферическим плоскоклеточным раком верхней доли правого легкого. К наиболее практичным инструментам на этом этапе можно отнести обычные средства оконтуривания (paint, erase), межслойного заполнения (fill between slices) и сглаживания (smoothing). Выделенные сегменты далее могут быть использованы инструментом mask volume для заполнения изображений заданными значениями, например, для создания 3D «карты ослабления» или 3D «карты накопления РФП». На рис. 3 представлены ОФЭКТ- и КТ-изображения выделенных фрагментов с опухолевым поражением.
Значения накопленной активности в единицах импульс/воксел определялись из клинических реконструированных изображений реального пациента в плоскостях (axial, coronal, sagittal) как средние значения по выделенной области (органу). Однако значения накопления и соотношения между значениями накопления в разных органах (в частности, отношение «опухоль/фон») на клинических ОФЭКТ-изображениях могут не соответствовать истинным отношениям накопления. Это обусловлено ошибками реконструкции, особенно небольших очагов со скачками накопления РФП. Ошибки возникают из-за ограничений алгоритма OSEM, а также отсутствия поправок на рассеяние гамма-излучения РФП в тканях организма, на эффекты частичного объема и мертвого времени регистрации импульсов. В этом смысле более правильно ориентироваться на клинические измеренные «сырые» данные. В данной работе рассчитывались «сырые» данные с «карты накопления» фантома, которые сравнивались с реальными клиническими «сырыми» данными. По результатам сравнения вводились соответствующие поправки в «карту накопления». Например, отношение усредненных значений опухоль/фон, равных отношению накопления в очаге к накоплению в выбранной области
Òàблицà 1/Table 1
Îтнîñитåльныå знàчåния êîнцåнтðàции ÐФП Òñ-МИБИ в «îðгàнàõ» вîêñåльнîé мîдåли тîðñà (ÂМÒ)
Relative values of the concentration of the radiop-

Рис. 4. «Карта накопления Тс-МИБИ» модели ВМТ – 3D-распределение относительных значений концентрации РФП Тс-МИБИ в органах грудной клетки с опухолью в верхней доле правого легкого (а), коронарный (б) и аксиальный (в) срезы. Опухоль указана стрелками
Fig. 4. The «Tc-MIBI uptake map» of the Voxel Model of Torso (VMT) is a 3D distribution of the relative values of the uptake of Tс-MIBI in tumor of the right lung (a), coronary (b) and axial (c) sections. The arrows point to the tumor
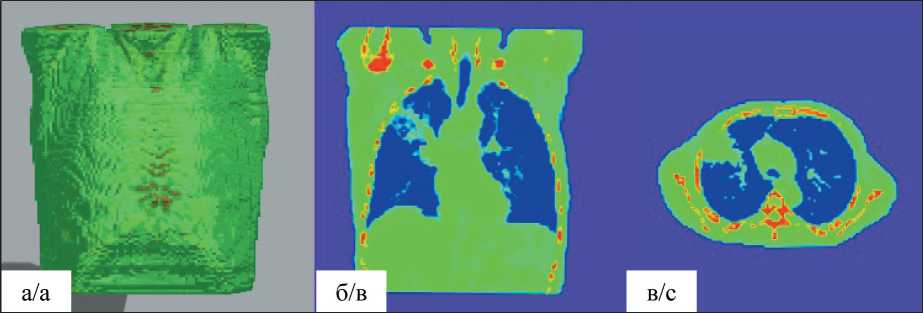
Рис. 5. «Карта ослабления», сгенерированная на основе КТ-данных. 3D-распределение коэффициентов ослабления для фотонов с энергией 140 кэВ (а), коронарный (б) и аксиальный (в) срезы
Fig. 5. «Attenuation map» based on CT data. 3D distribution of attenuation coefficients for photons with an energy of 140 keV (a), coronary (b) and axial (c) slices
Òàблицà 2/Table 2
Знàчåния êîэффициåнтîв îñлàблåния для гàммà-излóчåния ñ энåðгиåé 140 êэ (тåõнåциé) Values of attenuation coefficients for gamma radiation with an energy of 140 keV (technetium)
|
Название материала (база данных)/ Material name (database) |
Линейный коэффициент ослабления для 140 кэВ, см-1/ Linear attenuation coefficient for 140 keV, cm-1 |
|
Сухой воздух/ Dry Air (ICRU-44) |
<0,001 ≈ 0 |
|
Легкие/Tissue of lung (ICRU-44) * |
0,035 |
|
Жировые ткани/Adipose tissue (ICRU-44) |
0,146 |
|
Мягкие ткани/Soft tissue (ICRU-44) |
0,162 |
Кортикальная кость/Cortical bone (ICRU-44) 0,298
Примечание: * – плотность уменьшена на ~2 порядка для соответствия известным значениям линейного коэффициента ослабления легких (0,035–0,04 cm-1).
Note: * – density reduced by ~2 orders of magnitude to match known values of linear lung attenuation coefficient (0.035–0.04 cm-1).
в различных органах и тканях «виртуального пациента» в единицах импульс/воксел, которые использовались для создания «карты накопления РФП», представлены в табл. 1. 3D «карта накопления Тс-МИБИ» представлена на рис. 4а. Также на рис. 4 показаны коронарный (б) и аксиальный (в) срезы, которые выбраны таким образом, чтобы продемонстрировать опухоль в верхнем сегменте правого легкого.
Для учета ослабления гамма-излучения в биологических тканях разной плотности используются данные КТ, с помощью которых генерируется индивидуальная «карта ослабления» для каждого пациента. В данной работе 3D «карта ослабления» была сгенерирована на основе КТ-данных пациента. В табл. 2 представлены используемые значения коэффициентов ослабления (в 1/см) для гамма-излучения с энергией 140 кэВ [14]. 3D «карта ослабления» и изображения сечений, соответствующих сечениям «карты накопления Тс-МИБИ», включающим опухолевое поражение, представлены на рис. 5. На 3D «карте ослабления» пациент представлен в одежде, поскольку ее рентгеновская плотность близка к плотности жировой ткани/кожи, что затрудняет исключение одежды из фантома.
Моделирование сбора проекционных данных – «виртуальная система ОФЭКТ/КТ»
В наших предыдущих исследованиях [10, 11] моделирование сбора «сырых» данных осуществлялось на основе метода режекции Неймана. В рамках этого подхода вначале рассчитываются точные данные, а потом они «зашумляются пуассоновским шумом». Такой метод имеет определенные ограничения. Более продвинутым подходом, наиболее приближенным к клинической процедуре записи данных в методе ОФЭКТ, является статистический метод Монте-Карло. В данной работе развит подход к расчету «сырых» проекционных данных на основе метода Монте-Карло [15]. Моделировалась установка ОФЭКТ/КТ GE Discovery NM/CT 670 Pro с низкоэнергетическим коллиматором высокого разрешения (LEHR) и кристаллом детектора 3/8” (табл. 3).
Процедура обследования включала круговую орбиту с пошаговым сканированием по дуге 360° с шагом в 3°. Аналогично клиническим исследованиям в численном моделировании имитировалась процедура записи данных с одинаковым временем сканирования на каждом из 120 ракурсов. Общее набранное число импульсов за время записи со всех ракурсов составило 10 500 000, что соот-
Òàблицà 3/Table 3
Пàðàмåтðы иñпîльзóåмîгî êîллимàтîðà Parameters of the used collimator
|
Наименование/ Name |
Поле видимости, см/ Field of view, cm |
Чувствительность (cps/MBq)/ Sensitivity (cps/ MBq)* |
Диаметр канала, мм/ Channel diameter, mm |
Толщина септы, мм/ Septa thickness, mm |
Длина канала, мм/ Channel length, mm |
|
LEHR |
54×40 |
72 |
1,5 |
0,2 |
35 |
Примечание: * – на расстоянии 100 мм от лицевой поверхности коллиматора для кристалла 3/8”.
Note: * – at a distance of 100 mm from the front surface of the collimator for a 3/8” crystal.
Òàблицà 4/Table 4
Пàðàмåтðы ñêàниðîвàния
Scan options
Сравнение клинических проекционных данных и данных, полученных методом моделирования Монте-Карло, представлено на рис. 6. Показаны данные 3 проекций из 120. Для большей наглядности на изображениях пропорционально повышены яркость и контрастность. Красной окружностью выделена область повышенного накопления радиофармпрепарата в легких. Наблюдается достаточно хорошее согласие между клиническими сырыми данными, записанными с реального пациента, и аналогичными проекционными данными, рассчи-
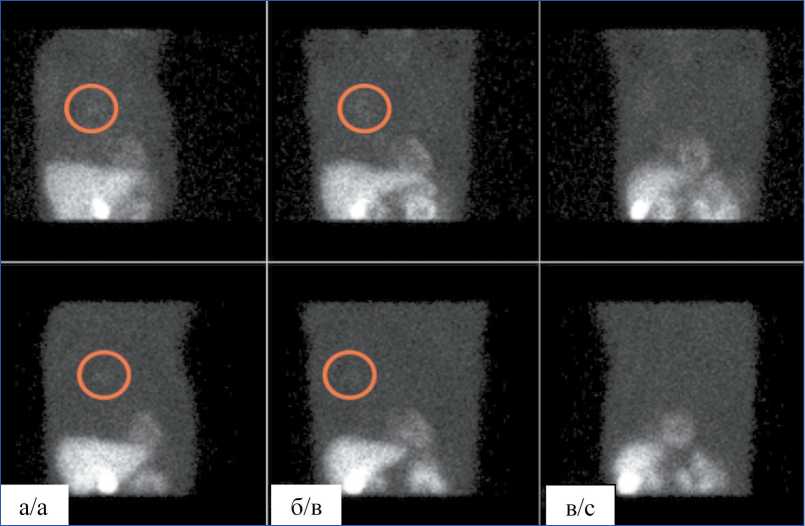
Рис. 6. Клинические (верхний ряд) и полученные в результате моделирования методом Монте-Карло (нижний ряд) проекционные данные. Левая передняя косая (а), фронтальная (б) и правая передняя косая (в)
Fig. 6. Clinical (upper row) and projection data obtained of Monte Carlo simulation (lower row). Left front oblique (a), front (b) and right front oblique (c)
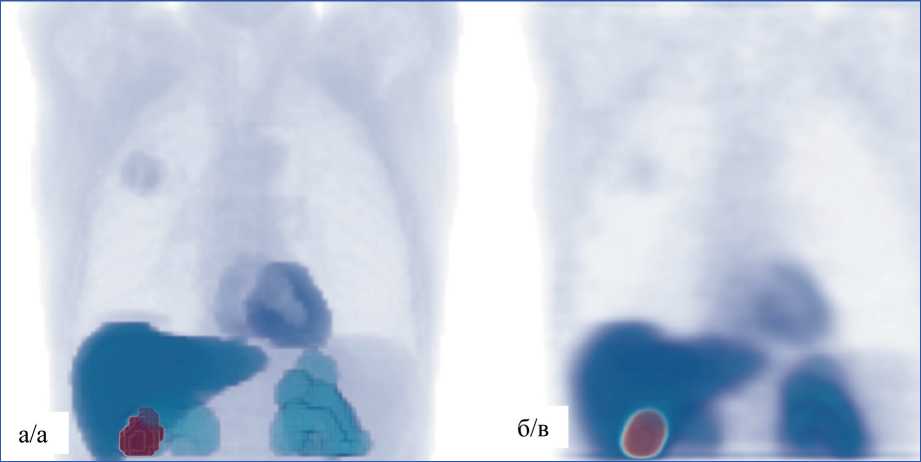
Рис. 7. Сравнение заданной «карты накопления Тс-МИБИ» виртуального пациента (а) и реконструированных изображений, полученных в результате имитационного моделирования (б)
Fig. 7. Comparison of a assigned «Tc-MIBI uptake map» of a virtual patient (a) and reconstructed images obtained as a result of simulation modeling (b)
танными методом Монте-Карло с использованием «виртуального пациента».
Алгоритм реконструкции
Для реконструкции 3D-изображений из сырых данных, рассчитанных методом Монте-Карло, использовался стандартный базовый алгоритм реконструкции OSEM (Ordered Subsets Expectation Maximization) [16]. На абсолютном большинстве современных коммерческих ОФЭКТ/КТ систем установлены алгоритмы реконструкции, основанные на OSEM (Astonish на Philips BrightView XCT, Evolution на GE Discovery NM/CT 670 Pro, Flash 3D на Symbia Intevo Siemens). Различия заключаются в использовании (или неиспользовании) различных сглаживающих фильтров, а также в расчете системной матрицы, входящей в алгоритм реконструкции. Системная матрица учитывает физические процессы, связанные с получением «сырых» данных. В работе в алгоритме OSEM использовалась системная матрица с учетом эффекта ослабления потока гамма-квантов в биологических тканях, который в англоязычной литературе принято обозначать как Attenuation Correction (AC). Также учитывался эффект прохождения через коллиматор и детектор, который описывался с помощью функции рассеяния точки (ФРТ). В англоязычной литературе учет ФРТ обозначается как Resolution Recovery (RR). Не учитывалась поправка на рассеяние гамма-излучения РФП в тканях организма (Scatter Correction), не учитывался эффект частичного объема (Partial Volume Effect), не учитывалось влияние мертвого времени регистрации импульсов на гамма-камере. Эти 3 последних эффекта не были включены в алгоритм реконструкции на клинической установке GE Discovery NM/CT 670 Pro, на которой проводились клинические исследования пациента, представленные в данной работе.
Реконструкция осуществлялась с использованием алгоритма OSEM с учетом ослабления (AC) и восстановления разрешения (RR). Изображение формировалось на матрице 128×128×128, размер стороны воксела в поперечном сечении изображения составлял 4,4 мм. Поскольку изображение опухоли получалось «зашумленным», осуществлялось сглаживание полученного изображения с помощью медианной фильтрации. В настоящее время не существует определенного руководства по протоколу обследования пациентов с поражением легких методом ОФЭКТ/КТ, в данной работе реконструкция выполнялась в режиме 30 subsets, номер итерации останова варьировался в интервале 3–10.
На рис. 7 представлено сравнение реконструированного изображения с заданной «картой накопления Тс-МИБИ» в фантоме. Изображения были нормированы по максимальному значению. Видно, что опухоль уверенно диагностируется на реконструированном изображении. На рис. 8 представлено сравнение клинических ОФЭКТ-изображений распределения активности РФП Тс-МИБИ в органах грудной клетки пациента с опухолью в верхней доле правого легкого и реконструированных изображений, полученных в результате имитационного моделирования данного клинического случая. Визуально наблюдается достаточно хорошая корреляция этих изображений.
Результаты и обсуждение
Создан программный комплекс для имитационного компьютерного моделирования процедуры ОФЭКТ/КТ обследования больных раком легких и выполнена его валидация путем сравнения результатов моделирования с клиническим случаем пациента с периферическим плоскоклеточным раком верхней доли правого легкого на установке
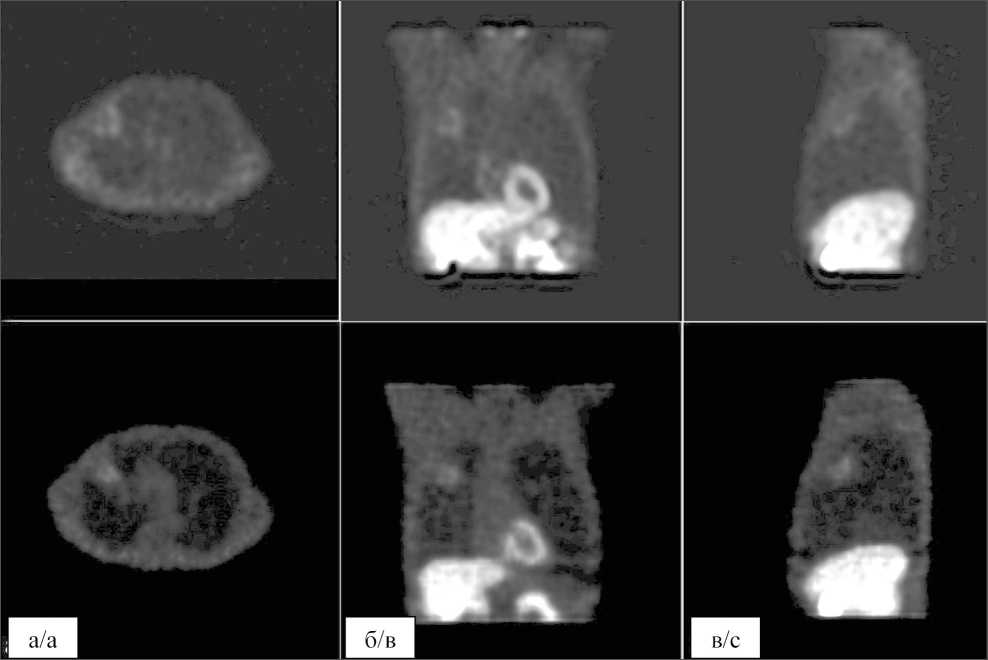
Рис. 8. Сравнение клинических ОФЭКТ-изображений накопления РФП Тс-МИБИ в органах грудной клетки с опухолью в верхней доле правого легкого (верхний ряд) и реконструированных изображений, полученных в имитационном моделировании (нижний ряд). Срезы, проходящие через опухоль: поперечный (а), коронарный (б) и сагиттальный (в)
Fig. 8. Comparison of clinical SPECT images of the Tc-MIBI uptake in the chest organs with a tumor in the upper lobe of the right lung (upper row) and reconstructed images obtained in simulation (lower row). Sections passing through the tumor lesion are shown: transverse (a), coronal (b) and sagittal (c)
ОФЭКТ/КТ GE Discovery NM/CT 670 Pro. Получены следующие результаты:
– Разработана и протестирована методология создания персонализированных воксельных фантомов («виртуальных пациентов») для исследований в области диагностической ядерной медицины. Создание «карты накопления РФП» необходимо контролировать с помощью сравнения рассчитанных и клинических «сырых» данных, чтобы учитывать ошибки на реконструированных изображениях, особенно в опухолевых очагах.
– Разработана и протестирована программа расчета «сырых» данных на основе метода Монте-Карло с нормировкой на конкретный клинический случай, которая задается общим числом зарегистрированных импульсов за время записи данных. Сравнение клинических «сырых» данных и рассчитанных методом Монте-Карло с «виртуального пациента» является тестовой проверкой правильности задания «карты накопления РФП». В численных экспериментах вначале было получено несоответствие данных в зоне опухолевого поражения. Для устранения этого несоответствия в фантоме было изменено значение накопления Тс-МИБИ в опухоли.
– Разработана программа расчета системной матрицы для алгоритма реконструкции изображений OSEM с учетом ослабления (AC) и восстановления разрешения (RR). Выполнена реконструкция изображения из рассчитанных методом Монте-Карло «сырых» данных для «виртуального пациента». Выполнены оценки отношения опухоль/фон для усредненных значений накопления активности в опухоли и в нормальной зоне в легких. Эти оценки составляли 20.0 в фантоме и 5.91 и 6.48 на реконструированных изображениях после 5-й и 10-й итераций соответственно.
Таким образом, в численных имитационных исследованиях были получены заниженные значения накопления в опухоли, что подтверждает вышесказанное предположение о том, что на реконструированных клинических изображениях накопление в опухоли занижено по сравнению с реальным. Причиной этого могут быть ограничения алгоритма OSEM, а также сглаживание, которое проводилось из-за «зашумленности» изображения опухоли. В наших предыдущих исследованиях показано, что сглаживание может приводить к заниженной оценке накопления РФП в опухоли [17]. Также указывалось, что сглаживание артефактов Гиббса, возникающих на изображениях опухоли, может привести к заниженным значениям накопления в опухоли и, как результат, заниженной величине отношения «опухоль/фон» [18]. Требуются дальнейшие детальные исследования этой проблемы. Следует отметить, что вопрос о точ- ности реконструкции опухоли при использовании стандартных алгоритмов реконструкции OSEM не изучен. Одной из главных проблем современных ОФЭКТ (и ПЭТ)-систем являются недостатки (недоработки) статистических итерационных алгоритмов OSEM. С точки зрения фундаментальной математической теории задача реконструкции изображений в методе ОФЭКТ принадлежит к классу обратных некорректных задач с пуассоновскими данными, решение которых должно быть основано на методе статистической регуляризации. Метод статистической регуляризации Maximum a Posteriori (MAP) активно развивается, но существуют нерешенные проблемы, которые сдерживают применение MAP алгоритмов на коммерческих ОФЭКТ и ПЭТ системах. Решение OSEM не является регуляризированным. Фактически при клинических применениях алгоритма OSEM осуществляется грубая регуляризация за счет прерывания итерационного процесса на итерации с наиболее «подходящим» изображением. В ядерной кардиологии область выделенного интереса – сердце – заранее известна, поэтому номер итерации останова определяется производителем оборудования с помощью исследований на вещественных антропоморфных фантомах и волонтерах. Этот номер останова (в зависимости от условий сбора данных и параметров алгоритма) рекомендуется в протоколе обследований. В случае онкологических поражений положение и размер опухоли могут быть абсолютно разными, поэтому в общем случае трудно определить подходящий номер останова итерационного процесса. Дополнительную трудность создают краевые артефакты, известные в литературе как артефакты Гиббса, искажающие оценку «опухоль/фон». Как отмечено выше, при сглаживании изображения оценка «опухоль/фон» становится заниженной. При реконструкции без сглаживания возникает
Список литературы Возможности компьютерного моделирования опухолевого поражения легких при сравнении с данными ОФЭКТ/КТ с 99mТс-миби
- AminM.B., Greene F.L., EdgeS.B., ComptonC.C., GershenwaldJ.E., Brookland R.K., Meyer L., Gress D.M., Byrd D.R., Winchester D.P. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more "personalized" approach to cancer staging. CA Cancer J Clin. 2017; 67(2): 93-9. doi: 10.3322/caac.21388.
- Трухачева Н.Г., Фролова И.Г., Коломиец Л.А., Усова А.В., Григорьев Е.Г., Величко С.А., Чуруксаева О.Н. Новые возможности лучевой визуализации в диагностике местнораспространенного рака шейки матки. Сибирский онкологический журнал. 2019; 18(2): 83-91. [Trukhacheva N.G., Frolova I.G., Kolomiets L.A., Usova A.V., Grigorev E.G., Velichko S.A., Churuksaeva O.N. Novel approaches to diagnostic imaging of locally advanced cervical cancer. Siberian Journal of Oncology. 2019; 18(2): 83-91. (in Russian)]. doi: 10.21294/1814-4861 -2019-18-2-83-91.
- Канаев С.В., Нажмудинов Р.А., Новиков С.Н., Левченко Е.В., БейнусовД.С. Диагностическая ценность однофотонной эмиссионной компьютерной томографии - рентгеновской компьютерной томографии (ОФЭКТ-КТ) в оценке опухолевого поражения регионарных лимфоузлов у больных немелкоклеточным раком легкого. Человек и его здоровье. 2015; (2): 29-34. [Kanaev S.V., Nazhmudinov R.A., Novikov S.N., Levchenko E.V., Beynusov D.S. The diagnostic ability of single-photon emission computed tomography - computed tomography (SPECT-CT) in evaluation of tumor involvement of regional lymph nodes in patients with NSCLC. Man and His Health. 2015; (2): 29-34. (in Russian)].
- КундинВ.Ю., СатырМИ., НеверкоИ.В. Совмещенная технология ОФЭКТ/КТ в диагностике, стадировании и дифференциальной диагностике злокачественных и доброкачественных поражений легкого. Клиническая онкология. 2013; 9(1): 152-156. [Kundin V.Yu., SatyrM.I., NeverkoI.V. Combined SPECT/CT technology in the diagnosis, staging and differential diagnosis of malignant and benign lung lesions. Clinical Oncology. 2013; 9(1): 152-156. (in Russian)].
- Nikoletic K., Mihailovic J., Srbovan D., Kolarov V, Zeravica R. Lung tumors: early and delayed ratio of 99mTc-methoxy-2-isobutyli-sonitrile accumulation. Vojnosanit Pregl. 2014; 71(5): 438-45.
- NosottiM., SantambrogioL., GaspariniM., Baisi A., BellavitiN., Rosso L. Role of (99m)tc-hexakis-2-methoxy-isobutylisonitrile in the diagnosis and staging of lung cancer. Chest. 2002; 122(4): 1361-4. doi: 10.1378/chest.122.4.1361.
- Santini M., Fiorelli A., Vicidomini G., Laperuta P., Busiello L., Rambaldi P.F., Mansi L., Rotondo A. F-18-2-fluoro-2-deoxyglucose positron emission tomography compared to technetium-99m hexakis-2-methoxyisobutyl isonitrile single photon emission chest tomography in the diagnosis of indeterminate lung lesions. Respiration. 2010; 80(6): 524-33. doi: 10.1159/000321373.
- Zhang S., Liu Y. Diagnostic Performances of 99mTc-Methoxy Isobutyl Isonitrile Scan in Predicting the Malignancy of Lung Lesions: A Meta-Analysis. Medicine (Baltimore). 2016; 95(18): 3571. doi: 10.1097/ MD.0000000000003571.
- Abadi E., Segars W.P., Tsui B.M.W., Kinahan P.E., Bottenus N., FrangiA.F., Maidment A., Lo J., SameiE. Virtual clinical trials in medical imaging: a review. J Med Imaging (Bellingham). 2020; 7(4). doi: 10.1117/1. JMI.7.4.042805.
- Denisova N.V., Ansheles A.A. A study of false apical defects in myocardial perfusion imaging with SPECT/CT. Biomed. Phys. Eng. Express. 2018; 4(6). doi: 10.1088/2057-1976/aae414.
- Denisova N., Ondar M., Kertesz H., Beyer T. Development of anthropomorphic mathematical phantoms for simulations of clinical cases in diagnostic nuclear medicine. Computer Methods in Biomechanics and Biomedical Engineering: Imaging & Visualization. 2022; 1-9. doi: 10.1080/21681163.2022.2074308.
- 12.Денисова Н.В. Вычислительные фантомы для медицинской радиологии. Медицинская радиология и радиационная безопасность. 2022; 67(6): 51-61. [DenisovaN.V. Computational Phantoms for Medical Radiology. Medical Radiology and Radiation Safety. 2022; 67(6): 51-61. (in Russian)]. doi: 10.33266/1024-6177-2022-67-6-51-61.
- Fedorov A., Beichel R., Kalpathy-Cramer J., Finet J., Fillion-Robin J.C., Pujol S., Bauer C., Jennings D., Fennessy F., Sonka M., Buatti J., AylwardS., Miller J.V., Pieper S., KikinisR. 3D Slicer as an image computing platform for the Quantitative Imaging Network. Magn Reson Imaging. 2012; 30(9): 1323-41. doi: 10.1016/j.mri.2012.05.001.
- Berger M.J., Hubbell J.H., Seltzer S.M., Chang J., Coursey J.S., Sukumar R., Zucker D.S., Olsen K. XCOM-Photon Cross Sections Database, NIST Standard Reference Database 8. National Institute of Standards and Technology. 1987. doi: 10.18434/T48G6X.
- ГуркоМ.А., Денисова Н.В. Моделирование сбора «сырых» проекционных данных в однофотонной эмиссионной компьютерной томографии. Журнал технической физики. 2022; 92(5): 747. [Gurko M.A., Denisova N.V. The Modelling of the acquiring of "raw" projection data in single-photon emission computed tomography. Journal of Applied Physics. 2022; 92(5): 747. (in Russian)]. doi: 10.21883/JTF.2022.05.52381.264-21.
- Shepp L.A., Vardi Y. Maximum likelihood reconstruction for emission tomography. IEEE Trans Med Imaging. 1982; 1(2): 113-22. doi: 10.1109/TMI.1982.4307558.
- Нестерова А.В., Денисова Н.В. «Подводные камни» на пути количественной оценки тяжести онкологических поражений в диагностической ядерной медицине. Журнал технической физики. 2022; 92(7): 1018. [Nesterova A.V., Denisova N.V. «Pitfalls» in the path of quantitative assessment of the severity of oncological lesions in diagnostic nuclear medicine. Journal of Applied Physics. 2022; 92(7): 1018. (in Russian)]. doi: 10.21883/JTF.2022.07.52659.331-21.
- Nuyts J. Unconstrained image reconstruction with resolution modelling does not have a unique solution. EJNMMI Physics. 2014; 1: 98. doi: 10.1186/s40658-014-0098-4.


