Возможности комплексного ультразвукового исследования в дооперационном стадировании диссеминированного рака яичников
Автор: Вяткина Нина Вадимовна, Фролова Ирина Георгиевна, Коломиец Лариса Александровна, Молчанов Сергей Валерьевич, Виллерт Алиса Борисовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (76), 2016 года.
Бесплатный доступ
Проведена сравнительная оценка эффективности разработанной оптимизированной методики УЗИ с применением дополнительных приёмов (с переменой положения тела пациентки, с форсированным типом дыхания и сканированием брюшной полости линейным датчиком высоких частот) в оценке дооперационного стадирования у 47 больных с первичным диагнозом эпителиального рака яичников. Показано, что оптимизированная методика УЗИ, особенно при минимальном количестве асцитической жидкости, позволяет с чувствительностью метода 87 % повысить эффективность дооперационного стадирования рака яичников.
Узи, диссеминированный рак яичников, дооперационное стадирование
Короткий адрес: https://sciup.org/140253946
IDR: 140253946 | УДК: 618.11-006.6-089.163-073.48 | DOI: 10.21294/1814-4861-2016-15-4-26-32
Текст научной статьи Возможности комплексного ультразвукового исследования в дооперационном стадировании диссеминированного рака яичников
Рак яичников является одной из наиболее часто встречающихся формой злокачественных новообразований у женщин и остаётся ведущей причиной смертности у онкологических больных [1–5]. Высокая смертность объясняется агрессивными биологическими свойствами злокачественных опухолей яичников, их способностью к частому рецидивированию, быстрому и обширному метастазированию. Наиболее часто (66–88 %) опухоль выявляется в III–IV стадиях, когда она метастазирует, инфильтрирует смежные органы и характеризуется чрезвычайно злокачественным течением с плохим прогнозом [2, 6–8].
Эффективность лечения в значительной степени зависит от качества диагностики. Правильное ста-дирование на первом этапе обследования больных раком яичников и полноценное представление о характере распространения опухоли являются важной информацией для выбора адекватной тактики лечения [9, 10]. Прогрессирование рака яичников происходит преимущественно за счёт диссеми-нации по брюшине. Этим объясняется малосим-птомное течение заболевания на ранних стадиях, вследствие чего у значительного большинства пациенток болезнь диагностируется на поздних стадиях. Знание путей возможного распространения опухоли является ключевым моментом в интерпретации данных диагностических методов визуализации (УЗИ, МРТ, КТ), а также необходимо для установления стадии процесса [11–13].
Одно из ведущих мест среди методов диагностики опухолей органов малого таза занимает ультразвуковое исследование. Благодаря высокой информативности, доступности, безвредности, возможности многократного проведения и объективного документирования данный метод позволяет на дооперационном этапе проводить первичную диагностику опухоли яичников, оценивать распространение опухоли за пределы малого таза, когда определяются метастатическое поражение большого сальника, висцеральной и париетальной брюшины, метастазы по капсуле печени и селезёнки, при наличии которых изменяются и стадия процесса и лечебная тактика [10, 11, 14, 15].
Однако существуют условия, ограничивающие возможности ультразвукового метода диагностики при визуализации метастатических изменений париетальной и висцеральной брюшины, большого сальника, брыжейки тонкой кишки. К ним относятся: выраженный подкожно-жировой слой, вздутие кишечника, спаечный процесс, массивный конгломерат опухоли в брюшной полости, отсутствие акустического окна в виде анэхогенной свободной жидкости, наличие которой облегчает
дифференцировку органов и тканей при их метастатическом поражении. Особые трудности связаны с выявлением канцероматоза брюшины и большого сальника в виде мелких просовидных высыпаний до 5 мм, особенно при небольшом количестве асцита или его отсутствии [15, 16].
Чаще всего рак яичников на поздних стадиях (III–IV стадии) сопровождается асцитом. При УЗИ наличие свободной жидкости является вспомогательным фактором для выявления метастазов в брюшной полости, так как создаётся анэхогенное акустическое окно, на фоне которого отчётливо дифференцируются метастатические очаги, схожие по эхогенности с окружающими органами и тканями. В тех случаях, когда асцит представлен минимальным количеством свободной жидкости, эхографическая визуализация канцероматоза брюшины и большого сальника затрудняется из-за схожей эхогенности метастатических изменений и окружающих тканей [7]. Вследствие чего для повышения информативности ультразвукового метода исследования в дооперационном стадировании диссеминированного рака яичников целесообразно применение оптимизированной методики УЗИ с использованием дополнительных приёмов.
Цель исследования – оптимизация методики дооперационного ультразвукового стадирования у больных диссеминированным раком яичников при минимальном количестве асцитической жидкости.
Материал и методы
Проведено исследование 47 пациенток с первичным диагнозом эпителиального рака яичников (T3N0 _ 1M 0 —1), у 16 больных асцит был слабо выражен. Морфологически у всех больных была выявлена аденокарцинома различной степени дифференцировки. Возраст больных колебался в пределах от 29 до 66 лет, средний возраст составил 58 ± 3,8 года. Всем больным проведено ультразвуковое исследование органов малого таза и брюшной полости на аппарате Сонник-Мед 90, в режиме серошкального сканирования (В-режим), цветового допплеровского картирования (ЦДК), энергетического картирования (ЭК).
На первом этапе проводилось ультразвуковое исследование органов малого таза с использованием трансабдоминального и трансвагинального доступа. При выявлении опухоли яичников оценивали размеры, форму, структуру, контуры, взаимоотношение с окружающими органами и тканями, васкуляризацию (характер кровотока), состояние параметральной клетчатки, позадиматочного пространства (наличие или отсутствие жидкости и объемных образований по висцеральной и париетальной брюшине).
На втором этапе для оценки распространённости процесса трансабдоминальная сонография конвексным датчиком 3,5–5 МГц проводилась по стандартной методике в положении пациента лёжа на спине. Затем всем больным проводилось ультразвуковое сканирование по разработанной нами оптимизированной методике. Оптимизация методики достигалась применением следующих дополнительных приёмов:
-
1. Осмотр конвексным датчиком в положении пациентки лёжа на боку, сидя, стоя, что позволило дифференцировать метастатические очаги или утолщение париетальной брюшины и/или большого сальника за счёт оттока асцитической жидкости в нижние, боковые отделы брюшной полости и к передней брюшной стенке. Использование данного приёма способствовало визуализации области между париетальной брюшиной и большим сальником.
-
2. Приём с форсированным брюшным типом дыхания в положении пациентки лёжа и стоя, что давало возможность определить локализацию метастатических очагов в париетальной брюшине и/или в большом сальнике, выявить спаечный процесс большого сальника с париетальной брюшиной. При этом, если объёмное образование расположено под передней брюшной стенкой и при дыхательных движениях движется вместе с ней в направлении вверх-вниз и смещается относительно ниже прилежащих структур (большого сальника и/или петель тонкой кишки), то оно локализуется в париетальной брюшине. При метастатическом поражении большого сальника с применением этого же приёма, при отсутствии спаечного процесса, сальник движется параллельно передней брюшной стенке и при надавливании датчиком смещается относительно неё. При наличии спаечного процесса между большим сальником и передней брюшной стенкой при форсированном типе дыхания и надавливании датчиком сальник не смещается относительно передней брюшной стенки, а движется вместе с ней синхронно дыхательным движениям.
-
3. Во всех случаях, когда не удаётся дифференцировать локализацию очага в париетальной брюшине или в большом сальнике конвексным датчиком, применялось дополнительное сканирование линейным датчиком высоких частот (7,5–11 МГц), также в положении пациентки лежа на спине, стоя, в покое и совместно с приёмом при форсированном брюшном типе дыхания, что позволяет более чётко визуализировать структуру метастатических очагов, особенно малых размеров, схожих по эхогенности с окружающими тканями.
Для выявления диссеминации по диафрагмальной поверхности брюшины, капсуле и субкапсулярной зоне паренхимы печени, капсуле селезёнки проводилось сканирование линейным датчиком высокой частоты в проекции верхнего этажа брюшной полости на вдохе с задержкой дыхания и в покое. Сканирование брюшной полости конвексным и линейным датчиком проводилось последовательно от передней подмышечной линии одной стороны тела на противоположную, сверху вниз от рёберных дуг до паховых складок, при этом особое внимание уделялось оценке состояния тканей на уровне париетальной брюшины, большого сальника, брыжейки тонкой кишки. Затем проводилось сканирование в области верхнего этажа брюшной полости в проекции печени и селезёнки, эпигастрия и в произвольных разнонаправленных проекциях сканирования в зависимости от выявленных изменений.
Всем пациенткам с целью хирургического ста-дирования проводилась лапароскопия с помощью лапароскопической стойки Karl Storz с последующим морфологическим исследованием биоптатов. Статистическая обработка полученных данных проводилась с помощью компьютерных программ Microsoft Exel и «Statistica 6.0».
Результаты и обсуждение
При анализе эхографической картины первичная злокачественная опухоль яичников определялась в пределах органа у 4 (8,5 %) пациенток с эхо-признаками диффузных изменений структуры, у 43 (91,5 %) пациенток опухоль выходила за пределы органа, имела преимущественно кистозносолидное строение, с признаками патологического кровотока, размерами от 40 до 187 мм (табл. 1).
Оценка распространённости первичной опухоли яичников проводилась как по стандартной методике УЗИ, так и по оптимизированной, включающей дополнительные приёмы, с последующим сопоставлением с данными диагностической лапароскопии (табл. 2). Сравнительный анализ оценки распространённости РЯ с использованием стандартной методики УЗИ и оптимизированной методики в сопоставлении с результатами лапароскопии показал повышение эффективности выявления метастазов в брюшной полости при использовании дополнительных приёмов УЗИ как при выраженном, так и при минимальном асците. Применение оптимизированной методики УЗИ даже при выраженном асците позволило повысить выявляемость метастатических изменений большого сальника с 47 до 62 %, метастазов по париетальной брюшине с 51 до 64 %.
Сканирование брюшной полости конвексным датчиком в условиях минимального количества свободной жидкости с использованием дополнительного приёма с изменением положения тела пациентки из горизонтального в вертикальное позволило повысить выявляемость метастатического поражения большого сальника с 6 до 12 % (рис. 1). Осмотр брюшной полости высокочастотным линейным датчиком совместно с форсированным брюшным типом дыхания способствовал увеличению эффективности метода с 13 до 17 % в определении метастазов по париетальной брюшине в виде неравномерного утолщения и очагов размером до 10–15 мм. Сканирование высокочастотным линейным датчиком на вдохе с задержкой дыхания в области верхнего этажа брюшной полости в условиях отсутствия свободной жидкости в данной области позволило дополнительно в 1 случае визуализировать метастазы по капсуле печени в виде единичных гиперэхогенных округлых образований до 6 мм (рис. 2).
В то же время не было отмечено различий между стандартной и оптимизированной методикой УЗИ в визуализации метастазов в брыжейку тонкой кишки при выраженном подкожно-жировом слое и вздутии петель толстой кишки, при массивном конгломерате первичной опухоли и наличии спаечного процесса вследствие снижения проникающей способности ультразвука. Лишь в 1 случае у пациентки с невыраженным подкожно-жировым слоем
Эхо-семиотика первичной опухоли яичников (n = 47)
таблица 1
результаты оценки распространённости ря по данным стандартного УЗИ, оптимизированной методики УЗИ и лапароскопии
|
Локализация метастатических изменений |
Стандартная методика УЗИ |
Оптимизированная методика УЗИ |
Результаты лапароскопии |
||||
|
Асцит |
При минимальном асците |
Всего |
Асцит |
При минимальном асците |
Всего |
||
|
Метастазы в большом |
22 |
3 |
25 |
29 |
6 |
35 (74,4 %) |
42 |
|
сальнике |
(47 %) |
(6 %) |
(53 %) |
(62 %) |
(12,7 %) |
(89 %) |
|
|
Метастазы по парие- |
24 |
6 |
30 |
30 |
8 |
38 (81 %) |
44 |
|
тальной брюшине |
(51 %) |
(13 %) |
(64 %) |
(64 %) |
(17 %) |
(93,5 %) |
|
|
Метастазы в брыжейке |
3 |
3 |
4 |
4 |
7 |
||
|
тонкой кишки |
(6,4 %) |
(6,4 %) |
(8,5 %) |
(8,5 %) |
(15 %) |
||
|
Метастазы по капсуле |
3 |
1 |
4 |
3 |
2 |
5 |
7 |
|
печени |
(6,4 %) |
(2,1 %) |
(8,5 %) |
(6,4 %) |
(4,2 %) |
(10,6 %) |
(14,8 %) |
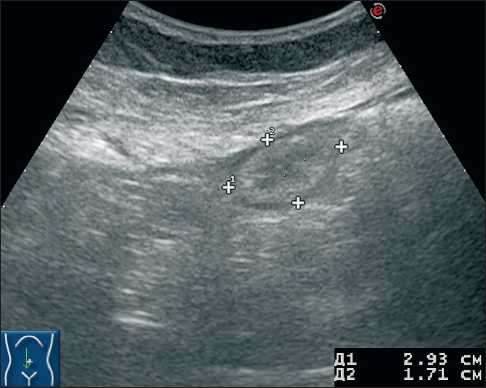
Рис. 1. Сонограммы пациентки С., 56 лет. а) УЗИ брюшной полости по стандартной методике (положение пациентки лёжа), сагиттальная плоскость сканирования. В условиях отсутствия свободной жидкости определяется изоэхогенное образование овальной формы без признаков перистальтики. При форсированном брюшном типе дыхания отмечается её подвижность;
б) УЗИ брюшной полости с применением дополнительного приёма (сканирование конвексным датчиком в положении пациентки стоя), сагиттальная плоскость сканирования. За счёт оттока небольшого количества свободной жидкости к передней брюшной стенке чётко дифференцируется утолщенный большой сальник с бугристыми контурами (эхо-признаки метастатического поражения)
Б
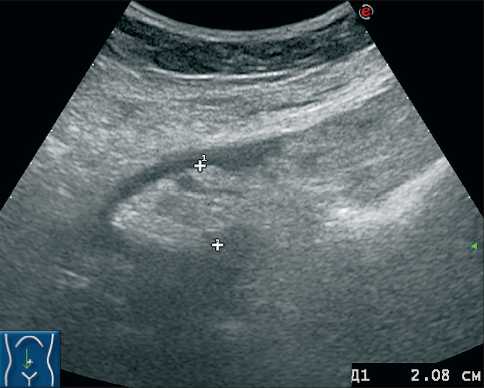
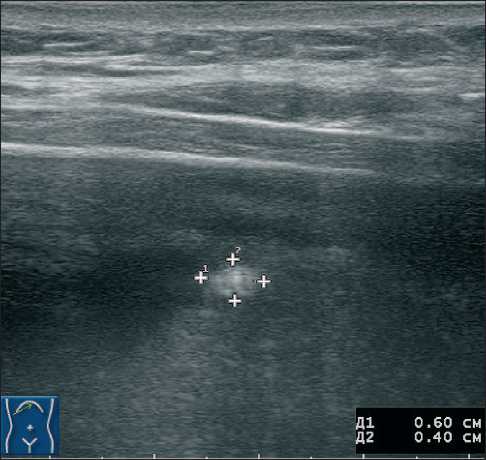
Рис. 2. Сонограмма пациентки У., 58 лет. В условиях минимального количества асцитической жидкости только линейным высокочастотным датчиком удалось визуализировать гиперэхогенный округлый очаг (метастаз) по капсуле печени размерами 6×4 мм при минимальном количестве свободной жидкости использование приёма с форсированным типом дыхания позволило диагностировать метастазы в брыжейку размером до 20 мм.
Сопоставление с данными лапароскопии показало, что визуализируемые с применением оптимизированной методики УЗИ метастатические изменения большого сальника, париетальной брюшины и брыжейки тонкой кишки были подтверждены во всех случаях. В то же время ложноотрицательные результаты – 16 (17 %) случаев – были обусловлены трудностями визуализации метастатических изменений в виде мелких изоэхогенных просовидных высыпаний по поверхности большого сальника и париетальной брюшины у больных с выраженным подкожно-жировым слоем, отсутствием свободной жидкости в брюшной полости, массивным конгломератом первичной опухоли, спаянной с петлями тонкой кишки и с сальником. Лучшая визуализация метастатических изменений париетальной брюшины достигалась с помощью линейного датчика высоких частот.
У 3 (6,4 %) пациенток данные о метастатическом поражении брюшины и сальника, полученные по результатам УЗИ, были более информативны, чем при лапароскопии. Это было обусловлено тем, что при лапароскопии спаечный процесс и большой объём первичной опухоли не позволили оценить состояние брюшины задних отделов малого таза. Метастазы по капсуле печени при лапароскопии подтвердились в 5 (10,6 %) случаях, в 2 (4,3 %) случаях были ложноотрицательные эхографические заключения, обусловленные мелкими размерами образований, их высоким поддиафрагмальным расположением, выраженным подкожно-жировым слоем и отсутствием в околопечёночной области свободной жидкости. Чувствительность стандартного УЗИ в выявлении эхо-признаков метастатического поражения брюшной полости составила 61 %, а чувствительность УЗИ с применением дополнительных приёмов – 81 %.
Данные ультразвукового дооперационного стади-рования по стандартной методике и с использованием оптимизированной методики были сопоставлены с результатами хирургического стадирования. Стадирование РЯ проводилось по системе FIGO. По стандартной методике УЗИ правильно классифицированы 33 (70,2 %) пациентки (табл. 3). В 1 (2,1 %) случае выставлена Ic стадия, когда опухоль визуализировалась в пределах яичников с наличием умеренного асцита, но при лапароскопии в данном случае была выставлена IIIb стадия за счёт выявленного локального метастатического поражения париетальной брюшины по правому флангу брюшной полости, размерами до 15 мм, и множественных мелких просовидных метастатических высыпаний до 3–4 мм. Ложноотрицательный результат был обусловлен отсутствием свободной жидкости в данной области, выраженным подкожно-жировым слоем и изоэхогенностью метастазов. Из 9 (19,1 %)
больных, у которых дооперационно была выставлена IIb стадия, после хирургического стадирования в 2 (4,3 %) случаях стадия была подтверждена, у 6 (12,8 %) больных выставлена IIIb стадия, у 1 (2,1 %) больной – IIIc стадия. Это связано с невыявленными достаточно крупными метастазами до 20–30 мм в большом сальнике, париетальной брюшине и брыжейке тонкой кишки при использовании только кон-вексного датчика в положении лёжа. У 12 (25,5 %) IIIb стадия при УЗИ классифицирована верно, у 6 (12,8 %) – при хирургическом стадировании выставлена IIIc. Следует отметить полное совпадение дооперационного и хирургического стадирования у 19 (40,4 %) пациенток с IIIс стадией, когда были выявлены метастазы в брюшной полости размерами более 20 мм.
При сопоставлении результатов оптимизированной методики УЗИ и данных хирургического стадирования правильное предоперационное определение стадии процесса у больных РЯ было у 41 (87,3 %) больной (табл. 4). У 4 (8,6 %) пациенток на основании оптимизированной методики УЗИ была выставлена IIb стадия, из них по данным хирургического стадирования правильное определение стадии подтвердилось у 2 (4,3 %) больных. В 2 (4,3 %) случаях была выставлена IIIb стадия (ложноотрицательные результаты), что было обусловлено ограничением метода в визуализации мелких изоэхогенных просовидных метастатических очагов по париетальной брюшине и большому сальнику, особенно при минимальном количестве асцита. Правильно была определена IIIb стадия при УЗИ у 17 (36,2 %) пациенток, ложноотрицательные результаты составили 4 (8,5 %) случая и были обусловлены у 3 больных значительно выраженным подкожно-жировым слоем и вздутием петель кишки при наличии небольшого количества свободной жидкости, что затруднило визуализацию метастазов в брыжейку тонкой кишки. У 1 пациентки определялся большой конгломерат первичной опухоли, выходящий из полости малого таза верхним полюсом, с выраженным спаечным процессом с вовлечением большого сальника и петель кишки, что затруднило визуализацию очагов по брюшине, размерами более 20 мм в нижних отделах брюшной полости. Полное совпадение результатов стадирования РЯ с использованием оптимизированной методики УЗИ в сопоставлении с данными хирургического стадирования было у всех 22 (46,8 %) пациенток с IIIc стадией. Использование дополнительных приёмов УЗИ позволило повысить выявляемость больных с диссеминированным РЯ (IIIb, IIIc стадии) – на 17 %.
Заключение
Ультразвуковая диагностика метастатического поражения брюшины у больных диссеминированным РЯ при небольшом количестве асцита представляет большие сложности. Оптимизированная методика УЗИ органов малого таза и брюшной по- таблица 3
сопоставление результатов дооперационного (стандартная методика УЗИ) и хирургического стадирования
|
Стадия РЯ по результатам стандартной |
Стадия РЯ по результатам хирургического стадирования (лапароскопии) |
||
|
методики УЗИ |
IIb |
IIIb |
IIIc |
Список литературы Возможности комплексного ультразвукового исследования в дооперационном стадировании диссеминированного рака яичников
- Аксель Е.М. Статистика злокачественных новообразований яичников: современный подход к лекарственной терапии (обзор женской половой сферы. Онкогинекология. 2012; 1: 18-23.
- Антонеева И.И., Генинг Т.П., Абакумова Т.В., Арсланова Д.Р., 11. Молчанов С.В., Коломиец Л.А., Фролова И.Г., Вяткина Н.В., Генинг С.О. Алгоритм диагностики прогрессирующих форм рака яичников. Медицинский альманах. 2012; 4: 29-31.
- Жорданиа К.И., Хохлова С.В. Ранний рак яичников. Наш взгляд на проблему. Онкогинекология. 2012; 1: 51-58.
- Новикова Е.Г. Новые возможности лечения сарком и рака некоторые особенности эволюции, распространения и диагностики. яичников. www Medlinks.ru. Раздел онкология и гематология. 2011.
- Jemal A., Siegel R., Xu J., Ward E. Cancerstatistic,2010. CACancer J. Clin. 2010; 60 (5): 277-300 DOI: 10.3322/caac.20073
- Ашрафян Л.А., Антонова И.Б., Ивашина С.В., Люстик А.В., Ульянова А.В., Вашакмадзе С.Л. Ранняя диагностика рака эндометрия Практическая онкология. 2009; Т. 10, № 2: 71-75
- Синицина М.Е., Чекалова М.А., Брюзгин В.В., Махова Е.Е. Место эхографии в уточнении подходов к лечению рака яичников. Опухоли 22-28. женской репродуктивной системы. 2008; 4: 72-76.
- Takur A., Mishra V., Jain S.K. Feed Forward Artificial Neural Network: Tool for Early Detection of Ovarian Cancer. Sci Pharm. 2011; (3): 493-505 DOI: 10.3797/scipharm.1105-11.16
- Виллерт А.Б., Коломиец Л.А., Родичева Н.С., Иванова А.А., Чердынцева Н.В., Стуканов С.Л. Особенности рака яичников у больных с мутацией BRCA1 5382insC. Сибирский онкологический журнал. 2014; 6: 19-26.
- Молчанов С.В., Коломиец Л.А. Диссеминированный рак яичников: современный подход к лекарственной терапии (обзор литературы). Сибирский онкологический журнал. 2015; 6: 68-75.
- Молчанов С.В., Коломиец Л.А., Фролова И.Г., Вяткина Н.В., Бакланова Н.С. Перитонеальный канцероматоз при раке яичников: эхосемиотика, классификация. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2014. Т. 25, № 1-2: 14-21.
- Прокопенко П.Г., Терентьев А.А. Опухоли яичников: некоторые особенности эволюции, распространения и диагностики. Вопросы онкологии. 2009; 55 (2): 143-150.
- Чекалова М.А., Поддубная И.В., Мазырко М.А., Синицина М.Е. Место УЗТ при планировании лечения злокачественных эпителиальных опухолей яичников. Современная онкология. 2007; Т. 9, № 1: 66-70.
- Востров А.Н., Степанов С.О., Корнеева И.А. История и современные тенденции применения ультразвукового исследования при раке яичников//Лучевая диагностика и терапия. 2013; 3 (4): 22-28.
- Степанов С.О., Митина Л.А., Гуц О.В., Беспалов П.Д. Визуализация перитонеальной диссеминации при ультразвуковом исследовании. Лучевая диагностика и терапия. 2013; 3 (4): 66-70.
- Болдогоева И.М., Берзин С.А. Современные возможности диагностики рака яичников в онкологическом диспансере/Под ред. С.М. Демидова. Екатеринбург; 2007: 34-52.
- Молчанов С.В., Коломиец Л.А., Фролова И.Г., Вяткина Н.В., Бакланова Н.С. Перитонеальный канцероматоз при раке яичников: эхосемиотика, классификация. Вестник РОНЦ им. Н.Н. Блохина РАМН. 2014. Т. 25, № 1-2: 14-21.
- Прокопенко П.Г., Терентьев А.А. Опухоли яичников: некоторые особенности эволюции, распространения и диагностики. Вопросы онкологии. 2009; 55 (2): 143-150.
- Чекалова М.А., Поддубная И.В., Мазырко М.А., Синицина М.Е. Место УЗТ при планировании лечения злокачественных эпителиальных опухолей яичников. Современная онкология. 2007; Т. 9, № 1: 66-70.
- Востров А.Н., Степанов С.О., Корнеева И.А. История и современные тенденции применения ультразвукового исследования при раке яичников//Лучевая диагностика и терапия. 2013; 3 (4): 22-28.
- Степанов С.О., Митина Л.А., Гуц О.В., Беспалов П.Д. Визуализация перитонеальной диссеминации при ультразвуковом исследовании. Лучевая диагностика и терапия. 2013; 3 (4): 66-70.
- Болдогоева И.М., Берзин С.А. Современные возможности диагностики рака яичников в онкологическом диспансере/Под ред. С.М. Демидова. Екатеринбург; 2007: 34-52.


