Возможности комплексной терапии ревматоидного артрита
Автор: Марусенко Ирина Михайловна, Везикова Наталья Николаевна, Максимов Максим Владимирович, Корякова Нина Витальевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 9 (103), 2009 года.
Бесплатный доступ
Ревматоидный артрит, болезнь-модифицирующая терапия, пульс-терапия, метотрексат, тромбовар, локальная терапия, телегамматерапия, синовит
Короткий адрес: https://sciup.org/14749641
IDR: 14749641
Текст статьи Возможности комплексной терапии ревматоидного артрита
В настоящее время ревматологи всего мира озабочены ситуацией, связанной с поздней диагностикой ревматоидного артрита. Проблема раннего РА заключается в решении вопроса: как приблизить диагноз и начало болезнь-модифицирующей терапии к больному [10], [11], [17].
Распространенность РА составляет в популяции около 1 %, то есть в мире от него страдает примерно 63 миллиона человек. Экономические потери от РА для общества сопоставимы с ИБС. Около 50 % больных становятся инвалидами в первые 5 лет заболевания [25]. В России средний возраст пациентов, выходящих на инвалидность, – 48 лет, а более 25 % нуждаются в дорогостоящем лечении. Выживаемость неадекватно леченных пациентов с РА оказалась сопоставимой с такими заболеваниями, как лимфогранулематоз, сахарный диабет, инсульт и трехсосудистое поражение коронарных артерий при ИБС [15]. РА снижает продолжительность жизни больных в среднем на 10 лет.
Современной ревматологией накоплено достаточное количество данных о том, что при РА иммунопатологический процесс развивается до появления клинических признаков артрита [1], [16]. Первые годы болезни являются решающими в развитии и прогрессировании патологического процесса. В самый ранний период РА, когда процесс находится в первичной экссудативной фазе, обратимость заболевания существенно выше. Уже через 2–4 месяца от начала заболевания при биопсии синовиальной оболочки можно обнаружить морфологические признаки хронического синовита. У 75 % больных РА в раннем периоде выявляются эрозии [16], [17].
Вся стратегия современного лечения РА направлена на наиболее раннее начало терапии, так как даже самая активная противовоспалительная терапия позволит затормозить прогрессирование болезни только в случае ее своевременного назначения. Иногда этот временной промежуток ограничивается несколькими меся-
цами [11], [18], [21], [23]. По данным исследований известно, что назначение в первые недели болезни даже самых «мягких» базисных средств оказывает благоприятное влияние на дальнейшее течение РА. И чем позже начата базисная терапия, тем хуже будет ответ на нее. Таким образом, целью ранней базисной терапии является не только подавление активности РА, но и предупреждение необратимых повреждений суставов, а значит, сохранение функциональной активности больного.
В практической деятельности ревматолог нередко сталкивается с проблемой: начинать ли базисную терапию, если диагноз РА еще сомнителен. Чаще всего это связано с дебютом РА в виде моно- или олигоартрита, отсутствием ревматоидного фактора, так как часть больных становятся серопозитивными в течение первых полугода болезни, или отсутствием типичных рентгенологических изменений в раннем периоде заболевания. В подобной ситуации врач, не имея полного набора диагностических критериев РА, не рискует назначать активную терапию, предпочитает обойтись нестероидными противовоспалительными препаратами (НПВП) и наблюдением за больным, – таким образом упускается время.
Для оптимизации диагностики и выбора тактики ведения пациента предложена концепция «раннего ревматоидного артрита». Ранний ревматоидный артрит – это условно выделенная клинико-патогенетическая стадия болезни, которая характеризуется антигенспецифической активацией CD4+ Т-лимфоцитов, гиперпродукцией провоспалительных цитокинов, пролиферацией сосудистой стенки капилляров с последующей пролиферацией синовиальных клеток и отложением фибрина на синовиальной оболочке и наличием активного синовита не более 1 года [10], [17].
В клинической практике диагноз РА устанавливается согласно диагностическим критериям АСR 1987 года: утренняя скованность, артрит трех или более суставных зон, артрит суставов кистей, симметричный артрит, ревматоидные узелки, ревматоидный фактор в сыворотке, рентгенологические изменения. К сожалению, классические критерии не всегда позволяют установить диагноз раннего РА, так как они не работают при моно- и олигоартрите, не часто в дебюте болезни встречаются ревматоидные узелки. Стандартная рентгенография характеризуется не очень высокой чувствительностью, что приводит к позднему выявлению эрозий, а ревматоидный фактор не является идеальным методом ранней диагностики, поскольку в дебюте болезни многие пациенты серонегативны. Появившиеся новые методы диагностики, такие как магнитнорезонансная томография (МРТ) и ультразвуковое исследование (УЗИ) суставов, не решили проблемы, поскольку они высокочувствительны, но не обладают специфичностью.
Поэтому сегодня выделяют признаки, вызывающие подозрение на ранний ревматоидный артрит: наличие более трех воспаленных суставов, поражение пястно-фаланговых / плюсне-фаланго-вых суставов – положительный тест «сжатия», продолжительность утренней скованности более 30 мин, увеличение СОЭ до 25 мм/ч. При наличии этих признаков пациента необходимо направить на консультацию к ревматологу [10], [17].
Нами изучены 84 пациента, которым в ревматологическом отделении впервые установлен диагноз «ревматоидный артрит», из них мужчин – 22, женщин – 62, средний возраст – 47 лет. От момента дебюта суставного синдрома до верификации диагноза прошло от 1 до 26 месяцев, в среднем – 6,3 месяца. На момент обращения за медицинской помощью у исследуемых больных диагностические критерии РА были представлены следующим образом:
-
• симметричный артрит – у 71 (84,5 %);
-
• рентгенологические изменения – у 57 (68 %);
-
• ревматоидный фактор в сыворотке – у 50 (59,5 %);
-
• артрит суставов кистей – у 48 (57 %);
-
• утренняя скованность – у 47 (56 %);
-
• артрит трех или более суставных зон – у 37 (44 %);
-
• ревматоидные узелки – у 2 (2 %).
При этом только у 2 больных на момент диагностики РА были представлены все 7 критериев, у 3 отмечались 6 критериев, у 16 – 5 критериев и у 27 – 4 критерия. Суставной синдром дебютировал типичным артритом кистей у 42 пациентов, тогда как дебют в виде олигоартрита отмечен у 30 пациентов, в виде моноартрита – у 13.
В связи с различными вариантами начала заболевания, недостаточным количеством диагностических критериев потребовалось проведение дифференциального диагноза с реактивным артритом – у 16 больных, остеоартрозом – у 11, системной красной волчанкой – у 2, системной склеродермией – у 2.
Вся стратегия современного лечения РА направлена на наиболее раннее начало болезнь-модифицирующей терапии [6], [9], [11], [17]. Несмотря на определенные достижения в лечении РА, подавляющее большинство больных постепенно, год от года инвалидизируются. Поэтому целью ранней базисной терапии является не только подавление активности РА, но и предупреждение необратимых повреждений суставов, а значит, сохранение функциональной активности больного [2].
Основные лекарственные препараты, используемые для лечения РА, представлены следующими группами:
-
• нестероидные противовоспалительные препараты,
-
• глюкокортикоиды (ГК),
-
• болезнь-модифицирующие препараты: метотрексат, гидроксихлорохин, сульфасалазин, лефлюномид и др.,
-
• биологические агенты,
-
• комбинированная терапия.
Болезнь-модифицирующие препараты должны назначаться с момента установления диагноза РА. Раннее назначение базисной терапии снижает выраженность клинических проявлений РА, улучшает функциональную активность больных, замедляет рентгенологическое прогрессирование, улучшает качество жизни и снижает риск потери трудоспособности, а кроме того, снижает смертность до популяционного уровня [10], [12].
Среди болезнь-модифицирующих средств «эталонным» препаратом признан метотрексат (МТ), так как характеризуется высокой эффективностью при хорошей переносимости большинством пациентов, предсказуемыми побочными эффектами, может комбинироваться с большинством базисных средств. По данным рандомизированных контролируемых исследований (РКИ), эффективное лечение МТ не только замедляет рентгенологическое прогрессирование, но и снижает летальность от сердечнососудистых заболеваний, которая у пациентов РА является важнейшей причиной уменьшения продолжительности жизни [11], [12].
Место глюкокортикоидов в лечении РА обсуждается уже более 50 лет. ГК до сих пор являются наиболее эффективными противовоспалительными препаратами и потенциально обладают способностью подавлять большинство механизмов, лежащих в основе ревматоидного воспаления. Ранняя агрессивная терапия позволяет существенно улучшить отдаленный прогноз при РА. По данным 10 РКИ (более 700 больных), низкие дозы преднизолона (5–10 мг) высокоэффективны в отношении облегчения симптомов у пациентов с активным РА и позволяют замедлить рентгенологическое прогрессирование, причем этот эффект сохраняется в течение длительного времени после отмены ГК [14]. Согласно этим данным, бридж-терапия и комбинированная терапия ГК с болезнь-модифицирую-щими препаратами коротким курсом рекомендованы для лечения РА. Однако длительный прием высоких доз (более 20 мг) ГК при РА полностью нивелирует благоприятный эффект лечения, так как частота развития и значимость побочных эффектов существенно превышают пользу терапии. Поэтому монотерапия и длительное рутинное использование ГК не рекомендуются в лечении РА [3], [4], [8], [13].
Новое направление в лечении РА, появившееся в 90-х годах ХХ века, – это биологическая терапия антагонистами цитокинов [7], [24]. Биологические агенты позволяют блокировать эффекты провоспалительных цитокинов – фактора некроза опухоли а (инфликсимаб, адалимумаб, этанерцепт), интерлейкина-1 (анакинра), интерлейкина-6 (тоцилизумаб). Эффективность данной терапии оказалась достаточно высокой как при плохом ответе на стандартные базисные средства, так и при раннем РА. Кроме того, все биологические препараты замедляют рентгенологическое прогрессирование РА, однако существенно удорожают стоимость лечения [12].
В реальной клинической практике всем 84 исследуемым пациентам с момента диагностики РА была начата базисная терапия: МТ – у 50 больных, сульфасалазином – у 26, делагилом – у 7 и тауредоном – у 1 больного. В последующем у 6 больных МТ был отменен: из-за непереносимой тошноты у 2, из-за 3-кратного повышения трансаминаз – у 2, из-за лейкопении – у 1. Только у 7 пациентов проведена бридж-терапия малыми дозами ГК, 22 больным к МТ добавлен делагил.
При высокой активности болезни, наличии системных проявлений, плохой переносимости базисных препаратов 21 пациенту выполнялся плазмаферез (в среднем 4,46 сеанса) в сочетании с пульс-терапией. Дважды плазмаферез выполнен 3 больным, трижды – 1 больному, 4 раза – 2 больным: пульс-терапия дважды выполнена 7 пациентам, трижды – 4 больным, 4 раза – 2 больным и 5 раз – 1 больному. Из всех больных, получивших пульс-терапию, она проводилась метилпреднизолоном в дозе 500 или 1000 мг № 3 только у 8 пациентов. Другие варианты пульс-терапии: метилпреднизолон 500 или 1000 мг № 1 - 11 случаев, метилпреднизолон < 500 мг - 1 случай, дексаметазон 100 мг – 6 случаев, дексаметазон < 80 мг - 7 случаев, дексаметазон < 80 мг -10 случаев; циклофосфан 800 мг – 1 больной и в 3 случаях - циклофосфан < 600 мг; метотрексат в/в в 2 случаях – 50 мг, в 5 случаях – 40 мг и у 1 больного – 20 мг.
Начало лечения РА всегда отличается трудностями, так как НПВП не у всех больных могут в полной мере подавить проявления воспаления в отдельно взятом суставе, а болезнь-модифици-рующие препараты реализуют свои свойства не ранее чем через 1,5–2 месяца. В связи с этим при наличии выраженных синовитов, сопровождающихся болевым синдромом, ограничением объема движения в суставе, мы использовали различные методы локальной терапии:
-
1. Лекарственная:
-
• ГК,
-
• МТ,
-
• Тромбовар.
-
2. Лучевая:
-
• Телегамматерапия в дозе 20 и 30 Гр (ЛТГТ),
-
• Рентгентерапия (РТ).
Эффективность всех видов локальной терапии оценивалась по динамике признаков местного воспаления: местный суставной индекс (МСИ) – выраженность болей при сильном надавливании на сустав, определенная в баллах (0 – боль отсутствует, 1 – слабая боль, 2 – больной морщится, 3 – отдергивает суставы), местный индекс боли (МИБ) оценивается больным по 5-балльной системе (0 – болей нет, 1 – легкие боли, 2 – умеренные боли, 3 – сильные боли, 4 – очень сильные боли), выраженность боли в исследуемом суставе по визуально-аналоговой шкале (ВАШ) в мм, окружность сустава (ОС) в см и объем движения (ОД) в градусах с использованием ортопедического угломера. Дополнительно выполнялось УЗИ суставов с оценкой толщины синовиальной оболочки (СО) при поперечном супрапателлярном сканировании по верхнему краю надколенника и количества жидкости в полости сустава.
Локальная ГК-терапия выполнена 54 больным, пунктировалось в среднем 3,86 сустава. ГК вводились согласно приказу о внутрисуставных введениях в наиболее пораженные суставы с признаками синовита. Динамика суставного синдрома при классическом варианте локальной лекарственной терапии следующая (рис. 1): до введения МСИ – 1,48 ± 0,1, МИБ – 1,75 ± 0,14, ОС – 38,5 ± 0,45, ОД – 103,1 ± 1,77, ВАШ – 54,4 ± 5,7; в течение недели после введения ГК показатели составили МСИ – 0,58 ± 0,18, МИБ – 0,5 ± 0,14, ОС – 37,6 ± 0,57, ОД – 122,0 ± 2,6, ВАШ – 22,7 ± 6,23; через 3 месяца МСИ – 1,08 ± 0,18, МИБ – 1,0 ± 0,29, ОС – 37,6 ± 0,56, ОД – 112,6 ± 2,71, ВАШ – 11,6 ± 4,14. Следует отметить, что 7 пациентам через 3 месяца потребовалось повторное введение ГК в связи с рецидивом синовита.
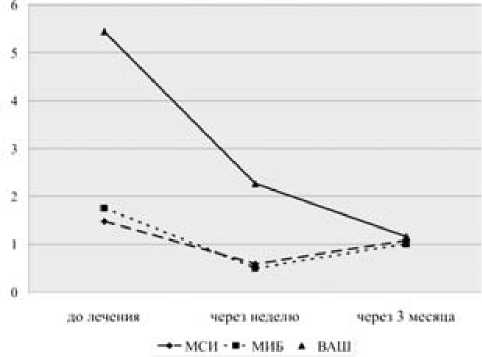
Рис. 1. Динамика суставного синдрома на фоне локальной терапии ГК
МТ вводился 33 больным в коленные суставы при наличии выраженных признаков синовита в дозе 10–20 мг. Прием метотрексата в качестве базисного препарата в данную неделю исключался. Исходные признаки локального воспаления в группе внутрисуставного введения МТ составили МСИ – 1,3 ± 0,09, МИБ – 1,4 ± 0,09, ОС – 38,7 ± 0,47, ОД – 107,5 ± 1,52, ВАШ – 57,4 ± 4,51. В течение недели после введения МТ показатели составили (рис. 2): МСИ – 0,32 ± 0,09, МИБ – 0,36 ± 0,1, ОС – 35,8 ± 0,33, ОД – 116,9 ± 2,4, ВАШ – 27,4 ± 4,28; через месяц МСИ – 0,75 ± 0,41, МИБ – 0,5 ± 0,25, ОС – 37,5, ОД – 104 ± 3,54, ВАШ – 36,5 ± 3,18; через 3 месяца МСИ – 0,67 ± 0,21, МИБ – 0,72 ± 0,23, ОС – 40,6 ± 0,99, ОД – 105,4 ± 5,2,
ВАШ – 46,2 ± 7,1; через 6 месяцев МСИ – 1,0 ± 0,26, МИБ – 0,82 ± 0,25, ОС – 33,95 ± 3,25, ОД – 111,8 ± 1,39, ВАШ – 45,6 ± 9,68. В течение 6 месяцев наблюдения у 3 пациентов отмечался рецидив синовита коленного сустава, потребовавший введения ГК. Толщина СО при УЗИ составила исходно 3,41 ± 0,66 мм (рис. 3), а через 3 месяца (рис. 4) – 2,34 ± 0,15 мм (р = 0,0038).
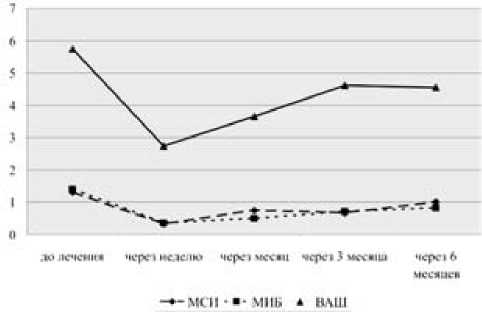
Рис. 2. Динамика суставного синдрома на фоне локальной терапии МТ
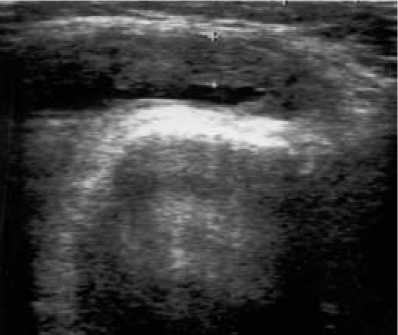
Рис. 3. УЗИ коленного сустава перед введением МТ
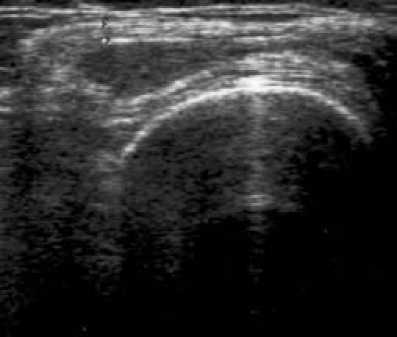
Рис. 4. УЗИ коленного сустава через 3 месяца после введения МТ
С целью осуществления «бескровной синовэктомии» при РА нами предложено внутрисуставное введение тромбовара (Т). Еще в начале 70-х годов ХХ столетия для внутрисуставного введения был впервые применен флебосклерозирующий препарат моруат натрия (варикоцид), являющийся наиболее активным склерозирующим компонентом в тот период [19], [20]. Предварительные эксперименты на крысах доказали безопасность и эффективность методики склерозирующей терапии. При сравнении внутрисуставного введения моруата натрия с химической синовэктомией 1 % раствором осмиевой кислоты была отмечена сходная положительная динамика клинических проявлений синовита. Однако повреждение прилежащих структур суставного хряща при использовании моруата натрия было минимальным в отличие от развития некроза хондроцитов при применении осмиевой кислоты.
В настоящее время при проведении склерозирующей терапии предпочтение отдается тетрадецилсульфату натрия, а препараты, созданные на его основе, признаются «средствами выбора» (тромбовар, фибровейн) [22]. Введение Т в полость сустава позволяет разрушить наиболее гиперплазированные участки СО без формирования некроза. При морфологическом исследовании через 6 месяцев после введения Т выявляется замещение СО соединительной тканью (рис. 5). Подобное склерозирующее действие Т способствует подавлению иммунного воспаления, разрушает паннус и предотвращает костную деструкцию, сохраняя функцию сустава. Непосредственно после введения препарата отмечалось развитие реактивного синовита, потребовавшее у части пациентов дополнительного введения НПВП.
Т вводился 15 больным в коленные суставы в дозе 6 – 8 мл. Динамика суставного синдрома при терапии тромбоваром следующая (рис. 6): исходно МСИ составил 1,13 ± 0,19, МИБ – 1,4 ± 0,17, ОС – 38,9 ± 0,72, ОД – 106,3 ± 2,5, ВАШ – 54,3 ± 4,5; в течение недели после введения МСИ – 0,58 ± 0,18, МИБ – 0,42 ± 0,14, ОС – 37,1 ± 0,57, ОД – 117,5 ± 2,4, ВАШ – 36,8 ± 4,73; через три месяца МСИ – 0,8 ± 0,33, МИБ – 0,4 ± 0,36, ОС – 38,4 ± 1,12, ОД – 115,4 ± 6,3, ВАШ – 24,7 ± 9,26; через 6 месяцев МСИ – 0,71 ± 0,33, МИБ – 0,43 ± 0,19, ОС – 38,4 ± 0,68, ОД – 109,7 ± 6,23, ВАШ – 45,86 ± 5,43; через год наблюдения МСИ – 0,5 ± 0,43, МИБ – 0,25 ± 0,22, ОС – 34,5 ± 9,97, ОД – 111,7 ± 6,24, ВАШ – 35,75 ± 14,4. Динамика толщины синовиальной оболочки по данным УЗИ: исходно – 4,8 ± 0,39 мм (рис. 7), после введения – 4,5 ± 0,38 мм (р = 0,049), через 3 месяца – 2,12 ± 0,45 мм (р = 0,017), через 6 месяцев (рис. 8) – 1,8 ± 0,38 мм (р = 0,0012) и через год (рис. 9) – 0,67 ± 0,14 мм (р = 0,0016). За время наблюдения ни у одного больного не отмечено рецидива синовита коленного сустава, в который вводился тромбовар.
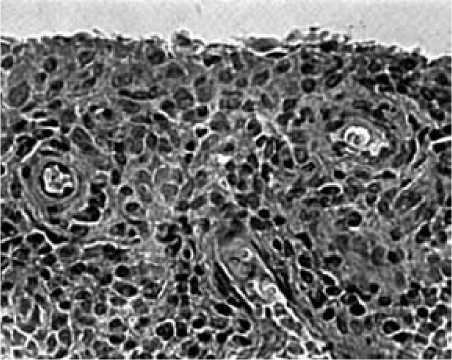
а
б
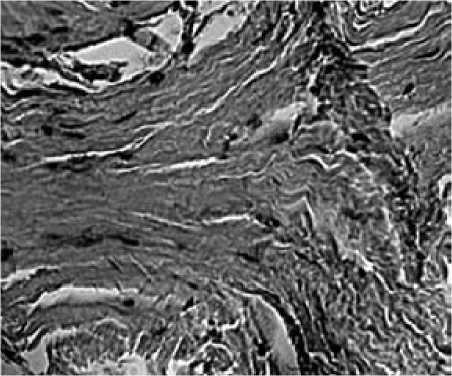
Рис. 5. Динамика морфологических изменений на фоне локальной терапии Т:
а – до введения Т выявлено увеличение количества слоев кроющих синовиоцитов, выраженная лимфоцитарная и плазмоклеточная инфильтрация с формированием скоплений, явления васкулита; б – через 6 месяцев после введения Т определяется соединительная ткань
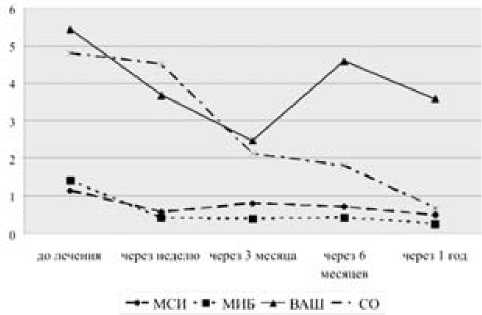
Рис. 6. Динамика суставного синдрома и толщины СО на фоне локальной терапии Т
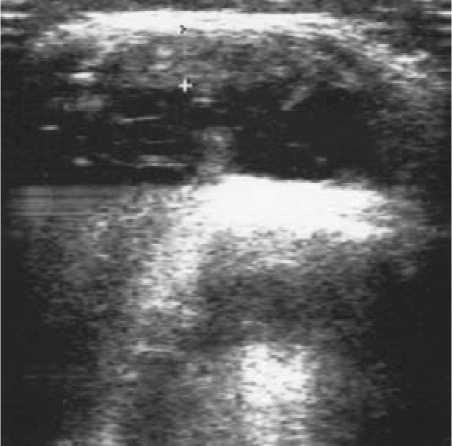
Рис. 7. УЗИ коленного сустава перед введением Т
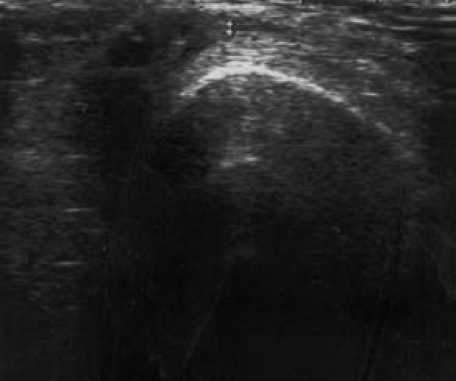
Рис. 8. УЗИ коленного сустава через 6 месяцев после введения Т
Лучевые методы локальной терапии применялись у больных старше 40 лет, также при упорном суставном синдроме, плохо отвечающем на терапию НПВП и базисными средствами. При этом ЛТГТ выполнялась у одного больного только на один или два симметричных сустава, тогда как РТ выполнялась на 2 и более суставные зоны с учетом ее меньшей лучевой нагрузки. ЛТГТ выполнена 22 больным, при этом динамика суставного синдрома была следующей: до лечения МСИ составил 1,76 ± 0,15, МИБ – 1,94 ± 0,17, ОС – 38,9 ± 0,6, ОД – 98,2 ± 4,7, ВАШ – 31,1 ± 5,3; через три месяца МСИ – 0,67 ± 0,54, МИБ – 0,67 ± 0,54, ОС – 41,7 ± 2,63, ОД – 114,0 ± 2,5, ВАШ – 16,7 ± 13,6; через 6 месяцев МСИ – 0,75 ± 0,41, МИБ – 0,75 ± 0,41, ОС – 38,9 ± 0,97, ОД – 113,0 ± 4,7, ВАШ – 40,5 ± 12,3; через год МСИ – 1,0 ± 0,28, МИБ – 0,8 ± 0,44, ОС – 32,0 ± 7,2, ОД – 105,3 ± 6,3; через 2 года МСИ – 1,0 ± 0,35, МИБ – 0,5 ± 0,25, ОС – 38,25 ± 1,15, ОД – 119,25 ± 4,35, ВАШ – 45,0 ± 5,5; через 3 года МСИ – 1,37 ± 0,25, МИБ – 1,13 ± 0,21, ОС – 39,3 ± 0,82, ОД – 111,25 ± 3,42, ВАШ – 11,25 ± 6,89.
При морфологическом исследовании СО в группе ЛТГТ не обнаружено повреждающего влияния лучевой терапии в ближайшие сроки наблюдения, выявлено лишь стихание воспалительно-экссудативных признаков и уменьшение степени инфильтрации субсиновиального слоя. В отдаленном периоде динамика синовита проявляется регрессом лимфоидной и плазмоклеточной инфильтрации, уменьшением процента очаговых инфильтратов и прогрессированием склеротических изменений, сменяющих явления васкулита. Подобные гистологические изменения отражают иммуносупрессивное действие ЛТГТ при РА [5]. Влияние ЛТГТ на толщину СО при УЗИ, косвенно свидетельствующее о подавлении иммунного воспаления, представлено на рис. 10 и 11.
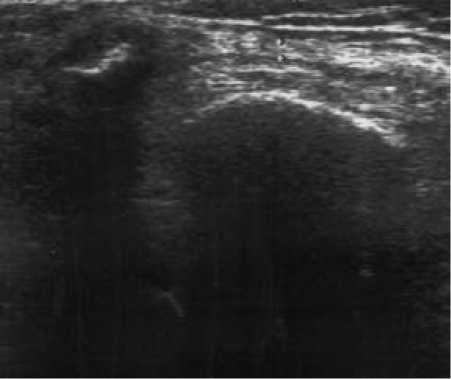
Рис. 9. УЗИ коленного сустава через год после введения Т
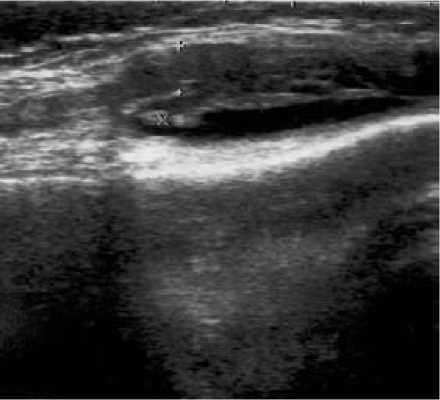
Рис. 10. УЗИ коленного сустава до ЛТГТ
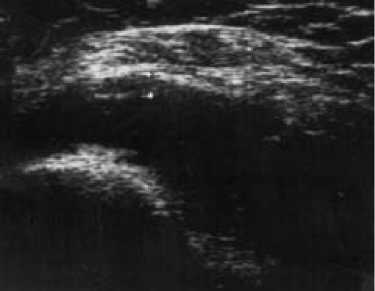
Рис. 11. УЗИ коленного сустава через 6 месяцев после ЛТГТ
РТ получали 36 пациентов, в среднем воздействию подвергалось 5,1 суставной зоны. Динамика суставного синдрома: до лечения МСИ составил 1,45 ± 0,15, МИБ – 1,38 ± 0,13, ОС – 37,49 ± 0,62, ОД – 104,0 ± 2,35, ВАШ – 52,0 ± 2,1; в течение недели по завершении рентгенотерапии МСИ – 1,0, МИБ – 1,0, ОС – 37,5 ± 0,24, ОД – 108,7 ± 3,81, ВАШ – 43,3 ± 7,1; через 6 месяцев МСИ – 1,33 ± 0,27, МИБ – 1,0 ± 0,47, ОС – 37,83 ± 0,14, ОД – 106,7 ± 7,2, ВАШ – 41,7 ± 9,01; через год МСИ – 1,44
± 0,17, МИБ – 1,44 ± 0,23, ОС – 36,4 ± 0,39, ОД – 115,0 ± 5,3, ВАШ – 53,7 ± 3,72. Через полгода после проведения РТ 7 пациентам потребовалось введение ГК в суставы, подвергавшиеся лучевой терапии, в связи с рецидивом синовита.
Таким образом, диагноз РА должен устанавливать ревматолог, активная терапия должна начинаться с момента установления диагноза. Выбор тактики лечения конкретного пациента должен основываться на данных доказательной медицины, адаптированных к индивидуальным особенностям заболевания. Необходимо более широко внедрять в практику комбинированную базисную терапию. Ни один больной РА в настоящее время не должен лечиться без болезнь-модифицирующих препаратов . С учетом отсроченного эффекта базисной терапии в стратегию лечения РА могут включаться различные варианты локальной терапии . Такие локальные вмешательства, как внутрисуставное введение МТ и Т, а также ЛТГТ уменьшают деструктивный потенциал хронического синовита при РА. То есть данные виды локальной терапии обладают не только симптоматическим противовоспалительным эффектом, но и позволяют надеяться на замедление прогрессирования структурных повреждений суставов.
Список литературы Возможности комплексной терапии ревматоидного артрита
- Багринцева К. М., Федотова Н. М., Стародубова А. В. Ранний ревматоидный артрит. Клинико-иммунологическая характеристика//Мед. журнал молодых исследователей. 1998. № 11. С. 11-19.
- Балабанова Р. М. Современная концепция фармакотерапии ревматоидного артрита//Вестник РАМН. 2003. № 7. С. 19-23.
- Грунина Е. А., Виноградова Н. А. Кортикостероиды при ревматоидном артрите -базисные препараты?//Клин. фармакология и терапия. 2000. № 9 (2). С. 51-57.
- Грунина Е. А., Виноградова Н. А., Надирова Н. Н. Возможность антидеструктивного действия низких доз кортикостероидов при ревматоидном артрите: предварительное сообщение//Научно-практич. ревматол. 2000. № 1. С. 29-31.
- Игнатьев В. К., Марусенко И. М., Здоров А. Е. Локальная лучевая терапия в комплексном лечении ревматоидного артрита//Тер. архив. 2001. № 5. С. 15-19.
- Каратеев Д. Е., Иванова М. М. Базисная терапия ревматоидного артрита и исход болезни: ретроспективная оценка данных многолетнего наблюдения//Научно-практич. ревматол. 2000. № 1. С. 5-12.
- Лукина Г. В. Перспективы антицитокиновой терапии ревматоидного артрита//Вестн. РАМН. 2003. № 7. С. 23-30.
- Насонов Е. Л. Глюкокортикоиды: 50 лет применения в ревматологии//РМЖ. 1999. № 7-8. С. 5-9.
- Насонов Е. Л. Почему необходима ранняя диагностика и лечение ревматоидного артрита?//РМЖ. 2002. № 22. С. 1009-1012.
- Насонов Е. Л. Ревматоидный артрит как общемедицинская проблем//Тер. архив. 2004. № 5. С. 5-7.
- Насонов Е. Л. Метотрексат. Перспективы применения в ревматологии. М., 2009.
- Рекомендации по применению базисных противовоспалительных препаратов и биологических агентов при ревматоидном артрите (Американская коллегия ревматологов, 2008 г.)//Клин. фармакол. и терапия. 2009. № 1. С. 2-7.
- Сигидин Я. А., Лукина Г. В., Гусев Д. Е. О базисных свойствах глюкокортикостероидов при ревматоидном артрите//Клин. фармакол. и терапия. 2000. № 1. С. 55-57.
- Bijlsma J. W. J., van Everdingen A. A., Huis m a n M. et al. Glucocorticoids in rheumatoid arthritis: effects on erosions and bone//Ann. NY Acad. Sci. 2002. Vol. 966. P. 82-90.
- Callahan L. F. The burden of rheumatoid arthritis: facts and figures//J. Rheumatol. 1998. Vol. 25 (suppl. 53). P. 8-12.
- Duffy T., Bresnihan B. Early arthritis -mechanisms of synovitis and prevention of damage//Rheumatology Highlights. 2001. № 2. P. 7-14.
- Emery P. Therapeutic approaches for early rheumatoid arthritis. How eаrly? How aggresive?//Br. J. Rheumatol. 1995. 34. № 2. P. 87-90.
- Emery P., Mazzo H., Proudman S. Management of patients with newly diagnosed rheumatoid arthritis//Rheumatol. 1999. № 38. P. 27-31.
- Kastner P. Chemical synovectomy using varicocid in progressive chronic polyarthritis//Z. Gesamte Inn. Med. 1973. № 28(23). P. 737-740.
- Kastner P., Wessel G. Chemical synovectomy with Varicocid in rheumatoid arthritis -further results//Scand.J. Rheumatol. 1977. № 6(1). P. 28-32.
- Kremer J. M. New and emerging therapies for rheumatoid arthritis//Rheum. Dis. Clin. North. Am. 2004. № 30(2). P. 11-12.
- Labas P., Ohradka B., Cambal M. et. al. Long term results of compression sclerotherapy//Bratisl. Lek. Listy. 2003. № 104(2). P. 78-81.
- O' Dell J. R. Treating rheumatoid arthritis early: a window of opportunity?//Аrthr. Rheum. 2002. № 46. P. 283-285.
- Olsen N. J., Stein C. M. New drugs for rheumatoid arthritis//N. Engl. J. Med. 2004. № 350. P. 2167-2179.
- Wolfe F., Hawley D. J. The long-term outcomes of rheumatoid arthritis: work disability. A prospective 18 year study of 823 patients//J. Rheumatol. 1998. № 25. P. 2108-2117.


