Возможности коррекции синдрома эндогенной интоксикации при интраоперационном облучении больных раком желудка
Автор: Афанасьев С.Т., Авдеев С.В., Ли А.А., Рудык Ю.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (21), 2007 года.
Бесплатный доступ
Проведено изучение эффективности методики корригирующей медикаментозной терапии, включающей мексидол, токоферол ацетат и гордокс, которая дополнительно назначалась на периоперационном этапе комбинированного лечения рака желудка, по сравнению со стандартным ведениемпослеоперационного периода. В исследование включено 56 больных с местнораспространен-ной опухолью, которым была выполнена радикальная операция в сочетании с интраоперационным облучением на зоны лимфогенного метастазирования в дозе 10 Гр. По результатам проведенного исследования установлено, что применение корригирующей медикаментозной терапии в раннем послеоперационном периоде достоверно снижает уровень основных маркеров эндогенной интоксикации и улучшает непосредственные результаты операции. В основной группе нехирургические осложнения наблюдались в 9,1 %, послеоперационная летальность равнялась 3,0 %; в контрольной группе - 34,8 % и 8,7 % соответственно.
Рак желудка, интраоперационная лучевая терапия, синдром эндогенной интоксикации
Короткий адрес: https://sciup.org/14054540
IDR: 14054540
Текст научной статьи Возможности коррекции синдрома эндогенной интоксикации при интраоперационном облучении больных раком желудка
Общий уровень интоксикации онкологического больного в раннем послеоперационном периоде при комбинированном лечении в сочетании с интраоперационной лучевой терапией (ИОЛТ) складывается из интоксикации, связанной с опухолевым процессом, последствий хирургического вмешательства, действия электронного облучения на фоне повреждающего воздействия операционной травмы и препаратов наркоза. Развитие злокачественных новообразований приводит к стресс-индуцированным реакциям, нарушению всех видов обмена, активации протеолиза, дисбалансу в системе перекисного окисления, энергодефициту. На этом фоне хирургическое воздействие на опухолевые и окружающие здоровые ткани влечёт за собой также повреждение клеток, что ведёт к образованию и выбросу в кровь продуктов их жизнедеятельности, а также биологически активных веществ [6, 9, 11].
I группа (основная) – 33 больных, которым была выполнена радикальная операция в сочетании с ИОЛТ в однократной дозе 10 Гр на фоне специальной корригирующей медикаментозной терапии (КМТ), направленной на предупреждение периоперационных осложнений.
II группа (контрольная) – 23 больных, получивших хирургическое лечение в сочетании с интраоперационным облучением в дозе 10 Гр.
Формирование исследуемых групп осуществлялось после комплексного обследования, включавшего клинико-лабораторные, рентгенологические, ультразвуковые, эндоскопические и морфологические исследования методом «случай-контроль». В сравниваемых группах распределение по полу и возрасту было одинаковым: мужчин – 33 (58,9 %), женщин – 23 (41,1 %), в возрасте от 39 до 71 года, средний возраст – 56,7 ± 4,9 года. Состав групп больных по распространенности и гистологическому типу опухолевого процесса также был практически однороден. Объем радикальных операций, выполненных в сравниваемых группах (табл. 1), одинаков (p>0,05), что позволило провести адекватный сравнительный анализ результатов исследования.
Таблица 1
Распределение больных в сравниваемых группах по объему оперативного вмешательства, абс.ч.,%
Источником энергии при выполнении ИОЛТ служил малогабаритный бетатрон, генерирующий пучок быстрых электронов с энергией 6 МэВ, аппарат размещен непосредственно в операционной, на специальной потолочной подвеске. Во время операции, после органоуносящего этапа вмешательства, проводилось облучение ложа удаленной опухоли и зон регионарного метастазирования в разовой дозе 10 Гр.
В качестве метода общей анестезии взята за основу комбинированная эндотрахеальная анестезия с ингаляцией закиси азота и галогеносодержащих анестетиков (галотана, севофлюрана), внутривенным введением фентанила. Для проведения анестезиологического пособия использовался наркозный аппарат Dreger «Fabius». В основной группе в схему наркоза добавлена корригирующая медикаментозная терапия (КМТ), которая может рассматриваться как специальный компонент общей анестезии и послеоперационной интенсивной терапии. Целью последней являлись предупреждение и коррекция избыточной активности систем перекисного окисления ли- пидов и связанных с ними нарушений регуляции агрегатного состояния крови и детоксикации в предоперационном, операционном и послеоперационном периодах. Методика КМТ включала комплекс антиоксидантной терапии, применение мексидола, токоферола ацетата в сочетании с антиферментными препаратами, ее начинали за 1 ч до операции путем внутримышечного введения токоферола ацетата в дозе 300 мг и мексидола внутривенно в дозе 200 мг. На этапе удаления опухоли и выполнения лимфодис-секции, за 45–50 мин до проведения ИОЛТ, внутривенно вводили мексидол в дозе 400 мг и гордокс в дозе 100 000 ЕД. После завершения операции продолжалось внутримышечное введение токоферола ацетата в дозе 300 мг через каждые 8 ч и мексидола в дозе 200 мг внутривенно через каждые 6 ч в течение 3–5 сут раннего послеоперационного периода.
Оценку эффективности методики корригирующей медикаментозной терапии проводили по динамике лабораторных методов, отражающих уровень эндогенной интоксикации, для этого производилось определение общей (ОКА) и эффективной концентрации альбумина (ЭКА), резерва связывающей способности альбумина (РСА), лейкоцитарного индекса интоксикации (ЛИИ) по Я.Я. Кальф-Калиф, ядерного индекса интоксикации (ЯИИ) по Г.А. Даштаянц, индекса токсичности (ИТ), уровня молекул средней массы (МСМ) по Н.И. Габриэлян [7]. Забор крови для исследования осуществляли в установленные сроки: перед операцией; во время операции, после завершения сеанса ИОЛТ; в 1, 3, 5-е сут раннего послеоперационного периода.
Полученные данные подвергались статистической обработке при помощи программы STATISTICA 6.0. Достоверность различий оценивали с помощью непараметрических критериев U-критерия Манна-Уитни, W-критерия Уилкоксона и точного теста Фишера для качественных признаков. Различия считали достоверными при p<0,05. Для определения существования корреляций между параметрами вычисляли коэффициент корреляции Спирмана (R), который считали достоверным при p<0,05 [10].
Результаты и обсуждение
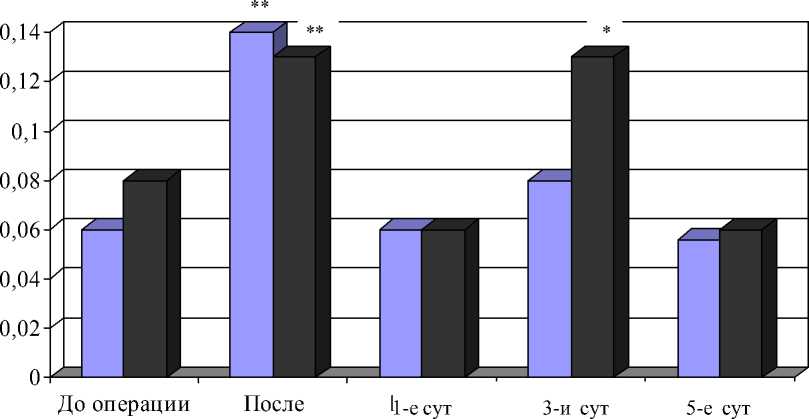
Для оценки степени токсического воздействия нами проанализирована динамика показателей, харак- теризующих степень интоксикации организма. По полученным данным об изменении индекса «ядер-ного сдвига» можно заключить, что обе группы пациентов показали адекватную реакцию на операционный стресс, которая выразилась в увеличении значения ЯИИ. Непосредственно по окончании оперативного вмешательства его величина у пациентов контрольной группы, возросла в 1,6 раза, а в основной группе – в 2,3 раза. На 3-и сут после операции у больных контрольной группы значение ядерного индекса интоксикации превышало аналогичный показатель у пациентов основой группы в 1,6 раза (рис. 1).
В литературе имеются данные о том, что ИОЛТ может рассматриваться в качестве дополнительного повреждающего фактора [2, 3]. Наблюдаемое различие в показателях ядерного индекса интоксикации можно объяснить проводимой медикаментозной коррекцией эндогенной интоксикации в основной группе больных. Таким образом, у этих пациентов наблюдалась менее выраженная реакция нейтрофильного ростка кроветворения на одинаковый раздражитель.
По данным проведенного анализа непосредственно после операции уровень МСМ в обеих сравниваемых группах недостоверно повысился. При этом в контрольной группе в несколько большей степени, чем в основной (табл. 2). При этом в обеих группах снизились общая и эффективная концентрации альбумина, возрос показатель РСА. Непосредственно после операции индекс токсичности у больных контрольной группы остался без изменений, а у пациентов основной группы он оказался снижен относительно исходных значений в 1,5 раза (р<0,05).
Интегральный показатель эндогенной интоксикации – индекс токсичности возрастал в послеопераци-
операции
□ I группа (основная) □ II группа (контроль)
Рис. 1. Значение ядерного индекса интоксикации у пациентов сравниваемых групп. Примечание: * – различия статистически значимы между сравниваемыми группами (p<0,05); ** – различия статистически значимы по сравнению с исходным уровнем (р<0,05)
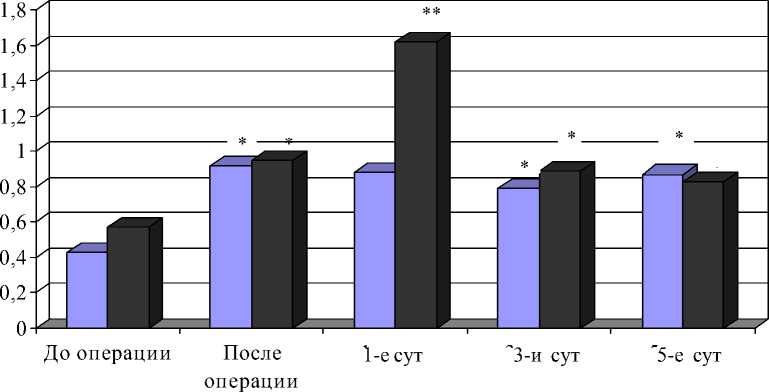
□ I группа (КМТ) □ II группа (контроль)
Таблица 2
Динамика показателей эндотоксикоза в сравниваемых группах
|
Маркеры интоксикации |
До операции |
После операции |
||
|
КМТ |
Контроль |
КМТ |
Контроль |
|
|
МСМ, ед. опт. плот. |
0,46 ± 0,089 |
0,46 ± 0,050 |
0,46 ± 0,069 |
0,47 ±0,052 |
|
ОКА, г/л |
52 ± 3 |
51 ±2 |
42 ± 1** |
43 ±2* |
|
ЭКА, г/л |
40 ±3 |
40±2 |
35 ± 2** |
34±1* |
|
РСА, % |
76,9 ± 4,6 |
78,4 ± 5,2 |
79,5 ± 3,9 |
84,6 ± 3,1 |
|
ИТ, усл.ед. |
0,30 ± 0,05 |
0,28 ± 0,06 |
0,20 ± 0,03* |
0,26 ± 0,02 |
Примечание: * – р<0,05; ** – р<0,01, различия статистически значимы по сравнению с исходными показателями.
Таблица 3
Динамика показателей эндогенной интоксикации в раннем послеоперационном периоде
|
Маркеры интоксикации |
1-е сут после операции |
3-и сут после операции |
5-е сут после операции |
|||
|
КМТ |
Контроль |
КМТ |
Контроль |
КМТ |
Контроль |
|
|
МСМ, ед. опт. плот. |
0,43 ± 0,49 |
0,50 ± 0,30 |
0,43 ± 0,40 |
0,51 ± 0,49 |
0,41 ± 0,48 |
0,49 ± 0,59 |
|
ОКА, г/л |
43 ± 1* |
39 ± 1 |
42 ± 1 |
38 ± 1 |
42 ± 1 |
40 ± 2 |
|
ЭКА, г/л |
35 ± 1 |
33 ± 2 |
33 ± 1* |
29 ± 2 |
33 ± 1 |
30 ± 1 |
|
РСА, % |
81,4 ± 5,4 |
82,5 ± 6,2 |
78,6 ± 1,4 |
76,3 ± 2,9 |
78,6 ± 4,1 |
75,0 ± 3,8 |
|
ИТ, усл.ед. |
0,23 ± 0,09 |
0,22 ± 0,08 |
0,27 ± 0,09 |
0,31 ± 0,05 |
0,27 ± 0,08* |
0,33 ± 0,03 |
Примечание: * – различия статистически значимы по сравнению с исходными показателями (р<0,05).
онном периоде в обеих группах обследованных пациентов. Однако если в контрольной группе пациентов нарастание показателя носило непрерывный характер, то проведение КМТ в основной группе больных позволило сдержать рост ИТ и стабилизировать его на 3-и сутки после операции. Таким образом, к 5-м суткам ИТ в контрольной группе пациентов превышал аналогичный показатель у больных основной группы в 1,2 раза (р<0,05) (табл. 3).
Изучение маркеров эндотоксикоза позволяет сделать заключение о том, что оперативное вмешательство в сочетании с интраоперационным облучением является мощным повреждающим фактором и может привести к ухудшению «лабораторного» состояния больного, что является платформой для последующего развития общесоматических послеоперационных осложнений. Однако проведение профилактических мероприятий, направленных на предупреждение эндогенной интоксикации и уменьшение выраженности последствий хирургической и лучевой агрессии – применение методики КМТ, – способствует более эффективному репаративному процессу в послеоперационном периоде.


