Возможности объемной сегментации опухоли по данным диффузионно-взвешенной МРТ в прогнозировании и оценке эффективности химиотерапии при раке мочевого пузыря
Автор: Григорьев Е.Г., Фролова И.Г., Усынин Е.А., Усова А.В., Табакаев С.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Цель исследования - разработка и оценка методики объемной сегментации опухоли по данным диффузионно-взвешенной магнитно-резонансной томографии (ДВ-МРТ) для прогнозирования и оценки эффективности химиотерапии при раке мочевого пузыря (РМП). материал и методы. Обследовано 26 пациентов с морфологически верифицированным переходно-клеточным раком мочевого пузыря. Группа характеризовалась наличием одной или нескольких опухолей, размером от 17 до 46 мм. Перед планированием химиотерапии по схеме M-VAC выполнялось исследование и постпроцессинговая обработка ДВ-МРТ с объемной сегментацией образований, оценкой объема и коэффициента диффузии (ИКД) во всей массе опухоли. По данным ИКД, по форме опухоли и ее отношению к стенке мочевого пузыря вычисляли коэффициент (К) прогноза эффективности химиотерапевтического лечения. Результаты. При значении коэффициента ниже 0,51 прогнозировался высокий риск неэффективности химиотерапии, при К≥0,74 - положительный эффект лечения. При 0,51≤K
Мрт, диффузионно-взвешенные изображения, рак мочевого пузыря, прогнозирование, оценка эффективности химиотерапии
Короткий адрес: https://sciup.org/140300178
IDR: 140300178 | УДК: 616.62-006.6-08-037-073.756.8:615.28 | DOI: 10.21294/1814-4861-2023-22-3-25-35
Текст научной статьи Возможности объемной сегментации опухоли по данным диффузионно-взвешенной МРТ в прогнозировании и оценке эффективности химиотерапии при раке мочевого пузыря
В структуре онкологической заболеваемости рак мочевого пузыря (РМП) входит в число наиболее часто встречающихся локализаций, составляя от 3 до 5 % всех новообразований. Ежегодно в мире заболевает около 430 тыс. человек, в России за последние 10 лет прирост стандартизованного показателя заболеваемости РМП составил 16,1 % [1].
Современные стандарты лечения РМП предусматривают применение химиотерапии в самостоятельном варианте и в неоадъювантном режиме. При лечении немышечноинвазивного РМП (стадия T1) выполняют трансуретральную резекцию с внутрипузырным введением цитостатиков. При органосохраняющем хирургическом лечении мышечноинвазивного РМП (стадии T2a-b) неоадъювантная химиотерапия с применением новых схем уменьшает вероятность рецидива на 20–30 %, улучшая показатели общей выживаемости. При РМП T3b-T4b стадии используются сочетания химио- и лучевой терапии в паллиативном варианте [2].
Известно, что факторами, безусловно определяющими положительный прогноз эффективности химиотерапии, являются стадия заболевания, гистотип опухоли, непосредственная эффективность используемых препаратов. Однако прогноз и оценка эффективности проводимого лечения часто представляют трудную задачу для клинициста. В частности, при определении стадии РМП до начала лечения в 10–20 % случаев имеют место завышение или недооценка. Также может не оправдаться ожидаемый прогноз эффективности лечения [3–5]. Так или иначе, для возможности прогнозирования эффективности химиотерапии необходимо иметь минимум две контрольные точки для визуализации опухоли: до и после лечения. Первая – для оценки распространенности опухолевого процесса и возможного прогноза. Вторая – для проверки состоятельности прогноза и оценки эффекта лечения. Для локальной оценки РМП используются различные методы диагностики, и ведущую роль играет цистоскопия. Однако изменчивость формы опухолей во время этой манипуляции не позволяет достоверно оценивать их линейные размеры. Также при цистоскопии нередко визуализируются неопухолевые изменения слизистой оболочки мочевого пузыря, трудно отличимые от рака, осмотр может быть затруднен гематурией, послеоперационными изменениями, при наличии стриктуры уретры цистоскопия становится технически невозможной.
Магнитно-резонансная томография (МРТ) позволяет выявить количество, размеры, локализацию опухолевых образований мочевого пузыря, их
МР-сигнальные характеристики, состояние периве-зикальной клетчатки, окружающих анатомических структур и лимфатических узлов, разграничить инвазивную и неинвазивную формы РМП, уточнить распространенность опухоли и вовлеченность окружающих органов. Однако в настоящее время нет четких данных об эффективности МРТ в мониторинге химиотерапии: точность метода составляет от 65 до 80 % [6]. Последние достижения сделали возможным применение различных видов функциональных методик визуализации, которые косвенно отражают метаболизм и структуру опухоли, наиболее актуальным из них является применение диффузионно-взвешенных изображений (ДВИ) МРТ, с получением серии сканов с измеряемым коэффициентом диффузии (ИКД, аpparent diffusion coefficient – ADC). Методика позволяет применять количественный параметр – коэффициент диффузии, который может быть полезным для прогноза эффективности лечения. Патофизиологические процессы, приводящие к изменению проницаемости клеточных мембран, вызывают и изменение диффузии молекул воды, что может быть выявлено на ДВИ и измерено при вычислении ИКД, который отражает величину среднего квадрата расстояния, которое проходят молекулы за единицу времени. На ДВИ каждый воксель (трехмерный пиксель) изображения имеет интенсивность, отражающую степень свободы диффузии воды. Ограничение диффузии, оптимально визуализирующееся на сканах с высоким b-фактором (800–1000) за счет контрастности и характеризующееся численными значениями на картах ИКД, может выступать основной характеристикой, позволяющей оценивать патофизиологические процессы и патоморфоз, отражая эффективность проводимой химиотерапии при исследовании в динамике до и после лечения. Преимуществом ДВИ являются относительная быстрота выполнения и отсутствие необходимости внутривенного контрастирования, что позволяет включить эту методику в протокол МР-исследования у всех пациентов.
Цель исследования ‒ разработка и оценка методики объемной сегментации опухоли по данным диффузионно-взвешенной магнитно-резонансной томографии в прогнозировании и оценке эффективности химиотерапии при раке мочевого пузыря.
Материал и методы
Исследование проведено в НИИ онкологии Томского НИМЦ. Обследовано 26 пациентов с морфологически верифицированным переходноклеточным раком мочевого пузыря, из них 23 – мужчины, 3 – женщины, средний возраст составил 62,6 ± 11 лет. Все пациенты, включенные в исследование, подписали информированное согласие. Пациенты в группе характеризовались наличием одной или нескольких опухолей мочевого пузыря, с сопоставимым линейным размером в интервале от 17 до 46 мм. В исследование не включались пациенты после инвазивных вмешательств, биопсии, внутрипузырного введения химиопрепаратов или проведения лучевой терапии, с признаками отдаленного и регионарного метастазирования (по данным СКТ органов грудной клетки, брюшной полости и почек). Интервал после диагностической цистоскопии до МР-томографии составлял не менее 4 дней.
Пациентам проводилось органосохраняющее лечение, которое включало 2 курса системной неоадъювантной химиотерапии по стандартной схеме M-VAC (метотрексат – 30 мг/м2 в 1, 15 и 22-й день, винбластин – 4 мг/м2 в 1, 15 и 22-й день, цисплатин – 70 мг/м2 во 2-й день, доксорубицин 30 мг/м2 во 2-й день), перерыв между курсами – 4–6 нед.
МР-исследование выполнялось на сканере MAGNETOM ESSENZA (SIEMENS, Германия) с напряженностью магнитного поля 1,5Т. Подготовка к МРТ соответствовала общепринятой: сканирование проводилось натощак, артефакты от перистальтики кишечника минимизировались препаратами глюкагон или бускопан и приемом накануне капсулы имодиума, эспумизана. Пациенты не мочились за 1,5 ч до выполнения МРТ. Исследование проводилось в положении пациентов на спине с использованием стандартной (мягкой) РЧ-катушки для исследования органов брюшной полости и малого таза. Сканирование проводилось в стандартных импульсных последовательностях (в режиме T2, Т1, STIR, в сагиттальной, аксиальной и коронарной плоскостях). В протокол МРТ включались ДВИ с подавлением сигнала от жировой ткани в аксиальной плоскости, со следующими характеристиками: серия с величинами b-фактора 50 и 800 с/мм2, толщина томографического среза – 3 мм, TR=2500–3000 ms, TE=90–100 ms, матрица 128×128, FOV 250×250 мм (рис. 1).
На изображениях оценивали толщину, четкость и ровность контуров стенки мочевого пузыря, наличие участков локального утолщения и экзофитных образований, однородность перивезикальной клетчатки. При наличии образований оценивали их форму, размеры, структуру, отношение к стенке и перивезикальной клетчатке. Далее по данным МР-исследования проводились постпроцессинговая обработка и анализ с использованием программы Horos (Horosproject.org и Nimble Co LLC Purview, США): на всех сканах с b-фактором 800 с/мм2, содержащих в сечении патологическое образование, проводился полуавтоматический выбор зон интереса (ROI) по контуру опухоли, с отсечением значений меньше ее минимальной интенсивности (рис. 2). Далее проводили объемную сегментацию выявленного образования и по скопированным границам ROI на сканах ADC во всей массе опухоли оценивали значение ИКД данной сегментированной опухоли (C) и ее объем (рис. 3).
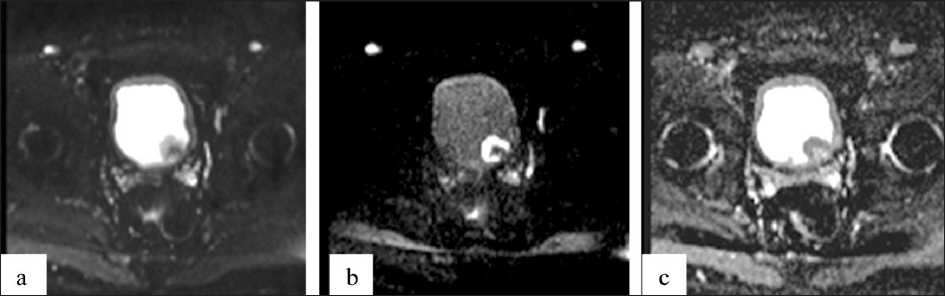
Рис. 1. ДВИ в аксиальной плоскости при раке мочевого пузыря, в режимах DWI с b-фактором 50 с/мм2 (a), 800 с/мм2 (b) и ИКД (c) Fig. 1. Diffusion-weighted images in the axial plane, bladder cancer, b-factor of 50 s/mm2 (a), 800 s/mm2 (b) and АDС (c)
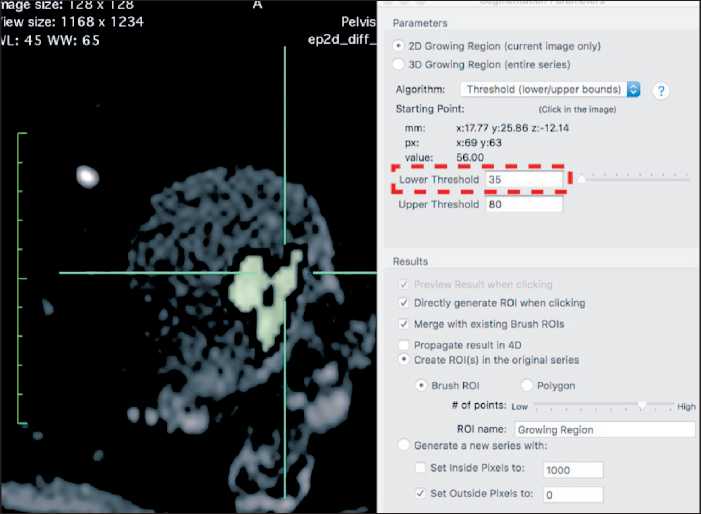
Рис. 2. ДВИ в аксиальной плоскости при раке мочевого пузыря, DWI с b-фактором 800 с/мм2. Выбор зон интереса (RОI) по контуру опухоли, при отсечении значений МР-сигнала меньше ее минимальной интенсивности (отмечена пунктирной рамкой)
Fig. 2. Diffusion-weighted imaging of bladder cancer at the axial plane, in DWI b-factor of 800 s/mm2.
Selecting areas of interest (RОI) along the contour of the tumor, with cut-off values less than its minimum intensity (marked with a dotted frame)
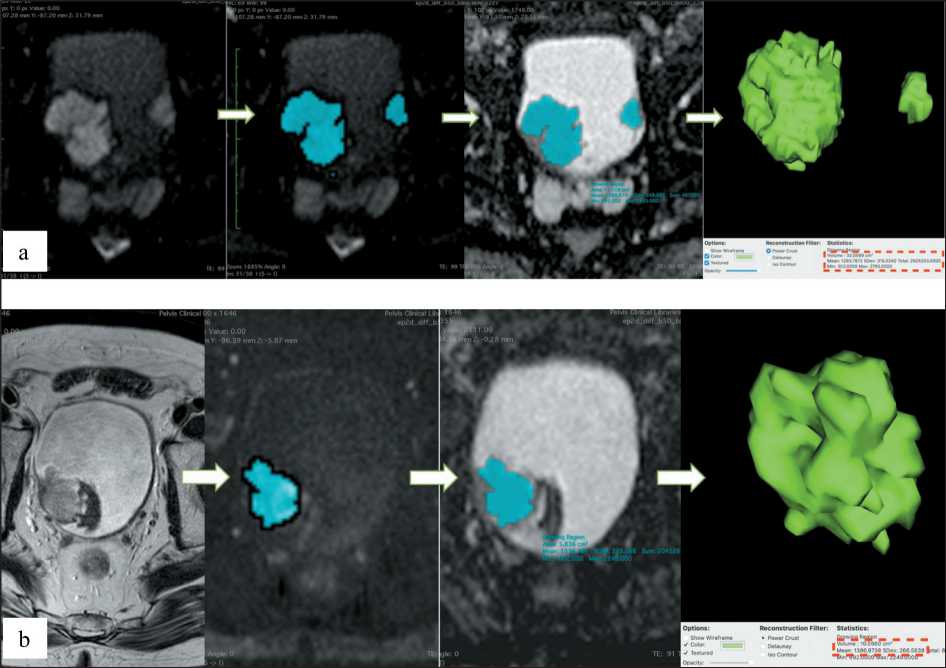
Рис. 3. Объемная сегментация, вычисление общего объема опухоли и ИКД в случае двух образований (а) – 33,06 мм3, С=1293 мм2/с и при наличии сгустков крови (b) – 10,56 мм3, С=1387 мм2/с
Fig. 3. Volumetric segmentation, calculation of the total volume of the tumor and АDС in the case of two lesions (a) – 33.06 mm3, С=1293 mm2/s, and in the presence of blood clots (b) – 10.56 mm3, С=1387 mm2/s
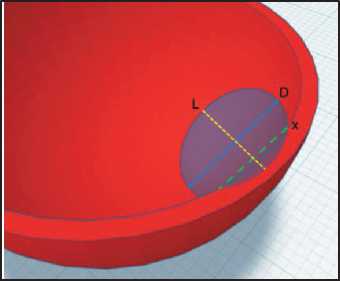
Рис. 4. Схема определения размеров опухоли
Fig. 4. Scheme for determining the size of the tumor
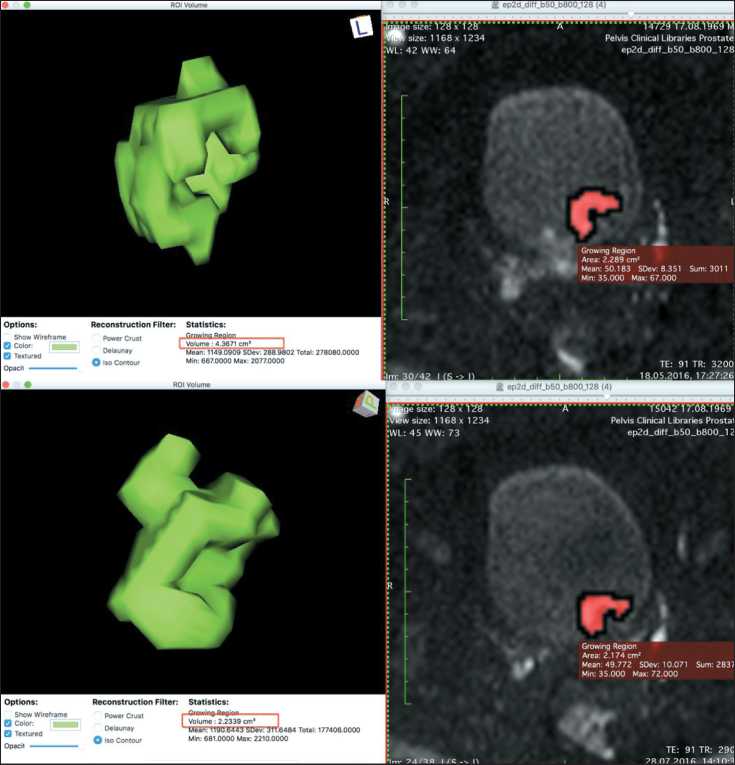
Рис. 5. Объемная сегментация образования мочевого пузыря с оценкой динамики изменения объема опухоли. Верхний ряд – до лечения, нижний – после лечения, объем составляет 4,37 и 2,23 мм3 соответственно
Fig. 5. Volumetric segmentation of bladder lesion with an assessment of the changes in the volume of the tumor. Upper row before treatment, lower row after treatment, the volume is 4.37 and 2.23 mm3, respectively
Учитывая, что форма опухоли и ее отношение к стенке являются проявлением характера роста, проводили измерения с получением значений: L (ось опухоли) – расстояние от просветного контура опухоли до границы стенки мочевого пузыря, x – максимальный поперечник опухоли на границе со стенкой мочевого пузыря (рис. 4). Значение C равнялось значению ИКД в объеме всей сегментированной опухоли. Получив все данные, вычисляли коэффициент прогноза эффективности (К), который является производным L/x/C×1000 для непосредственной оценки прогноза эффективности предстоящего химиотерапевтического лечения.
После 2-го курса химиотерапии МР-исследова-ние повторяли с теми же импульсными последовательностями, постпроцессинговую обработку выполняли по указанной методике с дублировани- ем значений отсечения интенсивности МР-сигнала, выявляя изменение объема сегментированной опухоли (рис. 5). Оценка эффективности лечения проводится по критериям, сопоставимым с RECIST R1.1: полный эффект – исчезновение всех очагов поражения на срок не менее 4 нед; частичный эффект – уменьшение очагов на 30 % и более; прогрессирование – увеличение очага на 20 % или появление новых очагов; стабилизация – нет уменьшения опухоли менее чем 30 % и увеличения более чем на 20 %.
Результаты
Исходные показатели ИКД до химиотерапии у больных РМП с разным эффектом лечения (рис. 6, 8) отличались между собой и характеризовались при прогрессировании опухоли (n=6) относительно вы-
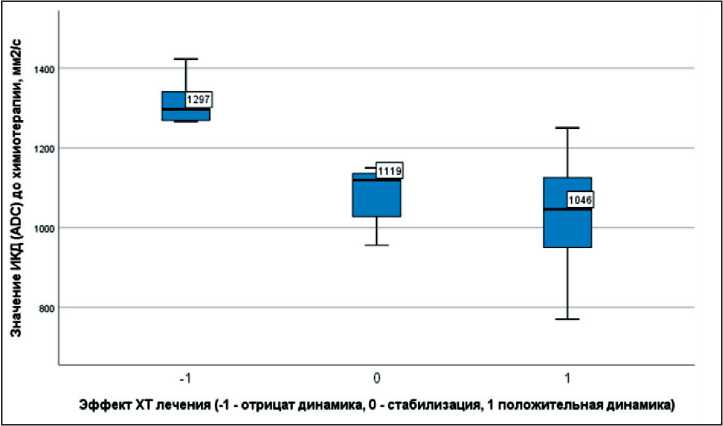
Рис. 6. Исходное значение измеряемого коэффициента диффузии до химиотерапии в группах с разным эффектом лечения, мм2/с.
Примечание: -1 – прогрессирование опухоли;
0 – стабилизация; 1 – регрессия
Fig. 6. The initial value of the measured diffusion coefficient before chemotherapy in groups with different treatment effects, mm2/s.
Note: -1 – disease progression tumor, 0 – stable disease, 1 – regression tumor
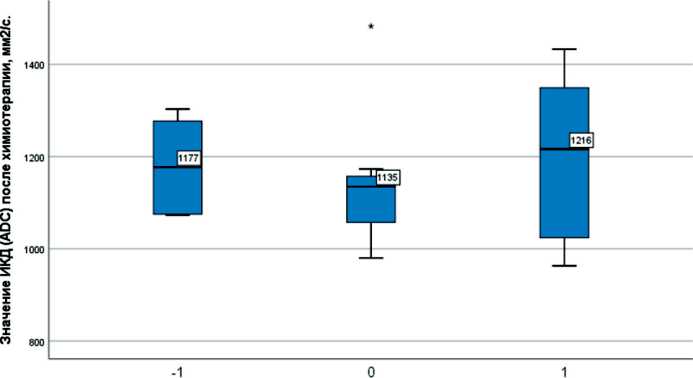
Эффект XT лечения (-1 - отрицат динамика, 0 - стабилизация, 1 положительная динамика)
Рис. 7. Значение ИКД после химиотерапии, мм2/с. Примечание: -1 – прогрессирование опухоли; 0 – стабилизация; 1 – регрессия
Fig. 7. The value of the measured diffusion coefficient after chemotherapy, mm2/s.
Note: -1 – disease progression tumor, 0 – stable disease, 1 – regression tumor
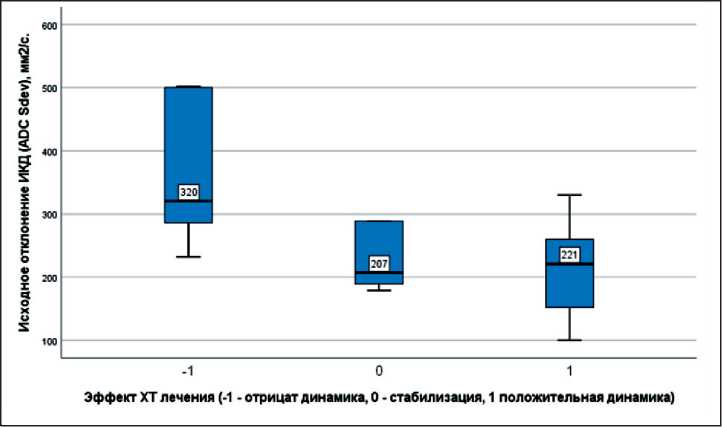
Рис. 8. Степень неоднородности структуры опухоли по данным стандартного отклонения ИКД до химиотерапии в зависимости от эффекта лечения, мм2/с.
Примечание: -1 – прогрессирование опухоли;
0 – стабилизация; 1 – регрессия
Fig. 8. The degree of heterogeneity of the tumor structure according to the standard deviation of the АDС before chemotherapy depending of treatment effects, mm2/s.
Note: -1 – disease progression tumor, 0 – stable disease, 1 – regression tumor
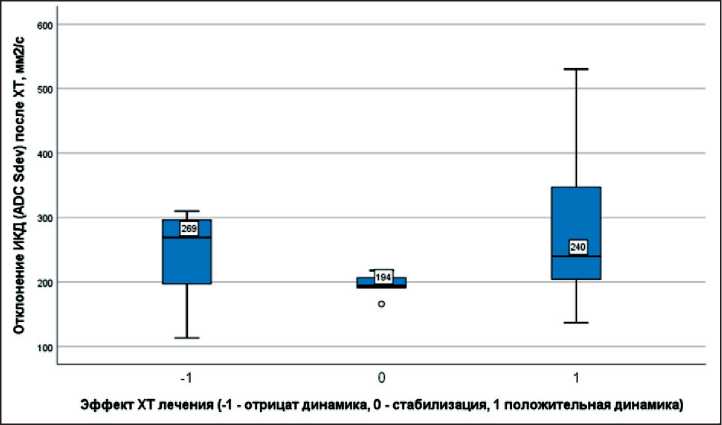
Рис. 9. Степень неоднородности структуры опухоли по данным стандартного отклонения ИКД после химиотерапии, мм2/с.
Примечание: -1 – прогрессирование опухоли;
0 – стабилизация; 1 – регрессия
Fig. 9. The degree of heterogeneity of the tumor structure according to the standard deviation of the АDС after chemotherapy, mm2/s.
Note: -1 – disease progression tumor, 0 – stable disease, 1 – regression tumor
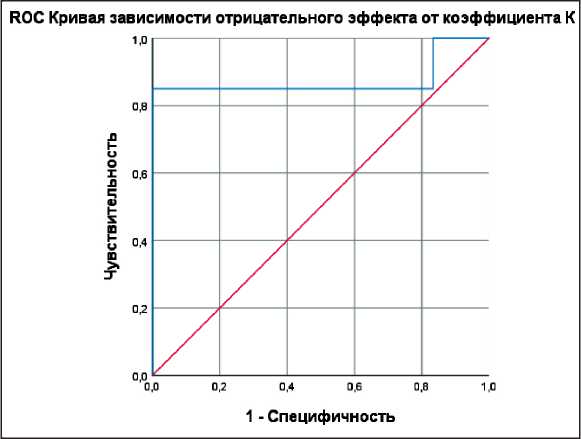
Рис. 10. RОС-кривая зависимости отрицательного эффекта лечения от коэффициента К
Fig. 10. RОС-curve of dependence of the negative effect of treatment on the coefficient С
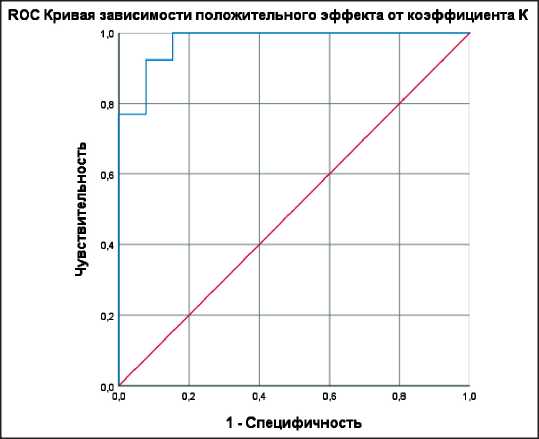
Рис. 11. RОС-кривая зависимости положительного эффекта лечения от коэффициента К
Fig. 11. RОС-curve of dependence of the positive effect of treatment on the coefficient С
сокими значениями (медиана – 1297 мм2/с, невысокая целлюлярность) и более выраженной неоднородностью структуры (стандартное отклонение – 320 мм2/с); при стабилизации (n=7) и регрессии опухоли (n=13) – относительно низкими значениями (медиана – 1119 и 1046 мм2/с, невысокая целлюлярность) и менее выраженной неоднородностью структуры (стандартное отклонение – 207 и 221 мм2/с). При оценке после химиотерапии отмечались снижение ИКД у больных с прогрессированием и повышение ИКД у пациентов со стабилизацией и регрессией опухоли (рис. 7). При этом по значениям стандартного отклонения ИКД во всем объеме опухолевого узла отмечались снижение неоднородности структуры при прогрессировании РМП и более высокий разброс значений неоднородности при регрессии опухоли (рис. 8, 9). Данные показатели, вероятно, характеризуют разный эффект терапии на уровне структурных изменений опухолевой ткани.
Несмотря на вариативность форм опухолевых узлов (преимущественно, варианты овоидных/ уплощенных), во всех случаях есть возможность оценить три определяющих размера – максимальную высоту внутрипузырного компонента, максимальные поперечные размеры и размер основания узла по внутреннему контуру, соединяющего края интактных частей стенки мочевого пузыря. Уже сами по себе данные измерения могут быть информативными в отношении характера роста опухоли и степени инфильтрации мышечной стенки, особенно если имеют подтверждение на диффузионно-взвешенных изображениях [7]. Предлагаемый интегральный коэффициент прогноза эффективности (К) может, по сути, характеризовать степень инфильтрации стенки при большинстве вариантов форм узлов и в сочетании с ИКД косвенно позволяет судить о степени гистологической дифференцировки опухоли [8, 9].
Для анализа прогноза эффективности химиотерапии проведена оценка диагностической значимости коэффициента К методом ROC-кривых, с определением оптимального разделяющего значения, позволяющего классифицировать пациентов по степени риска неэффективности химиотерапии (рис. 10), а также предполагать благоприятный эффект лечения (рис. 11). Площадь под ROC-кривой, соответствующей взаимосвязи прогноза отрицательного эффекта химиотерапии и коэффициента К, составила 0,875 ± 0,071 с 95 % ДИ: 0,735–1,000. Полученная модель была статистически значимой (p=0,006). Пороговое значение выбрано по максимальной сумме чувствительности и специфичности, в точке cut-off (точке отсечения) коэффициент К составил 0,51 (K=0,51). При К<0,51 прогнозировался высокий риск неэффективности химиотерапии. Чувствительность и специфичность метода составили 85,0 и 83,3 %.
Площадь под ROC-кривой, соответствующей взаимосвязи прогноза положительного эффекта химиотерапии и коэффициента К, составила
0,976 ± 0,024 с 95 % ДИ: 0,929–1,000 (специфичный вид ROC-кривой может быть связан с небольшой выборкой). Полученная модель была статистически значимой (p<0,001). Пороговое значение выбрано по максимальной сумме чувствительности и специфичности в точке cut-off (точке отсечения) ‒ 0,74. При К, равном или превышающем данное значение, прогнозировался положительный эффект лечения. Чувствительность и специфичность метода составили 92,3 и 92,4 % соответственно.
Если значение K менее 0,74, но больше либо равно 0,51, прогноз эффективности терапии неопределенный и более вероятна стабилизация опухоли в ответ на проводимую химиотерапию.
Клинический пример № 1
Больной Б., 65 лет, поступил с жалобами на боли в животе и кровь в моче. По данным цистоскопии (21.04.17): слева под устьем мочеточника определяется средневорсинчатая, контактно кровоточащая опухоль, диаметром до 25 мм, с очагами некроза. По данным МРТ (19.05.17): мочевой пузырь деформирован за счет мягкотканого новообразования, размерами 24×27 мм, исходящего из левой боковой стенки, в основании опухоль – до 25 мм (рис. 12). Опухоль инфильтрирует стенку мочевого пузыря, паравезикальную клетчатку и устье левого мочеточника. В паравезикальной клетчатке – единичные лимфоузлы, размером до 6 мм. При контрастном усилении опухоль интенсивно неравномерно накапливает контрастное вещество, в режиме DWI отмечается ограничение диффузии до 1074 мм2/с. По ходу наружных подвздошных сосудов слева – увеличенные лимфоузлы, размерами до 16 мм. Заключение: опухоль мочевого пузыря, с признаками инфильтрации паравези-кальной клетчатки и устья левого мочеточника,
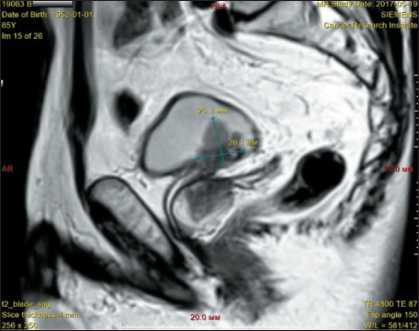
Рис. 12. Измерение опухоли с получением значений L=25 мм и x=26 мм
Fig. 12. Measurement of the tumor to obtain values L=25 mm and x=26 mm
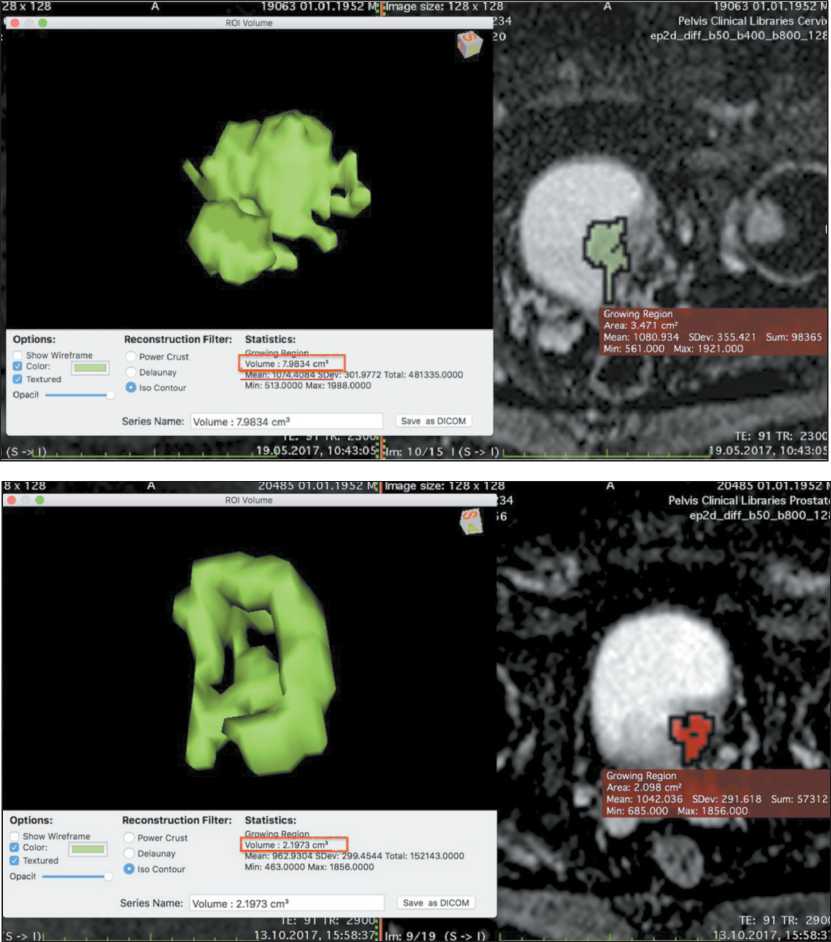
Рис. 13. Объемная сегментация, вычисление объема опухоли (7,98 мм3) и значения ИКД 1074 мм2/с до лечения
Fig. 13. Volumetric segmentation, calculation of tumor volume (7.98 mm3), and mean АDС of 1074 mm2/s before treatment
Рис. 14. Объемная сегментация, вычисление объема опухоли (2,19 мм3) после химиотерапии
Fig. 14. Volumetric segmentation, calculation of tumor volume (2.19 mm3) after chemotherapy паравезикальная и подвздошная лимфаденопатия. Проведены объемная сегментация и вычисление объема опухоли до лечения (рис. 13). Коэффициент К (25/26/1074×1000) составил 0,89.
По данным МРТ после двух курсов химиотерапии по схеме M-VAC: (13.10.17): мочевой пузырь деформирован за счет мягкотканого образования, исходящего из левой боковой стенки, размеры которого уменьшились до 13×19 мм, в большей степени за счет внутрипузырного компонента. Заключение: состояние после химиотерапии, опухоль мочевого пузыря с инвазией мышечного слоя, уменьшение размеров новообразования по сравнению с МРТ от 19.05.17. Проведены объемная сегментация образования и вычисление объема опухоли после лечения (рис. 14). Выполнено сравнение данных объема опухоли по МР-диффузии от 19.05.17 и 13.10.17. По объемной сегментации объем опухоли до и после лечения составил 7,98 и 2,19 мм3 соответственно. Объем опухоли после лечения уменьшился на 72,56 %, что, по критериям RECIST R1.1, соответствует частичной регрессии.
Клинический пример № 2
Больной Ш., 51 года, поступил с жалобами на боли в животе и кровь в моче. По данным цистоскопии (12.08.17): слева по боковой стен-
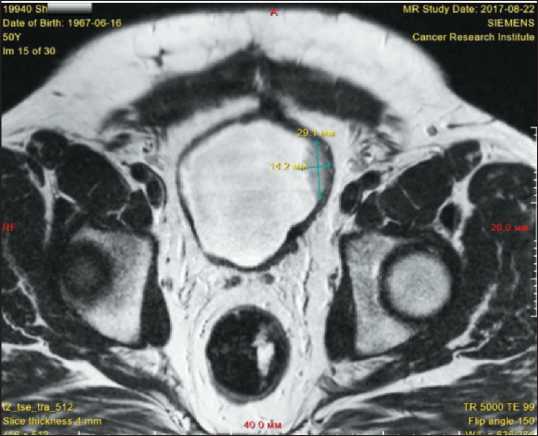
Рис. 15. Измерение опухоли с получением значений L=14 мм и x=29 мм
Fig. 15. Measurement of the tumor with the values L=14 mm, and x=29 mm
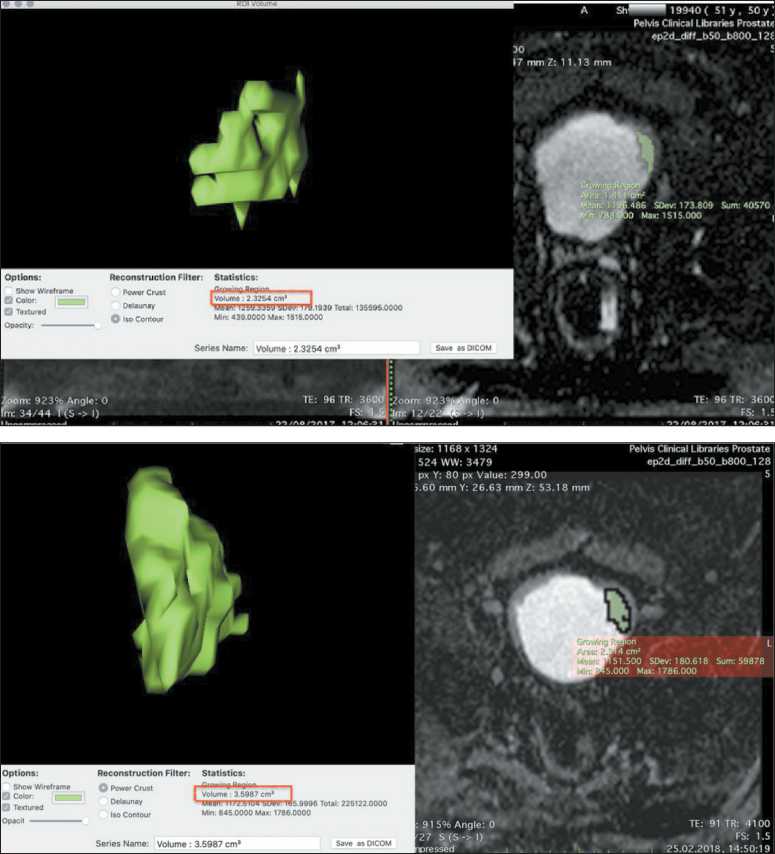
Рис. 16. Объемная сегментация, вычисление объема опухоли (2,32 мм3) и значения ИКД 1259 мм2/с до лечения
Fig. 16. Volumetric segmentation, calculation of tumor volume (2.32 mm3), and mean АDС of 1259 mm2/s before treatment
Рис. 17. Объемная сегментация, вычисление объема опухоли (3,59 мм3) после лечения
Fig7. Volumetric segmentation, calculation of tumor volume (3.59 mm3) after treatment ке определяется средневорсинчатая опухоль до 30 мм, с очагами некроза. По данным МРТ (22.08.17): мочевой пузырь деформирован за счет мягкотканого новообразования, исходящего из левой боковой стенки, размерами 14×32 мм, в основании опухоль – до 29 мм (рис. 15). Опухоль инфильтрирует стенку пузыря. При контрастном усилении опухоль интенсивно неравномерно накапливает контрастное вещество, в режиме DWI отмечается ограничение диффузии до 1259 мм2/с. По ходу наружных подвздошных сосудов слева увеличенные лимфоузлы, размерами до 13 мм в поперечнике. Заключение: опухоль мочевого пузыря, подвздошная лимфоаденопатия. Проведены объемная сегментация образования и вычисление объема опухоли до лечения (рис. 16). Коэффициент К (14/29/1259×1000) составил 0,38.
По данным МРТ после двух курсов химиотерапии по схеме M-VAC (25.02.18): мочевой пузырь деформирован за счет новообразования, с признаками инфильтрации мышечной стенки, размеры которого увеличились до 16×37 мм. Заключение: состояние после химиотерапии, опухоль мочевого пузыря, с инвазией мышечного слоя, с увеличением размеров по сравнению с МРТ от 22.08.17. Для оценки эффекта химиотерапии выполнено срав- нение данных МР-диффузии, полученных при МРТ от 22.08.17 и 25.02.18. По данным объемной сегментации образований их объем до и после лечения составил 2,32 и 3,59 мм (рис. 17) соответственно. Объем опухоли после лечения увеличился на 54,74 %, что по критериям RECIST R1.1 соответствует прогрессированию.
Обсуждение
На данный момент в литературе представлено достаточно большое количество рекомендаций по использованию диагностических методов в прогнозировании и оценке результатов химиотерапии у больных РМП. Известен способ оценки эффективности неоадъювантной химиотерапии по данным МРТ с измерением ИКД выявленных образований до и после лечения [10]. Описывается подобный способ прогнозирования пролиферативного и инвазивного потенциала опухоли по данным измеряемого коэффициента диффузии в опухоли [11]. Недостатками указанных методов являются низкая точность и информативность вследствие выбора зон интереса (ROI) в ткани опухоли лишь на одном из срезов, что может приводить к погрешности измерения.
Кроме того, при опухолевом поражении Та-Т1-Т2а стадий как при цистоскопии, так и по данным лучевых методов визуализируемое образование часто представлено не только опухолевой тканью. Наиболее часто имеет место так называемый «стебель» папиллярной опухоли, представленный сосудистым матриксом и состоящий из подслизистой оболочки, иногда с явлениями отека и фиброза, но без опухолевых клеток. Прилежащие сгустки крови также ограничивают возможности визуализации. Размеры и визуальные характеристики опухоли не имеют четкой корреляции со степенью патоморфоза и изменением ее структуры и, соответственно, не могут быть достоверным критерием эффективности химиотерапии. На данный момент эффект лечения оценивается по международной классификации RECIST R1.1, основанной, прежде всего, на изменении линейных размеров опухоли и их сравнении до и после терапии [12]. Однако только размерные характеристики опухоли не дают полной информации о патофизиологических процессах (изменение интенсивности метаболизма, фиброз, некроз, целлюлярность), в связи с чем проявления патоморфоза могут остаться вне границ полученной информации. С этой точки зрения совокупный анализ ДВИ в динамике обладает явным преимуществом.
Список литературы Возможности объемной сегментации опухоли по данным диффузионно-взвешенной МРТ в прогнозировании и оценке эффективности химиотерапии при раке мочевого пузыря
- Kaprin A.D., Starinskii V.V., Petrovoi G.V. Zlokachestvennye novoobrazovaniya v Rossii v 2018 godu (zabolevaemost' i smertnost'). M., 2019. 250 s.
- Babjuk M., Burger M., Comperat E., Gontero P., Mostafid A., Palou J. EAU Guidelines. Edn. presented at the EAU Annual Congress Amsterdam, 2020.
- Down C.J., Nair R., Thurairaja R. Bladder cancer. Surgery (Oxford). 2016; 34(10): 532-9. https://doi.org/10.1016/j.mpsur.2016.08.001.
- Grigor'ev E.G., Frolova I.G., Usynin E.A., Velichko S.A., Okunev V.V., Gol'dberg A.V. Rak mochevogo puzyrya: vozmozhnosti vysokopol'noi magnitno-rezonansnoi tomografii (obzor literatury). Sibirskii onkologicheskii zhurnal. 2014; (3): 65-71.
- Bostrom P.J., van Rhijn B.W., Fleshner N., Finelli A., Jewett M., Thoms J., Hanna S., Kuk C., Zlotta A.R. Staging and staging errors in bladder cancer. Eur Urol Suppl. 2010; 9(1): 2-9. https://doi.org/10.1016/j.eursup.2010.01.005.
- Frolova I.G., Grigor'ev E.G., Velichko SA., Usova A.V., Trukhacheva N.G. Diffuzionno-vzveshennaya magnitno-rezonansnaya tomografiya v diagnostike i stadirovanii raka mochevogo puzyrya. Vestnik rentgenologii i radiologii. 2019; 100(6): 379-86. https://doi.org/10.20862/0042-4676-2019-100-6-379-386.
- Panebianco V., Pecoraro M., Del Giudice F., Takeuchi M., Muglia V.F., Messina E., Cipollari S., Giannarini G., Catalano C., Narumi Y. VI-RADS for Bladder Cancer: Current Applications and Future Developments. J Magn Reson Imaging. 2022; 55(1): 23-36. https://doi.org/10.1002/jmri.27361.
- Harri P.A., Alexander L., Camacho J.C., Moreno C.C., Mittal P. Magnetic Resonance Imaging Evaluation of Urothelial Cell Carcinoma: Histopathological Correlation, Staging, and Treatment Planning. Curr Prob Diagn Radiol. 2018; 47(1): 28-41. https://doi.org/10.1067/j.cpradiol.2017.04.009.
- Barsoum N., Talaat M., Saraya S. Can diffusion-weighted MRI predict the histological grade of urinary bladder carcinoma? Kasr Al Ainy Medical Journal. 2017; 23(2): 86-95. https://doi.org/10.4103/kamj.kamj_53_16.
- Yoshida S., Koga F., Kobayashi S., Ishii C., Tanaka H., Tanaka H., Komai Yo., Saito K., Masuda H., Ya. Fujii, Kawakami S., Kihara K. Role of diffusion-weighted magnetic resonance imaging in predicting sensitivity to chemoradiotherapy in muscle-invasive bladder cancer. Int J Radiat Oncol Biol Phys. 2012; 83(1): 21-7. https://doi.org/10.1016/j.ijrobp.2011.11.065.
- Kobayashi S., Koga F., Kajino K., Yoshita S., Ishii C., Tanaka H., Saito K., Masuda H., Fujii Y., Yamada T., Kihara K. Apparent diffusion coefficient value reflects invasive and proliferative potential of bladder cancer. J Magn Reson Imaging. 2014; 39(1): 172-8. https://doi.org/10.1002/jmri.24148.
- van Persijn, van Meerten E.L., Gelderblom H., Bloem J.L. RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 2010; 20(6): 1456-67. https://doi.org/10.1007/s00330-009-1685-y.


