Возможности перехода стратегии от глюкозоцентричности к органопротекции при назначении антидиабетических препаратов у пациенток с сахарным диабетом 2-го типа в перименопаузе
Автор: Смирнов В.В., Семенова Ю.Б., Шаповалова А.Б., Матвеева Н.Н., Зубарев В.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 5 т.13, 2023 года.
Бесплатный доступ
Актуальность. Ожирение, сахарный диабет 2-го типа и ассоциированные с этими состояниями сердечно-сосудистые заболевания остаются одной из крупнейших всемирных проблем здравоохранения. По статистическим данным не менее 90 % пациентов с сахарным диабетом 2-го типа имеют ожирение или как минимум лишний вес (ИМТ > 25). Очень часто причиной летального исхода у этой когорты пациентов является развитие сердечно-сосудистой катастрофы. В настоящее время происходит постепенный отказ от исключительно глюкозоцентрической концепции терапии сахарного диабета 2-го типа в пользу органопротективной. В данной статье мы рассмотрели возможность применения различных групп инкретиномиметиков (ингибиторов ДПП-4 и агонистов ГПП-1) в первичной профилактике сердечно-сосудистых заболеваний у пациенток с сахарным диабетом 2-го типа в перименопаузе и сравнение их действия с традиционной терапией метформином.Цель исследования: оценить влияние неинсулиновых противодиабетических препаратов из класса инкретиномиметиков на факторы риска развития сердечно-сосудистых заболеваний у пациенток с сахарным диабетом 2-го типа в перименопаузе.Объект и методы. Проведено динамическое обследование трёх групп пациенток. Первая группа (n = 22) получала терапию агонистом ГПП-1 семаглутидом, вторая группа (n = 30) - терапию метформином и третья (n = 19) - ингибитором ДПП-4 линаглиптином. Всем пациенткам помимо общеклинического обследования, оценки динамики снижения массы тела и уровня инсулинорезистентности проводилось динамическое исследование уровней триглицеридов, холестерина липопротеидов низкой плотности, а также маркеров общего воспаления - С-реактивного белка и интерлейкина-6.Результаты. Результаты исследования показали, что семаглутид и метформин одинаково эффективно снижали массу тела, но метформин и линаглиптин существенно не влияли на уровень атерогенных фракций липидограммы в отличие от семаглутида. Тем не менее, и семаглутид, и линаглиптин, и метформин снижали уровень маркеров общего воспаления.Выводы. Результаты исследования позволяют разглядеть определённый кардиопротективный потенциал не только у агонистов ГПП-1, но и у представителей класса ингибиторы ДПП-4, что требует проведения дальнейших исследований.
Сахарный диабет 2-го типа, ожирение, менопауза, инкретины, агпп-1, идпп-4, инсулинорезистентность, триглицериды, лпнп, сердечно-сосудистые факторы риска
Короткий адрес: https://sciup.org/143181087
IDR: 143181087 | УДК: 616.379-008.64 | DOI: 10.20340/vmi-rvz.2023.5.CLIN.5
Текст научной статьи Возможности перехода стратегии от глюкозоцентричности к органопротекции при назначении антидиабетических препаратов у пациенток с сахарным диабетом 2-го типа в перименопаузе
Сахарный диабет (СД) 2-го типа остаётся одной из крупнейших всемирных проблем как эндокринологии, так и кардиологии. Эта болезнь становится лишь тяжелее, моложе и активно распространяется по всему миру. Около 90 % людей с сахарным диабетом 2-го типа имеют ожирение или как минимум избыточную массу тела (ИМТ > 25), а ассоциированные сердечно-сосудистые заболевания (ССЗ) остаются основной причиной смертности данных пациентов [1–3]. В патогенезе метаболического синдрома и ассоциированного с ним ожирения, а также нарушений углеводного обмена значительную роль может играть хроническое системное воспаление и оксидативный стресс, опосредуемый патофизиологическими механизмами, ведущими к развитию инсулино- и лептинорезистентности. Многочисленные исследования последних лет, посвящённые изучению метаболического менопаузального синдрома у женщин, показывают значительное снижение уровня адипонектина, который обладает противовоспалительными свойствами и достоверное, коррелирующее со степенью инсулинорезистентности, повышение уровня адипокинов, которое, в свою очередь, приводит к выраженному повышению уровня провоспалительных цитокинов, таких как интерлейкин-6 (ИЛ-6), фактор некроза опухолей (TNF-а), интерлейкин-1 (ИЛ-1), интерферон-Y и т.д.
[2, 4]. Моноциты и другие лейкоциты, а также тканевые макрофаги в ответ на повышение уровней гликемии и липидов активируют синтез провоспалительных цитокинов [5]. Стоит отметить и изменения в лептин-грелиновой системе, повышенный уровень лептина, наблюдаемый при метаболическом синдроме, также вносит значительный вклад в изменение активности иммунной системы. Лептин является одним из адипокинов, секретируемых преимущественно подкожной жировой тканью. Обладая множеством функций, лептин, в том числе, увеличивает продукцию провоспалительных цитокинов (TNF-α, ИЛ-6, ИЛ-1, ИЛ-8) [6]. Многочисленные исследования последнего времени показали, что лечение cахарного диабета 2-го типа требует изменения стратегии – отказа от глюкозоцентричной концепции в пользу органопротективного подхода. В последние годы появились новые группы препаратов, такие как ингибиторы натрий зависимого ко-транспортера 2-го типа (иНГЛТ-2), инкретиномиметики, в первую очередь агонисты ГПП-1 (аГПП-1), предоставляющие возможность улучшения сердечно-сосудистых исходов у пациентов, что стало основанием к разработке принципиально новых подходов к терапии СД 2-го типа [7–11]. Неслучайно современные рекомендации АDA и EASD по лечению сахарного диабета 2-го типа предполагают обязательное назначение препаратов из групп аГПП-1 или иНГЛТ-2 в составе терапии у пациентов с очень высоким сосудистым риском, независимо от исходного уровня гликозилированного гемоглобина и индивидуальных целевых показателей гликемического контроля [1, 12, 13].
Традиционные представления о терапии сахарного диабета на фоне ожирения в контексте гиперинсулинемии и инсулинорезистентности подразумевали терапию метформином в качестве первой линии рекомендаций, что находило подтверждение в алгоритмах по терапии сахарного диабета 2-го типа, где метформин указывался как безусловный препарат выбора до 2018 года. Стоит заметить, что в отношении пациенток среднего возраста с высокой физической активностью метформин на фоне значительных физических нагрузок, таких как занятия спортом даже в рамках обычных фитнесс программ, способен индуцировать повышение уровня лактата, а также в ряде случаев способствовать развитию остеопении, в особенности это актуально для пациенток в перименопаузе [14]. Кроме того, необходимо учитывать тот факт, что не менее 15 % пациентов, которым показана такая терапия, являются «плохими респондентами» бигуанидов в силу достаточно выраженных диспепcических расстройств. Стоит отметить также и относительно невысокие возможности препарата в снижении уровня гликозилированного гемоглобина. Безусловными преимуществами метформина являются невысокая стоимость лечения, существенные возможности в коррекции веса и доказанное снижение онкологического риска в первую очередь в отношении рака эндометрия и колоректального рака [1, 2, 14].
Исследования последних лет показали, что альтернативой здесь могут являться другие препараты – инкрети-номиметики (ингибиторы ДПП-4 (иДПП-4) и аГПП-1). Кар-диопротективные возможности аГПП-1 заключаются в усилении экспрессии фосфорилированной протеинки-назы В в миокарде и снижении активности каспазы 3 типа. Активация рецепторов глюкагоноподобного пептида-1 (ГПП-1) приводит к релаксации гладкомышечного слоя артерий и вазодилатации, повышает активность антиоксидантных ферментов и систем в клетках сосудистой стенки и почках, тормозит образование свободных кислородных радикалов, что, в свою очередь, приводит к торможению окислительного стресса и увеличению поглощения глюкозы миокардом [9, 15]. Кроме того, гипотензивное действие ГПП-1 частично осуществляется за счёт стимуляции секреции предсердного натрийуретического пептида (NaPro-BNP), что приводит к увеличению натрийуреза и, таким образом, снижению объёма циркулирующей крови (ОЦК) [12, 16]. Взаимодействие ГПП-1 и активации эндотелиальной NO-синтетазы также играет важное значение для регуляции активации и агрегации тромбоцитов, в которых происходит снижение продукции тромбоксана А2, таким образом предотвращая развитие гиперкоагуляции [12].
Что касается непосредственно панкреатических эффектов ГПП-1, то в альфа-клетках поджелудочной железы снижается продукция глюкагона и, в результате, подавляется глюконеогенез и гликогенолиз в печени, что также способствует снижению уровня гиперинсулинемии.
Итогом является снижение инсулинорезистентности и значительное снижение массы тела [17, 18].
Исследование SCALE и ряд других исследований продемонстрировали, что ГПП-1 подавляет локальное воспаление в кишечнике, воздействуя на рецепторы в кишечных интраэпителиальных лимфоцитах, уменьшает воспаление в других периферических органах за счёт снижения массы тела, снижения гликемии, действуя на рецепторы ГПП-1. ГПП-1 уменьшает продукцию противовоспалительных цитокинов мононуклеарами периферической крови, TNF-а, ИЛ-6, ингибитора активатора плазминогена-1, внутриклеточной молекулы адгезии и т.д., что сопровождается снижением уровня С-реактивного белка (СРБ), фибриногена и других маркеров воспаления [1, 16, 19]. Справедливости ради стоит заметить, что вышеуказанные кардиопротективные эффекты по данным международных исследований доказаны для более современных представителей класса аГПП-1, таких как лираглутид, семагутид и дулагутид. Более «древние» представители, такие как лик-сенатид и эксенатид, не доказали значительного влияния на снижение сердечно-сосудистого риска, но, по крайней мере, продемонстрировали свою «кардиобезопасность» [19– 21]. Существенными недостатками аГПП-1 является высокая стоимость лечения и побочные эффекты в виде замедления моторики кишечника с наклонностью к формированию констипаций, риск развития холестаза и пан-креонекроза. Некоторые исследования также показали повышение вероятности развития спорадического медуллярного рака щитовидной железы. Что касается иДПП-4, то на сегодняшний день, по данным международных исследований, пока не существует доказательной базы в отношении кардиопротективного эффекта у этой группы препаратов [6, 19, 22]. Разница в механизме действия между иДПП-4 и аГПП-1 заключается в том, что иДПП-4 замедляют деградацию собственного ГПП-1, а прямые аГПП-1 обладают непосредственно стимулирующим действием на рецепторы. Тем не менее, несмотря на кажущуюся общность механизмов действия, существует множество международных рандомизированных исследований, таких, например, как SUSTAIN 1-7, PIONER, LEADER, SCALE, REWAIND и т.д., которые показали свою эффективность во вторичной и первичной профилактике неблагоприятных сердечно-сосудистых исходов [12, 13, 16]. Ещё раз напомним, что современные рекомендации АDA и EASD по лечению сахарного диабета 2-го типа предполагают обязательное назначение препаратов из групп аГПП-1 или иНГЛТ-2 в составе терапии у пациентов с очень высоким сосудистым риском, независимо от исходного уровня гликозилированного гемоглобина и индивидуальных целевых показателей гликемического контроля [18, 23, 24].
Тем не менее, рассматривая механизм действия иДПП-4, можно предположить определённые кардиопро-тективные возможности у этой группы с учётом общности механизмов действия с аГПП-1. Кроме того, в экономическом аспекте у иДПП-4 значительно ниже стоимость лечения, и можно отметить практически полное отсутствие побочных эффектов за исключением гипомоторной дискинезии кишечника, что позволяет рассматривать в том числе и эту группу препаратов в качестве перспективной терапии первой линии сахарного диабета 2-го типа у достаточно широкой группы пациентов.
Цель исследования: оценить эффективность современных инкретиновых препаратов иДПП-4, аГПП-1, их воздействие на инсулинорезистентность и сердечно-сосудистые факторы риска в сравнении с традиционной терапией метформином, проанализировать возможность их применения в первичной профилактике ССЗ при сахарном диабете 2-го типа.
Объект и методы
В течение 3–6 месяцев в динамике обследованы три группы пациентов женского пола в перименопаузе, имеющих избыточную массу тела или ожирение 1 ст. (ИМТ 25–35) в возрасте от 45 до 60 лет с впервые выявленным сахарным диабетом 2-го типа, не имеющих манифестных сердечнососудистых атеросклерозассоциированных заболеваний или риска тяжёлой гипогликемии (целевой показатель гликемического контроля Hba1C < 7,0 %). Оценивались следующие показатели: С-пептид, уровни базального инсулина, холестерина липопротеидов низкой плотности, триглицеридов, динамика изменения ИМТ, индекса инсулино-резистентности HOMA-IR. Исследование проходило на базе клиники МЭДИС. За время проведения исследования все пациентки в обследуемых группах достигли целевых значений Hba1С %.
Первую группу (n = 22) составили пациентки, получающие терапию семаглутидом в дозе 14 мг/cутки; вторую группу (n = 30) – пациентки, получающие терапию метформином 3000 мг/сутки; третью группу (n = 19) составили пациентки, получающие терапию линаглиптином в дозе 5 мг/сутки.
Результаты
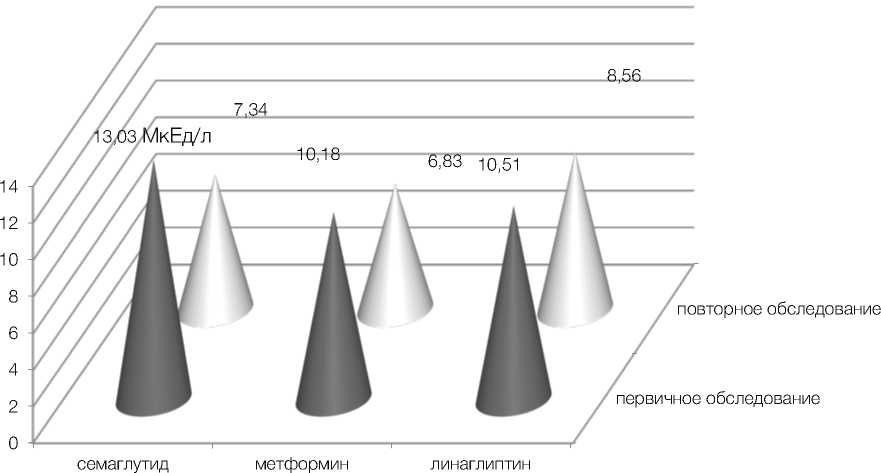
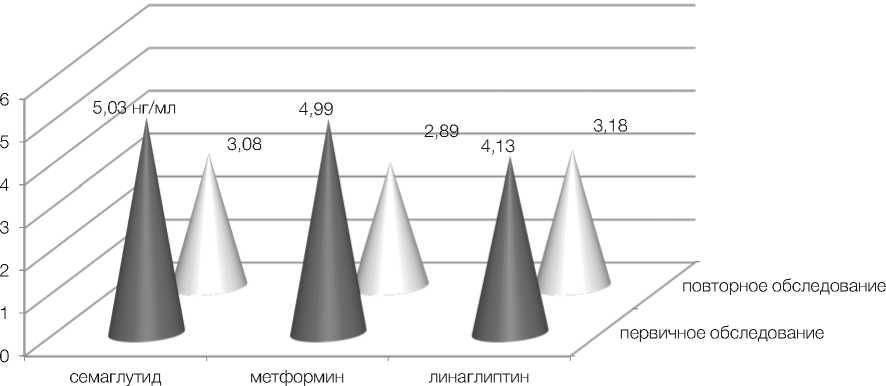
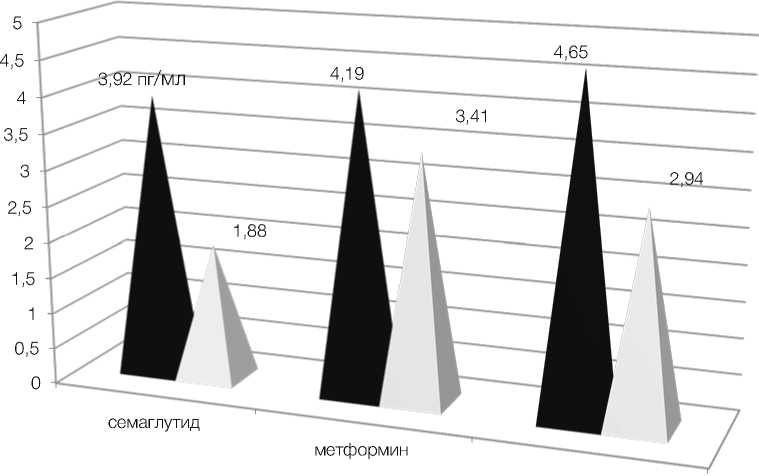
По результатам исследования у пациенток, получавших терапию семаглутидом, произошло значительное снижение уровней базального инсулина и С-пептида – с 13,03 ± 1,4 мкЕД/мл и 5,03 ± 0,4 нг/мл до 7,34 ± 0,6 мкЕД/мл и 3,82 ± 0,4 нг/мл соответственно (p < 0,01) (рис. 1, 2). Отмечено выраженное снижение уровней потенциально атерогенных фракций липидограммы, холестерина липопротеидов низкой плотности и триглицеридов – с 5,08 ± 0,4 ммоль/л и 3,91 ± 0,4 ммоль/л до 2,82 ± 0,4 ммоль/л и 1,88 ± 0,1 ммоль/л соответственно (p < 0,01) (рис. 3). Семаглутид показал выраженное влияние на снижение индексов массы тела и инсулинорезистентности HOMA-IR с 32,28 ± 0,4 и 4,58 ± 0,4 до 26,48 ± 0,2 и 1,63 ± 0,2 соответственно (p < 0,01) (рис. 4).
Во второй группе у пациенток, получавших терапию метформином в максимально допустимой дозе, произошло не менее значимое снижение уровней инсулина и С-пептида – с 10,18 ± 0,6 мкЕД/мл и 4,99 ± 0,5 нг/мл до 6,83 ± 1,0 мкЕД/мл и 2,89 ± 0,4 нг/мл соответственно (p < 0,01) (рис. 1, 2). Также продемонстрирована эффективность в снижении массы тела и инсулинорезистентно-сти – существенно снизились средние показатели ИМТ и НОМА-IR с 33,23 ± 0,4 и 4,11 ± 0,3 до 25,14 ± 0,4 и 2,01 ± 0,2 соответственно (p < 0,01) (рис. 4). Что же касается влияния на липидный обмен, то метформин продемонстрировал низкую эффективность. Уровни холестерина липопротеидов низкой плотности и триглицеридов изменились несущественно – с 4,78 ± 0,3 ммоль/л и 3,97 ± 0,4 ммоль/л до 4,04 ± 0,3 ммоль/л и 3,22 ± 0,3 ммоль/л соответственно (p > 0,05) (рис. 3).
В третьей группе пациенток на фоне терапии линаглип-тином средние уровни инсулина и С-пептида также достоверно понизились с 10,51 ± 0,5 мкЕД/ мл и 4,13 ± 0,5 нг/мл до 8,56 ± 0,6 мкЕД/мл и 3,17 ± 0,4 нг/мл соответственно (p < 0,05) (рис. 1, 2). Также произошло достоверное снижение индекса HOMA-IR с 4,24 ± 0,6 до 1,9 ± 0,3. Средний же показатель ИМТ достоверно не изменился, хотя и показал тенденцию к снижению с 30,53 ± 0,9 до 28,39 ± 0,6 (p > 0,05) (рис. 4). Что касается влияния на липидный обмен, оно оказалось незначительным, уровни холестерина ЛПНП изначально 4,28 ± 0,2 и повторно 3,86 ± 0,2, триглицеридов – 2,7 ± 0,4 и 2,32 ± 0,2 соответственно (p > 0,05) (рис. 3).
Во второй части нашего исследования мы определяли в динамике уровни ИЛ-6 и СРБ с целью оценки влияние терапии инкретинами в сравнении с метформином на продукцию медиаторов системного воспаления.
В первой группе уровни СРБ и ИЛ-6 при первичном обследовании составили 4,48 ± 0,3 мг/л и 3,91 ± 0,3 пг/мл, при повторном исследовании – 3,15 ± 0,2 мг/л и 1,88 ± 0,1 пг/мл соответственно (p < 0,01). Таким образом, при проведении терапии семаглутидом отмечается наиболее выраженное достоверное снижение уровня маркеров системного воспаления (рис. 5, 6).
Во второй группе отмечено менее значимое, но тоже достоверное снижение концентрации СРБ и ИЛ-6 с 5,45 ± 0,4 мг/л и 4,19 ± 0,4 пг/мл до 35 ± 0,3 мг/л и 3,41 ± 0,2 пг/мл соответственно (p < 0,05) (рис. 5, 6).
У пациенток третьей группы мы также видим эффект от терапии в плане снижения маркеров воспаления несколько уступающий семаглутиду, но превосходящий эффект метформина, снижение уровня СРБ составило с 5,52 ± 0,4 до 4,14 ± 0,2 (p < 0,03), ИЛ-6 с 4,65 ± 0,4 до 2,94 ± 0,2 (p < 0,02) (рис. 5, 6).
первичное обследование повторное обследование
Рисунок 1. Снижение уровня базального инсулина в динамике у пациенток обследуемых групп (р < 0,01)
Figure 1. Decrease in basal insulin levels in dynamics in patients of the examined groups (p < 0.01)
первичное обследование
повторное обследование
Рисунок 2. Снижение уровня С-пептида у пациенток обследуемых групп (р < 0,01–0,5)
Figure 2. Decrease in the level of C-peptide in patients of the examined groups (p < 0.01–0.5)
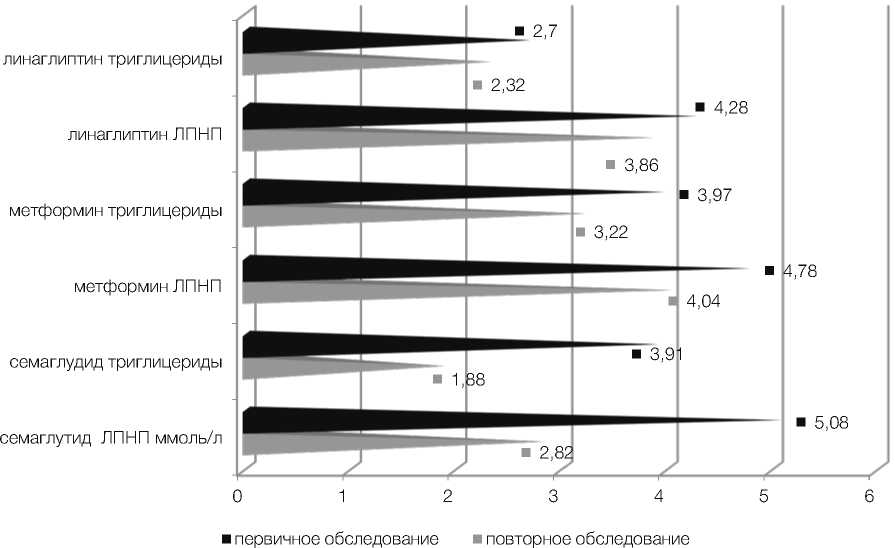
Рисунок 3. Динамика снижения уровней холестерина ЛПНП и триглицеридов на фоне терапии семаглутидом, метформином и линаглиптином у пациенток обследуемых групп
Figure 3. Dynamics of lowering LDL cholesterol and triglycerides levels duringtherapy with liraglutide, metformin and linagliptin in patients of the examined groups
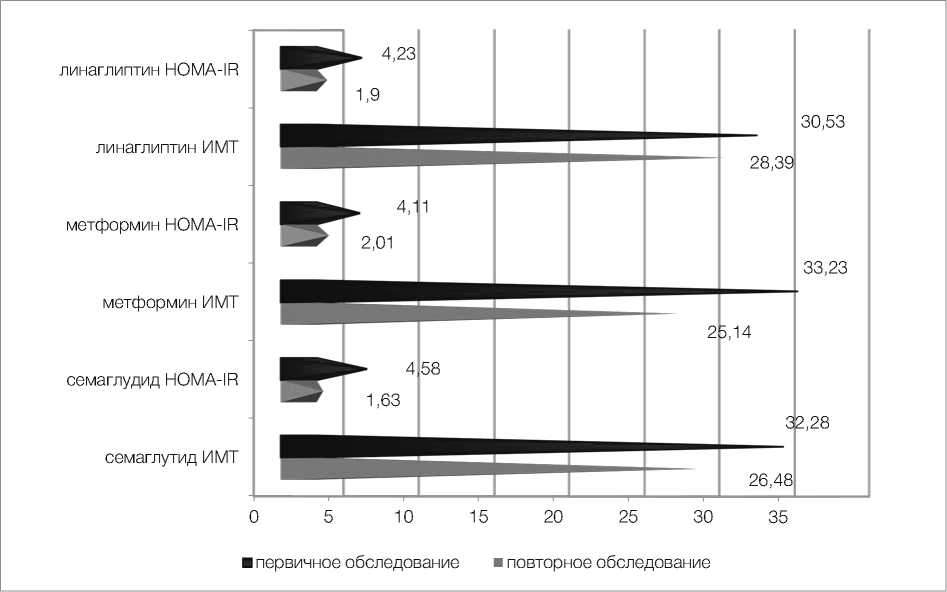
Рисунок 4. Динамика снижения индексов массы тела и инсулинорезистентности HOMA-IR на фоне терапии семаглутидом, метформином и линаглиптином
Figure 4. Dynamics of decrease in body mass indices and insulin resistance of HOMA-IR against the background of therapy with liraglutide, metformin and linagliptin
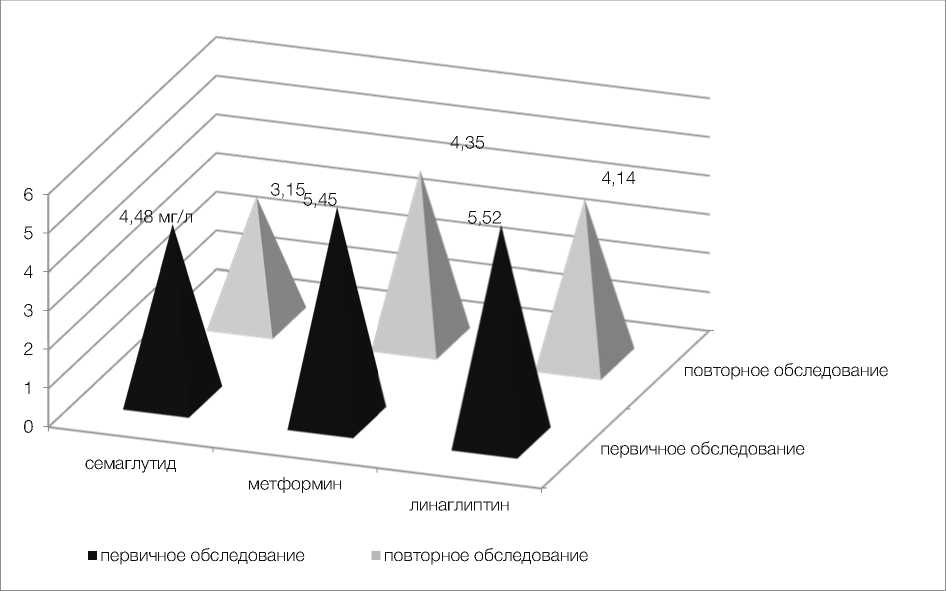
Рисунок 5. Снижение уровней СРБ в динамике в обследуемых группах
Figure 5. Decrease in CRP levels in dynamics in the surveyed groups
линаглиптин
первичное обследование повторное обследование
Рисунок 6. Динамика снижения уровня ИЛ-6 у пациенток обследуемых групп
Figure 6. Dynamics of IL-6 level decrease in patients of the examined groups
Выводы
Семаглутид ожидаемо показал максимальную эффективность в снижении массы тела, инсулинорезистент-ности, уровня атерогенных фракций липидограммы. Исследование подтвердило возможности класса аГПП-1 в первичной профилактике атеросклерозассоциированных сердечно-сосудистых заболеваний.
Метформин показал сопоставимую эффективность в снижении массы тела, что позволяет по-прежнему рассматривать его, наряду с семаглутидом, как эффективное и надёжное средство для снижения массы тела, но при этом метформин, в отличие от семаглутида, не влияет на снижение уровня атерогенных липидов. Тем не менее, за счёт снижения инсулинорезистентности отмечается снижение маркеров системного воспаления, что позволяет рассматривать терапию метформином, по крайней мере, как коррекцию модифицируемых факторов сердечно-сосудистого риска.
Линаглиптин показал не меньшую эффективность в снижении уровня гликемии, чем семаглутид и метформин, но практически не влиял на снижение массы тела и уровень атерогенных фракций липидограммы. Тем не менее, терапия линаглиптином приводила к значительному снижению индекса инсулинорезистентности HOMA-IR и уровней маркеров системного воспаления, более выраженному, чем у метформина, и лишь немного уступающему се-маглутиду. Проведённое исследование позволяет рассматривать определённый потенциал в снижении сердечно-сосудистого риска не только у аГПП-1, но и у иДПП-4 за счёт снижения оксидативного стресса.
Список литературы Возможности перехода стратегии от глюкозоцентричности к органопротекции при назначении антидиабетических препаратов у пациенток с сахарным диабетом 2-го типа в перименопаузе
- Муравицкая М.Н., Зуйкова А.А., Ханина Е.А., Добрынина И.С., Бакутина Ю.Ю. Анализ коморбидной патологии у больных сахарным диабетом 2 типа. Системный анализ и управление в биомедицинских системах. 2022;21(3):163-168. [Muravitskaya M.N., Zuikova A.A., Khanina E.A., Dobrynina I.S., Bakutina Analysis.comorbid. pathologies in patients with type 2 diabetes mellitus. System analysis and management in biomedical systems. 2022;21(3):163-168. (In Russ)].
- Пьяных О.П., Гусенбекова Д.Б., Аметов А.С., Преимущества долгосрочного управления метаболическим здоровьем и ранними нарушениями углеводного обмена. Эндокринология: новости, мнения, обучение. 2020;9(2):40-48. [Pyanykh O.P., Gusenbekova D.B., Ame-tov A.S., Advantages of long-term management of metabolic health and early disorders of carbohydrate metabolism. Endocrinology: news, opinions, training. 2020;9(2):40-48. (In Russ)].
- Chou C.Y., Chang Y.T., Yang J.Y., Lee., et al. Effect of long-term incretin-based therapies on ischemic heart diseases in patient with type 2 diabetes mellitus: a network meta-analysis. Sci. Rep. 2017;7(1): 15795
- Прохорова Я.Д., Демидова Т.Ю., Грицкевич Е.Ю. Депрескрайбинг противодиабетических препаратов у лиц среднего и пожилого возраста. Эндокринология: новости, мнения, обучение. 2021; 10(3): 108-110. [Prokhorova Ya.D., Demidova T.Yu., Gritskevich E.Yu. Deprescribing of antidiabetic drugs in middle-aged and elderly people. Endocrinology: news, opinions, training. 2021;10(3):108-110. (In Russ)].
- Бабенко А.Ю., Федоров А.В., Матвеев Г.А., Алексеенко Т.И. Взаимосвязь экспрессии генов в жировой ткани с уровнем в циркуляции адипокинов, инкретинов и некоторых биомаркеров при ожирении. Журнал эволюционной биохимии и физиологии. 2020;56(7):535. [Babenko A.Yu., Fedorov A.V., Matveev G.A., Alekseenko T.I. The relationship of gene expression in adipose tissue with the level in the circulation of adipokines, incretins and some biomarkers in obesity. Journal of Evolutionary Biochemistry and Physiology. 2020;56(7):535. (In Russ)].
- Демидова Т.Ю., Плахотняя В.М. Предиабет, новая парадигма ранней профилактики сердечно-сосудистых заболеваний. Медицинский совет. 2021;14:124-132. [Demidova T.Yu., Plakhotnik V.M. Prediabetes, a new paradigm of early prevention of cardiovascular diseases. Medical advice. 2021;14:124-132. (In Russ)].
- Викулова О.К., Галстян Г.Р., Шестакова М.В. Анализ влияния агонистов рецептора глюкагоноподобного пептида 1 на сердечнососудистые исходы у пациентов с сахарным диабетом 2 типа: обзор исследований и оценка целевой популяции по данным регистра сахарного диабета Российской Федерации. Сахарный диабет. 2022;25(1):61-71. [Vikulova O.K., Galstyan G.R., Shestakova M.V. Analysis of the effect of glucagon-like peptide 1 receptor agonists on cardiovascular outcomes in patients with type 2 diabetes mellitus: a review of studies and evaluation of the target population according to the data of the Diabetes Mellitus Register of the Russian Federation. Diabetes mellitus. 2022;25(1):61-71. (In Russ)].
- Платонова А.А. Смирнов В.В. Матвеева Н.Н. Протекторная роль инкретинов в терапии сахарного диабета тип 2. Перспективные исследования в психологии спорте здравоохранении: сборник избранных статей международнойнаучная конференции. МИПИ им. Ломоносова. 2022:34-38. [Platonova A.A. Smirnov V.V. Matveeva N.N. The protective role of incretins in the treatment of diabetes mellitus type 2. Promising research in psychology, sports and healthcare: a collection of selected articles of the International scientific conference. MIPI named after Lomonosov. 2022:34-38. (In Russ)].
- Спасов А.А., Чепляева Н.И. Потенциал фармакологической модуляции уровня и активности инкретинов при сахарном диабете типа 2. Биомедицинская химия. 2015;61(4):488-496. [Spasov A.A., Cheplyaeva N.I. The potential of pharmacological modulation of the level and activity of incretins in type 2 diabetes mellitus. Biomedical chemistry. 2015;61(4):488-496. (In Russ)].
- Цыганкова О.В., Веретюк В.В., Аметов А.С. Инкретины сегодня: множественные эффекты и терапевтический потенциал. Сахарный диабет. 2019;22(1):70-78. [Tsygankova O.V., Veretyuk V.V., Ametov A.S. Incretins today: multiple effects and therapeutic potential. Diabetes mellitus. 2019;22(1):70-78. (In Russ)].
- Giorgino F., Leonardini A., Laviola L. Cardiovascular disease and glycemic control in type 2 diabetes: now that the dust is settling from large clinical trials. Annals of the New York Academy of Sciences. 2013;1281(1):36-50.
- Аметов А.С., Кулиджанян Н.К. Инкретины в терапии больных сахарным диабетом 2 типа: фокус на сердечно-сосудистую безопасность. Эффективная фармакотерапия. 2013;5:26-31. [Ametov A.S., Kulidzhanyan N.K. Incretins in the treatment of patients with type 2 diabetes mellitus: focus on cardiovascular safety. Effective pharmacotherapy. 2013;5:26-31. (In Russ)].
- Анциферов М.Б., Зилов А.В., Котешкова O.M., Демидов Н.А. Практические аспекты применения семаглутида в реальной клинической практике. Фарматека. 2021;28(4):16-23. [Antsiferov M.B., Zilov A.V., Koteshkova O.M., Demidov N.A. Practical aspects of the use of semaglutis in real clinical practice. Pharmateca. 2021;28(4):16-23. (In Russ)].
- Зилов А.В. Метформин в лечении сахарного диабета типа 2. Эффективная фармакотерапия. 2015;43:38-42. [Zilov A.V. Metformin in the treatment of type 2 diabetes mellitus. Effective pharmacotherapy. 2015;43:38-42. (In Russ)].
- Knop F.K., Visboll T., Holst J.J. Incretin-based therapy of type 2 diabetes mellitus. Curr. Protein. Pept. Sci. 2009;10(1):46-55.
- Потеряева О.Н., Усынин И.Ф. Дисфункциональные липопротеины высокой плотности при сахарном диабете 2 типа. Проблемы эндокринологии. 2022;68(4):69-77. [Poteryaeva O.N., Usynin I.F. Dysfunctional high-density lipoproteins in type 2 diabetes mellitus. Problems of endocrinology. 2022;68(4):69-77. (In Russ)].
- Аметов А.С. Сахарный диабет: Нужны кардинальные перемены! Эндокринология: новости, мнения, обучение. 2020;9(1):8-10. [Ametov A.S. Diabetes mellitus: Drastic changes are needed! Endocrinology: news, opinions, training. 2020;9(1):8-10. (In Russ)].
- Смирнов В.В., Шаповалова А.Б., Карповская Е.Б., Матвеева Н.Н., Иванов В.С., Иванов С.Н, Худякова Н.В. Актуальные вопросы комплексной терапии инсулинорезистентности у спортсменок с синдромом поликистозных яичников. Медицина: теория и практика. 2022;7(2);23-28. [Smirnov V.V., Shapovalova A.B., Karpovskaya E.B., Matveeva N.N., Ivanov V.S., Ivanov S.N., Khudyakova N.V. Topical issues of complex therapy of insulin resistance in athletes with polycystic ovary syndrome. Medicine: theory and practice. 2022;7(2);23-28. (In Russ)].
- Занозина O.B., Сорокина Ю.А., Ловцова Л.В., Ураков А.Л. Глиптины в инкретин-направленной фармакотерапии сахарного диабета возможности и персонализация. Нижний Новгород. 2019:112. [Zanozina O.B., Sorokina Yu.A., Lovtsova L.V., Kurakov A.L. Gliptins in incretin-directed pharmacotherapy of diabetes mellitus opportunities and personalization. Nizhniy Novgorod. 2019:112. (In Russ)].
- Аметов А.С., Бращенкова А.В. Роль и место инкретинов в достижении всестороннего гликемического контроля. РМЖ. 2015;27:9-15. [Ametov A.S., Brashchenkova A.V. The role and place of incretins in achieving comprehensive glycemic control. RMJ. 2015;27:9-15. (In Russ)].
- Демидов Н.А., Анциферов М.Б., Зилов А.В. Результаты клинического исследования эффективности комбинации вилдаглиптин + метформин в реальной клинической практике в России (исследование Мастер). Сахарный диабет. 2020;23(6):514-522. [Demidov N.A., Antsiferov M.B., Zilov A.V. Results of a clinical study of the effectiveness of the combination of vildagliptin + metformin in real clinical practice in Russia (Master study). Diabetes mellitus. 2020;23(6):514-522. (In Russ)].
- Аметов А.С., Черникова Н.А., Кнышенко О.А. Ингибиторы дипептидилпептидазы 4 в современной российской практике. Медицинский совет. 2020;7:14-18. [Ametov A.S., Chernikova N.A., Knyshenko O.A. Dipeptidyl peptidase 4 inhibitors in modern Russian practice. Medical advice. 2020;7:14-18. (In Russ)].
- Смирнов В.В., Шаповалова А.Б., Иванов В.С., Яворский Е.В, Бондарев С.А., Худякова Н.В., Попова В.В. Метаболизм костной ткани при яичниковой гиперандрогении у спортсменок молодого возраста с синдромом поликистозных яичников. Медицина: теория и практика. 2021 ;6(2):3-10. [Smirnov V.V., Shapovalova A.B., Ivanov V.S., Yavorsky E.V., Bondarev S.A., Khudyakova N.V., Popova V.V. Bone metabolism in ovarian hyperandrogenism in young athletes with polycystic ovary syndrome. Medicine: theory and practice. 2021 ;6(2):3-10. (In Russ)].
- Cambell J.E., Drucker D.J. Pharmacology, psysiology and mechanisms of incretin hormone action. Cell. Metab. 2013; 17(6):819-837.


