Возможности применения гипербарической оксигенации в комплексном лечении больных злокачественными опухолями
Автор: Суров Д.А., Коноплев Н.А., Алимов П.А., Рудаков Д.А., Еселевич Р.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 1 т.19, 2024 года.
Бесплатный доступ
В связи с высокой смертностью от онкологических заболеваний мировое медицинское сообщество продолжает работать над методами лечения и профилактикой развития осложнений, связанных лечением злокачественных новообразований. Однако, активному изучению некоторых научно обоснованных способов борьбы с раком уделяется недостаточно внимания. Одним из таких эффективных и малоизученных методов воздействия на процессы канцерогенеза является воздействие на организм повышенным давлением кислорода. В связи с этим проведен анализ научных и научно-исследовательских работ, посвященных исследованию механизма действия и возможности использования гипербарической оксигенации у больных злокачественными новообразованиями. Описаны и структурированы результаты экспериментальных и клинических исследований, в ходе которых проводилась оценка применения гипербарической кислородной терапии в онкологии. В ходе изучения литературных данных выявлено, что воздействие повышенного давления кислорода приводит к активации апоптоза опухолевых клеток, уменьшению их пролиферации и агрессивности. В послеоперационном периоде улучшаются показатели гемограммы, водно-электролитного баланса, кислотно-щелочного состояния. Комплексное использование с полихимиотерапией способствует преодолению химиотерапевтической резистентности, уменьшению токсического и цитостатического действия химиопрепаратов на организм. А сочетание с лучевой терапией позволяет использовать гипербарическую оксигенацию как в виде метода повышения чувствительности опухолевых клеток к облучению, так и в виде профилактического и лечебного воздействия на отсроченные лучевые поражения. Таким образом, использование терапии повышенным давлением кислорода в комплексном лечении злокачественных опухолей приводит к повышению качества и продолжительности жизни больных с новообразованиями. При этом, имеется возможность использовать как метод поддержки основной полихимиотерапии и/или лучевой терапии, так и метод профилактики развития и лечения осложнений. Но, в связи с недостаточностью проведенных клинических исследований, данный метод нуждается в обширном мультидисциплинарном обсуждении и изучении как в отечественной медицине, так и в зарубежной практике
Апоптоз, новообразования, лучевая терапия, оксигенация гипербарическая, рак, химиотерапия
Короткий адрес: https://sciup.org/140307024
IDR: 140307024 | DOI: 10.25881/20728255_2024_19_1_121
Текст обзорной статьи Возможности применения гипербарической оксигенации в комплексном лечении больных злокачественными опухолями
В последние десятилетия отмечается тенденция к росту количества больных онкологическими заболеваниями. Это связано не только с воздействием эндогенных и экзогенных факторов, но и с появлением новых методов исследования, позволяющих диагностировать злокачественные новообразования на ранних стадиях. Проводимая глобальная просветительская работа по профилактике и ранней диагностике рака, создание различных организаций и фондов, а также направление усилий медицинского сообщества на изучение и совершенствование различных методов лечения позволило увеличить выживаемость больных со злокачественными новообразованиями. Тем не менее смертность от онкологических заболеваний остается на высоком уровне, занимая второе место после смертности от сердечно-сосудистой патологии. По данным ВОЗ доля смертности в 2022 г. от рака составила около 18% от общего количества смертей.
При этом продолжающийся поиск наиболее рационального и радикального метода лечения, изучение влияния гипербарической оксигенации (ГБО) на канцерогенез остается малоизученным, что является плодородной почвой для использования лечебного и профилактического воздействия повышенного давления кислорода на злокачественные новообразования [1; 2].
ГБО — это способ, оказывающий лечебное действие на организм человека за счет повышенного давления кислорода в условиях барокамеры. Растворение кислорода в жидких средах организма, в частности в плазме крови,

под высоким давлением оказывает системное действие, что приводит к таким эффектам, как устранение гипоксии, усиление выработки Т- и В-лимфоцитов, снижение перекисного окисления липидов (ПОЛ), повышение эффективности проводимой комплексной терапии, усиление регенераторных возможности тканей, профилактике послеоперационных осложнений, в том числе и профилактике развития анаэробной инфекции. Глубокое понимание механизмов онкогенеза дает возможность оценить эффект ГБО в профилактике и лечении новообразований. Несмотря на то, что вопрос воздействия повышенного давления кислорода на опухолевые клетки остается малоизученным, данный метод является достаточно перспективным.
В ходе проведенного поиска научных статей в основных базах данных научного цитирования (Elibrary, PubMed, Google Scholar, Scopus) за 1986–2023 гг. по ключевым словам: «ГБО», «адаптация, рак», «опухоли легких», «опухоли ЖКТ», «опухоли органов малого таза», «послеоперационный период», «профилактика осложнений» найдено 46 научных статей и научно-исследовательских работ, удовлетворяющих данным требованиям, а именно: исследование механизма действия и возможность использования ГБО у пациентов с новообразованиями, как самостоятельного метода, так и в комплексной терапии.
В основе воздействия ГБО на канцерогенез лежат процессы активации апоптоза опухолевых клеток, уменьшения их пролиферации и агрессивности. Также, при воздействии повышенного давления кислорода происходит снижение процессов ПОЛ, усиления антиоксидазной защиты крови, нормализация системной гемодинамики путем усиления сократимости миокарда и улучшения показателей гемограммы.
В послеоперационном периоде ГБО приводит к более быстрой коррекции показателей крови, водно-электролитного баланса, кислотно-щелочного состояния, что способствует уменьшению общего числа гнойно-воспалительных осложнений и благоприятному течению послеоперационного периода у пациентов, оперированных по поводу злокачественных новообразований. Анализ состояния иммунной системы, кровообращения и фильтрационной функции почек после комбинированной терапии ГБО с органосохраняющими оперативными вмешательствами выявил улучшение показателей почечного кровотока, скорости клубочковой фильтрации и снижение частоты воспалительных заболевания почек в отдаленном послеоперационном периоде [3].
Путем повышения перфузии опухоли и чувствительности клеток ГБО позволяет преодолевать химиотерапевтическую резистентность, а также снижать общее токсическое и цитостатическое действие на организм. Это, в свою очередь, увеличивает общую трехлетнюю выживаемость и медиану выживаемости пациентов со злокачественными новообразованиями [4]. Сочетание полихимиотерапии (ПХТ) и ГБО можно рассматривать как новый, высокоэффективный клинико-биологический подход в лечение рака. При этом, имеются разноречивые данные о развитии побочных эффектов, что требует проведения дополнительных и обширных исследований [6].
Анализ результатов сочетания ГБО с лучевой терапией показал, что гипербарическая кислородная терапия увеличивает насыщение тканей кислородом и улучшает кровоток, а также влияет на регенерацию пораженных клеток, что уменьшает последствия радиационных побочных эффектов после лучевой терапии [8]. Проведенный количественный систематический обзор со статистическим анализом доказал эффективность ГБО в профилактике и лечении лучевого проктита [9].
Имеются данные, что радиотерапия, проведенная сразу после ГБО с мультиагентной химиотерапией, оказалась не только эффективной в лечении пациентов с глиомами высокой степени тяжести, но и безопасной, практически без поздних токсических явлений в отдаленном периоде [10]. Несмотря на множество данных о положительном влиянии ГБО в профилактике и лечении побочных эффектов радиотерапии, данное направление в рамках доказательной медицины нуждается в более масштабных исследованиях.
Обсуждение
В основе механизма возникновения опухоли и ее роста лежат нарушения в двух главных процессах клеточной жизни — это клеточная пролиферация и апоптоз. В ходе генетических мутаций опухолевые клетки способны преодолевать зависимость пролиферации от факторов роста, вследствие чего они приобретают способность к безграничному потреблению глюкозы. В процессе малиг-низации, раковые клетки теряют функциональную деятельность митохондрий, замедляют апоптоз, тем самым усиливают способность пролиферировать [11]. Таким образом, запрограммированная гибель клеток является «тормозным медиатором» в процессе канцерогенеза.
Исследования апоптоза в неопластических процессах при воздействии ГБО не многочисленны. Проведенные опыты «in vitro» не выявили изменений явления апоптоза в раковых клетках под влиянием ГБО. Вместе с тем, в экспериментах «in vivo», напротив, происходило усиление апоптоза в клетках опухоли и снижение ее пролиферации. Механизм усиления запрограммированной клеточной гибели заключается в блокировании «эффекта Варбурга» путем поглощения кислорода опухолевыми клетками под давлением, что замедляет потребление глюкозы и переводит процесс гликолиза в более упрощенный и менее пагубный - кислотный гликолиз. Одновременно с этим со стороны клеток происходит защелачивание, в результате чего сохраняется стабильность проводимой гиперокси-ческой терапии [11; 12]. Применение препаратов, усиливающих потребление кислорода опухолевыми клетками, способствуют усилению апоптоза раковых клеток, либо перестроению их на аэробный путь метаболизм. Основная их цель - повышение степени аэробного дыхания в

клетке. Они поддерживают свое постоянство при каждой трансформации pH среды. В случае отклонений в организме в одну из сторон, ацидоза или алкалоза, такие перемены возмещаются в необходимую для организма сторону, сохраняя постоянство среды [13; 14].
Важную роль, способствующую росту и метастазированию злокачественных клеток, играют и процессы ангиогенеза. В клинической медицине известно, что ГБО способствует усилению пролиферации сосудов и клеток в нормальных тканях. Считалось, что индукция ангиогенеза также будет и в новообразованиях, подвергнутых гипероксигенации. Однако, в двух экспериментах было показано, что ГБО напротив, индуцирует антиангиоген-ный эффект [15].
Индекс пролиферативной активности является одним из показателей степени агрессивности опухоли, которая проявляется в метастазировании и способности к инвазивному росту, что в некоторых ситуациях требует применения циторедуктивной хирургии [16]. Уменьшение агрессивности новообразования, которое наблюдалось при использовании ГБО, это одна из приоритетных задач современных методов профилактики и лечения. Выдвинуто предположение, что кислород может приводить к типу рака с менее инвазивным и метастатическим фенотипом. В качестве примера, подкрепляющего состоятельность данной теории, можно привести результаты экспериментального исследования на мышах, целью которого было изучение влияния ГБО на рост опухоли, кинетику и микроциркуляцию метастазов колоректального рака в печени. По итогам работы были сделаны выводы, что воздействие высоким давлением кислорода вызывает значительное снижение явлений некроза и пролиферации опухоли, не оказывает стимулирующего эффекта на метастазы в печени и может безопасно сочетаться с другими терапевтическими методами лечения [17].
Одним из важных методов и этапов лечения в онкологии является химио- и лучевая терапия. Сложность данных методов заключается в тяжелых побочных реакциях, которые не всегда позволяют комбинировать терапию с другими методами лечения.
Использование ГБО усиливает эффективность химиотерапии в исследованиях как на культурах клеток, так и на живых организмах. Важно отметить, что взаимодействие ГБО с химиотерапевтическим препаратом и пациентом строго индивидуальны, и на успешность их сочетания влияют множество факторов: молекулярный тип опухоли, вид химиопрепарата, соотношение времени приема препарата ко времени окончания последней ги-пероксической терапии. Выяснилось, что максимальный эффект химиопрепарата сохраняется в течение 30 мин. после окончания сеанса ГБО. Также отмечено отсутствие токсического влияния на субкультуры Т-лимфоцитов, моноцитов, а также снижение лейкопении, гранулоцито-пении и тромбоцитопении, что проявлялось снижением общего токсического действия химиотерапии. У паци- ентов, с диагностированным мелкоклеточным раком легких, которым проводилась коррекция осложнений ПХТ с использованием ГБО, было выявлено снижение степени выраженности анемии [18].
Стоить отметить, что одним из частых побочных явлений ПХТ производными препаратов платины, является нефротоксичность. Однако, достоверных данных о положительном влиянии ГБО на функции почек пациентов, получающих ПХТ, не выявлено. При этом в зарубежных странах не только применяют комбинацию химиопрепаратов с ГБО, но и широко используют их сочетание в клинической практике, что показывает высокое синергичное действие ПХТ и гипербарического кислорода в борьбе с новообразованиями [6]. В тоже время проведение ПХТ некоторыми препаратами (доксорубицин, блеомицин, дисульфирам, цисплатин) в сочетании с ГБО строго противопоказаны в связи с возможным усилением токсического эффекта [1; 18].
Относительно сочетания ГБО с лучевой терапией, стоит отметить, что для повышения эффективности проводимой радиационной терапии её можно применять как самостоятельный метод лечения отсроченных лучевых поражений, так и в виде метода повышения чувствительности к облучению. При этом нельзя забывать, что развитие таких побочных эффектов, как кислородная интоксикация и тяжелое лучевое поражение тканей находится в зависимости от времени сочетания ГБО и лучевой терапией. Для профилактики развития этих эффектов радиотерапию рекомендовано проводить сразу после сеанса ГБО, но не одновременно с ним. Правильный выбор сочетания лучевой терапии и радиомодификации оказывает непосредственное влияние: на эффективность и результаты проводимого лечения; на одногодичную и пятилетнюю выживаемость; на развитие осложнений и возникновение рецидивов [1; 19–21].
В результате проведенного экспериментального исследования по оценке влияния ГБО на частоту возникновения побочных эффектов применения лучевой терапии при злокачественных новообразованиях нижней челюсти, отмечено, что у животных из исследуемой группы, которым лучевую терапию сочетали с ГБО, в отличии от контрольной группы, в гистологических срезах тканей нижней челюсти обнаружен продолжающийся рост зубов и сохранение дифференцированных тканей (слюнные железы и костная ткань). Таким образом, подтверждается эффективность применения ГБО для улучшения отдаленных последствий побочных явлений радиационной терапии [22].
Проведенный Yuan J. et al в 2020 г. мета-анализ доказывает эффективность ГБО в профилактике и лечении желудочно-кишечных осложнений радиационной терапии, в том числе и хронического лучевого проктита тяжелого течения [9]. При выполнении 30 сеансов ГБО ежедневно, под давлением 1,5 ата в течение 60 мин., в послеоперационном периоде у пациента с инвазивным умеренно-дифференцированным плоскоклеточным

раком шейки матки отмечена выраженная положительная динамика в виде полного прекращения выделения крови из прямой кишки при дефекации, уменьшения частоты стула до 1 раза в сутки, полное отсутствие отека и инфильтрации слизистой прямой кишки, а также, отсутствие эндоскопических данных за рецидив лучевого проктита [23; 24].
Исследование морфологии влияния оксигенации на эффективность химиолучевой терапии плоскоклеточного рака шейки матки показало, что применение ГБО на фоне проведения химиолучевой терапии способствует снижению количества клеток с признаками дегенерации, вакуолизации цитоплазмы, лизисом, ядра, кариопикно-зом и кариорексисом. Наблюдалось и уменьшение размеров опухолевых клеток (конкретно клеток и ядер) и их дальнейшая регрессия с последующим замещением соединительной тканью [25]. Также имеются исследования оценки профилактического влияния ГБО на фоне проведения стереотаксической радиохирургии у пациентов с метастазами в головной мозг. Количество случаев радиационно-индуцированного повреждения мозга у пациентов, прошедших курс ГБО, было достоверно ниже, чем в группе без ГБО [26; 27].
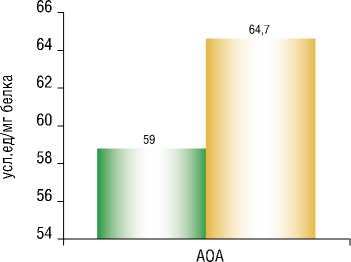
Особое внимание исследователями уделено влиянию ГБО на организм пациентов с онкологическими заболеваниями, лечение которых требует оперативного вмешательства. Так, при изучении возможности применения ГБО как антигипоксанта и модулятора уровня перекисного окисления липидов, проведено обследование с использованием чистого медицинского кислорода под давлением 0,5 ата. Гипероксигенация проводилась в предоперационном периоде и составляла 5–6 сеансов по 50 мин. После сеанса ГБО выявлено достоверное снижение уровня ПОЛ и рост уровня ферментативной антиоксидазной защиты (Рис. 1; 2) [28].
В литературе отмечено, что применение ГБО способствует снижению проявления окислительного стресса и интенсификации антиоксидантной защиты крови [29–31].
Matzi V. et al. в 2004 г. в ходе исследования, целью которого была оценка эффективности интраоперационной фотодинамической терапии (ФДТ) в условиях ГБО по сравнению с одной только декортикацией легкого, пришли к выводу, что применение ФДТ в комплексе с ГБО является безопасным и технически выполнимым подходом в паллиативном лечении злокачественной мезотелиомы плевры. При сравнении результатов КТ в группе с применением ГБО был зафиксирован очаговый рост опухоли в 41% случаев, против 83% в группе, в которой проводилась только декортикация легкого. Анализ выживаемости также показал значительное преимущество группы, в которой проводилась ФДТ в условиях гипербарической оксигенации [32].
В работе, посвященной изучению роли гипербарической оксигенации в борьбе с осложнениями при операциях на легких и плевре, описывается опыт применения
13^
10,65
9_
7_
5 _
3_
8,47
МДА
1,54 1,38
ДК
I ДоГБО
После ГБО
Рис. 1.
Влияние ГБО на уровень ПОЛ на примере диеновых конъюгат (ДК) и малонового диальдегида плазмы (МДА).
I До ГБО После ГБО
Рис. 2. Влияние ГБО на уровень антиоксидазной активности мембран эритроцитов (АОА).
ГБО в комплексе с другими лечебными мероприятиями как эффективный метод в профилактике послеоперационных осложнений. По результатам исследования выяснилось, что применение ГБО в пред- и послеоперационном периодах у пациентов с новообразованием легких уменьшало выраженность воспалительных явлений и, как следствие, отмечалось улучшение таких показателей, как количество отделяемой мокроты, ЧСС, ЧДД, ЖЕЛ, МВЛ, что способствовало уменьшению гипоксии и полному исчезновение ацидоза [33].
Использование ГБО в профилактике осложнений оперативного лечения рака толстой кишки показало, что его применение не только снижает уровень гипоксии тканей, но и нормализует системную гемодинамику, усиливая сократимость миокарда и улучшая многие физиологические показатели жизнедеятельности организма. Выявлена более быстрая нормализация показателей «красной крови», в особенности у пациентов с большей интраоперационной кровопотерей. Касаемо изменений в гемодинамике было отмечено, что у пациентов группы, в котором использовалась ГБО, уменьшались показатели сАД и дАД, а также происходило достоверное снижение ЧСС и ЧДД.

А кислотно-щелочной состав крови к концу курса ГБО смещался в щелочную сторону, тогда как в раннем послеоперационном периоде у большинства пациентов данный показатель указывал на метаболический ацидоз. Таким образом, применение ГБО у пациентов, оперированных по поводу рака толстой кишки способствовало снижению возникновения гнойно-воспалительных осложнений и летальности более чем в два раза [34].
К схожим выводам пришел и Чубухчиев Г.Б., который отметил уменьшение послеоперационных осложнений и госпитальной летальности почти в два раза в группе, где ГБО использовали в комплексе интенсивной терапии при оперативном лечении рака легкого [28].
При оценке отдаленных результатов применения ПХТ в раннем послеоперационном периоде в сочетании с ГБО, проведенной после экстирпации матки по поводу эндометриоидной аденокарциномы, было выявлено, что ГБО увеличивает общую трехлетнюю выживаемость и медиану выживаемости пациентов [4]. Отмечено, что ГБО увеличивает эффективность проводимой ПХТ и снижает частоту возникновения рецидивов заболевания у больных с раком шейки матки III стадии [35].
Напротив, в результате проведенных исследований, Тростинская А.Б. выявила, что сочетание ПХТ и ГБО не оказывает значительного влияния на 3-х и 5-ти летнюю выживаемость больных раком [36].
В случае применения нормобарической оксигенации (НБО) в лечении осложнений цитостатической терапии рака яичников, выявлено, что НБО улучшает показатели оксигенации крови. Стоить отметить, что НБО проводилось во время второго курса ПХТ (Табл. 1).
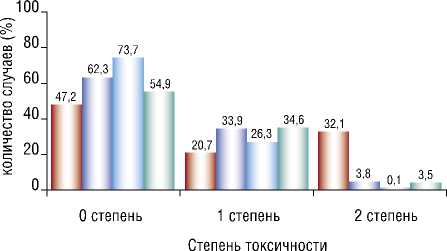
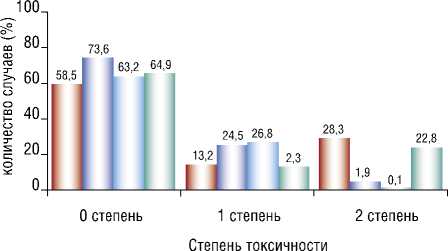
После второго курса ПХТ признаки токсичности у пациентов, получавших НБО, не выявились у 62,3%, сократилась доля 2 степени токсичности. Из-за снижения частоты 2 степени отмечено увеличение количества больных с 1 степенью по критерию «анемия». В контрольной группе отмечен рост больных с 1 и 2 степенью анемии. Похожие изменения в обоих группах произошли и по критерию «лейкопения» (Рис. 3; 4) [37].
Кроме того, ГБО способствует значительному улучшению реологических и гемостазиологических свойств крови, проявляющееся в снижение степени и скорости спонтанной агрегации эритроцитов и тромбоцитов, а также улучшении коэффициента деформируемости эритроцитов [38].
Использование ГБО для улучшения результатов органосохраняющих операций при онкологических заболеваниях играет немаловажную роль. Так, анализ состояния кровообращения и функции почек через 6 месяцев после резекции почки по поводу почечно-клеточного рака выявил улучшение показателей почечного кровотока, скорости клубочковой фильтрации и снижение частоты воспалительных заболевания почек в отдаленном послеоперационном периоде [3].
В исследовании приняло участие 69 пациентов, которым была выполнена органосохраняющая операция
Табл. 1. Воздействие НБО на газовый состав крови
|
Первый курс ПХТ |
Второй курс ПХТ |
||
|
рО2 (%) |
основная |
63,55±0,88 |
75,98±0,78 |
|
контроль |
59,61±0,29 |
57,11±0,26 |
|
|
рСО2 (%) |
основная |
40,63±0,3 |
36,68±0,24 |
|
контроль |
40,46±0,15 |
42,5±0,19 |
|
I I 1 курс [о] 1 курс [к]
I 12 курс [о] 2 курс [к]
Рис. 3. Воздействие НБО на гематологическую токсичность ПХТ по критерию «анемия» в основной и в контрольной группах.
I I 1 курс [0]
■ 12 курс [о]
1 курс [к]
2 курс [к]
Рис. 4. Воздействие НБО на гематологическую токсичность ПХТ по критерию «лейкопения» в основной и в контрольной группах.
по поводу злокачественного новообразования почки. В первую группу вошли пациенты, которым проводилась стандартная послеоперационная терапия (СПТ). Во второй группе, помимо СПТ, с четвертых суток после операции, под давлением 2,0 ата, в течение 5 суток по 60 мин. ежедневно, проводились сеансы ГБО.
Через 6 месяцев оценка состояния периферических сосудов проводилась путем оценки периферического сосудистого сопротивления (индекса резистентности (RI) и пикового индекса (PI)) междолевых и дугообразных артерий в зоне резекции, в интактных участках оперированной почки, и в тех же участках контрлатеральной почки. Выявлено, что периферическое сосудистое сопро-
тивление междолевых артерий не имели статистически значимых различий, как в исследуемой группе, так и в контрольной (Табл. 2).
Напротив, на уровне дуговых артерий в зоне резекции, в интактных участках оперированной почки и в тех же участках здоровой контрлатеральной почки, в группе СПТ отмечается достоверное увеличение показателей в сравнении с группой КПТ (Табл. 3).
При этом снижение почечного кровотока в отдаленном послеоперационном периоде у контрольной группы (без ГБО) составило 16,3±1,4%, а в основной группе (с ГБО) — 10,1±1,2%.
Для оценки функции почечной паренхимы была анализирована скорость клубочковой фильтрации. При выполнении ангионефросцинтиграфии было отмечено, что в группе со СПТ продолжительность периода полувыведения радиоизотопа дольше, чем в группе с КПТ, что составляло 24,1 и 18,4 мин. соответственно.
Стоит отметить, что за шестимесячный период наблюдения за пациентами, которым выполнена органосохраняющая операция по поводу почечно-клеточного рака, у пациентов в группе КПТ, пиелонефрит проявился у 1 (2,9%) пациента, в то время как в группе СПТ у 5 (14,7%) больных, причем заболевание протекало в тяжелой форме [3].
Отечественной литературы, посвященной опыту сочетания ГБО с лучевой терапией в борьбе с онкологическими заболеваниями, встречается крайне мало. Тем не менее, имеющиеся исследования российских и зарубежных авторов приводят к выводу, что комплексное лечение рака с использованием ГБО значительно улучшают результаты радиационной терапии, положительно влияя на качество жизни пациента.
Так, проводя радиационную терапию сразу после одновременного курса ПХТ и сеанса ГБО, исследователи отметили, что во время лечения глиом высокой степени злокачественности, ни у одного пациента не было нейтропенической лихорадки или внутричерепного кровоизлияния. А в отдаленном периоде отсутствовали серьезные негематологические или поздние токсические эффекты [10].
Изучение влияния ранней ГБО после лучевой терапии в исследованиях, в том числе и рандомизированных, показало, что использование терапии повышенного давления кислорода улучшило показатели возможности глотания, качества слюны, уменьшение ксеростомии и боли во рту, чем значительно повысило качество жизни у пациентов с новообразованиями ротовой полости и ротоглотки [39; 40].
Особый анализ заслуживают и результаты использования ГБО, как отдельного метода, так и в комплексном применении с химиолучевой терапией, в профилактике и лечении злокачественных новоообразований различных локализаций.
Так, ряд исследователей выдвинули теорию антипро-лиферативного эффекта гипербарического кислорода
Табл. 2. Периферическое сосудистое сопротивление на уровне междолевых артерий
|
RI |
PI |
|||
|
СПТ, n = 27 |
КПТ, n = 28 |
СПТ, n = 27 |
КПТ, n = 28 |
|
|
Зона резекции |
0,59±0,004 |
0,58±0,004 |
1,0±0,03 |
0,99±0,02 |
|
Интактные участки оперированной почки |
0,59±0,002 |
0,58±0,003 |
0,97±0,02 |
0,97±0,03 |
|
Контралатеральная почка |
0,58±0,004 |
0,59±0,001 |
0,98±0,03 |
0,99±0,01 |
Табл. 3. Периферическое сосудистое сопротивление на уровне дуговых артерий
В результате оценки влияния кислородо- и озоно-терапии на кожу больных злокачественным новообразованием, описана возможность применения ГБО в коррекции показателей противомикробной защиты и микроэкологии кожи у больных раком молочной железы после ПХТ. На основе полученных данных, при оценке обсеменённости кожи, исследователи пришли к заключению, что проведение ГБО и озонотерапии у больных раком молочной железы снизило микробную загрязненность кожи патогенной микрофлорой [41].
В 2017 г. отечественными онкологами были описаны два клинических случая рака молочной железы с применением ГБО, по результатам лечения которых был сделан вывод, что терапия гипербарическим кислородом способствует ускорению заживления ран, уменьшения количества этапных оперативных вмешательств, и сокращению сроков их госпитализации [42].
В статье, посвященной использованию ГБО в лучевой терапии рака головы и шеи, описывают её клиническую ценность в борьбе с опухолями головы и шеи. Выявлен положительный эффект сочетания ГБО с нитроимидазолами, которые использовались в качестве сенсибилизатора радиации [43]. Стоит отметить, что в последние годы описано одно экспериментальное исследование по изучению сочетания ГБО и лучевой терапии при карциноме головы и шеи у мышей, в ходе которого выяснилось, что как самостоятельно, так и в сочетании с лучевой терапией гипероксигенация не оказывает никакого влияния на рост опухоли [1].
Исследования, проведенные на мышах с карциномой толстой кишки, показало, что применение только лишь ГБО не оказывает какого-либо лечебного эффек-
та. Однако, при сочетании ГБО с пирарубицином было отмечено уменьшение метастазов в печени, замедление роста опухоли и индукция повышения уровня некроза [17].
Обещающие результаты применения ГБО в лечении лейкоза дают эксперименты «in vitro». Исследователи пришли к выводу, что способность ГБО усиливать апоптоз лейкемических клеток, позволит применять его как метод лечения лейкемии. Учитывая, что исследования проводились на культуре клеток, данная методика нуждается дальнейшей оценке «in vivo», с целью исключения феномена положительного эффекта только «in vitro» [1; 43; 44].
Отсутствует однозначное мнение и в возможности использования ГБО в лечении злокачественного новообразования предстательной железы. Chong et al. в 2004 г. и Tang et al. в 2009 г. не обнаружили изменений характеристик атипичных клеток (степень дифференциации, плотность микрососудистой сети, пролиферация или апоптоз) «in vivo» под воздействием ГБО. Kalns et al. напротив, отметили, что использование ГБО в экспериментах «in vivo» способствовало снижению скорости роста и повышению чувствительности опухолевых клеток предстательной железы к противоопухолевым препаратам за счет их накопления в хемочувствительной части клеточного цикла [1].
В 2013 г. проведено исследование, посвященное оценке воздействия озон-кислородной смеси на проводимую лучевую терапию при местнораспространенном раке шейки матки [44; 45]. Основной концепцией метода авторы считали, что чем больше диффузия кислорода из прямой кишки в кровь и далее в саму опухоль, тем выше ее чувствительность к воздействию ионизирующей радиации.
Для контроля уровня оксигенации опухоли, как показателя эффективности проводимой терапии, была применена оригинальная методика пульсоксиметриче-ской оценки оксигенации опухоли.
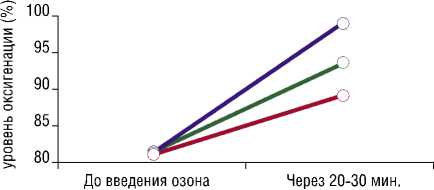
Изначальные показатели оксигенации в шейке матки у больных, показывали выраженную гипоксию (81,3+1,5%). После инсуфляции озон-кислородной смеси, сатурация выросла до 98,8% (Рис. 5). Параллельно с озон-кислородной смесью, на 20-й минуте, начинали сеанс лучевой терапии.
На фоне проводимой терапии, авторы отмечают, что в основной группе достоверно снизилось количество циститов, по сравнению с контрольной. Также присутствует тенденция к снижению постлучевых и химиотерапевтических осложнений. Осложнения имели транзиторный характер и хорошо поддавались лечению.
Проведя сравнительный анализ одно- и трехлетней выживаемости, авторы отмечают, что применяемый метод инсуфляции озон-кислородной смеси в комплексном лечении больных раком шейки матки имеет ряд преимуществ, в том числе в профилактике радиационно-индуцированного цистита [46].
—С* 500 мл —' — 10ОО мл Ч> 1500 мл
Рис. 5. Динамика насыщения кислородом опухоли в зависимости от объема введенной озон-кислородной смеси.
Заключение
Анализ данных литературы показал, что ведущим звеном в воздействии ГБО на злокачественные новообразования является замедление процессов пролиферации и усиление апоптоза клеток опухоли. При этом, влияя на гомеостаз, ГБО улучшает физиологические показатели организма, в том числе иммунитет, кровообращение и показатели крови.
В связи с недостаточными клиническими исследованиями остается актуальным возможность применения данного метода как в отечественной медицине, так и в зарубежной практике. Тем не менее, в большинстве анализированных экспериментальных исследованиях, показавших результаты воздействия ГБО на тканевых культурах и на животных, с опухолевыми поражениями различных органов и систем, в конечном итоге, определяло изменения лабораторных и гистохимических показателей в положительную сторону. Использование ГБО у пациентов с новообразованиями привело к улучшению общего самочувствия, снижению развития послеоперационных и иных осложнений, а также повышению качества и продолжительности жизни.
Также остается неоднозначным эффект одновременного применения гипероксической терапии и ПХТ, что требует проведения дополнительных клинических исследований. При этом, большинство литературных данных указывают на снижение показателей химиорезистентности, уменьшение агрессивности опухолей различных органов и систем, а также снижение количества рецидивов.
Изучение научных данных сочетания ГБО и лучевой терапии показало, что применение гипербарической кислородной терапии в профилактике отсроченных побочных явлений лучевой терапии является патогенетически обоснованным и эффективным методом. При этом комбинирование химиолучевой терапии с инсуфляцией озон — кислородной смеси достоверно приводит к снижению постлучевых и химиотерапевтических осложнений.
Таким образом применение метода ГБО рекомендовано больным онкологического профиля на любой стадии болезни, при отсутствии абсолютных и относительных противопоказаний. Использование ГБО возможно как в роли поддержки основной ПХТ и/или
лучевой терапии, так и в виде профилактики развития и лечения осложнений.
Стоит отметить, что официальной позиции, касаемо применения ГБО в терапии опухолевых поражений, на электронных сайтах ВОЗ, Министерства здравоохранения РФ, а также Ассоциации онкологов России не найдено, что говорит о необходимости проведения масштабных клинических исследований и объективной оценке полученных результатов.
Список литературы Возможности применения гипербарической оксигенации в комплексном лечении больных злокачественными опухолями
- Moen I, Stuhr LE. Hyperbaric oxygen therapy and cancer-a review. Target Oncol. 2012; 7(4): 233-242. doi:10.1007/s11523-012-0233-x.
- Sahni T, Jain M, Hukku S, Jadhav GK. Role of hyperbaric oxygen therapy in oncology and radiation induced tissue damage. Apollo Medicine. 2004; 1: 186-189. doi: 10.1016/S0976-0016(11)60246-9.
- Шорманов И.С., Лось М.С., Титов К.С. Комплексная противоишемическая терапия раннего послеоперационного периода органосохраняющего оперативного лечения почечно-клеточного рака // Российский биотерапевтический журнал. — 2018. — Т.17. — №1. — С. 58-63. doi: 10.17650/1726-9784-2018-17-1-58-63.
- Дзасохов А.С. Перспективы применения гипербарической оксигенации при лечении рака эндометрия. // Вестник новых медицинских технологий. Электронное издание. — 2013. — №1. — С.150.
- Звягин Г.В., Зезикова Е.И., Ромасенко М.В. Организация и принципы работы отделения ГБО в структуре многопрофильного стационара скорой медицинской помощи // Многопрофильный стационар. — 2019. — Т.6. — №.1. — С.23-26.
- Seledtsov VI, Von Delwig AA. Oxygen therapy in traditional and immunotherapeutic treatment protocols of cancer patients: current reality and future prospects. Expert Rev Anticancer Ther. 2022; 22(6): 575-581. doi: 10.1080/14737140.2022.2070153.
- Wu X, Zhu Y, Huang W, et al. Hyperbaric Oxygen Potentiates Doxil Antitumor Efficacy by Promoting Tumor Penetration and Sensitizing Cancer Cells. Adv Sci (Weinh). 2018; 5(8): 1700859. doi: 10.1002/advs.201700859.
- Kirby JP. Hyperbaric Oxygen Therapy and Radiation-Induced Injuries. Mo Med. 2019; 116(3): 198-200.
- Yuan JH, Song LM, Liu Y, et al. The Effects of Hyperbaric Oxygen Therapy on Pelvic Radiation Induced Gastrointestinal Complications (Rectal Bleeding, Diarrhea, and Pain): A Meta-Analysis. Front Oncol. 2020; 10: 390. doi: 10.3389/fonc.2020.00390.
- Ogawa K, Ishiuchi S, Inoue O, et al. Phase II trial of radiotherapy after hyperbaric oxygenation with multiagent chemotherapy (procarbazine, nimustine, and vincristine) for high-grade gliomas: long-term results. Int J Radiat Oncol Biol Phys. 2012; 82(2): 732-738. doi: 10.1016/j.ijrobp.2010.12.070.
- Ромашова М.Ф., Демиденко Л.А., Казакова В.В., Сырвакова А.О. Оксигенация онкоклеток // Ученые записки Крымского инженерно-педагогического университета. — 2019. — №1. — С.37-42.
- Zhang L, Ke J, Min S, et al. Hyperbaric Oxygen Therapy Represses the Warburg Effect and Epithelial-Mesenchymal Transition in Hypoxic NSCLC Cells via the HIF-1α/PFKP Axis. Front Oncol. 2021; 11: 691762. doi: 10.3389/fonc.2021.691762.
- Chen YC, Chen SY, Ho PS, et al. Apoptosis of T-leukemia and B-myeloma cancer cells induced by hyperbaric oxygen increased phosphorylation of p38 MAPK. Leuk Res. 2007; 31(6): 805-815. doi: 10.1016/j.leukres. 2006.09.016.
- Xiong Y, Yong Z, Xu C, et al. Hyperbaric Oxygen Activates Enzyme-Driven Cascade Reactions for Cooperative Cancer Therapy and Cancer Stem Cells Elimination. Adv Sci (Weinh). 2023; e2301278. doi:10.1002/advs.202301278.
- Chen SY, Tsuneyama K, Yen MH, et al. Hyperbaric oxygen suppressed tumor progression through the improvement of tumor hypoxia and induction of tumor apoptosis in A549-cell-transferred lung cancer. Sci Rep. 2021; 11(1): 12033. doi: 10.1038/s41598-021-91454-2.
- Нгуен В.Т., Бромберг Б.Б., Новикова М.В., и др. Двухэтапная циторедуктивная хирургия при осложненном прогрессирующем раке тонкой кишки // Вестник национального медико-хирургического центра им. Н.И. Пирогова. — 2022. — Т.17. — №3. — С.142-147. doi: 10.25881/20728255_2022_17_3_142.
- Daruwalla J, Christophi C. The effect of hyperbaric oxygen therapy on tumour growth in a mouse model of colorectal cancer liver metastases. Eur J Cancer. 2006;42(18):3304-3311. doi:10.1016/j.ejca.2006.08.004.
- Попова М.Е., Козлов С.В., Королева И.А., Зайцева Е.Н. Новый метод коррекции химиотерапевтических осложнений у больных немелкоклеточным раком лёгких // Известия Самарского научного центра Российской академии наук. — 2013. — Т.15. — №3(6). — С.1914-1916.
- Малеева К.П., Каримов Н.А., Мулатов А.А., и др. Радиочувствительность опухолей и способы радиомодификации // Международный студенческий научный вестник. — 2018. — №2. — С.22-22.
- Bennett MH, Feldmeier J, Smee R, Milross C. Hyperbaric oxygenation for tumour sensitisation to radiotherapy. Cochrane Database Syst Rev. 2018; 4(4): CD005007. doi: 10.1002/14651858.CD005007.pub4.
- Wang PH, Yuan CC, Lai CR, et al. Rapid progression of squamous cell carcinoma of the cervix after hyperbaric oxygenation. Eur J Obstet Gynecol Reprod Biol. 1999; 82(1): 89-91. doi: 10.1016/s0301-2115(98)00168-7.
- Williamson RA. An experimental study of the use of hyperbaric oxygen to reduce the side effects of radiation treatment for malignant disease. Int J Oral Maxillofac Surg. 2007; 36(6): 533-540. doi: 10.1016/j.ijom.2007.03.003.
- Леонтьев А.В., Левина О.А., Гришина Е.А. и др. Гипербарическая оксигенация при рецидивирующих ректальных кровотечениях на фоне лучевого проктита // Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. — 2022. — Т.11. — №1. — С.186-190. doi: 10.23934/2223-9022-2022-11-1-186-190.
- Леонтьев А.В., Левина О.А., Гришина Е.А. и др. Клиническое значение гипербарической оксигенации в лечении хронического лучевого проктита // Доказательная гастроэнтерология. — 2022. — Т.11. — №3. — С.20–28. doi: 10.17116/ dokgastro20221103120.
- Маненков П.М. Морфологическая и клиническая оценка влияния оксигенации на эффективность химиолучевой терапии плоскоклеточного рака шейки матки: Автореферат дис. … канд. мед. наук. — Ульяновск; 2015.
- Ohguri T, Imada H, Kohshi K, et al. Effect of prophylactic hyperbaric oxygen treatment for radiation-induced brain injury after stereotactic radiosurgery of brain metastases. Int J Radiat Oncol Biol Phys. 2007; 67(1): 248-255. doi: 10.1016/j.ijrobp.2006.08.009.
- Токарев А.С., Степанов В.Н., Рак В.А. и др. Опыт применения гипербарической оксигенации при лечении радионекроза, развившегося как осложнение стереотаксически ориентированного радиохирургического лечения менингиомы на примере клинического случая // Журнал им. Н.В. Склифосовского Неотложная медицинская помощь. — 2020. — Т.9. — №4. — С.670–676. doi: 10.23934/2223-9022-2020-9-4-670-676.
- Чубухчиев Г.Б. Гипербарическая оксигенация в комплексе интенсивной терапии при оперативном лечении рака легкого: Автореферат дис. … канд. мед. наук. — Саратов; 1991.
- Мартусевич А.К., Поповичева А.Н., Соснина Л.Н. и др. Влияние гипербарической оксигенации на состояние окислительного стресса и антиоксидантной системы крови у детей с воспалительными заболеваниями кишечника // Экспериментальная и клиническая гастроэнтерология. — 2022. — Т.197. — №1. — С.45-49. doi: 10.31146/1682-8658-ecg-197-1-45-49.
- Бабкина А.В., Хубутия М.Ш., Левина О.А. и др. Параметры системы окислительно-восстановительного гомеостаза у женщин с опухолями репродуктивной системы после трансплантации органов на фоне гипербарической оксигенации // Трансплантология. — 2019. — Т.11. — №4. — С.290-300 doi: 10.23873/2074-0506-2019-11-4-290-300.
- Хубутия М.Ш., Бабкина А.В., Левина О.А. и др. Гипербарическая оксигенация в послеоперационном периоде у женщин с опухолями репродуктивной системы после трансплантации органов / Материалы научно-практической конференции «Вектор развития высоких медицинских технологий на госпитальном этапе оказания скорой и неотложной медицинской помощи»; Рязань, 18–19 апреля 2019 г. — М.: НПО ВНМ, НИИ СП им. Н.В. Склифосовского ДЗМ, 2019. — 176-177.
- Matzi V, Maier A, Sankin O, et al. Photodynamic therapy enhanced by hyperbaric oxygenation in palliation of malignant pleural mesothelioma: clinical experience. Photodiagnosis Photodyn Ther. 2004; 1(1): 57-64. doi: 10.1016/S1572-1000(04)00009-2.
- Намазбеков Б.К. Гипербарическая оксигенация в профилактике и комплексном лечении гнойных осложнений при операциях на легких и плевре: Дис. … канд. мед. наук. — Москва; 1986.
- Чумак В.Н. Гипербарическая оксигенация в профилактике осложнений при оперативном лечении рака толстой кишки: Дис. … канд. мед. наук. — Киев, 1987.
- Савкова Р.Ф., Юдина Л.Ф., Геращенко М.А., Дзасохов А.С. Гипербарическая оксигенация в комплексном лечении рака шейки матки // Научный электронный архив академии естествознания. — 2012.
- Тростинская А.Б. Значение гипербарической оксигенации в сочетании с полихимиотерапией в комплексном лечении рака молочной железы: Автореферат дис. … канд. мед. наук. — Санкт-Петербург; 1996.
- Дзасохов А.С. Нормобарическая оксигенация в лечении осложнений цитостатической терапии рака яичников: Автореферат дис. … канд. мед. наук. — Тула; 2005.
- Поповичева А.Н., Мартусевич А.К., Соснина Л.Н. и др. Влияние гипербарической оксигенации на состояние реологии крови и гемостаза у детей с воспалительными заболеваниями кишечника // Экспериментальная и клиническая гастроэнтерология. — 2022. — Т.202. — №6. — С.83-89. doi: 10.31146/1682-8658-ecg-202-6-83-89.
- Teguh DN, Levendag PC, Noever I, et al. Early hyperbaric oxygen therapy for reducing radiotherapy side effects: early results of a randomized trial in oropharyngeal and nasopharyngeal cancer. Int J Radiat Oncol Biol Phys. 2009; 75(3): 711-716. doi: 10.1016/j.ijrobp.2008.11.056.
- Gerlach NL, Barkhuysen R, Kaanders JH, et al. The effect of hyperbaric oxygen therapy on quality of life in oral and oropharyngeal cancer patients treated with radiotherapy. Int J Oral Maxillofac Surg. 2008; 37(3): 255-259. doi: 10.1016/j.ijom.2007.11.013.
- Хайруллин Р.Г., Гольдберг В.Е., Красноженов Е.П., Чубик М.В. Влияние кислородо- и озонотерапии на состояние противоинфекционной защиты кожи у больных раком молочной железы // Сибирский онкологический журнал. — 2007. — №1. — С.23-26.
- Ивашков В.Ю., Сопромадзе С.В., Доколин Р.М. и др. Применение метода гипербарической оксигенации для лечения осложнений после реконструктивных операций в онкологии // Саркомы костей, мягких тканей и опухоли кожи. — 2017. — №1. — С.46-51.
- Sealy R. Hyperbaric oxygen in the radiation treatment of head and neck cancers. Radiother Oncol. 1991; 20(1): 75-79. doi: 10.1016/0167-8140 (91)90192-j.
- Kim K, Ahaneku H, Deborah M, et al. P1590: outcome of hyperbaric oxygen therapy in patients with hematologic malignancies –a tertiary cancer center experience. Hemasphere. 2022; 6: 1471-1472. doi:10.1097/01.HS9. 0000849216.77483.dd.
- Панов А.В., Миндубаев Э.Ю., Насруллаев М.Н. и др. Гибридная радиомодификация в лечении местно-распространенного рака шейки матки // Поволжский онкологический вестник. — 2013. — №4. — С.26-32.
- Tanaka T, Minami A, Uchida J, Nakatani T. Potential of hyperbaric oxygen in urological diseases. Int J Urol. 2019; 26(9): 860-867. doi: 10.1111/ iju.14015.


