Возможности применения холодной атмосферной плазмы в онкологии (обзор литературы)
Автор: Короткий Владимир Николаевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Лучевая и фотодинамическая терапия, используемые при противоопухолевом лечении, генерируют только активные формы кислорода. Вместе с тем было показано, что высокие концентрации NO индуцируют апоптоз опухолевых клеток, предполагая, что азотзависимый стресс может быть одним из решающих факторов в противоопухолевой терапии. Холодная атмосферная плазма (CAP) представляет собой высокореактивное ионизированное физическое состояние, которое вызывает различные биологические эффекты. Процессы ионизации, диссоциации, возбуждения и рекомбинации атомов и молекул в низкотемпературной плазме (НТП) приводят к образованию большого количества активных форм кислорода и азота. В обзоре представлены результаты исследований, раскрывающих механизм противоопухолевого действия НТП, ее воздействие на различные клеточные линии опухолей, описаны результаты лечения опухолей на моделях животных. Высказываются предложения по применению НТП в терапии злокачественных новообразований.
Холодная атмосферная плазма, злокачественные опухоли, гелий, аргон, азот, смесь гелия и кислорода, воздух
Короткий адрес: https://sciup.org/140254164
IDR: 140254164 | УДК: 616-006-08:533.92]-092.9 | DOI: 10.21294/1814-4861-2018-17-1-72-81
Текст обзорной статьи Возможности применения холодной атмосферной плазмы в онкологии (обзор литературы)
В последнее время большое внимание уделяется изучению влияния активных форм кислорода и азота (АФКиА) на появление опухолевых клеток, прогрессию опухоли и ее лечение. Механизм действия лучевой терапии и химиотерапии нередко опосредован генерацией АФКиА, действующих непосредственно на опухолевые клетки [1].
Плазма – частично ионизированный газ, содержащий ионы, электроны и незаряженные частицы (атомы, молекулы и радикалы) [2]. Плазма может быть двух типов: горячая и негорячая или низкотемпературная (холодная) атмосферная (НТП), которая в месте контакта имеет температуру ниже 104°F, т.е. комнатную температуру [2]. Для получения НТП используются различные газы (гелий, аргон, азот, смесь гелия и кислорода, воздух) [2, 3]. В зависимости от источника НТП состав и концентрация отдельных компонентов АФКиА различны [2–4].
Процессы ионизации, диссоциации, возбуждения и рекомбинации атомов и молекул в плазме приводят к образованию большого количества активных форм кислорода (АФК): атомарный кислород (О) [5, 6], гидроксил (ОН) [7], супероксид (О2-) [8], синглет-дельта кислород (1О2) [9] и пере- киси кислорода (Н2О2) [10], – и, в зависимости от используемого газа (газовой смеси) и геометрии плазмы, большого количества активных форм азота (АФА): атомарный азот (N) [11], оксид азота (NO) [12], периоксинитрит (ONOO-) [13] и других активных форм NOx-семейства. Известно, что лучевая и фотодинамическая терапия, используемые при противоопухолевом лечении, генерируют только АФК. Вместе с тем было показано, что высокие концентрации NO индуцируют апоптоз опухолевых клеток, предполагая, что азотзависимый стресс может быть одним из решающих факторов в противоопухолевой терапии [14].
Участие АФК в инициации и прогрессии опухоли [15] и их лечебный потенциал [16] внимательно изучаются долгие годы. Угроза малых количеств АФК хорошо переносится любой клеткой и нейтрализуется специальными ферментами, в том числе супероксиддисмутазой и каталазой [17]. Врожденная повышенная метаболическая активность в злокачественных клетках (эффект Варбурга) может представлять собой терапевтическую цель, поскольку опухолевые клетки по существу уже находятся на границе переносимости АФК по сравнению с нормальными клетками [1, 18]. Именно
поэтому в противоопухолевой терапии долгие годы используются различные методики, при которых генерируется большое количество АФК (лучевая и фотодинамическая терапия, некоторые химиопрепараты), что приводит к гибели злокачественных клеток [19–21]. Способность генерировать АФКиА [22] позволяет рассматривать холодную атмосферную плазму как весьма эффективного кандидата в состав противоопухолевой терапии.
Цель исследования – подытожить современные знания о механизмах биологического действия НТП на опухолевые клетки и представить возможные направления клинического применения НТП в составе противоопухолевого лечения.
Воздействие НТП на клетки и ткани – многофазный процесс, который начинается непосредственно при генерации плазмы, за которой следует фаза послесвечения плазмы, приводя к диффузному взаимодействию с жидкостьподобным слоем или окружением. Жидкую среду можно представить либо лечением культуры клеток в лабораторных экспериментах, либо физиологической жидкостью внутри и вокруг опухоли при клиническом применении НТП. Именно жидкая среда, модифицированная плазмой, влияет на клетки и ткани вокруг нее [23]. T. Murakami et al. [23] предложили глобальную модель, описывающую этот процесс, вовлекающий более 60 различных активных форм и около 1000 различных реакций. A.M. Hirst et al. [24] схематично представили этот процесс (рис. 1) с приблизительным временным масштабом для различных явлений в плазме и жидких фазах и последующее биологическое взаимодействие. Результаты дальнейших исследований [6, 11, 25–27] расшифровывают сложный химический процесс на границах газ – жидкость – ткань фаз, что позволяет точнее оценить механизм воздействия НТП на опухолевые клетки.
Биологическое действие НТП на опухолевые клетки исследовалось на различных клеточных линиях (табл. 1–2). M. Vandamme et al. [40] представили результаты одного из первых экспериментов по воздействию НТП на опухоль in vivo . Опухолевые клетки U87-Luc глиомы в количестве 4×106 клеток в 0,1 мл физиологического раствора были подкожно введены самкам мышей (бестимусные голые мыши Balb/c и C57bl6 мыши). Лечение пульсами НТП (3 раза по 2 мин 100 Гц с интервалами 1 мин) в течение 5 дней было начато, как только опухолевый объем достиг размера 150 ± 50 мм3. Авторами показано, что через 24 ч после первого пульса у всех подопытных мышей было отмечено повышение биолюминесценции опухоли в 1,3 раза, что может свидетельствовать о повышении активности в опухолевых клетках вследствие эффекта реоксигенации, связанного с большим количеством АФК, что обычно наблюдается при действии малых доз облучения [56, 57]. Подобный эффект повышает чувствительность опухолевых клеток к дальнейшему воздействию, что и было отмечено через 5 дней лечения пульсами НТП, наблюдалось снижение интенсивности биолюминесценции на 54–88 %,
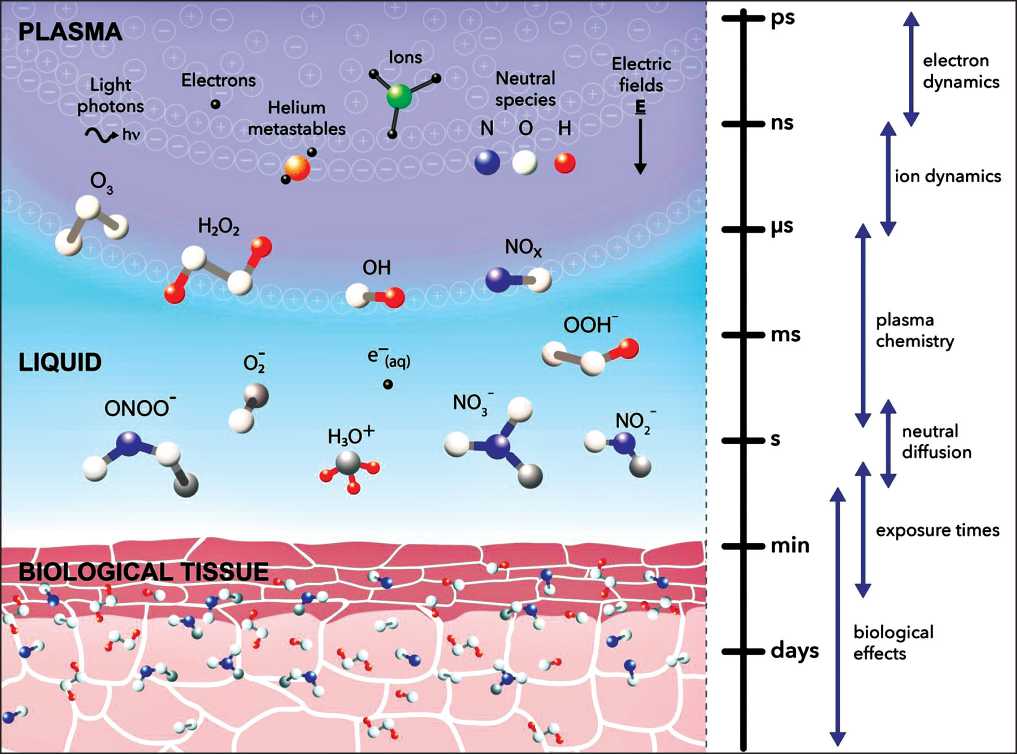
Рис. 1. Схематичное представление многофазного перехода генерированных НТП форм в биологический объект [24]. Показаны основные компоненты плазменной фазы, включая ионы, фотоны и нейтральные частицы, приводящие к генерации различных АФКиА по границе раздела плазма –жидкость и их продвижение и диффузия через произвольный слой биологической ткани. Справа представлены приблизительные временные рамки основных событий на границе плазма – жидкость и биологическое взаимодействие
Таблица 1
Доклиническое исследование биологического действия холодной атмосферной плазмы на опухолевые клетки
Было зарегистрировано, что АФК генерируются в клетках, подверженных стрессовым состояниям, таким как гипоксия, воздействие химических веществ, УФ-излучения и т. д., которые вызывают повреждение внутриклеточных органелл и мембран, белков, ДНК и липидов, что приводит к гибели
Таблица 2
Механизмы гибели опухолевых клеток под действием холодной атмосферной плазмы
|
Клеточная линия |
Среда |
Длительность воздействия |
Механизм гибели клеток |
Источник |
|
Клеточные линии рака простаты (PC-3 и LNCaP) |
Суспензия, объем 500 мкл |
10 сек |
Апоптоз |
[38] |
|
Клеточные линии глиомы (U87, U373, A172) |
Адгезированные клетки, 96-лунковая плашка, ~40 % слияния |
До 180 сек |
Апоптоз / некроз |
[44] |
|
Клеточная линия лимфомы (U937) |
Адгезированные клетки, плашки 10 см, объем 5 мл |
До 480 сек |
Апоптоз |
[28] |
|
Злокачественные клеточные линии различного происхожде- |
Адгезированные клетки, плашки |
30–60 сек, до 10 повторяющихся |
Апоптоз |
[12] |
|
ния |
воздействий |
|||
|
Клеточные линии колорек- |
Адгезированные клетки в различ- |
|||
|
тального рака (Caco2,HCT116, |
ных многолуночных культураль- |
До 30 сек |
Апоптоз |
[47] |
|
SW480, HT29) |
ных плашках |
|||
|
Клеточные линии глиомы и колоректального рака (U87MG- |
Адгезированные клетки, 24-лунковая плашка, объем 500 мкл |
До 30 сек |
Апоптоз |
|
|
Luc2, HCT-116-Luc2) |
6 мин ежедневно, |
[48] |
||
|
Ксенографт глиомы (U87MG-Luc2) |
Подкожная опухоль |
последовательно в течение 5 дней |
Апоптоз |
|
|
Клеточные линии рака головы и шеи (FaDu, SNU1041, SNU899, HN9) |
Суспензия, плашки 6 см, объем 3 мл |
1 сек при 2 кВ или 4 кВ 20 сек ежедневно, |
Апоптоз |
[8] |
|
Ксенографт FaDu |
Подкожная опухоль |
последовательно в течение 20 дней |
Апоптоз |
|
|
Различные клеточные линии меланомы |
Адгезированные клетки, различные культуральные плашки без культуральной среды |
До 120 сек |
Физиологическое старение, апоптоз |
[49, 58–65] |
|
Первичные эпителиальные клетки рака предстательной |
Суспензия, объем 1,5 мл |
До 600 сек |
Некроз, аутофагия |
[10] |
|
железы |
клеток путем апоптоза. В последних работах были изучены различные механизмы действия CAP в раковых клетках, которые включают: активацию генов белка p53 [66] и р21 CDK ингибитора [67], арест клеточного цикла в фазах G2/M и S [68], опосредованный АФК арест клеточного цикла [48] и апоптоз вследствие дисфункции митохондрий [69, 70]. K. Panngom et al. [71] продемонстрировали снижение активности митохондриальных ферментов и мембранного потенциала митохондрий в опухолевых клетках после воздействия на них НТП. Кроме того, экспериментально было доказано, что НТП может контролировать внутриклеточное содержание АФКиА и перекисей [72]. Основные пути передачи клеточных сигналов и функции белков могут быть нарушены или полностью повреждены в результате сильного и продолжительного нарушения окислительно-восстановительных сигналов под действием НТП [73].
В целом противоопухолевые механизмы воздействия НТП различны: повреждение ДНК вследствие внутриклеточного накопления АФКиА [46, 50, 74, 75], снижение жизнеспособности и клоногенности клеток [51, 52], снижение пролиферации [38], арест клеточного цикла [53, 54, 76], феномен естественного старения клеток [55] и не-апоптотическая гибель опухолевых клеток [52], причем с дозозависимым эффектом. Ключевыми молекулами противоопухолевого эффекта НТП оказались Н2О2 и NO [77].
Многими исследователями было показано, что растворы, подвергшиеся воздействию НТП, способны оказывать сходное с прямым воздействием НТП действие на опухолевые клетки [78–81]. H. Tanaka et al. исследовали действие обработанного НТП раствора Рингера с лактатом на клеточные линии U251SP клетки (клеточная линия глиобластомы человека), MCF10A клетки (клеточная линия эпителиальных клеток грудной железы человека), SiHa клетки (клеточная линия рака шейки матки человека), SK-OV-3 клетки (клеточная линия рака яичников человека) и клеточную линию
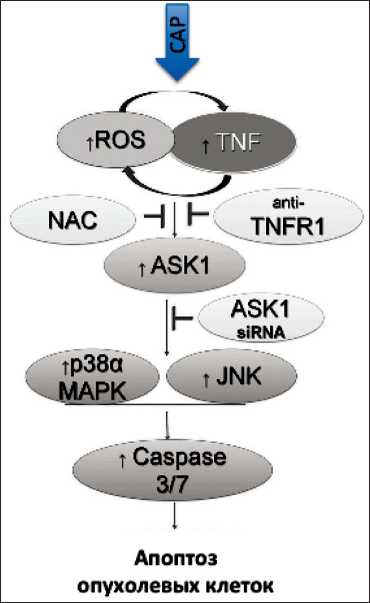
Рис. 2. Модель индукции холодной атмосферной плазмы апоптоза опухолевых клеток [65]. Индуцированная НТП продукция АФК и активация сигнального пути TNF за счет прямого или непрямого взаимодействия клеток, которые приводят к активации сигнального пути ASK1, далее стимуляции p38α MAPK или JNK для последующей индукции Caspase-3/7-зависимого апоптоза опухолевых клеток человеческих кератиноцитов новорожденного [80]. Исследования показали, что облучение НТП L-лактата, входящего в состав раствора, приводит к образованию большого количества Н2О2, что и обеспечивает противоопухолевый эффект как в культуре клеток, так и в эксперименте на модели ксенографных мышей. Вместе с тем под действием НТП из лактата образуются группы, подобные уксусной и пировиноградной кислотам, которые также обладают выраженным противоопухолевым эффектом. Авторы продемонстрировали различную чувствительность опухолевых клеток к обработанному НТП раствору [80].
Список литературы Возможности применения холодной атмосферной плазмы в онкологии (обзор литературы)
- Gorrini C., Harris I.S., Mak T.W. Modulation of oxidative stress as an anticancer strategy. Nat Rev Drug Discov. 2013 Dec; 12 (12): 931-47. DOI: 10.1038/nrd4002
- Fridman A. Plasma Chemistry. Cambridge University Press: Cambridge, 2008. 979.
- Fridman G., Friedman G., Gutsol A., Shekhter A.B., Vasilets V.N., Fridman A. Applied plasma medicine. Plasma Process Polym. 2008; 5: 503-533.
- Короткий В.Н. Низкотемпературная атмосферная плазма в дерматологии. Клиническая дерматология и венерология. 2017; 16 (5): 4-11. DOI: 10.17116/klinderma20171654-10
- Waskoenig J., Niemi, K., Knake N., Graham L.M., Reuter S., Schulz-Von Der Gathen V., Gans T. Atomic oxygen formation in a radiofrequency driven micro-atmospheric pressure plasma jet. Plasma Sources Sci Technol. 2010; 19 (4): 045018.


