Возможности применения имплантатов, изготовленных из различных материалов, в хирургии поясничного спондилодеза (обзор)
Автор: Шувалов С.Д., Толкачев В.С., Бажанов С.П., Шульга А.Е., Островский В.В., Ульянов В.Ю.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Травматология и ортопедия
Статья в выпуске: 4 т.20, 2024 года.
Бесплатный доступ
Цель - провести сравнительный анализ показателей остеоинтеграции межпозвоночных имплантатов из полиэфирэфиркетона (PEEK), титанового (Ti) сплава и пористого Ti после заднего поясничного межтелового спондилодеза. Методика написания обзора. Поиск англоязычных и отечественных источников осуществляли в системах PubMed и eLibrary по ключевым словам «межтеловой спондилодез», «поясничный отдел позвоночника», «кейдж», «ортопедические имплантаты», «остеоинтеграция», «пористый титан», «interbody fusion», «lumbar spine», «cage», «orthopedic implants», «osseointegration», «porous titanium». Период поиска - 1953-2023.
Дорсопатия, межтеловой спондилодез, ортопедические имплантаты, остеоинтеграция
Короткий адрес: https://sciup.org/149148642
IDR: 149148642 | УДК: 617.3:616.711.6:611.018.4 | DOI: 10.15275/ssmj388
Текст обзорной статьи Возможности применения имплантатов, изготовленных из различных материалов, в хирургии поясничного спондилодеза (обзор)
EDN: FNOARA
1Введение . Спондилодез — хирургический метод, направленный на стабилизацию позвоночника путем сращивания двух или более позвонков. Это вмешательство становится необходимым, когда другие хирургические методы лечения патологий позвоночника, таких как спондилолистез, переломы позвоночника, стеноз позвоночного канала и спондилолиз, оказываются неэффективными. Примечательно, что число такого рода заболеваний растет, и при пересчете на 100 тыс. взрослого населения прирост составляет 4,3% для деформирующих дорсопатий, 3,7% — для артропатий и 1,2% — для остеопатий и хондропатий ежегодно [1]. Наиболее значительные темпы роста наблюдаются в демографической группе в возрасте 65 лет и старше, что объясняется такими факторами, как старение населения, изменение образа жизни [2]. Однако частота повторных операций на позвоночнике, составляющая от 10 до 20%, является серьезной проблемой для пациентов, хирургов и системы здравоохранения в целом [3].
Цель — провести сравнительный анализ показателей остеоинтеграции межпозвоночных имплантатов из полиэфирэфиркетона (PEEK), титанового (Ti) сплава и пористого Ti после заднего поясничного межтелового спондилодеза.
Методика написания обзора. Для реализации цели исследования отобрано 22 оригинальных исследования, опубликованные в период с 1953 по 2023 г. Базой для отбора послужили следующие интернет-ресурсы: eLibrary, PubMed. Отбор осуществляли по следующим ключевым словам: «межтеловой спондилодез», «поясничный отдел позвоночника», «кейдж», «ортопедические имплантаты», «остеоинтеграция», «пористый титан», «альтернативные материалы», «interbody fusion», «lumbar spine», «cage», «orthopedic implants», «osseointegration», «porous titanium», а также по спискам литературы найденных публикаций.
Критериями включения статей стали оригинальные исследования, в которых представлены данные о возможностях применения имплантатов из пористого Ti и комбинированных каркасов в хирургии поясничного спондилодеза. Исключали повторяющиеся статьи. Схема отбора источников представлена на рисунке.
Результаты обзора. В 1933 г. D. Сареnеr впервые применил передний спондилодез пятого поясничного ( L V) и первого крестцового позвонка ( S I) с использованием трансплантата для лечения спондилолистеза. Несмотря на свои биомеханические преимущества, этот подход столкнулся с критикой среди клиницистов из-за его травматичности [4]. Десять лет спустя R. B. Cloward выполнил первый задний поясничный межтеловой спондилодез, который включал в себя удаление межпозвоночного диска и концевых хрящевых пластин путем частичной двусторонней ламинэктомии и, по сути, полной фасетэктомии. Позднее R. B. Cloward выполнил аналогичную операцию, использовав для формирования спондилодеза три крупных костных трансплантата,
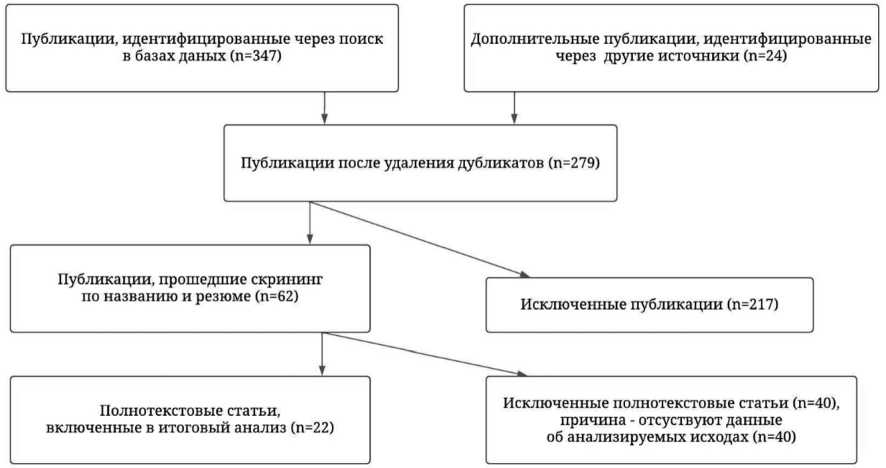
Методология отбора литературных источников
полученных из гребня подвздошной кости [5]. Исторически для стабилизации позвоночника и спондилодеза в межпозвоночное пространство имплантировали костные трансплантаты, такие как аутокость из гребня подвздошной или малоберцовой костей, а также аллотрансплантаты. Однако эти альтернативы связаны с дефицитом соответствующего донорского участка и недостаточной стабильностью позвоночника [6]. Спондилодез только с помощью костного трансплантата связан с высокой частотой выпадения фрагмента, что в итоге приводит к псевдоартрозу. Для устранения этих осложнений в 1980-х гг. приобрела популярность дополнительная стабилизация позвоночника с помощью транспедикулярных винтов, соединенных стержнями, для достижения стабильного спондилодеза.
Современные хирургические методы спондилодеза в значительной степени основаны на применении аутокостного трансплантата (АКТ) или его заменителей для достижения стабильного костного блока. АКТ остается критически важным компонентом для стабилизации позвоночно-двигательного сегмента из-за присущих ему свойств остеогенного потенциала, остеоиндуктивности и остеокондук-тивной способности [7]. Современные методы лечения предполагают использование фрагментов АКТ для повышения их остеогенного потенциала и облегчения их интеграции в межпозвонковом пространстве и полостных областях клеток. Гребень подвздошной кости часто используется в качестве источника для получения АКТ, однако его применение ограничено несколькими факторами: размером и объемом материала, болезненностью донорского участка после извлечения кости, что может привести к постоянным болям у 30% пациентов, а также наличием ограниченного количества жизнеспособных и биологически активных клеток в трансплантате. Количество стволовых клеток, присутствующих в трансплантате, заметно уменьшается после 55 лет [8, 9].
Частота консолидации позвоночно-двигательного сегмента поясничного отдела позвоночника после спондилодеза колеблется от 5 до 35%. Следовательно, необходима тщательная оценка существующего подхода к лечению и проведение клинических исследований, направленных на разработку более сложных методов, способствующих эффективному формированию костного блока [10].
Применение кейджей/клеток впервые описано G. W. Bagby в контексте лечения синдрома Воббле-ра у лошадей, включающего артродез дистракционно-компрессионным методом с использованием цилиндрического имплантата из нержавеющей стали в форме стержня [11]. Адаптированный для использования человеком метод межтеловой стабилизации при хронических дискогенных болях в пояснице, разработанный G. W. Bagby и S. D. Kuslich, включает «корзину Бэгби» и АКТ. Новый метод обеспечил хорошую скорость формирования костного блока. За 6 мес после операции при применении «корзины Бэгби» с добавлением аутотрансплантата наблюдалось частичное (20%) формирование костного блока, а в сочетании с рекомбинантным костным морфогенетическим белком-2 человека (rhBMP-2) его формирование достигло 100% [12]. Таким образом, применение межтеловых корзин обеспечивало дополнительную стабильность и скорость формирования спондилодеза за счет восстановления высоты диска и нейрофораминального объема.
На протяжении 1990-х гг. межтеловой спондилодез с использованием традиционных металлических корзин, в первую очередь титан-алюминиево-вана-диевых (Ti6Al4V или Ti), получил широкое коммерческое распространение. В то время как Ti обеспечивает долговечность, прочность, остеокондуктивность и устойчивость к коррозии, его высокий модуль упругости приводит к осложнениям — травмам концевых пластин, заболеваниям смежных сегментов и проседанию каркаса. В начале 2000-х гг. использование корзин из PEEK получило широкое распространение. Они обладают благоприятным модулем упругости, близким к костному, что обычно способствует увеличению скорости заживления [13]. Однако биоинерт-ная природа PEEK снижает его остеоинтегрирующую способность, а такие требует более тщательной подготовки концевой пластины и ведет к чрезмерной дистракции позвоночного столба, что снижают эффективность имплантата из РЕЕК [14].
Исторический переход от традиционных металлических корзин к использованию имплантатов из PEEK позволил существенно изменить подход к решению биомеханических задач. Хотя каждый материал обладает своими особыми преимуществами, стремление к идеальному балансу между прочностью, остеокондукцией и биосовместимостью стимулировало поиск дальнейших инноваций. В 2010-х гг. появились гибридные материалы и модификации поверхностей, что привело к разработке композитных материалов на основе PEEK с покрытием из Ti (Ti-PEEK). Эта инновация объединила механические преимущества PEEK с желаемыми характеристиками биосовместимости Ti. Растущая популярность аддитивного производства с конца 2010-х гг. позволила создавать биомиметические структуры, имеющие пористость и биомеханические свойства кортикальной кости. Этот технологический прорыв лег в основу создания межслойных каркасов с остео-кондуктивными покрытиями и топографическими модификациями, направленными на оптимизацию остеоиндуктивных, остеокондуктивно-проводящих и остеогенных свойств каркасов. Хотя для подтверждения эффективности этих устройств необходимы более масштабные клинические испытания in vitro , in vivo , первоначальные клинические испытания продемонстрировали их жизнеспособность [15]. Вместе с тем основные проблемы, такие как расслаивание и воспалительные реакции из-за износа, остаются значительными [16].
Несмотря на достижения в области производства титановых имплантатов методом селективного лазерного спекания (selective laser sintering), которые улучшают биомиметические свойства и биомеханические характеристики каркасов позвоночника из Ti, PEEK остается наиболее востребованным материалом для спинальной хирургии [17]. Моделирование методом плавленого осаждения PEEK более экономично по сравнению с SLS, что может способствовать его продолжающейся распространенности в хирургии позвоночника.
Имплантаты из пористого титана. Последние разработки в области технологий изготовления селективного лазерного спекания и электроннолучевого лазерного плавления позволяют широко использовать пористые Ti-имплантаты, которые по сравнению с твердыми металлическими имплантатами имеют меньший вес, большую контактную поверхность и могут обладать механическими свойствами, которые больше напоминают человеческую кость [18]. Кроме того, передовые технологии аддитивного производства позволяют печатать пористые металлические каркасы, которые более точно имитируют сложную трехмерную неоднородную структуру кости. При выборе формы пор, размера и общей пористости крайне важно тщательно учитывать механические свойства и предполагаемую функциональность, поскольку эти факторы существенно влияют на биологические свойства пористых металлических биоматериалов, адгезию и пролиферацию клеток, транспорт питательных веществ и остеоинтеграцию имплантата [19]. Ti-клетки из пористостью от 60 до 70% размером пор 250-750 мкм и связностью пор более 99% могут быть изготовлены с высокой механической прочностью [20].
Анализ in silico показывает, что, по сравнению с твердыми каркасами из Ti или PEEK, каркасы с пористостью от 65 до 80% обеспечивают более высокую биомеханическую прочность в поясничном отделе позвоночника [21]. В доклинических исследованиях на крупных животных продемонстрирована хорошая биосовместимость и остеоинтеграция напечатанных на 3D-принтере клеток из пористого Ti [22, 23]. Например, эти имплантаты продемонстрировали превосходную прочность при выталкивании по сравнению с материалами PEEK или аллотрансплантатами [22]. Примечательно, что на модели овцы напечатанные на 3D-принтере пористые межтеловые каркасы Ti были связаны с усиленным врастанием кости, значительным уменьшением амплитуды движений и улучшением жесткости конструкции для поясничного спондилодеза по сравнению с PEEK и PEEK, покрытым пористым Ti с плазменным напылением. Кроме того, предполагается, что отсутствие стыка между различными материалами с разными модулями в металлических каркасах, напечатанных на 3D-принтере, снижает риск расслоения [23]. Первоначальные клинические данные свидетельствуют о том, что пористые Ti-кейджи обеспечивают превосходные рентгенологические и клинические результаты по сравнению с клетками PEEK, что подчеркивает их успешный переход от доклинических исследований к клиническим [20, 24]. S. Fujibayashi и соавт. имплантировали биоактивные клетки из пористого Ti с аутотрансплантатом по методике TLIF пяти пациентам, добившись успешного сращивания костей в течение 6 мес и значительного улучшения клинических показателей во всех случаях [20]. Скорость оседания клетки составила 6,7% во время операции и 3,4% — в послеоперационный период — они ниже описанных ранее показателей оседания PEEK-клеток, имплантированных с помощью минимально инвазивного бокового поясничного межтелового спондилодеза (extreme lateral interbody fusion) (от 10,0 до 16,1%) [25–27]. При сравнении PEEK-клеток с покрытием Ti у 34 пациентов с трехмерными каркасами из пористого Ti сплава наблюдали сходные показатели сращения [24]. Однако в группе клеток PEEK с покрытием Ti частота и тяжесть послеоперационного образования кисты концевой пластинки позвонка были выше. Таким образом, необходимы долгосрочные проспективные рандомизированные исследования, в которых сравнивались бы эти материалы и конструкции с обычными клетками, чтобы подтвердить рентгенографическое и клиническое превосходство многообещающих краткосрочных результатов, связанных с пористыми клетками из Ti.
Клетки полиэфирэфиркетона. Благодаря инертности в биологических средах, простоте обработки и способности обеспечивать механическую поддержку, многие неразлагаемые синтетические полимеры широко исследованы для применения в биомедицине. В то время как синтетические полимеры, как правило, устойчивы к гидролитическому, окислительному и другим механизмам разложения, PEEK выделяется как полукристаллический термопластик, обладающий исключительной механической и химической стойкостью. Эти характеристики обеспечивают устойчивость к разрушению после облучения, позволяя проводить стерилизацию PEEK γ-излучением и электронным излучением, сохраняя при этом его механическую прочность в течение длительного времени в динамичных средах [28].
Модуль упругости PEEK практически идентичен модулю упругости кортикальной кости человека, особенно при армировании углеродом, что может обеспечить преимущества в распределении нагрузки и напряжений и таким образом уменьшить проседание каркаса [13]. Кроме того, по сравнению с Ti, PEEK продемонстрировал значительно меньшую прочность на сжатие при растяжении (в 2,5 раза меньше). В ранних исследованиях высказывались опасения по поводу синовита и распространения не-абсорбируемых полимерных частиц по лимфатической системе [29, 30]. При всем том многочисленные последующие исследования местной и системной токсичности показали, что PEEK не вызывает побочных реакций в тканях [31–33]. В частности, благодаря его радиопрозрачности при компьютерной томографии и магнитно-резонансном сканировании возникает меньше артефактов, что позволяет более точно визуализировать возможную миграцию и состояние костного сращивания [34]. Однако сообщалось о более низкой поддержке остеогенной ткани и более низком уровне интеграции кости при использовании PEEK по сравнению с Ti [13]. Например, при использовании клеток PEEK частота одноуровневого межтелового сращивания составила всего 71 % [34]. Такое снижение скорости сращивания частично объясняется образованием волокнистого слоя на границе «кость — имплантат» из-за химически инертной и гидрофобной поверхности PEEK [16, 35]. В конечном счете это снижает способность к остеоинтеграции и достижению прочного сращивания кости с клеткой, что увеличивает риск долгосрочных осложнений в виде нестабильности.
Примечательно, что клинические исследования не выявили различий в результатах между каркасами из PEEK, Ti и углеродного волокна [13]. Следовательно, рекомендации по выбору наиболее эффективного материала для межтелового сращивания ограничены из-за сходства клинических и рентгенографических результатов между этими материалами. Комбинированные каркасы для спондилодеза Ti/PEEK показали безопасность, эффективность, хорошую частоту сращивания и клинические результаты, сопоставимые со стандартными каркасами PEEK [36]. Таким образом, каркасы PEEK в основном используются в тех случаях, когда необходимы их радиопрозрачные свойства, например при лучевой терапии или после инфекций позвоночника.
Растущая распространенность межтелового спондилодеза, особенно среди пациентов в возрасте 75 лет и старше, представляет собой серьезную проблему для системы здравоохранения. Несмотря на заметный прогресс в хирургических методах и биоматериалах для межтеловых имплантатов, несостоятельность костного блока более чем у 10% пациентов ухудшает общую эффективность лечения, повышает спрос на повторные хирургические вмешательства и увеличивает расходы системы здравоохранения [37].
Ассортимент межтеловых имплантатов претерпел изменения: поверхности устройств из Ti и PEEK модифицируют и покрывают различными материалами. Заметным достижением стало появление имплантата из PEEK, напечатанного на 3D-принтере. Предварительные результаты доклинических испытаний указывают на улучшенную остеоинтеграцию таких имплантатов и врастание в них трабекулярной кости, что обещает потенциальный сдвиг парадигмы в технологии спондилодеза [38]. Поверхность имплантата из PEEK с антибактериальными свойствами и наношероховатостью продемонстрировала потенциал в сращивании в модели дефекта костной ткани овцы, а также отсутствие проблем, связанных с расслоением поверхности, неправильным позиционированием костных фрагментов [39].
Успешная стабилизация и полное сращивание зависит от гармоничной интеграции межпозвоночных имплантатов и протезов или заменителей костных трансплантатов. Появление аддитивного производства способствовало демократизации исследований и разработок медицинского оборудования, оснащению лабораторий инструментами для изучения сложных конструкций межтеловых каркасов, которые адаптируют геометрию, пористость и взаимосвязанность для достижения лучших биомиметических механических характеристик, остеогенной дифференциации и остеоинтеграции в моделях in vivo. Модификации рельефа поверхности, в частности нанесение различных покрытий, антибактериальных элементов и механическое придание шероховатости, способствуют созданию благоприятной среды, создавая оптимальные условия для клеточных процессов, важных для успешного формирования костного блока. По мере развития научных исследований синергетическая взаимосвязь между технологиями и биологическими материалами становится ключом к новым достижениям в области поясничного спондилодеза. Тем не менее переход к более безопасным и эффективным процедурам зависит от совместных усилий и инновационных исследований, в которых особое внимание уделяется тщательной клинической проверке. Хотя испытания in vitro и in vivo дают ценную информацию, для внедрения этих результатов в клиническую практику необходимы надежные клинические доказательства. Согласованная приверженность всесторонним клиническим подтверждениям будет иметь решающее значение для обеспечения того, чтобы многообещающие достижения, наблюдаемые в лабораторных условиях, приносили ощутимую пользу пациентам, проходящим хирургическое лечение, целью которого является формирование спондилодеза.
Характеристика имплантатов для поясничного спондилодеза представлена в таблице.
Характеристики имплантатов для поясничного спондилодеза
|
Материал имплан- Ссылка в списке тата источников |
Заключение: преимущества, недостатки, показания |
|
Ti [13] |
Ti- и PEEK-конструкции обеспечивают одинаковую частоту сращения, но Ti-имплантаты связаны с повышенным риском проседания |
|
[14] |
Преимущества Ti-имплантатов заключаются в их биосовместимости и устойчивости к коррозии. Они обладают высоким уровнем остеоинтеграции, что приводит к оптимальной скорости сращения. Однако Ti-диски имеют относительно высокий модуль упругости по сравнению с костью, что часто приводит к травмам концевых пластин и проседанию. Ti-имплантаты вызывают искажения при МРТ и КТ |
|
[16] |
Преимуществом сплавов Ti является сложная макро-/микро-/наноразмерная шероховатость поверхности, способствующая остеобластной дифференциации и создающая специфическую клеточную среду, которая благоприятствует образованию костной ткани |
|
[24] |
Недостатком Ti является его более высокая жесткость по сравнению с костью, что может привести к экранированию нагрузки на замыкательную пластинку и проседанию имплантата. |
|
[25] |
Проседание пористого Ti межпозвоночного имплантата произошло в 6,7% всех случаев. Этот показатель ниже, чем при спондилодезе с использованием PEEK-имплантатов |
|
Пористый Ti [15] |
Благодаря высокой механической прочности имплантаты из Ti могут быть изготовлены с пористостью от 60 до 70%, размером пор от 250 до 750 мкм и взаимосвязью пор более 99%, подвергнуты химической и термической обработкам для придания им биоактивности. Однако Ti обладает повышенным модулем упругости (по сравнению с PEEK и нативной костной тканью), что делает конструкцию подверженной экранированию напряжений и потенциальному проседанию |
|
[18] |
Конструкции, изготовленные из Ti-сплавов (Ti-6Al-4V), по сравнению с конструкциями из PEEK способствуют лучшей остеоинтеграции |
|
[20] |
Пористый биоактивный сплав Ti (60% пористости, средний размер пор 250 мкм и более 99% взаимосвязанности пор) обладает как высокой способностью к срастанию с костью, так и высокой механической прочностью. Вместе с тем сохраняется сложность придания биоактивных свойств внутренним поверхностям имплантатов с помощью традиционных методов, таких как нанесение покрытия из гидроксиапатита методом плазменного напыления |
|
[21] |
По сравнению с цельным кейджем из Ti или PEEK, пористые Ti-имплантаты имеют ячеистую структуру и шероховатую поверхность, что обеспечивает интеграцию с костной тканью по всей поверхности имплантата. Ячеистые каркасы с пористостью от 69 до 80% обеспечили лучшие биомеханические характеристики |
Окончание табл.
|
Материал имплантата |
Ссылка в списке источников |
Заключение: преимущества, недостатки, показания |
|
[22] |
Прочность на выталкивание значительно выше у имплантатов с пористым покрытием Ti по сравнению с PEEK: средняя прочность на сдвиг при выдавливании значительно выше в группе с пористым Ti-каркасом, чем в группах с PEEK или аллотрансплантатом (10,2 МПа против 1,5 и 3,1 МПа соответственно; p <0,05) |
|
|
[23] |
Имплантаты из пористого Ti создают остеокондуктивную поверхность, которая обеспечивает краткосрочную стабильность за счет трения и долгосрочную стабильность за счет адгезии клеток, что приводит к разрастанию костной ткани (непосредственному прилеганию костной ткани к поверхности имплантата) и врастанию (образованию костной ткани в пористой структуре имплантата). Клетки на Ti-имплантате пролиферируют шире и дифференцируются быстрее, чем на имплантате из PEEK. Во время сращивания Ti-имплантат демонстрируют хороший контакт «кость — имплантат» и остеогенные свойства |
|
|
PEEK |
[14] |
Межпозвоночные имплантаты, изготовленные из PEEK, имеют модуль упругости, сравнимый с модулем упругости кости, что позволяет добиться относительно низкой скорости проседания. Однако имплантаты из PEEK имеют гидрофобную поверхность и могут ограничивать остеоинтеграцию. Эффективность PEEK-кейджей снижается в процессе тщательной подготовки торцевых пластин, возникают проблемы с чрезмерным модулем упругости. При этом основным преимуществом PEEK-имплантатов являются их радиопрозрачные свойства, которые позволяют лучше оценить сращивание при визуализации |
|
[15] |
К преимуществам имплантатов из PEEK относится более низкий модуль упругости, позволяющий избежать экранирования напряжений. В то же время PEEK — это гидрофобный материал, с которым клетки имеют ограниченную способность связываться и на котором культивируемые остеобласты дифференцируются в меньшей степени |
|
|
[16] |
Несмотря на все преимущества РЕЕК, имплантаты из этого материала часто покрывается фиброзной тканью, что может быть связано со снижением остеобластной дифференциации клеток-предшественников и создания воспалительной среды. В итоге отсутствие интеграции с костью может привести к проседанию имплантата и несращению |
|
|
[22] |
Привлекательность PEEK в первую очередь заключается в биосовместимости этого материала и возможности воспроизвести механические свойства человеческой костной ткани. Имплантаты из PEEK вызывают меньшее напряжение в месте соединения имплантата с телом позвонка, что может снизить риск проседания по сравнению с металлическими имплантатами. Однако поверхность имплантатов из PEEK, как правило, гладкая, а материал биологически инертен, что препятствует остеоинтеграции. Гистологические исследования показали, что при непосредственном контакте костной ткани с имплантатами из PEEK образуется больше волокнистой ткани, чем костной. Таким образом, достижение стабильности и сращивания зависит от соединения костных фрагментов через отверстия в имплантате, а не от дополнительного эффекта врастания костей в кейдж. Отсутствие костной ткани, врастающей в устройство, может замедлить сращение |
|
|
[23] |
Имплантаты из PEEK демонстрируют прочность и модуль Юнга, близкий к нативной кости, сам материал обычно не интегрируется в кость после имплантации. Вместе с тем PEEK по своей природе гидрофобен и не способен соединяться с костной тканью для достижения прочного сращивания, что может вызвать миграцию имплантата |
|
|
[24] |
Химическая инертность и гидрофобность PEEK, которые обеспечивают биосовместимость, ограничивают прямую адгезию клеток к поверхностям имплантатов. Авторы сообщают о худших рентгенологических результатах из-за псевдоартроза после межтелового сращивания в поясничном отделе с использованием PEEK-имплантатов, чем с Ti-имплантатами |
|
|
[32] |
Межпозвоночные имплантаты из PEEK устойчивы к коррозии и вызывают минимальную аллергическую реакцию. При этом модуль упругости и прочность композитного имплантата можно регулировать, изменяя содержание и ориентацию волокон. Авторы продемонстрировали отсутствие цитотоксической реакции имплантатов из PEEK на любую из экстракционных жидкостей |
|
|
[33] |
Модуль упругости чистых (незаполненных) полимеров можно подогнать под модуль упругости кортикальной кости или Ti-сплава, изготовив композиты, армированные углеродным волокном, с разной длиной и ориентацией волокон, и таким образом изготовить индивидуальный имплантат под каждого конкретного пациента |
|
|
[34] |
PEEK-кейджи, заполненные аутотрансплантатом или rhBMP-2 на коллагеновой губке, продемонстрировали рентгенологическую консолидацию, повышенную биомеханическую жесткость и гистологическую консолидацию. Не замечено деградации устройства или износа. В тканях вокруг имплантата наблюдалось легкое хроническое воспаление |
|
|
Ti/PEEK |
[35] |
Добавление Ti-покрытия обеспечивает не только стабильность за счет повышенной шероховатости поверхности, но и долгосрочную стабильность за счет образования костной ткани из остеокондуктивной микросреды на поверхности устройства |
|
[36] |
Имплантаты Ti/PEEK продемонстрировали показатели сращивания и клинические результаты, аналогичные стандартным PEEK-кейджам |
Заключение . Ti-кейджи и покрытые Ti-имплантаты из PEEK, используемые для межтелового спондилодеза в поясничном отделе позвоночника, демонстрируют схожие показатели проседания, но более высокую скорость сращения по сравнению с PEEK-кейджами. Для более точной оценки влияния материалов каркасов и потенциальных факторов, которые могут повлиять на исход хирургического лечения, необходимы рандомизированные контролируемые исследования.
Финансирование. Финансирование исследования осуществляется в соответствии с соглашением Министерства здравоохранения Российской Федерации на выполнение государственного задания «Разработка прототипов имплантата для замещения тела позвонка грудного и поясничного отделов позвоночника и инструментария для его установки» (номер государственной регистрации НИОКТР 1023022700061-0-3.2.10).
Вклад авторов. Все авторы внесли эквивалентный вклад в подготовку публикации.


