Возможности применения "пропеллерного" лоскута для устранения объемного дефекта подмышечной ямки после лимфаденэктомии по поводу рака молочной железы
Автор: Решетов Игорь Владимирович, Хияева Виктория Аркадьевна, Кудрин Константин Геннадьевич, Фатьянова Анастасия Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 5 т.20, 2021 года.
Бесплатный доступ
Цель исследования - оценить возможности применения «пропеллерного» лоскута для устранения объемного дефекта подмышечной ямки после лимфаденэктомии у больных раком молочной железы. Материал и методы. По данной методике прооперировано 100 пациенток: 64 выполнена радикальная модифицированная мастэктомия по Мадену и 36 - радикальная резекция молочной железы с применением «пропеллерного» мышечного лоскута. Катамнез прослежен у 61 пациентки - 50 выполнена мастэктомия и 11 - радикальная резекция с использованием «пропеллерного» лоскута. Случайным образом были отобраны 15 пациенток для осмотра и исследования состояния лоскута при помощи УЗИ. Двум выполнена радикальная резекция, 13 - радикальная мастэктомия с использованием «пропеллерного» лоскута. Срок наблюдения составил от 3 до 6 мес. Предметом изучения были такие явления, как кровотечение в послеоперационном периоде, гематома, длительность лимфореи, сроки госпитализации, данные ультразвукового исследования, функция руки, размер верхней конечности, физическая активность. результаты. Статистически значимых различий в количестве осложнений в зависимости от объема операции не выявлено. Кровотечений в группах не прослежено. Организовавшаяся гематома малых размеров зарегистрирована у одной пациентки в группе резекций. У 43 (70,49 %) пациенток после удаления дренажа лимфореи не было. У 9 (14,75 %) больных лимфорея продолжалась до 1 мес, у 4 (6,56 %) - в течение 1-2 мес, у 5 (8,2 %) пациенток - 3 мес и более. У 12 (19,67 %) больных развился лимфоотек руки. Срок госпитализации составил 7 койко-дней в 90,0 % случаев. Жизнеспособность лоскута достигла 100,0 %. У 54 (88,53 %) из 61 опрошенной активная функция руки восстановилась сразу. Спустя 3 года после операции 38 (62 %) пациенток имели статус ECoG 1. Заключение. Лоскут позволил решить локальные задачи укрытия аксиллярного сосудисто-нервного пучка при выполнении лимфаденэктомии при раке молочной железы и устранения объемного дефекта подмышечной ямки. Полученные результаты продемонстрировали высокие показатели приживления при малом количестве осложнений независимо от объема операции на молочной железе.
Рак молочной железы, подмышечная лимфаденэктомия, «пропеллерный» лоскут, лимфорея
Короткий адрес: https://sciup.org/140261323
IDR: 140261323 | УДК: 618.19-006.6-089.843 | DOI: 10.21294/1814-4861-2021-20-5-41-48
Текст научной статьи Возможности применения "пропеллерного" лоскута для устранения объемного дефекта подмышечной ямки после лимфаденэктомии по поводу рака молочной железы
Ежегодно в мире выявляют около 1 млн новых случаев рака молочной железы (РМЖ). По данным ЮНЕСКО, рак молочной железы является одной из ведущих причин смертности женщин молодого возраста. В 2019 г. в России выявлено 66 990 новых случаев данного заболевания. Хирургический метод является доминирующим в лечении больных РМЖ, несмотря на развитие и совершенствование методик лучевой терапии, внедрение в клиническую практику эффективных лекарственных препаратов. Однако, по данным ряда авторов, в 20–93 % случаев хирургическое лечение сопровождается развитием различных осложнений в раннем и позднем послеоперационных периодах [1–3].
Хирургическая реабилитация больных включает не только восстановление объема молочной железы, удаленной полностью или частично, с применением протезов, собственных тканей либо их сочетании, но и интраоперационную профилактику возможных осложнений. Вследствие подключично-подмышечно-подлопаточной лимфаденэктомии при местнораспространенных стадиях РМЖ образуется полость. Из-за недостаточного прилегания кожных лоскутов к грудной стенке и пересечения значительного числа лимфатических сосудов в ране накапливается серозная и геморрагическая жидкость, что способствует формированию лимфоцеле (серомы). Различные авторы сообщают о развитии сером у 25–81 % оперированных больных [4, 5]. Обильная лимфорея, сформировавшееся лимфоцеле приводят к грубому разрастанию рубцовой соединительной ткани в области лимфаденэктомии. В результате у пациенток формируется выраженный косметический дефект в подмышечной области, а также высок риск развития постмастэктомического синдрома [1, 5]. При развитии данных осложнений значительно увели- чиваются сроки госпитализации больных (койкодень) и количество необходимых амбулаторных визитов к доктору, что приводит к увеличению финансовых затрат на лечение [6].
При послеоперационной лучевой терапии вследствие возможного постлучевого фиброза и сужения просвета подключичной вены вероятность возникновения лимфатического отека верхней конечности повышается до 70 % [7]. Данное осложнение может привести не только к снижению качества жизни, но и к инвалидизации пациентки.
Многими авторами разрабатывались методы, направленные на интраоперационную профилактику лимфореи при хирургическом лечении РМЖ, однако не все они были эффективны и приводили к удовлетворительному косметическому результату. Вышеизложенные факты указывают на необходимость разработки новых профилактических методов, которые могли бы способствовать закрытию свободного пространства в подмышечной области, сформированного в результате лимфаденэктомии, что приведет к уменьшению частоты развития ранних и поздних послеоперационных хирургических осложнений, улучшит косметический результат, поспособствует повышению качества жизни пациенток.
В последние годы пропеллерные лоскуты стали популярным вариантом для укрытия широкого спектра дефектов. Термин «пропеллерный» лоскут был впервые использован в 1991 г. H. Hyakusoku et al. для описания кожно-жирового лоскута, базирующегося на центральной подкожной ножке, с формой, напоминающей пропеллер, который повернут на 90°. Четкое определение пропеллерного лоскута дано в 2009 г. на первом Токийском съезде по перфорантным и пропеллерным лоскутам и определено как «островной» лоскут, который посредством осевого вращения на своей сосудистой ножке перемещается в реципиентную зону. Эти лоскуты все чаще используются для восстановления различных дефектов мягких тканей [8, 9].
Целью методики являются устранение объемного дефекта подмышечной ямки и укрытие сосудов и нервов путем применения местного пропеллерного лоскута, что способствует профилактике длительной лимфореи, развития лимфоцеле, а также формирования вторичного лимфатического отека верхней конечности. Строение и расположение малой грудной мышцы позволяют использовать ее ткань для поставленной цели.
Уникальность сосудистой анатомии подмышечной ямки заключается в дублировании питания основных групп мышц плечевого пояса. В том числе и малая грудная мышца получает питание из двух основных источников: ветки грудоакромиальной артерии и ветки латеральной грудной артерии (рис. 1). В связи с этим имеется возможность без ущерба кровоснабжению мышцы выделить ткань с питанием на ветке грудоакромиальной артерии и ротировать мышечную ткань в пределах подвижности сосуда до 180°.
Цель исследования – оценить возможности применения «пропеллерного» лоскута для устранения объемного дефекта подмышечной ямки после лимфаденэктомии у больных раком молочной железы.
Материал и методы
Всего по данной методике было прооперировано 100 пациенток, из них 64 выполнена радикальная модифицированная мастэктомия по Мадену с применением «пропеллерного» мышечного лоскута, 36 – радикальная резекция молочной железы с применением «пропеллерного» мышечного лоскута. Эти группы явились предметом анализа.
Возраст больных варьировал от 34 до 87 лет, средний возраст – 60,3 года. Избыточную массу тела имели 34 (34 %) больных, 37 (37 %) – страдали ожирением различной степени. У 1 (1 %) больной был дефицит массы тела. В 28 (28 %) наблюдениях масса тела была нормальной. Рак молочной железы I стадии был у 25 больных, II стадии – у 44, III стадии – у 26, IV стадии – у 5 пациенток.
Среди морфологических форм опухолей преобладал инвазивный рак неспецифического типа, протоковый вариант – у 61 больной. Инвазивный дольковый рак диагностирован у 13, инвазивный рак неспецифического типа, смешанный вариант – у 12 пациенток. Другие, более редкие морфологические формы заболевания наблюдались у 14 больных. По фено-генотипической классификации пациентки разделились следующим образом: люминальный А – 40, люминальный В Her-2-neu(-) – 33, люминальный В Her-2-neu(+) – 9, нелюминальный Her-2-neu(+) – 4, тройной негативный – 14 наблюдений. По морфотипу обе подгруппы основной группы распределились пропорционально.
Неоадъювантную химиотерапию получали 27 пациенток. Основным критерием выбора объема операции являлись локализация опухоли и размер органа. При локализации опухоли в верхненаружном квадранте и размере молочной железы по чашечке бюстгалтера 4 и более отдавали предпочтение резекции органа.
После выполнения вмешательства, связанного с удалением молочной железы или части молочной железы с блоком подключичных, подмышечных и подлопаточных лимфатических узлов, большая грудная мышца поднимается мягким крючком, малая грудная мышца отсекается от места прикрепления к 3–5 ребрам и клювовидного отростка лопатки, формируется «пропеллерный» лоскут (рис. 2). Далее лоскут ротируется по часовой стрелке при операции на правой молочной железе и против часовой стрелки при операции на левой молочной железе в область подключичноподмышечных сосудов. При помощи двух хирургических пинцетов мышечный лоскут укладывается
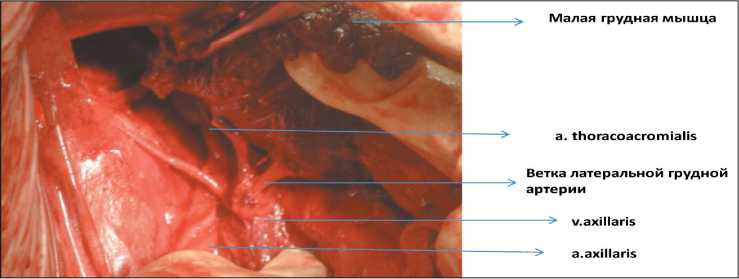
Рис. 1. Кровоснабжение малой грудной мышцы
Fig. 1. Blood supply to the pectoralis minor
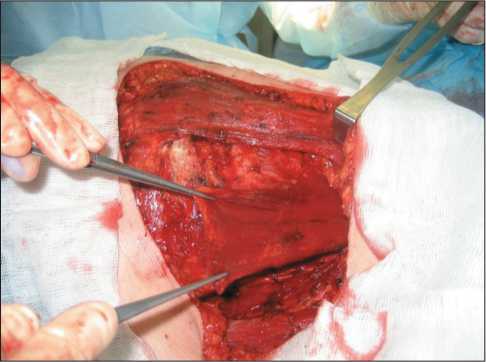
Рис. 2. Этап формирования лоскута из малой грудной мышцы («пропеллерный» лоскут)
Fig. 2. Forming a flap from the pectoralis minor muscle (propeller flap)
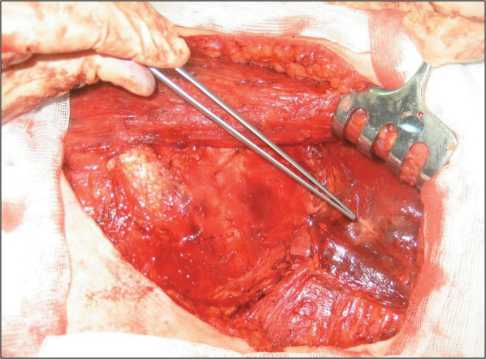
Рис. 3. Пинцетом указан «пропеллерный» лоскут из малой грудной мышцы, ротированный на область подключичноподмышечных сосудов и фиксированный
Fig. 3. Tweezers indicate a propeller flap from the pectoralis minor, rotated to the subclavian-axillary vessels and fixed
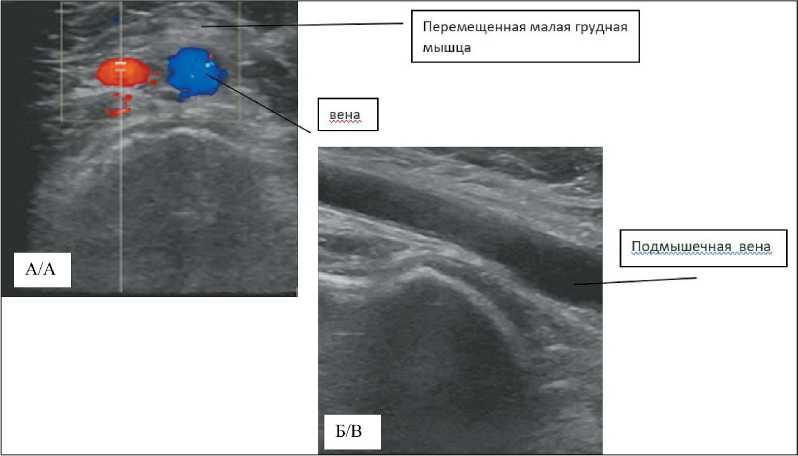
Рис. 4. А – ультразвуковая картина подмышечной области после операции. Отмечены подмышечные сосуды в режиме ЦДК и перемещенная малая грудная мышца; Б – Оценка состояния подмышечной вены при исследовании по продольной оси Fig. 4. A – ultrasound image of the axillary region after surgery. The axillary vessels and the displaced pectoralis minor are seen;
B – Assessment of the axillary vein along the longitudinal axis
на сосуды, укрывая их, и фиксируется редкими поверхностными швами нитью «Викрил 3/0» к окружающим тканям (рис. 3). Таким образом, имевшийся объемный дефект в подмышечной области, сформированный в результате подключично-подмышечно-подлопаточной лимфаденэктомии с обнажением сосудов и нервов, полностью устранен.
В послеоперационном периоде оценивались частота осложнений (кровотечение, гематома, длительность лимфореи), сроки послеоперационной госпитализации, данные ультразвукового исследования, функция верхней конечности, размер верхней конечности, физическая активность пациенток. Показанием для удаления дренажа служил объем лимфореи 40 мл за сут.
Для оценки жизнеспособности лоскута проводили УЗИ зоны операции при помощи аппарата General Electric Logiq 9 (линейный датчик 7–9 МГц) в B-режиме с цветовым допплеровским картированием и в режиме дуплексной цветовой допплерографии. Подключично-подмышечные сосуды осматривались по протяженности, доступной для визуализации для выявления возможных изменений диаметров и исключения их сдавления перемещенной малой грудной мышцей.
Катамнез прослежен у 61 пациентки: 50 больным выполнена мастэктомия с использованием «пропеллерного» лоскута, 11 – радикальная резекция с использованием «пропеллерного» лоскута. Случайным образом были отобраны 15 пациенток для осмотра и исследования состояния лоскута и подмышечных сосудов при помощи УЗИ. Двум из них была выполнена радикальная резекция, 13 – радикальная мастэктомия с использованием «пропеллерного» лоскута. Срок наблюдения составил от 3 до 6 мес. Для оценки отдаленных функциональных результатов (3 года) использовалось анкетирование по шкале ECOG.
Статистическую обработку проводили при помощи прикладной программы DoctorStat v. 1,9. Для каждого параметра сравнения или группы параметров строили таблицу размерностью 2xN, для которой рассчитывали значение точного двухстороннего критерия Фишера.
Результаты
Выявлено малое количество общих осложнений. Кровотечений в раннем послеоперационном периоде в обеих группах не наблюдалось. Образовавшаяся гематома малых размеров зарегистрирована у одной пациентки в группе резекций. Нагноение раны встретилось в одном случае в группе мастэктомий. У большинства пациенток после удаления дренажа лимфореи не было – 43 (70,49 %). Это явление наблюдалось как в группе мастэктомий, так и в группе радикальных резекций. У 9 (14,75 %) пациенток лимфорея продолжалась до 1 мес, у 4 (6,56 %) – в течение 1–2 мес, у 5 (8,2 %) пациенток – 3 мес и более (табл. 1).
У 12 (19,67 %) больных развился вторичный лимфатический отек руки. Этим больным была выполнена расширенная мастэктомия с послеоперационной лучевой терапией в связи с наличием метастатических лимфатических узлов.
При сравнении групп исследования по вышеуказанным параметрам мы не выявили значимых различий в количестве осложнений в зависимости от объема операции. Исключение составляет параметр «Лимфоотек руки», для которого вероятность отсутствия различий по точному двухстороннему критерию Фишера (р-value) составила всего 0,101, что не позволяет уверенно говорить как о различиях групп, так и об отсутствии различий (табл. 1).
Применение методики позволило существенно сократить госпитализацию пациенток до 7 койкодней в 90,0 % случаев, что достоверно выше, чем затяжное лечение более 14 койко-дней (1,0 %) с отсутствием достоверной разницы между группами. При этом надо отметить, что в подгруппе с госпитализацией до 14 койко-дней показанием для продления пребывания в стационаре была отдаленность проживания пациенток и невозможность патронажа в амбулаторной сети, а не реальная реакция раны. Группы «Мастэктомия» и «Резекция» при сравнении по количеству койкодней достоверно не отличаются (табл. 2).
Отмечена высокая жизнеспособность пластического материала, которая достигла 100,0 % по данным ультразвукового исследования с допплерографией. Стеноза подмышечных сосудов у осмотренных пациенток не выявлено (рис. 4а и 4б).
У 54 (88,53 %) из 61 опрошенной активная функция руки восстановилась сразу после операции и лишь 7 (11,47 %) больным на это потребовалось от 1 до 6 мес. При этом быстрее функция восстановилась у пациенток после резекции (табл. 3). При сравнении групп «Мастэктомия» и «Резекция» по срокам восстановления руки до статуса активной функции вероятность отсутствия различий по точному двухстороннему критерию Фишера (р-value) составила 1. Таким образом, группы «Мастэктомия» и «Резекция» по срокам восстановления руки до статуса активной функции достоверно не отличаются. Спустя 3 года после операции 38 (62 %) пациенток имели статус ECOG 1 (из них 11 пациенток, оперированных в объеме радикальной резекции).
Обсуждение
Современные подходы к реконструкции тканей все чаще используют «пропеллерные» лоскуты в качестве пластического материала. Это позволяет не только минимизировать урон донорской ране, но и успешно использовать сосудистую ножку для поворота лоскута. Ближайший пластический материал уменьшает травму и ускоряет операцию. Подобный подход позволил формировать мышечный лоскут из волокон малой грудной мышцы таблица 1/table 1
непосредственные результаты операций с «пропеллерным» лоскутом малой грудной мышцы immediate outcomes of surgery with a propeller flap of the pectoralis minor
непосредственные результаты операций с «пропеллерным» лоскутом малой грудной мышцы:койко-дни
immediate outcomes of surgery with a propeller flap of the pectoralis minor muscle: bed-days
|
Группа/ Group |
Мастэктомия/ Mastectomy |
Резекция/ Resection |
Всего/ Total |
Вероятность отсутствия различий по точному двухстороннему критерию Фишера по параметру сравнения (p-value)/ Probability of no difference according to Fisher’s exact test for the comparison parameter (p-value) |
|
Всего/Total |
64 |
36 |
100 |
– |
|
Койко-день/Bed-days |
||||
|
до 7/up to 7 |
56 |
34 |
90 |
|
|
до 14/up to 14 |
7 |
2 |
9 |
|
|
больше 14/more than 14 |
0,668 101 таблица 3/table 3 сроки восстановления руки до статуса активной функции timing of restoration of the arm to the status of active function |
|||
Группа/Group
Сроки/Timing
Мастэктомия/Mastectomy Радикальная резекция/Radical resection
Заключение
Современная реконструктивно-пластическая хирургия развивается по пути открытия новых аутопластических материалов на основе локальных лоскутов. Эти виды лоскутов позволяют не только пересаживать их с помощью микрохирургической техники, но и перемещать в пределах оси вращения сосудистой ножки (эффект пропеллера). Авторы разработали «пропеллерный» лоскут на основе малой грудной мышцы, используя ветку грудо- акромиальной артерии. Этот лоскут позволил решить локальные задачи укрытия подмышечного сосудисто-нервного пучка при выполнении подмышечной лимфаденэктомии при раке молочной железы и устранения объемного дефекта подмышечной ямки. Лоскут продемонстрировал высокую жизнеспособность и способность решать поставленную задачу. Ближайшие и отдаленные результаты продемонстрировали высокие показатели приживления при малом количестве осложнений, сокращении стационарного койко-дня и раннее восстановление функции верхней конечности независимо от объема операции на молочной железе. Таким образом, увеличение объема операции не приводит к статистически значимому росту осложнений благодаря надежности пластического материала.
Список литературы Возможности применения "пропеллерного" лоскута для устранения объемного дефекта подмышечной ямки после лимфаденэктомии по поводу рака молочной железы
- Пак Д.Д., Ермощенкова М.В. Пластика подмышечно-подключично-подлопаточной области при радикальных мастэктомиях по поводу рака молочной железы. Хирургия. Журнал им. Н.И. Пиро-гова. 2008; 10: 43-48.
- Ткачук О.А., Наров Ю.А., Войцицкий В.Е., Любарский М.С., Хабаров Д.В. Патогенетические аспекты лимфотропных методик в профилактике ранних послеоперационных осложнений у больных раком молочной железы. Сибирский онкологический журнал. 2008; приложение № 2: 85-86.
- Фатуев О.Э., Козлов Н.С., Королюк Г.М., Ратке И.А., Ронзин А.В., Степанянц Н.Г., Белов Е.Н., Сафронова В.В., Вагабова И.М. Новые подходы к профилактике и лечению ранней и поздней послеоперационной лимфореи. Исследования и практика в медицине. 2019; 6(1): 60-74.
- Корнеев К.В. Современные направления профилактики лимфореи у больных раком молочной железы после радикальных мастэктомий (обзор литературы). Вестник РНЦРР МЗ РФ. 2012; 12. URL: http://vestnik.rncrr.ru/vestnik/v12/papers/korneev_v12.htm (дата обращения: 1.05.2020).
- Agrawal A., Ayantunde A.A., Cheung K.L. Concepts of seroma formation and prevention in breast cancer surgery. ANZ J Surg. 2006 Dec; 76(12): 1088-95. doi: 10.1111/j.1445-2197.2006.03949.x
- van Bastelaar J., Granzier R., van Roozendaal L.M., Beets G., Dirksen C.D., Vissers Y. A multi-center, double blind randomized controlled trial evaluating flap fixation after mastectomy using sutures or tissue glue versus conventional closure: protocol for the Seroma reduction After Mastectomy (SAM) trial. BMC Cancer. 2018 Aug 17; 18(1): 830. doi: 10.1186/s12885-018-4740-8
- Erickson V.S., Pearson M.L., Ganz P.A., Adams J., Kahn K.L. Arm edema in breast cancer patients. J Natl Cancer Inst. 2001 Jan 17; 93(2): 96-111. doi: 10.1093/jnci/93.2.96
- D'Arpa S., Toia F., Pirrello R., Moschella F., Cordova A. Propeller flaps: a review of indications, technique, and results. Biomed Res Int. 2014; 2014: 986829. doi: 10.1155/2014/986829
- Pignatti M., Ogawa R., Hallock G.G., Mateev M., Georgescu A.V., Balakrishnan G., Ono S., Cubison T.C.S., D'Arpa S., KoshimaI., Hyaku-soku H. The "Tokyo" consensus on propeller flaps. Plast Reconstr Surg. 2011 Feb; 127(2): 716-722. doi: 10.1097/PRS.0b013e3181fed6b2


