Возможности прогнозирования эволюции церебральных глиом на основе исследования уровней экспрессии микроРНК в плазме крови и слюне
Автор: Селиверстов Р.Ю., Зарайский М.И., Гурчин А.Ф., Катаева Г.В., Тюрин Р.В., Нарышкин А.Г., Валерко В.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Комплексное лечение глиальных церебральных опухолей (ГЦО) - одна из наиболее сложных проблем нейроонкологии. Особое значение приобретает мониторинг заболевания, позволяющий оперативно оценивать эффекты лечения и прогнозировать течение опухолевого процесса. В последнее время в этом плане хорошо зарекомендовали себя методики, основанные на исследовании уровней экспрессии генов микроРНК в плазме крови. Известно, что объем опухолевой ткани коррелирует с повышенными уровнями экспрессии микроРНК-21 и -210. МикроРНК-15, -16, -34, -126 и -342 участвуют в регулировании пролиферативного потенциала опухоли, а микроРНК-128 - метаболической активности. Целью исследования была апробация расширенного протокола оценки экспрессии микроРНК-15, -16, -21,-34, -126, -128, -210 и -342 в плазме крови и слюне больных ГЦО для прогнозирования эволюции опухоли. Материал и методы. Основную группу составили 24 больных супратенториальными ГЦО (8 мужчин и 16 женщин в возрасте 41-71 год, средний возраст - 56 лет). Группу контроля составили 30 волонтёров. Исследование экспрессии микроРНК проводили в плазме крови и слюне по полуколичественному протоколу StemLoop-RealTime с использованием флуоресцентно меченных проб, применяя в качестве референтного гена малую микроРНК U6. Статистическую обработку проводили с использованием непараметрических методов. Результаты. Отсутствие стабилизации ГЦО и наиболее вероятная прогрессия опухоли с неблагоприятным прогнозом сопровождались повышением экспрессии микроРНК-21 и -210, снижением ниже референта экспрессии микроРНК -128 и не менее четырех из микроРНК-15,-16,-34,-126 и -342. Стабилизация ГЦО с высокой вероятностью прогрессирования и необходимостью продолжения комплексного лечения сочеталась с повышением экспрессии либо микроРНК-21, либо микроРНК-210, снижением ниже референта не более трех из микроРНК-15, -16,-34, -126, -342, а также снижением экспрессии микроРНК-128. При стойкой стабилизации опухоли (с низкой вероятностью прогрессирования) отмечено снижение экспрессии микроРНК-21 и -210, а также не более одной из микроРНК-15, -16, -34, -126, -342 ниже референта при одновременном повышении экспрессии микроРНК-128. Таким образом, определение экспрессии микроРНК в плазме крови и слюне может стать одним из важных критериев оценки прогноза течения церебральных глиом, лежащих в основе персонализированного подхода к их лечению.
Глиальные церебральные опухоли, микрорнк15, 16, 21, 34, -126, -128, -210 и -342, плазма крови, слюна, профилирование экспрессии, stemloop-realtime, мониторинг течения глиальных опухолей
Короткий адрес: https://sciup.org/140297845
IDR: 140297845 | УДК: 616-006.484.04-037:577.21 | DOI: 10.21294/1814-4861-2023-22-1-55-65
Текст научной статьи Возможности прогнозирования эволюции церебральных глиом на основе исследования уровней экспрессии микроРНК в плазме крови и слюне
В комплексном лечении глиальных церебральных опухолей (ГЦО) особое значение приобретает мониторинг эволюционирования опухоли, способный своевременно верифицировать активизацию опухолевого роста, анапластическую перестройку и прогнозировать дальнейшее течение заболевания. Наряду с известными высокоинформативными способами диагностики и контроля прогрессирования ГЦО с помощью методов нейровизуализации и ПЭТ [1, 2], в последнее время хорошо зарекомендовали себя методики, основанные на исследовании уровней экспрессии различных генов микроРНК в плазме крови [3, 4], позволяющие диагностировать эволюционирование патологического процесса [5, 6] и оценить эффективность специфической терапии [7].
Авторы большинства работ изучают регуляторный вклад конкретной микроРНК в развитие ГЦО. Так, было показано, что для анапластических глиом характерно повышение экспрессии микроРНК-21, отражающее напряженность антиапоптотических и проинвазивных процессов в опухоли [8, 9]. МикроРНК-128 активизирует ряд генов, отвечающих за механизмы подавления опухолевого роста, ингибирования ангиогенеза глиальной ткани, самообновления и пролиферации глиальных клеток [10, 11]. МикроРНК-15, участвуя в процессах супрессии глиом, ингибирует клеточную пролиферацию, инвазию и индуцирует апоптоз [12, 13]. Повышение экспрессии микроРНК-16 способствует подавлению инвазии при ГЦО [14]. МикроРНК-210 участвует в ингибировании апоптоза, высокие уровни ее экспрессии связаны с плохим прогнозом ГЦО [15, 16]. МикроРНК-126 негативно воздействует на пролиферацию и инвазию опухолевых клеток [17]. Гиперэкспрессия микроРНК-34 приводит к подавлению роста опухолевых клеток и снижает их инвазию [18], а экспрессия микроРНК-342 снижает пролиферативную активность опухоли [19].
Между тем, каждая из микроРНК контролирует активность до 3000 различных генов, включая и другие микроРНК, что создает трудности в интерпретации их клинической значимости [20]. Как нами было показано ранее, использование всего трех микроРНК существенно повышает клиническую информативность молекулярногенетического исследования, позволяя эффективно и неинвазивно проводить комплексную оценку состояния патологического процесса при ГЦО [21]. Учитывая ранее полученные результаты, в данной работе мы предлагаем взаимодополняющий подход в оценке уровней взаимной экспрессии расширенной панели микроРНК (микроРНК -15, -16, -21, -34, -126, -128, -210 и -342) с учетом их взаимной активности. Новизна работы связана как с комплемен-тарностью анализируемых параметров экспрессии микроРНК, так и с их интерполяцией на гистотип опухоли, а также нейровизуализационные признаки ее эволюционирования. Это позволяет целенаправленно учитывать сочетанную активность молекулярно-генетических регуляторов апоптоза, пролиферации и инвазивности опухолевых клеток и обеспечивает высокую прогностическую значимость получаемых результатов.
Цель исследования ‒ проверка прогностической значимости предложенной панели комплементарной оценки экспрессии микроРНК-15, -16, -21, -34, -126, -128, -210 и -342 в плазме крови и слюне больных ГЦО с использованием нейрови-зуализационных данных, включая ПЭТ (индекс накопления метионина) в качестве тест-системы для прогнозирования эволюции опухоли.
Материал и методы
Исследование проводили на базе нейрохирургического отделения ИМЧ РАН, общая группа составила 54 человека. Основную группу составили 24 больных супратенториальными злокачественными ГЦО (8 мужчин и 16 женщин в возрасте 41–71 год, средний возраст – 56 лет). При обращении все они были в ясном сознании, состояние по шкале функциональной активности Карновского соответствовало 70 ± 8,95 балла, а по шкале MMSE ‒ 26 ± 3,97 балла. В нейрохирургическом отделении ИМЧ РАН пациентам выполнена краниотомия с субтотальным (75–95 %) удалением опухоли. Полноту удаления опухоли в раннем послеоперационном периоде определяли с помощью МРТ с контрастным усилением.
Оценка данных гистологии и иммуногистохимии проведена по рекомендациям редакции классификации опухолей ЦНС ВОЗ (2021), при этом использовались референтные значения из базы данных центра патоморфологических, иммуногистохимических и лучевых методов исследования онкологических заболеваний РНХИ им. проф. А.Л. Поленова, Санкт-Петербург, РФ [22, 23]. Учитывали следующие параметры: гистотип опухоли, степень злокачественности (Grade I–IV и ICD-O code), индекс пролиферативной активности (ИПА) по экспрессии антител к ДНК-связывающему ядер- ному белку Ki67 в опухолевых клетках: низкий ИПА (в 1–5 % ядер опухолевых клеток), средний (в 5–10 % ядер опухолевых клеток) и высокий (в 10–15 % и выше ядер опухолевых клеток). Гистотипически ГЦО распределились следующим образом: астроцитома – grade III (n=15), олигодендроглиома grade III (n=3), глиобластома grade IV (n=6).
Через 2–4 нед после операции все пациенты клинически были в компенсированном состоянии, по шкале Карновского 80 ± 7,75 балла. Дистанционную лучевую терапию (ЛТ) проводили на базе онкологической клиники МИБС г. Санкт-Петербурга, РФ, в режиме стандартного фракционирования суммарной дозой 55–60 Гр с последующей цикловой монохимиотерапией темозоломидом для опухолей Grade III–IV. Одновременное химиолучевое лечение применяли у пациентов с ГЦО Grade IV. Для уточнения референтов экспрессии микроРНК создана группа контроля (n=30), представленная пациентами с заболеваниями, не связанными с ГЦО (17 женщин и 13 мужчин, средний возраст – 50,2 года). Проведение исследования одобрено комитетом по этике ИМЧ РАН.
Оценку экспрессии микроРНК-15, -16, -21, -34, -126, -128, -210 и -342 для пациентов основной и контрольной групп проводили с использованием плазмы крови и слюны по полуколичественному протоколу StemLoop-RealTime с использованием флуоресцентно меченных проб. В качестве референтного гена использовались показатели экспрессии малой микроРНК U6. Нуклеотидные последовательности праймеров для обратной транскрипции и полимеразной цепной реакции [24], а также проб приведены в табл. 1 и 2. Относительный уровень экспрессии микроРНК рассчитывался по протоколу 2–ΔΔCt, где –ΔΔСt – разница между расчетными уровнями выхода на плато амплификационных кривых исследуемой микроРНК и геном сравнения U6, полученный результат выражался в условных единицах уровней экспрессии микроРНК [25]. Числовые данные в таблицах представлены как среднее значение ± стандартное отклонение значений уровня экспрессии микроРНК в условных единицах. Также рассчитывались медиана и верхний и нижний квартили.
Cтатистический анализ проводился в два этапа. Для оценки статистической значимости разницы межгрупповых различий использовался непараметрический тест Манна–Уитни с коррекцией на множественность сравнений Бонферрони и тест Краскела–Уоллеса. На втором этапе, перед проведением линейного дискриминантного анализа (ЛДА), с целью приведения вида распределения к
Òàблицà 1/Table 1
Пîñлåдîвàтåльнîñти пðàéмåðîв для îбðàтнîé тðàнñêðипции
The sequence of primers for reverse transcription
|
микроРНК/microRNA |
Последовательности праймеров/The sequence of primers |
|
15 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCACAAA |
|
16 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGCCAA |
|
21 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAACA |
|
34 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACAACC |
|
126 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACCGCGTA |
|
128 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAGAG |
|
210 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACTCAGCC |
|
342 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACACGGGT |
|
U6 |
GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACAAAAATAT |
Òàблицà 2/Table 2
Пîñлåдîвàтåльнîñти пðàéмåðîв и пðîб для ПЦÐ
The sequence of primers and probes for PCR
Результаты и обсуждение
Валидизацию расширенной панели оценки уровней экспрессии микроРНК проводили путем сравнения результатов обследования крови и слюны (c целью достижения максимальной достоверности результатов) в контрольной и основной группах пациентов (табл. 3).
Результаты динамики экспрессии микроРНК в основной группе до и после хирургического удале- ния опухоли (на сроках не менее 2 нед) представлены на рис. 1, 2. До операции уровни микроРНК-21 и -210, ассоциированные с активацией опухолевого процесса, превосходили, а уровни микроРНК-15, -16,-34,-126,-128 и -342, отрицательно влияющие на пролиферацию опухолевых клеток, были статистически ниже контрольных значений (р<0,01).
Пациенты основной группы были разделены на 3 подгруппы, по 8 человек в каждой, на основе следующих критериев: результаты иммуногистохимического исследования ткани удаленной во время операции опухоли – индекс пролиферативной активности (ИПА) и клинико-нейровизуализационные данные МРТ с контрастным усилением и ПЭТ с 11С-метионином через 4 мес после операции. В подгруппе 1 объединены пациенты со стойкой стабилизацией ГЦО (низкая вероятность прогрессирования глиомы): отсутствие повышения метаболической
Таблица 3/table 3
Значимость различий уровней экспрессии микроРНК в общей группе пациентов и группе сравнения MicroRna expression levels in the study and control groups
|
микроРНК/ microRNA |
Группы/Groups |
Тест Манна–Уитни/ Mann–Whitney p-value |
|
|
Контроль/Control(n=30) Mean ± SD, Median (Q1-Q3) |
Пациенты/Patients(n=24) Mean ± SD, Median (Q1-Q3) |
||
|
microRNA-15к |
3,8 ± 1,8 3,3 (2,23–5,1) |
2,4 ± 1,1 2,7 (1,5–3,5) |
=0,008 |
|
microRNA-15с |
2,4 ± 1,2 2,0 (1,4–3,1) |
0,7 ± 0,3 0,6 (0,5–0,9) |
<0,001 |
|
microRNA-16к |
7314,7 ± 1402,1 |
3500,0 ± 1264,9 |
<0,001 |
|
7117,2 (6213,2–8111,5) |
3611,6 (2542,2–4561,7) |
||
|
microRNA-16с |
3458,6 ± 945,4 |
1320,9 ± 503,5 |
<0,001 |
|
3445,7 (2561,1–4129,2) |
1345,1 (1124,3–503,5) |
||
|
microRNA-21к |
166,1 ± 98,1 |
611,0 ± 180,9 |
<0,001 |
|
128,2 (88,0–255,2) |
597,0 (444,5–722,1) |
||
|
microRNA-21с |
23,5 ± 7,3 22,7 (18,0–28,9) |
118,4 ± 113,7 79,9 (61,0–113,0) |
<0,001 |
|
microRNA-34к |
8,6 ± 1,3 8,4 (7,6–9,1) |
4,4 ± 1,8 4,0 (3,2–5,8) |
<0,001 |
|
microRNA-34с |
4,3 ± 1,1 4,3 (3,6–5,1) |
0,8 ± 0,5 0,7 (0,4–1,1) |
<0,001 |
|
microRNA-126к |
3,1 ± 1,6 2,9 (2,0–3,7) |
0,4 ± 0,2 0,5 (0,3–0,7) |
<0,001 |
|
microRNA-126с |
1,9 ± 1,0 1,8 (1,3–2,2) |
0,5 ± 0,3 0,5 (88,0–263,8) |
<0,001 |
|
microRNA-128к |
5085,5 ± 1110,1 |
1828,9 ± 737,7 |
<0,001 |
|
4809,1 (4304,3–5677,1) |
1803,2 (1112,4–2611,7) |
||
|
microRNA-128с |
283,4 ± 108,1 |
72,8 ± 17,6 |
<0,001 |
|
276,1 (206,1–398,2) |
74,4 (60,7–89,7) |
||
|
microRNA-210к |
37,7 ± 13,2 |
89,8 ± 32,6 |
<0,001 |
|
38,0 (29,9–45,6) |
87,0 (73,2–97,7) |
||
|
microRNA-210с |
12,6 ± 5,2 12,8 (8,5–17,2) |
48,6 ± 29,0 41,1 (28,7–67,2) |
<0,001 |
|
microRNA-342к |
34,8 ± 10,6 33,5 (26,2–42,3) |
11,1 ± 3,5 10,2 (9,3–12,1) |
<0,001 |
|
microRNA-342с |
12,7 ± 9,4 7,4 (6,2–16,4) |
3,7 ± 1,6 3,5 (2,6–4,2) |
<0,001 |
Примечание: к – уровень экспрессии микроРНК в плазме крови; c – уровень экспрессии микроРНК в слюне.
Notes: к – level of microRNA expression in blood plasma; c – level of microRNA expression in saliva.
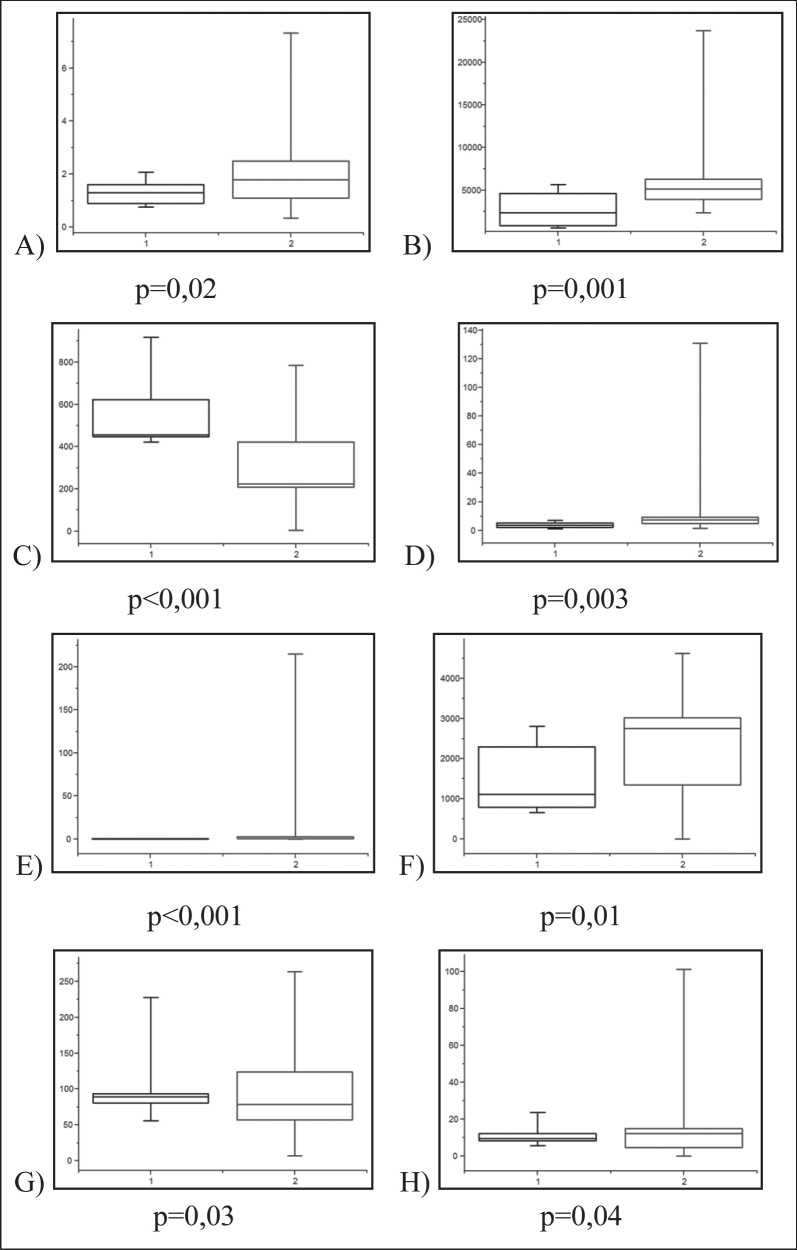
Рис. 1. Уровни экспрессии микроРНК в плазме до (1) и после (2) оперативного удаления опухоли (на момент проведения нейровизуа-лизационого исследования):
-
А) микроРНК-15; B) микроРНК-16;
-
C) микроРНК-21; D) микроРНК-34;
-
E) микроРНК-126; F) микроРНК-128;
G) микроРНК-210; H) микроРНК-342
Fig. 1. microRNA expression levels in plasma before (1) and after (2) surgical removal of the tumor: A) microRNA-15;
B) microRNA-16; C) microRNA-21;
-
D) microRNA-34; E) microRNA-126;
-
F) microRNA-128; G) microRNA-210;
H) microRNA-342
активности по ПЭТ и признаков опухолевой ткани при нейровизуализации, низкий ИПА. В подгруппу 2 включены пациенты с относительной стабилизацией ГЦО (высокая вероятность прогрессирования глиомы): не менее 25 % уменьшение объема опухоли и/или снижение ее метаболической активности, средний ИПА. В подгруппу 3 включались пациенты с отсутствием стабилизации ГЦО (прогрессирование глиомы с неблагоприятным прогнозом и необходимостью дополнительного лечения): более чем 10 % увеличение размеров опухоли и/или увеличение ее метаболической активности, высокий ИПА. Для формирования значимых молекулярнодиагностических критериев течения заболевания (отбора наиболее информативных статистических переменных для дифференцировки больных по выделенным подгруппам) проводился стандартный линейно-дискриминантный анализ (ЛДА) с априорной равной вероятностью принадлежности к подгруппам. Такой анализ проводился для двух наборов данных в зависимости от анализируемого материала – характеризующих уровни экспрессии микроРНК отдельно в крови и слюне. Далее методом пошагового включения по всему набору переменных (числовые значения уровней экспрессии микроРНК в условных единицах) отбирали те из них, которые дают наиболее высокий процент правильной классификации по подгруппам. Отбор наиболее информативных переменных по комбинированным данным (как по крови, так и по слюне) методом пошагового включения переменных определил набор из 7 переменных: уровни экспрессии микроРНК
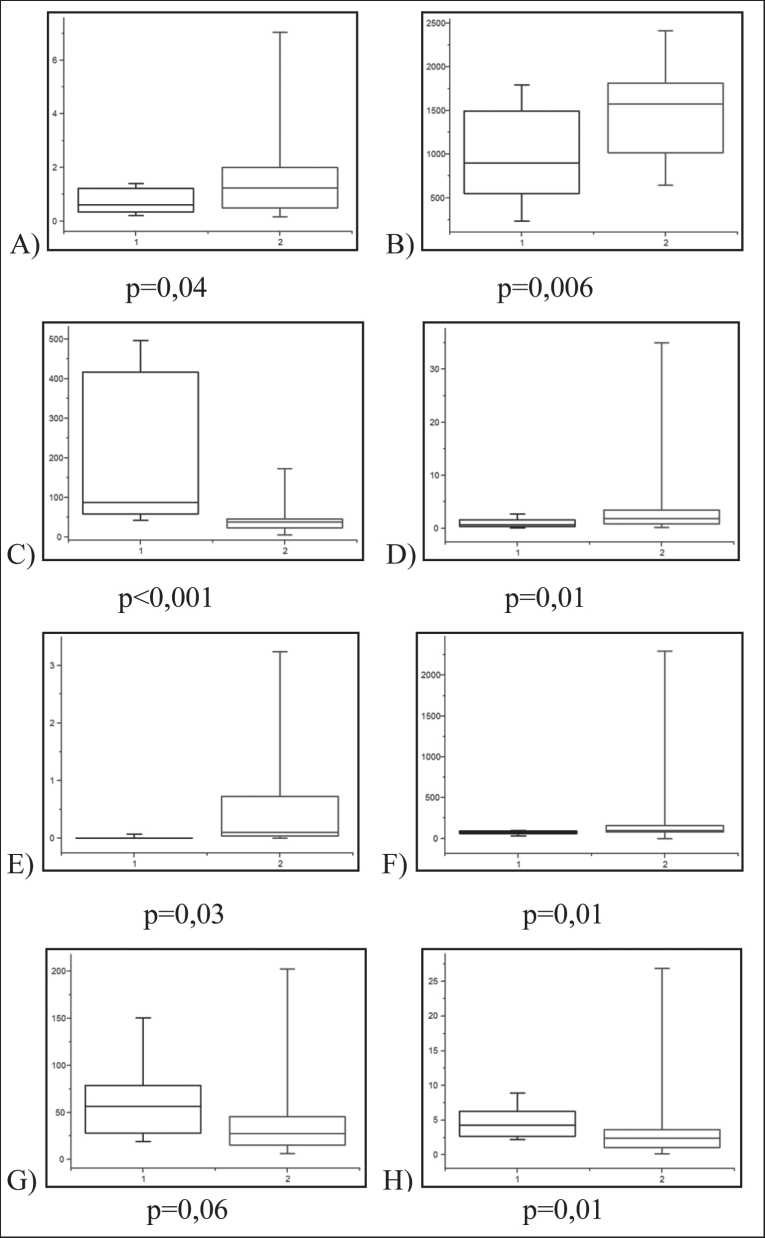
Рис. 2. Экспрессия микроРНК в слюне до (1) и после (2) оперативного удаления опухоли (на момент проведения нейрови-зуализационого исследования):
-
А) микроРНК-15; B) микроРНК-16;
-
C) микроРНК-21; D) микроРНК-34;
-
E) микроРНК-126; F) микроРНК-128;
-
G) микроРНК-210; H) микроРНК-342 Fig. 2. microRNA expression in saliva before (1) and after (2) surgical removal of the tumor:
-
A) microRNA-15; B) microRNA-16;
-
C) microRNA-21; D) microRNA-34;
-
E) microRNA-126; F) microRNA-128;
G) microRNA-210; H) microRNA-342
-16, -21, -34, -128, -210 (в крови) и микроРНК -342 и -15 (в слюне). В этом случае правильность классификации по подгруппам была равна 95,9 %. Данные экспрессии микроРНК в этих подгруппах представлены в табл. 4. В табл. 5 сформулированы и сгруппированы модели распределения экспрессии микроРНК по подгруппам в качестве возможных критериев течения заболевания.
Таким образом, если уровни экспрессии генов микроРНК-21 и -210 (ассоциированные с антиа-поптотическими и проинвазивными процессами опухоли, определяющими ее инвазивную активность) были выше референтных значений, отмечалось прогрессирование ГЦО с неблагоприятным прогнозом; в случаях повышения экспрессии лишь одной из микроРНК-21 или -210 констатирована стабилизация опухоли с высокой вероятностью прогрессии; при экспрессии микроРНК -21 и -210, равной или меньше референтного значения, отмечали стойкую стабилизацию, с отсутствием прогрессии на протяжении не менее 4 мес наблюдения. Это подтверждалось отсутствием МР-паттернов продолженного роста и роста индекса накопления 11С-метионина при ПЭТ. При исследовании уровней экспрессии генов микроРНК-15,-16,-34,126,-342 (оценка пролиферативной активности опухоли) было показано следующее: если уровни экспрессии не более четырех из них были ниже референтных значений, то это соответствовало прогрессированию ГЦО с неблагоприятным прогнозом; при уровнях экспрессии не более трех из них ниже референтных значений регистрировали
Таблица 4/Table 4
Сравнение показателей экспрессии микроРНК в группах пациентов с ГЦО (УЕ)
Comparison of miRNA expression levels in groups of patients with CG (UE)
|
микроРНК/ microRNA |
Группа 1/Group 1 (n=8) Mean ± SD, Mediane, Q1-Q3 |
Группа 2/Group 2 (n=8) Mean ± SD, Mediane, Q1-Q3 |
Группа 3/Group 3 (n=8) Mean ± SD, Mediane, Q1-Q3 |
Тест Краскелла–Уоллеса/ Kruskal–Wallis ANOVA by Ranks, p-value |
|
microRNA-15к |
1,53 ± 0,67 1,70 (0,80–2,10) |
1,33 ± 0,38 1,5 (0,9–1,6) |
1,09 ± 0,35 0,9 (0,9–1,3) |
p=0,55 |
|
microRNA-15с |
0,80 ± 0,50 0,8 (0,3–1,3) |
0,90 ± 0,56 1,0 (0,3–1,4) |
0,64 ± 0,45 0,5 (0,5–0,6) |
p=0,90 |
|
microRNA-16к |
5263,03 ± 365,17 5134,0 (4979,9–5675,2) |
1507,10 ± 948,23 1298,7 (680,4–2542,2) |
1895,52 ± 1269,77 2301,2 (680,4–2347,0) |
p=0,05 |
|
microRNA-16с |
1717,47 ± 129,60 1788,0 (1567,9–1796,5) |
670,23 ± 197,23 570,6 (542,7–897,4) |
683,90 ± 409,73 570,6 (456,7–897,6) |
p=0,06 |
|
microRNA-21к |
433,50 ± 11,82 435,0(421,0–444,5) |
464,10 ± 12,52 463,3 (452,0–477,0) |
645,66 ± 199,52 671,0 (456,0–722,1) |
p=0,05 |
|
microRNA-21с |
51,97 ± 9,24 57,0 (41,3–57,6) |
293,30 ± 203,11 398,0 (59,2–422,7) |
259,22 ± 199,52 216,70 (87,5–422,7) |
p=0,05 |
|
microRNA-34к |
5,91 ± 1,27 5,8 (4,7–7,2) |
3,50 ± 1,81 3,7 (1,6–5,2) |
2,85 ± 1,30 3,2 (1,8–3,7) |
p=0,08 |
|
microRNA-34с |
1,00 ± 0,75 0,9 (0,3–1,8) |
1,20 ± 1,35 0,8 (0,1–2,7) |
0,90 ± 1,02 0,5 (0,4–0,7) |
p=0,62 |
|
microRNA-126к |
0,30 ± 0,20 0,3 (0,1–0,5) |
0,12 ± 0,08 0,2 (0,05–0,2) |
0,09 ± 0,02 0,1 (0,1–0,1) |
p=0,11 |
|
microRNA-126с |
0,07 ± 0,00 0,07 (0,07-0,07) |
0,00 ± 0,00 |
0,00 ± 0,00 |
p=1,00 |
|
microRNA-128к |
2701,07 ± 102,20 2679,0 (2611,7–2812,5) |
963,07 ± 162,32 986,5 (790,3–1112,4) |
917,50 ± 303,68 790,3 (675,3–1122,4) |
p=0,05 |
|
microRNA-128с |
92,80 ± 4,06 91,3 (89,7–97,4) |
75,07 ± 20,95 65,4 (60,7–99,1) |
58,12 ± 18,71 60,7 (45,9–75,4) |
p=0,08 |
|
microRNA-210к |
69,57 ± 13,16 76,3 (54,4–78,0) |
94,57 ± 6,50 94,3 (88,2–101,2) |
118,08 ± 64,86 89,5 (89,1–89,5) |
p=0,04 |
|
microRNA-210с |
24,63 ± 5,16 27,1(27,1–28,1) |
64,53 ± 25,94 77,1 (34,7–81,8) |
79,14 ± 46,62 77,1 (56,5–79,2) |
p=0,06 |
|
microRNA-342к |
16,90 ± 6,03 15,2 (11,9–23,6) |
8,03 ± 2,25 8,2 (5,7–10,2) |
9,08 ± 2,10 8,45 (7,75–10,4) |
p=0,11 |
|
microRNA-342с |
5,83 ± 2,72 4,9(3,7–8,9) |
3,60 ± 2,34 2,3 (2,2–6,3) |
4,68 ± 2,18 4,6 (2,8–6,6) |
p=0,10 |
Примечание: к – уровень экспрессии микроРНК в плазме крови; c – уровень экспрессии микроРНК в слюне.
Notes: к – level of microRNA expression in blood plasma; c – level of expression of microRNA in saliva.
стабилизацию с высокой вероятностью прогрессирования. В случаях, если не более одной микроРНК-15; -16; -34; -126; -342 имела уровень экспрессии ниже референтного значения, верифицировали стойкую стабилизацию опухоли с низкой вероятностью прогрессирования. Если уровень экспрессии микроРНК-128 (оценка метаболической активности опухоли) в слюне и плазме крови больных ГЦО был ниже референтного значения, регистрировали прогрессирование ГЦО с неблагоприятным прогнозом; если он был равен или был ниже референтного значения, то подтверждали стабилизацию опухоли с высокой вероятностью прогрессирования, а в случае, если этот уровень был в норме или выше, то при нормальном уровне экспрессии микроРНК -21 и -210 также отмечали стойкую стабилизацию опухолевого процесса
Заключение
Комплексный подход в оценке уровней экспрессии расширенной панели микроРНК (микроРНК -15, -16, -21, -34, -126, -128, -210 и -342) позволяет учитывать их взаимную активность в молекулярногенетических процессах, определяющих потенциал анапластической перестройки опухоли (регуляция процессов апоптоза, миграционной, пролиферативной и инвазивной активности опухолевых клеток). В результате изучения спектров девиации данных микроРНК на фоне комбинированного лечения ГЦО определены пороговые значения их экспрессии, соответствующие клинически значимым вариантам течения заболевания, подтверждаемые стандартными высокоинформативными диагностическими критериями течения ГЦО (иммуногистохимическое исследование ткани
Таблица 5/table 5
Молекулярные критерии прогнозирования течения заболевания по экспрессии исследуемых микроРНК
Molecular criteria for predicting the course of the disease based on the expression of the studied microRnas
Стойкая стабилизация с низкой
Стабилизация (относительная) с вероятностью прогрессии/
МикроРНК/ Прогрессия, прогноз неблагоприят- высокой вероятностью прогрессии/
Stable stabilization with a low prob
Micro RNA ный/ Progression, poor prognosis Stabilization (relative) with a high ability of progression probability of progression
Инвазивность опухоли/ Invasiveness of the tumor
-21
-210
Обе микроРНК выше референта и в крови и в слюне, либо обе микроРНК повышены только в одном (любом) клиническом материале/ Both miRNAs are higher than the reference level in blood and saliva, or both miRNAs are elevated in only one (any) sample
Не менее одной микроРНК, повышенной в любом клиническом материале (в крови или в слюне)/ At least one miRNA is elevated in blood or saliva
Обе микроРНК имеют нормальный уровень или ниже референта и в крови и в слюне/
Both miRNAs have a normal level or below the reference level in blood and saliva
Пролиферативная способность/ Proliferative ability
-15
-16
-34
-126
-342
Не менее четырех микроРНК ниже референта в любом клиническом материале/
At least four miRNAs below the reference in blood and saliva
Не более трех микроРНК ниже референта в любом клиническом материале/
Not more than three miRNAs below the reference in blood and saliva
Не более одной микроРНК ниже референта в любом клиническом материале/
Not more than one miRNA below the reference in blood and saliva
Метаболическая активность/ Metabolic activity
-128
Выше референта в любом клиническом материале/
Above the reference in blood and saliva
В норме или ниже референта во всех клинических материалах/ Normal or below the reference level in blood and saliva
Клинически не значима при нормальной экспрессии микроРНК-21 и -210/
Clinically insignificant with normal expression of microRNA-21 and -210
опухоли, данные нейровизуализации, ПЭТ с 11С-метионином). Данный подход позволяет выделить группу пациентов с прогностически высокоэффективными и низкоэффективными возможными результатами комплексного лечения церебральных глиом. Для достижения максимальной надежности и достоверности трактовки результатов испытуе- мых микроРНК определение их экспрессии в крови и/или слюне дополняет друг друга. В результате определение экспрессии микроРНК в плазме крови и слюне может стать значимым критерием оценки течения церебральных глиом, что позволяет на любом этапе курации пациентов оценивать в динамике предиктивность прогноза заболевания.
Список литературы Возможности прогнозирования эволюции церебральных глиом на основе исследования уровней экспрессии микроРНК в плазме крови и слюне
- Preusser M., de Ribaupierre S., Wöhrer A., Erridge S.C., Hegi M., Weller M., Stupp R. Current concepts and management of glioblastoma. Ann Neurol. 2011; 70(1): 9-21. https://doi.org/10.1002/ana.22425.
- Konovalov A.N., Potapov A.A., Loshakov V.A., Olyushin V.E., Ulitin A.Yu., Kornienko V.N., Pronin I.N., Shishkina L.V., Golanov A.V., Tanyashin S.V., Urakov S.V., Kobyakov G.L. Standarty, rekomendatsii i optsii v lechenii glial'nykh opukholei golovnogo mozga u vzroslykh. Voprosy neirokhirurgii im. N.N. Burdenko. 2006; 2: 3-11.
- Karsy M., Arslan E., Moy F. Current Progress on Understanding MicroRNAs in Glioblastoma Multiforme. Genes Cancer. 2012; 3(1): 3-15. https://doi.org/10.1177/1947601912448068.
- Kuznetsov V.A., Tang Z., Ivshina A.V. Identification of common oncogenic and early developmental pathways in the ovarian carcinomas controlling by distinct prognostically significant microRNA subsets. BMC Genomics. 2017; 18(Suppl 6): 692. https://doi.org/10.1186/s12864-017-4027-5.
- Barciszewska A.M. MicroRNAs as efficient biomarkers in highgrade gliomas. Folia Neuropathol. 2016; 54(4): 369-74. https://doi.org/10.5114/fn.2016.64812.
- Visani M., de Biase D., Marucci G., Cerasoli S., Nigrisoli E., Bacchi Reggiani M.L., Albani F., Baruzzi A., Pession A.; PERNO study group. Expression of 19 microRNAs in glioblastoma and comparison with other brain neoplasia of grades I-III. Mol Oncol. 2014; 8(2): 417-30. https://doi.org/10.1016/j.molonc.2013.12.010. Erratum in: Mol Oncol. 2015; 9(1): 334. Erratum in: Mol Oncol. 2015; 9(1): 334.
- Zhang K., Zhou X., Han L., Chen L., Chen L., Shi1 Z., Yang M., Ren Y., Yang J., Frank T. S., Zhang C., Zhang J., Pu P., Zhang J., Jiang T., Wagner E. J., Li M., Kang C. MicroRNA-566 activates EGFR signaling and its inhibition sensitizes glioblastoma cells to nimotuzumab. Mol Cancer. 2014; 13: 63. https://doi.org/10.1186/1476-4598-13-6.
- Xu L.F., Wu Z.P., Chen Y., Zhu Q.S., Hamidi S., Navab R. MicroRNA21 (miR-21) regulates cellular proliferation, invasion, migration, and apoptosis by targeting PTEN, RECK and Bcl-2 in lung squamous carcinoma, Gejiu City, China. PLoS One. 2014; 9(8). https://doi.org/10.1371/journal.pone.0103698.
- Zhou X., Ren Y., Moore L., Mei M., You Y., Xu P., Wang B., Wang G., Jia Z., Pu P., Zhang W., Kang C. Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status. Lab Invest. 2010; 90(2): 144-55. https://doi.org/10.1038/labinvest.2009.126.
- Adlakha Y.K., Saini N. MicroRNA-128 downregulates Bax and induces apoptosis in human embryonic kidney cells. Cell Mol Life Sci. 2011; 68(8): 1415-28. https://doi.org/10.1007/s00018-010-0528-y.
- Cui J.G., Zhao Y., Sethi P., Li Y.Y., Mahta A., Culicchia F., Lukiw W.J. Micro-RNA-128 (miRNA-128) down-regulation in glioblastoma targets ARP5 (ANGPTL6), Bmi-1 and E2F-3a, key regulators of brain cell proliferation. J Neurooncol. 2010; 98(3): 297-304. https://doi.org/10.1007/s11060-009-0077-0.
- Sun G., Shi L., Yan S., Wan Z., Jiang N., Fu L., Li M., Guo J. MiR15b targets cyclin D1 to regulate proliferation and apoptosis in glioma cells. Biomed Res Int. 2014; https://doi.org/10.1155/2014/687826.
- Chen L.P., Zhang N.N., Ren X.Q., He J., Li Y. miR-103/miR-195/ miR-15b Regulate SALL4 and Inhibit Proliferation and Migration in Glioma. Molecules. 2018; 23(11): 2938. https://doi.org/10.3390/molecules23112938.
- Yang T., Lu X., Wu T., Ding D., Zhao Z., Chen G., Xie X., Li B., Wei Y., Guo L., Zhang Y., Huang Y., Zhou Y., Du Z. MicroRNA-16 inhibits glioma cell growth and invasion through suppression of BCL2 and the nuclear factor-jB1⁄MMP9 signaling pathway. Cancer Sci. 2014; 105(3): 265-71. https://doi.org/10.1111/cas.12351.
- Lai N.S., Wu D.G., Fang X.G., Lin Y.C., Chen S.S., Li Z.B., Xu S.S. Serum microRNA-210 as a potential noninvasive biomarker for the diagnosis and prognosis of glioma. Br J Cancer. 2015; 112(7): 1241-6. https://doi.org/10.1038/bjc.2015.91.
- Wang Z., Yin B., Wang B., Ma Z., Liu W., Lv G. MicroRNA-210 promotes proliferation and invasion of peripheral nerve sheath tumor cells targeting EFNA3. Oncol Res. 2013; 21(3): 145-54. https://doi.org/10.3727/096504013X13841340689573.
- Liu B., Peng X.C., Zheng X.L., Wang J., Qin Y.W. MiR-126 restoration down-regulate VEGF and inhibit the growth of lung cancer cell lines in vitro and in vivo. Lung Cancer. 2009; 66(2): 169-75. https://doi.org/10.1016/j.lungcan.2009.01.010.
- Yamakuchi M., Ferlito M., Lowenstein C.J. miR-34a repression of SIRT1 regulates apoptosis. Proc Natl Acad Sci U S A. 2008; 105(36): 13421-6. https://doi.org/10.1073/pnas.0801613105.
- Lu X., Wang H., Su Z., Cai L., Li W. MicroRNA-342 inhibits the progression of glioma by directly targeting PAK4. Oncol Rep. 2017; 38(2): 1240-50. https://doi.org/10.3892/or.2017.5783.
- Peng Y., Croce C.M. The role of MicroRNAs in human cancer. Signal Transduct Target Ther. 2016; 1. https://doi.org/10.1038/sigtrans.2015.4.
- Seliverstov R. Yu., Zaraiskii M.I., Kataeva G.V., Gurchin A.F. Sposob prognozirovaniya evolyutsii tserebral'nykh gliom. Patent RF № 2740194, byulleten' № 2. Opubl. 12.01.2021.
- Matsko D.E., Matsko M.V., Imyanitov E.N. Klassifikatsiya opukholei tsentral'noi nervnoi sistemy VOZ (2016). Prakticheskaya onkologiya. 2017; 18(1): 103-11.
- Louis D.N., Perry A., Wesseling P., Brat D.J., Cree I.A., FigarellaBranger D., Hawkins C., Ng H.K., Pfister S.M., Reifenberger G., Soffietti R., von Deimling A., Ellison D.W. The 2021 WHO Classification of Tumors of the Central Nervous System: a summary. Neuro Oncol. 2021; 23(8): 1231-51. https://doi.org/10.1093/neuonc/noab106.
- Seliverstov R.Yu., Zaraiskii M.I., Tyurin R.V., Naryshkin A.G., Valerko V.G., Semiglazov V.V., Takahachi C. MikroRNK v monitoringe evolyutsii glial'nykh tserebral'nykh opukholei. Sibirskii onkologicheskii zhurnal. 2020; 19(3): 47-53. https://doi.org/10,21294/1814-4861-2020-19-3-47-53.
- Rao X., Huang X., Zhou Z., Lin X. An improvement of the 2ˆ(-delta delta CT) method for quantitative real-time polymerase chain reaction data analysis. Biostat Bioinforma Biomath. 2013; 3(3): 71-85.
- Byuyul' A., Tsefel' P. SPSS: iskusstvo obrabotki informatsii, Analiz statisticheskikh dannykh i vosstanovlenie skrytykh zakonomernostei. M., 2005. 608 s.


