Возможности сокращения интервала между этапами тотального ревизионного эндопротезирования в лечении хронической перипротезной инфекции тазобедренного сустава (проспективное нерандомизированное сравнительное исследование)
Автор: Артюх В.А., Божкова С.А., Антипов А.П., Муравьва Ю.В.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 3 (45), 2021 года.
Бесплатный доступ
Обоснование. В лечении больных хронической перипротезной инфекцией (ППИ), двухэтапное ревизионное эндопротезирование (реЭП) остаётся ведущим методом выбора хирургического лечения. При этом оптимальная продолжительность времени между этапами реЭП не определена.Цель исследования: изучение эффективности двухэтапного хирургического лечения ППИ при сокращении интервала времени между этапами реЭП. Материалы и методы. В исследование включены 65 больных хронической ППИ: 14 (1,9%) пациентов с коротким интервалами времени (КИреЭП) между этапами реЭП (6-21 дня), вторую - 51 (7,0%) пациент с длинными интервалами (ДИреЭП, 22-100 дней).Результаты и обсуждение. Применяли бактерицидные антибиотики и доступные препараты с антибиоплёночной активностью. В группе КИреЭП перерыв в перерыв в приёме антибиотиков отсутствовал, в группе ДИреЭП был минимальный (3 (1-6) дня) (OR 0,8 CI95% 0,09-6,6). Интервал времени между первым и вторым этапами реЭП в группе КИреЭП 14 (10-17) дней, в ДИреЭП - 49 (41-66) дней (p=0,0005). Расчёт отношения шансов рецидива ППИ к длительности интервала установил значимые связи в группах сравнения: КИреЭП OR 6,4 CI95% 1,2-34, ДИреЭП OR 28 CI95% 6,4-119. Результаты по HHS в группе КИреЭП (96 (92-97) баллов) не значимо превосходили данные ДИреЭП (93 (75-97) баллов), p=0,513. Использование «ОМС-Остеомиелит» и квот высокотехнологической медицинской помощи покрывает затраты на лечение ППИ, составляющие в группе КИреЭП 392 (371-454) тыс. руб., ДИреЭП - 411 (363-449) тыс. руб.Заключение. Интервал времени между операциями двухэтапного реЭП может быть сокращён до нескольких дней или недель без риска увеличения доли рецидивов ППИ ТБС. Результаты лечения ППИ короткими (до 21 дня) и длинными (до 100 дней) интервалами сопоставимы. Потенциальные преимущества сокращения сроков лечения заключаются в ранней социальной реабилитации больных.
Тазобедренный сустав, ревизионное эндопротезирование, перипротезная инфекция, интервал между этапами
Короткий адрес: https://sciup.org/142231461
IDR: 142231461 | УДК: 617.3 | DOI: 10.17238/issn2226-2016.2021.3.17-25
Текст научной статьи Возможности сокращения интервала между этапами тотального ревизионного эндопротезирования в лечении хронической перипротезной инфекции тазобедренного сустава (проспективное нерандомизированное сравнительное исследование)
Перипротезная инфекция (ППИ) остаётся одним из ведущих показаний к ревизионному эндопротезированию (реЭП) тазобедренного сустава (ТБС) и несчастьем для ортопеда и больного [1]. Поскольку количество операций эндопротезирования (ЭП) продолжает увеличиваться, одновременно возрастает число реЭП по поводу ППИ [2].
Вопреки распространённому мнению о том, что двухэтапное реЭП является «золотым стандартом» лечения хронической ППИ ТБС, многие исследователи указывают на преимущества других методик [4]. Например, одноэтапное реЭП демонстрирует сопоставимые результаты у больных хронической ППИ ТБС без тяжёлой сопутствующей патологии, резистентных к антибиотикам микробных ассоциаций, удовлетворительным состоянием мягких тканей и кости [5].
Наряду с этим, очевидно, что в случае лечения больных хронической, особенно рецидивирующей ППИ ТБС, двухэтапное реЭП остаётся хирургической стратегией выбора, которая обеспечивает стабильный высокий уровень купирования инфекции [6].
Методика включает два этапа хирургического лечения. Целью первого этапа является эрадикация ППИ. Задача второго - реимплантация эндопротеза. Интервал между этапами по данным различных источников составляет от 103 (2-470) дней до 9 (8-12) месяцев [8,12].
Несмотря на накопленный в течение десятилетий опыт, оптимальная продолжительность времени между этапами реЭП до настоящего времени не определена [7]. Делегаты International Consensus Meeting (ICM) (2018) рекомендовали выполнять реимплантацию тогда, когда хирурги сочтут ППИ купированной [9].
В тоже время, появились некоторые предпосылки, определяющие возможность сокращения интервала времени между этапными операциями. Во-первых, некоторые исследования продемонстрировали необязательность отмены приёма антибиотиков (АБ) («drug holiday») за две и более недель до реимплантации эндопротеза [10]. Ранее считали, что перерыв в антибактериальной терапии (АБТ) необходим для корректной диагностики неизлеченной ППИ. Однако в настоящее время установлено, что существующие маркеры не справляются с выявлением ППИ в присутствии антимикробного спейсера, а частота несвоевременно выявленной инфекции на этапе реимплантации составляет до 20,9% [11].
Во-вторых, Cancienne J. et al. (2017) установили, что через один год после удаления эндопротеза и имплантации АБ спейсера только 60,2% больных в среднем через 124,4±39,3 дней выполняют реплантацию эндопротеза. В то же время у 16,8% пациентов антибактериальные спейсеры продолжают функционировать, 10,8% больных перенесли повторную хирургическую обработку, 6,5% - умерли, а 5,7% - выполнили резекционную артропластику [12].
Кроме того, немаловажным является сокращение межэтапного интервала с целью уменьшения вероятности развития осложнений, связанных с вынужденной иммобилизацией (пневмония, тромбоз вен верхних и нижних конечностей) [7].
Таким образом, проблема сокращения межэтапного интервала кажется весьма актуальной. Однако в доступной медицинской литературе мы обнаружили лишь единичные публикации, посвящённые этому вопросу. Данное обстоятельство послужило мотивацией для выполнения исследования.
Целью исследования было изучение эффективности хирургического лечения и факторов риска рецидива ППИ при сокращении интервала времени между этапами реЭП.
Материалы и методы
В проспективное нерандомизированное сравнительное исследование были включены больные хронической ППИ, поступившие в 2017-2020 гг. в отделение гнойной хирургии для реЭП ТБС.
Критерии включения в исследование были следующие: 1) хроническая ППИ ТБС вне зависимости от пола и возраста пациента; 2) патоген установлен, не является «трудным для эра-дикации», чувствителен к антибиотикам с пероральной формой препаратов; 3) дефект кости позволяет имплантировать конструкции эндопротеза (дефект вертлужной впадины 1-3А (Paprosky), бедра 1-3А (Mallory, Paprosky)); 4) инфекционное воспаление мягких тканей ограниченное (свищ, абсцесс); 6) отсутствуют другие не санированные очаги хронической инфекции; 7) имплантат-ассоциированный остеомиелит I-го (медуллярный), II-го (поверхностный) или III (локализованный) анатомического типа, физиологический класс больного А, В (l) (Cierny-Mader, 1985).
Критериями невключения были синдром системной воспалительной реакции (ССВР), сепсис на момент поступления в стационар.
Критерии исключения применяли в ходе обследования пациентов или в процессе самой операции: 1) рецидивирующее течение ППИ, когда количество реЭП с имплантацией АБ спей-сера было ≥3; 2) инфекционное воспаление мягких тканей неограниченной формы (флегмоны) или обширные гнойные затёки к сосудисто-нервным пучкам; 3) дефект мягких тканей не позволяет ушить послеоперационную рану 4) имплантат-ассоцииро-ванный остеомиелит IV-го (диффузный) анатомического типа, физиологический класс пациента В (s), C (Cierny-Mader); 5) дефекты вертлужной впадины 3В (Paprosky) и бедренной кости 4 (Mallory) (Рисунок 1).
При выявлении критериев исключения до- или во время операции, план лечения больных изменяли, выполняли двухэтапное реЭП по принятой в нашем Центре методике с Медианой интервала времени между операциями 6 месяцев (МКИ 4-11 мес.) или резекционную артропластику ТБС. Из 576 (100%) больных хронической ППИ ТБС, которым в отделении гнойной хирургии в 2017-2020 гг. выполнено двухэтапное реЭП, в проспективное исследование включены 65 (11,3%) пациентов. У 511 (88,7%) больных в ходе операции были выявлены критерии исключения, им была проведено двухэтапное реЭП в обычные для нашего Центра сроки.
576 (100%) больных хронической ПП И ТБС, которым выполнено II-этапноереЭПв отделении гнойной хирургии в 2017-2020 гг.
65 (11,3%) больных соответствовали критериям включения:
v' хроническая ППИ ТБС;
-
V патоген установлен, не является «ОТТ», чувствителен к антибиотикам pergs;
^ дефект кости позволяет имплантироватьэндопротез;
^ инфекция мягких тканей ограниченная (свищ, абсцесс);
-
V отсутствуют другие очаги хронической инфекции;
-
V остеомиелит ЦП анатомического типа, физиологический класс А, В (I).
14(1,9%) больных с коротким интервалом между этапами (до 21 дня, КИреЭП)
51 (7,0%) больной с длинным интервалом между этапами (до 100 дней ДИреЭП)
Группы сравнения
Рисунок 1. Дизайн исследования.
Первую группу составили 14 (1,9%) пациентов с коротким интервалом времени (КИреЭП) между этапами операции (от 6 до 21 дня). В этот период послеоперационная рана не заживала плотным рубцом, мягкие ткани в области ТБС оставались рыхлые, отёчные (I и II фаза раневого процесса). Большинство больных (8 из 14 пациентов) продолжали получать АБТ внутривенно. Симптомы обострения хронического инфекционного воспаления кости после РХО имплантат-ассо-циированного остеомиелита I-го и II-го анатомического типа, а также раны в области инфекционного поражения мягких тканей, были купированы, отвечали критериям включения в исследование.
Во вторую группу включён 51 (7,0%) пациент с длинным интервалом времени (ДИреЭП) между этапами реЭП (от 22 до 100 дней). К моменту реимплантации эндопротеза у большинства больных формировался прочный послеоперационный рубец, отёк мягких тканей отсутствовал (III фаза раневого процесса)., все пациенты получили курс парентеральной АБТ и принимали антимикробные препараты per os. Симптомы хронического остеомиелита бедренной кости III-го анатомического типа, были купированы, гранулирующие раны в области ТБС зажили первичным натяжением.
Диагностику ППИ выполняли в соответствии с критериями ICM (2013) [14]. В данной редакции международной согласительной конференции, свищевой ход, наряду с двухкратным положительным результатом микробиологического посева, является одним из двух «больших» признаков ППИ, достаточных для подтверждения диагноза. При отсутствии данных критериев, для диагностики ППИ считали достаточным наличие трёх из пяти «малых» признаков. Оценку характера ППИ (острая или хроническая) выполняли на основании современного представления о патогенезе имплантат-ассоциированной инфекции и классификации ППИ, предложенной Zimmerli W. (2014) [15].
Обязательным условием реализации предложенной методики было выделения штамма микробного возбудителя, чувствительного к пероральным антибиотикам (АБ). С целью выявления патогена в предоперационном периоде выполняли пункцию сустава с последующим микробиологическим исследованием аспирата. У пациентов с функционирующим свищём получить внутрисуставную жидкость в результате пункции было невозможно или её количество оказывалось недостаточно для исследования. В этих наблюдениях из глубины свищевого хода, с поверхности пости или эндопротеза, брали образцы тканей для последующего бактериологического анализа по разработанной методике (Патент на изобретение RU 2 698 175 C1. 2019. P).
Хирургическая техника. Все операции двухэтапного реЭП были выполнены по единому хирургическому протоколу. Этап санации выполняли в отделении гнойной хирургии, реимплантацию эндопротеза в одном из ортопедических отделений нашего центра. В ходе первого этапа реЭП удаляли все компоненты эндопротеза и другие инородные тела. Выбор динамического или статического АБ спейсера осуществляли на основании анализа дефекта костей таза, бедра и функционального состояния мышц. Послеоперационная рана была ушита первично во всех случаях, так как это было одним из критериев включения пациентов в группу исследования. Лабораторный контроль выполняли дважды в неделю, оценивая динамику изменения маркеров воспаления (лейкоциты, СОЭ, СРБ) и восстановление основных показателей гомеостаза. Мобилизацию больных начинали на следующий день после удаления дренажей или на 3-4 сутки после операции. После реимплантации эндопротеза, полную нагрузку разрешали через 3-8 недель после операции в зависимости от фиксации имплантата.
Стартовая антибактериальная терапия была широкого спектра, но с обязательным учетом выделенных до операции возбудителей. Накануне операции или перед началом анестезии больному устанавливали центральный венозный катетер для парентерального введения препаратов в периоперацион-ном периоде. Парентеральную АБТ начинали после взятия из операционной раны образцов тканей для микробиологического исследования. Выбор антимикробных средств для добавления в костный цемент также осуществляли на основании данных предоперационного микробиологического исследования. При необходимости АБТ корректировали после получения результатов исследования интраоперационного биологического материала. Общий курс АБТ в группе КИреЭП не имел перерыва («drug holiday») между этапами хирургического лечения. В группе ДИреЭП период без АБТ был сокращён до 3 (1-6) дней, его продолжительность зависела от организации поступления больного на второй этап реЭП. Контроль безопасности АБТ включал оценку активности печёночных трансаминаз и уровня креатинина.
Этическая экспертиза. Все манипуляции, выполненные в исследовании с участием людей, соответствовали этическим стандартам институционального и/или национального исследовательского комитета, а также Хельсинкской декларации 1964 г. и более поздним поправкам к ней или сопоставимым этическим стандартам. Для этого типа исследования формального согласия не требуется.
Согласно актуальной редакции СанПиН 2.1.3.2630-10, результат эрадикации ППИ ТБС оценивали не менее чем через 12 месяцев после санирующего этапа реЭП. Появление симптомов инфекции в течение одного года после операции считали рецидивом ППИ, после – инфекционным осложнением, возникшим по причинам, не связанным с предыдущим клиническим случаем ППИ.
Оценку функциональных результатов одноэтапного реЭП пациентов с хронической ППИ ТБС выполняли с помощью шкалы Harris (HHS), предполагающей оценку четырех категорий: боль, функция, деформация, амплитуда движений. Качество жизни больных изучали с помощью опросника EQ-5D-5L, описывающего профиль здоровья тремя уровнями выраженности проблем в пяти компонентах (подвижность, уход за собой, обычная деятельность, боль/дискомфорт, тревога/депрессия) и балльной оценки, полученной с помощью визуальной аналоговой шкалы (ВАШ).
Статистический анализ
Регистрацию, систематизацию первичных данных и визуализацию полученных результатов выполняли в электронных таблицах Microsoft Office Excel 365. Статистический анализ проводили средствами программной системы STATISTICA 10.
Для описания количественных показателей выполняли проверку на нормальность распределения по критерию Колмогорова — Смирнова. При нормальном распределении для описания признака использовали его среднее значение и среднее квадратичное отклонение. При распределении, отличном от нормального, медиану (Ме), а в качестве мер рассеяния нижний (Q1) и верхний (Q3) квартили (25–75% МКИ). Сравнение количественных параметров (возраст, длительность стационарного лечения, длительность опе- рации и объем кровопотери) в исследуемых группах осуществляли с использованием критериев Манна – Уитни.
Номинальные данные (пол, тип ППИ, коморбидность, тип спейсера и исход) описывали условными кодами не измеряемых категорий, не подлежащих упорядочиванию. В связи с малым количеством наблюдений сравнение номинальных данных проводилось при помощи критерия хи-квадрат Пирсона с поправкой на непрерывность Йетса. Различия между группами считали статистически значимыми при p<0,05.
С целью количественной оценки зависимости вероятности исхода от наличия фактора риска был рассчитан показатель отношения шансов (Odds retio, OR) с 95% доверительным интервалом (95% Confidence interval, CI).
Результаты
При анализе распределения больных по половому признаку установлено статистически незначимое преобладание лиц мужского пола в обеих группах больных (p>0,05) (Таблица 1).
Медиана возраста у пациентов групп сравнения были сходными, при этом доля больных старше 70 лет в группе КИреЭП была незначимо выше, чем в группе ДИреЭП (14,3% и 5,9% соответственно).
В группе ДИреЭП большинство пациентов страдали хронической гематогенной инфекцией. Во время лечения ППИ на этапах до специализированной помощи (двухэтапного реЭП) большая доля операций, перенесённых пациентами группах КИреЭП и ДИреЭП была санирующая (вскрытие абсцесоов, флегмон,…). Несмотря на то, что после манифестации симптомов инфекции больные группы КИреЭП в 2,2 раза дольше не получали специализированной ортопедической помощи в сравнении с пациентами группы ДИреЭП, указанные различия были статистически не значимыми.
Сравнительный анализ частоты встречаемости сопутствующих заболеваний не выявил существенных различий между группами сравнения, чаще других отмечали патологию сердечно-сосудистой системы и ЖКТ. Физический статус больных преимущественно определяли, как «Легкие заболевания без существенных функциональных ограничений», что отвечало критериям 2-го класса по системе ASA. Больше половины больных в группах КИреЭП (11 (78,6%)) и ДИреЭП (40 (78,4%)) имели избыточную массу тела, при этом структура распределения пациентов по степени ожирения в группах сравнения была сходной.
В когорте исследования, существенных различий по большинству показателей санирующей операции и послеоперационного периода обнаружено не было (Таблица 2).
Общее количество операций за время лечения в группе КИреЭП составило 2 (2-3), в группе ДИреЭП - 2 (2-2) (>0,05). В ряде наблюдений после санирующего этапа реЭП требовались дополнительные хирургические вмешательства, не связанные с рецидивом ППИ (Таблица 3). Фиксация компонентов эндопротеза во время реимплантации в большинстве случаев бесцементная.
Таблица 1
Распределение больных в группах сравнения по демографическим показателям, анамнезу и сопутствующим заболеваниям
|
№ |
Показатели |
КИреЭП, n=14 |
ДИреЭП, n=51 |
p |
||
|
1 |
Пол (n,%) |
Женщин |
3 (21,4) |
19 (37,3) |
>0,05 |
|
|
Мужчин |
11 (78,6) |
32 (62,8) |
||||
|
2 |
Возраст (лет, Ме, МКИ) |
57 (43-67) |
55 (44-64) |
>0,05 |
||
|
3 |
Хроническая гематогенная, (n,%) |
7 (50) |
33 (64,7) |
>0,05 |
||
|
Операции до II-х этапного реЭП |
Не инфекционные (n,%) |
2 (14,3) |
13 (25,5) |
>0,05 |
||
|
Санирующие, (n,%) |
6 (42,9) |
19 (37,3) |
>0,05 |
|||
|
5 |
Интервал времени: манифестация ППИ–реЭП, (дней, Ме, МКИ) |
751 (396-1232) |
342 (177-682) |
>0,05 |
||
|
ИМТ* (кг/м) (Ме, МКИ) |
28,3 (26-34) |
28,3 (26-31) |
>0,05 |
|||
|
Патология ССС*(Ме, МКИ) |
19 (38,8) |
69 (36,3) |
>0,05 |
|||
|
7 |
ЖКТ*(Ме, МКИ) |
14 (28,6) |
58 (30,5) |
>0,05 |
||
|
8 |
Курение (Ме, МКИ) |
3 (6,1) |
15 (7,9) |
>0,05 |
||
|
9 |
Алкоголизм (Ме, МКИ) |
4 (8,2) |
17 (8,9) |
>0,05 |
||
|
10 |
ASA* (Ме, МКИ) |
1 |
2 (18,2) |
0 |
>0,05 |
|
|
2 |
8 (72,7) |
11 (91,7) |
>0,05 |
|||
|
3 |
1 (9,1) |
1 (8,3) |
>0,05 |
|||
*ИМТ – индекс массы тела, ССС – сердечно-сосудистая система, ЖКТ – желудочно-кишечный тракт, ASA - физический статус пациентов по классификации ASA (Американского общества анестезиологов).
Таблица 2Сравнительная характеристика санирующей операции и послеоперационного периода в группах сравнения
|
№ |
Характеристика операции |
КИреЭП,n=14 (Ме, МКИ) |
ДИреЭП, n=51 (Ме, МКИ) |
p |
|
|
1 |
Время операции (мин.) |
177 (170-240) |
200 (175-225) |
>0,05 |
|
|
2 |
Кровопотеря во время операции (мл.) |
700 (500-800) |
700 (500-1000) |
>0,05 |
|
|
3 |
Дренажи |
Количество |
1 (1-1) |
1 (1-2) |
>0,05 |
|
Длительность (дней) |
3 (2,5-4) |
4 (3-5) |
0,035 |
||
|
Кровопотеря (мл.) |
400 (275-490) |
450 (350-500) |
>0,05 |
||
|
4 |
Пункции |
Количество |
1 (1-2) |
1 (1-2) |
>0,05 |
|
Кровопотеря (мл.) |
40 (30-100) |
25 (15-50) |
>0,05 |
||
|
5 |
Трансфузия эр. массы (дозы) |
2 (1-3) |
2 (1-3) |
>0,05 |
|
|
6 |
Трансфузия СЗП (мл.) |
555 (550-570) |
600 (580-800) |
>0,05 |
|
|
7 |
Койко-день (дней) |
19,5 (13-25) |
25 (21-29) |
0,001 |
|
|
8 |
Стоимость лечения, тыс. руб. |
161 (147-192) |
175 (154-186) |
>0,05 |
|
Показатели СОЭ, СРБ, Фибриногена до операции в группах сравнения не имели статистических различий. Исключение составляло количество лейкоцитов, которое в группе КИреЭП было достоверно выше по сравнению с ДИреЭП: 8,2 (7,1-8,7) и 7,3 (6,3-8,6) соответственно (p=0,039).
Информация о размере костных дефектов была доступна у 63 из 65 больных: у 13 (20,6%) пациентов группы КИреЭП и 50
(79,4%) группы ДИреЭП. Структура дефектов вертлужной впадины и бедренной кости была сопоставима в группах сравнения.
Анализ инфекционного поражения мягких тканей не выявил достоверных различий в группах сравнения (p>0,05). В тоже время среди больных с ДИреЭП доля пациентов со свищами, гранулирующими ранами, циллюлитом, фасциитом, гнойными затёками была выше (Рисунок 2).
Таблица 3
Характеристика этапа реимплантации эндопротеза в группах сравнения
|
№ |
Характеристика операции |
КИреЭП,n=14 (Ме, МКИ) |
ДИреЭП, n=51 (Ме, МКИ) |
p |
|
|
1 |
Интервал между операциями |
14 (10-17) |
49 (41-66) |
0,0005 |
|
|
2 |
Операции между этапами реЭП |
Ревизия гематомы п/о раны (n,%) |
3 (21) |
5 (9,8) |
>0,05 |
|
Вправление вывиха спейсера (n,%) |
0 |
2 (3,9) |
>0,05 |
||
|
3 |
Реимплантация эндопротеза |
Безцементная, (n,%) |
9 (64,3) |
43 (84,3) |
>0,05 |
|
Гибридная, (n,%) |
5 (35,7) |
8 (15,8) |
>0,05 |
||
|
4 |
Длительность в/венной АБТ между этапами реЭП |
9 (7-10) |
10 (10-12) |
>0,05 |
|
|
5 |
Длительность всего курса АБТ между этапами реЭП |
14 (9-17) |
47 (38-62) |
>0,05 |
|
|
6 |
Стоимость лечения, тыс. руб. |
232 (219-280) |
228 (201-268) |
>0,05 |
|
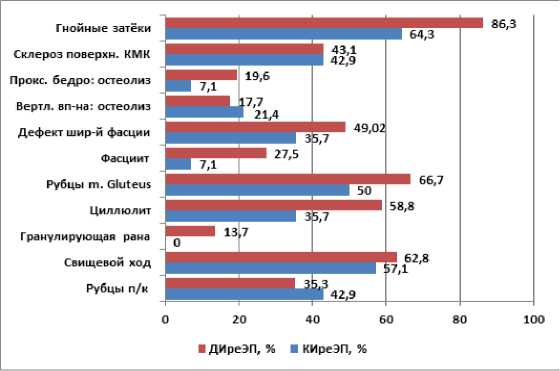
Рисунок 2. Инфекционное поражение мягких тканей и кости в группах сравнения (p>0,05).
Результаты изучения патогенной микрофлоры не продемонстрировали значимой разницы между группами (p>0,05). В большинстве наблюдений выделяли стафилококки (группа ДИреЭП 54,1%, группа КИреЭП 38%) (Рисунок 3). В группе ДИреЭП частота встречаемости штаммов MRSE составляла 62,5% (16 из 24 изолятов S.epidermidis ), а в группе КИре-ЭП из– 80% (4 из 5). Штаммы MRSA были выделены только в группе ДИреЭП, их доля составила 13,3% (2 из 15 изолятов S.aureus ).
Анализ данных микробиологического исследования биоматериала из области ТБС показал, что в обеих группах преобладали пациенты с монобактериальной инфекцией (в группе ДИреЭП – 67,3%, в группе КИреЭП – 61,5%, p>0,05) (Рисунок 4).
Сравнение результатов исследования биологического материала в изученной когорте, полученного до- и во время хирургического вмешательства, показало, что доля совпавших результатов составила в группе ДИреЭП 39,2%, в группе КИреЭП 28,6% (Рисунок 5). При этом доля «неверных» данных о пато- гене в группах сравнения была сопоставима и превышала 40% (p>0,05).
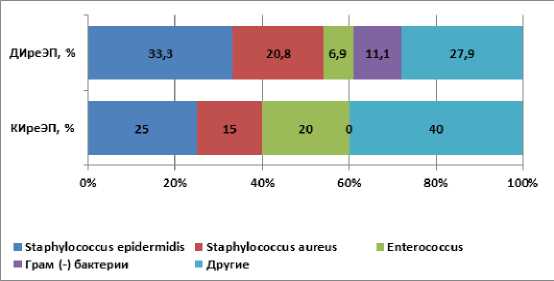
Рисунок 3. Спектр возбудителей ППИ в группах сравнения, выделенных из биоматериала (p>0,05).
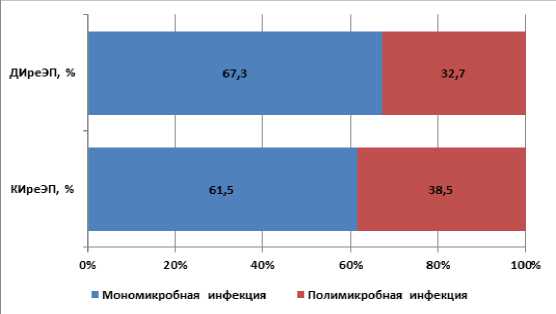
Рисунок 4. Характер этиологии (моно – и полибактериальная) ППИ ТБС.
Информация о ближайших результатах лечения была получена во всех наблюдениях. Медиана длительности наблюдения составила в группе ДИреЭП 21 (3-25), а в группе КИреЭП 27 (16-36), месяца (p=0,059). Установлено, что эра-дикация инфекции была достигнута у 96,1% (n=49) пациен- тов с ДИреЭП и 85,7% (n=12) – в группе КИреЭП (p>0,05) (Рисунок 6).
Во всех случаях рецидивы ППИ развились менее чем, через год после реимплантации эндопротеза (от 22 до 160 дней): в группе КИреЭП два (14,3%) наблюдения, в группе ДИреЭП - два (3,9%). У всех больных выявлена патогенная микрофлора с высокой устойчивостью к АБ, которая не была установлена на предыдущих этапах обследования и лечения (Таблица 4).
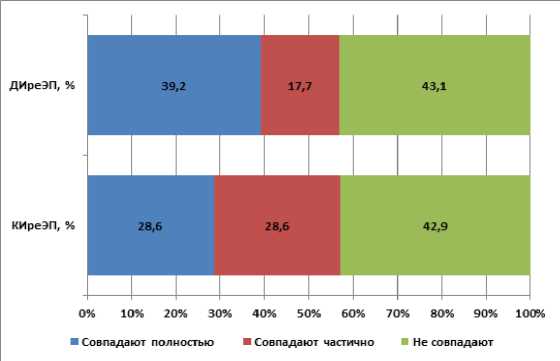
Рисунок 5. Сопоставимость результатов микробиологического исследования до- и интраоперационных образцов биологического материала в группах сравнения (p>0,05).
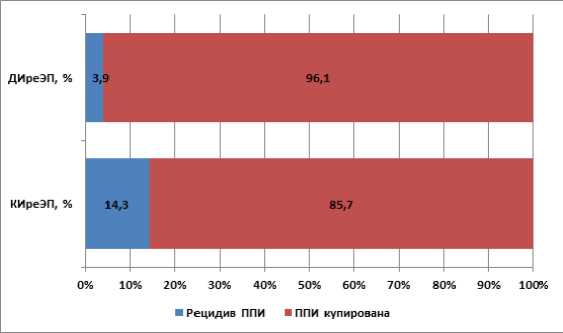
Рисунок 6. Распределение результатов одноэтапного реЭП в группах сравнения.
В одном из наблюдений с коротким интервалом выполнено повторное удаление эндопротеза, РХО, имплантация АБ спей-сера. В трёх других наблюдениях с рецидивом ППИ выполнена резекционная артропластика с замещением дефекта ТБС несвободным мышечным лоскутом m. Vastus lateralis.
У одного из больных (75 лет) из группы КИреЭП, после резекционной артропластики ТБС, по поводу рецидива ППИ, на фоне продолжавшейся интенсивной терапии, развились симптомы генерализации хронической рецидивирующей ППИ, которые явились показанием к экзартикуляции конечности. В дальнейшем, в раннем послеоперационном периоде возникла полиорганная недостаточность, которая стала причиной единственного в изученной когорте летального исхода.
Таблица 4
Характеристика микробного пейзажа в случаях рецидива ППИ ТБС
|
№ |
Группа больных |
Патогенные микроорганизмы |
||
|
Этап санации |
Рецидив ППИ |
|||
|
1 |
КИреЭП, n=2 |
Больной П. |
S. aureus, Enterococcus faecalis |
Klebsiella pneumonia, Acinetobacter spp., Candida albicans |
|
Больной С. |
Achromobacter |
Streptococcus dysgalactiae |
||
|
2 |
ДИреЭП, n=2 |
Больной Л. |
S. aureus |
Acinetobacter spp., Serratia marcescens |
|
Больной Б. |
S. aureus |
S. aureus, Enterococcus faecalis |
||
Достоверных различий между группами сравнения в функциональных возможностях пациентов, их социальной адаптации и уровне боли выявлено не было (Таблица 5).
После операции итоговые результаты оценки функциональных возможностей больных по шкале HHS (96 и 93 баллов, p=0,513), социальной адаптации по шкале EQ-5D-5L (0,88 и 1,0 баллов, p=0,396), а также субъективная оценка больными своего общего состояния по шкале ВАШ (90 и 85 баллов, p=0,519) в группах сравнения также были сопоставимы.
Таблица 5
Результаты ревизионного эндопротезирования у больных хронической ППИ в группах сравнения
|
№ |
Критерии оценки |
КИреЭП, (Ме, МКИ) |
ДИреЭП, (Ме, МКИ) |
p |
|
|
1 |
Сроки наблюдения (мес.) |
27 (16-36) |
21 (3-25) |
0,059 |
|
|
2 |
Шкала Harris W. |
До операции |
51 (28-72) |
40 (31-57) |
0,645 |
|
После операции |
96 (92-97) |
93 (75-97) |
0,513 |
||
|
3 |
EQ-5D-5L |
До операции |
0,43 (0,27-0,6) |
0,47 (0,28-0,58) |
0,539 |
|
После операции |
0,88 (0,77-1) |
1,0 (0,66-1) |
0,396 |
||
|
4 |
ВАШ |
До операции |
40 (35-50) |
50 (30-70) |
0,577 |
|
После операции |
90 (75-95) |
85 (60-95) |
0,519 |
||
Обсуждение
Изучение преимуществ сокращения интервала времени между операциями двухэтапного реЭП продиктовано по- требностью в некоторых случаях выполнять реимплантацию эндопротеза в кратчайшие сроки. Такая необходимость может быть связана с развитием в раннем послеоперационном периоде непереносимости компонентов антибактериального спейсера, его рецидивирующими или невправимыми вывихами, периимплантатными переломами. Кроме того, нельзя оставлять без внимания запрос больных хронической ППИ ТБС на скорейшее восстановление функциональных возможностей [7,13].
В проспективном исследовании Winkler T. et al. (2019) для сохранения эффективности хирургического лечения ППИ при сокращении межэтапного интервала, применяли агрессивную АБТ в течение не менее 12 недель, которая включала бактерицидные антибиотики, активные против микробных биоплёнок [7]. В нашей работе мы также применяли бактерицидные антибиотики и доступные препараты с антибиоплёночной активностью. В группе КИреЭП перерыв в АБТ накануне реимплантации отсутствовал, в группе ДИреЭП был минимальный (3 (1-6) дня), статистически значимой связи с рецидивами ППИ не установлено - OR 0,8 CI95% 0,09-6,6). Умеренное повышение СРБ не считали противопоказанием к выполнению второго этапа реЭП. Пункцию ТБС и бактериологическое исследование внутрисуставной жидкости перед реимплантацией эндопротеза не выполняли.
Согласно данным Winkler T. et al. (2019) средняя продолжительность времени между операциями в группе коротких (n=19) интервалов была 17,9 (7-27) дней, в группе длинных (n=19) интервалов – 63 (28-204) дня. Реализация предложенной авторами методики позволила купировать инфекцию у 100% больных в группе коротких интервалов и у 18 из 19 пациентов в группе длинных интервалов [7]. В изученной нами когорте больных продолжительность интервала времени между первым и вторым этапами реЭП была меньше: в группе КИреЭП составляла 14 (10-17) дней, в группе ДИреЭП – 49 (41-66) дней (p=0,0005). Был выполнен расчёт отношения шансов рецидива ППИ к длительности интервала между этапами и установлены значимые связи в группах сравнения: КИреЭП OR 6,4 CI95% 1,2-34, ДИреЭП OR 28 CI95% 6,4-119.
Целенаправленное сокращение интервала времени между этапами реЭП до минимального срока позволяло нам выполнять реимплантацию эндопротеза уже через 6-7 дней после санации ТБС. Дальнейшее развитие методики постепенно стирает границы между двухэтапным реЭП с короткими интервалами и другим способом лечения хронической ППИ ТБС - одноэтапным реЭП. Однако даже при самых коротких сроках между операциями, двухэтапное реЭП сохраняет свои главные преимущества: выполнение двух последовательных РХО, двух бактериологических исследований образцов тканей, полученных во время операции и продолжительная этиотропная АТБ.
Кроме того, ранняя реимплантация (через 2-3 недели после удаления эндопротеза) имеет такие преимущества, как быстрая мобилизация пациентов, лечение в течение одной госпитализации, лучшее состояние мягких тканей [7,13].
В нашем исследовании при реимплантации эндопротеза хирурги столкнулись с техническими трудностями при работе с мягкими тканями в случаях, когда после санирующего этапа прошло менее 3-х недель. Сохранялся отёк подкожной жировой клетчатки, фасции, мышц, который затруднял дифференцировку здоровых тканей и поражённых инфекционным воспалением. Эмпирически было установлено, что наилучшие условия для работы с тканями наступают через 4-6 недель после санации ТБС, когда отёк тканей уменьшается, а рана заживает прочным рубцом.
Erhart J. et al. (2010) установили зависимость функциональных исходов двухэтапного реЭП от длительности интервала между операциями. Наилучшие результаты были получены при сокращении периода ожидания реимплантации эндопротеза до 180,5 (36-390) дней [13]. Несмотря на то, что межэтапные интервалы Erhart J. были продолжительнее аналогичных показателей в нашем исследовании, функциональные результаты по HHS в группе КИреЭП (96 (92-97) баллов) также, хотя и не значимо превосходили группу ДИреЭП (93 (75-97) баллов), p=0,513.
В настоящее время одним из главных препятствий для широкого применения методики коротких интервалов является отсутствие источника финансирования второго этапа реЭП. В Германии при выполнении больному двух операций за одну госпитализацию или при повторной госпитализации для реимплантации в течение 30 дней после закрытия первой истории болезни, всё лечение оплачивается, как один клинических случай. Таким образом, полученные средства не покрывают расходы стационара на двухэтапное реЭП, что мотивирует хирургов увеличивать интервалы между операциями [7]. В нашей стране проблема финансирования первого этапа реЭП отчасти была решена с появлением соответствующей программы в системе обязательного медицинского страхования (ОМС-Остеомиелит). Однако сейчас данная возможность доступна только для больных с ППИ тазобедренного или коленного суставов. Последовательное использование «ОМС-Остеомиелит» и квот высокотехнологической медицинской помощи в значительной мере покрывает затраты на лечение ППИ, которые в нашей работе составили в группе КИреЭП 392 (371-454) тыс. руб., в группе ДИреЭП - 411 (363-449) тыс. руб.
Наше исследование имеет некоторые ограничения. Прежде всего это неоднородность групп исследования в которых количество наблюдений различается в 3,6 раза и существенно затрудняет сравнение полученных данных. Кроме того, были изучены лишь ближайшие результаты лечения (в среднем до двух лет) и полученной информации недостаточно для окончательных выводов об эффективности методики. Необходимо продолжать наблюдение за больными в более многочисленных и сбалансированных группах для определения исходов лечения в средние и отдалённые сроки.
Заключение
Выполненное исследование показало, что интервал времени между операциями двухэтапного реЭП может быть сокращён до нескольких дней или недель без риска увеличения доли рецидивов ППИ ТБС. Результаты лечения ППИ короткими (до 21 дня) и длинными (до 100 дней) интервалами сопоставимы. Потенциальные преимущества сокращения сроков лечения заключаются в ранней социальной реабилитации больных. Среди нерешённых проблем обращают на себя внимание длительное сохранение отёка мягких тканей после санации ТБС и своевременное определение источника финансирования этапа реимплантации эндопротеза ТБС.
Финансирование: исследование не имело спонсорской поддержки
Funding: the study had no sponsorship
Список литературы Возможности сокращения интервала между этапами тотального ревизионного эндопротезирования в лечении хронической перипротезной инфекции тазобедренного сустава (проспективное нерандомизированное сравнительное исследование)
- Kurtz S.M., Lau E., Watson H., Schmier J.K., Parvizi J. Economic burden of periprosthetic joint infection in the United States. J Arthroplasty. 2012 Sep;27(8 Suppl):61-5.e1. https://doi: 10.1016/j.arth.2012.02.022.
- Шубняков И.И., Тихилов Р.М., Денисов А.О., Ахмедилов М.А., Черный А.Ж., Тотоев З.А., Джавадов А.А., Карпухин А.С., Муравьёва Ю.В. Что изменилось в структуре ревизионного эндопротезирования тазобедренного сустава в последние годы? Травматология и ортопедия России. 2019;25(4):9-27. https://doi.org/10.21823/2311-2905-2019-25-4-9-27. [Shubnyakov I.I., Tikhilov R.M., Denisov A.O., Akhmedilov M.A., Cherny A.Z., Totoev Z.A. et al., Javadov A.A., Karpukhin A.S., Muravyeva Yu.V. What Has Changed in the Structure of Revision Hip Arthroplasty? Traumatology and Orthopedics of Russia. 2019;25(4):9-27. (In Russ.) https://doi.org/10.21823/2311-2905-2019-25-4-9-27]
- Cooper H.J., Della Valle C.J. The two-stage standard in revision total hip replacement. Bone Joint J. 2013 Nov;95-B(11 Suppl A):84-7. https://doi:10.1302/0301-620X.95B11.32906.
- Hipfl C., Carganico T., Leopold V., Perka C., Müller M., Hardt S. Two-Stage Revision Total Hip Arthroplasty Without Spacer Placement: A Viable Option to Manage Infection in Patients With Severe Bone Loss or Abductor Deficiency. J Arthroplasty. 2021 Feb 18:S0883-5403(21)00200-X. https://doi:10.1016/j.arth.2021.02.040.
- Thakrar R.R., Horriat S., Kayani B., Haddad F.S. Indications for a single-stage exchange arthroplasty for chronic prosthetic joint infection: a systematic review. Bone Joint J. 2019 Jan;101-B(1_Supple_A):19-24. https://doi:10.1302/0301-620X.101B1.BJJ-2018-0374.R1.
- Petis SM, Abdel MP, Perry KI, Mabry TM, Hanssen AD, Berry DJ. Long-Term Results of a 2-Stage Exchange Protocol for Periprosthetic Joint Infection Following Total Hip Arthroplasty in 164 Hips. J Bone Joint Surg Am. 2019 Jan 2;101(1):74-84. https://doi: 10.2106/JBJS.17.01103.
- Winkler T., Stuhlert M.G.W., Lieb E., Müller M., von Roth P., Preininger B., Trampuz A., Perka C.F. Outcome of short versus long interval in two-stage exchange for periprosthetic joint infection: a prospective cohort study. Arch Orthop Trauma Surg. 2019 Mar;139(3):295-303. https://doi: 10.1007/s00402-018-3052-4.
- Павлов В.В., Садовой М.А., Прохоренко В.М. Современные аспекты диагностики и хирургического лечения пациентов с перипротезной инфекцией тазобедренного сустава (обзор литературы). Травматология и ортопедия России. 2015;(1):116-128. https://doi.org/10.21823/2311-2905-2015-0-1-116-128. [Pavlov V.V., Sadovoy M.A., Prokhorenko V.M. Modern aspects of diagnostic and surgical treatment of patients with hip periprosthetic infection (review). Traumatology and Orthopedics of Russia. 2015;(1):116-128. (In Russ.) https://doi.org/10.21823/2311-2905-2015-0-1116-128.]
- Second International Consensus Meeting (ICM) on musculoskeletal infection. 2018. AalirezaieA., MorenoJ.D.V., MoojenD.J. 5.5.Treatment two-stage exchange. Question 1: What is the optimal timing for reimplantation of a two-stage exchange arthroplasty of the hip and knee? p.459. Режим доступа: https://icmphilly.com/wp-content/uploads/2018/11/Hipand-Knee.pdf.
- Tan T.L., Kheir M.M., Rondon A.J., Parvizi J., George J., Higuera C.A., Shohat N., Chen A.F. Determining the Role and Duration of the “Antibiotic Holiday” Period in Periprosthetic Joint Infection. J Arthroplasty. 2018 Sep;33(9):2976-2980. https://doi: 10.1016/j.arth.2018.04.019.
- Herman A., Albers A., Garbuz D.S., Duncan C. P., Masri B. Classic Markers for Infection Perform Poorly in Predicting Residual Infection Prior to Reimplantation. Published Online:January 03, 2019. https://doi.org/10.3928/01477447-20190103-03.
- Cancienne J.M., Werner B.C., Bolarinwa S.A., Browne J.A.. Removal of an Infected Total Hip Arthroplasty: Risk Factors for Repeat Debridement, Longterm Spacer Retention, and Mortality. J Arthroplasty. 2017 Aug;32(8):2519-2522. https://doi: 10.1016/j.arth.2017.03.018.
- Erhart J., Jaklitsch K., Schurz M., Vécsei V., Ehall R. Cementless twostaged total hip arthroplasty with a short term interval period for chronic deep periprosthetic infection. Technique and long-term results. Wien Klin Wochenschr. 2010 May;122(9-10):303-10. https://doi: 10.1007/s00508-010-1372-7.
- Valle C.D., Bauer T.W., Malizos K.N. Proceedings of the International Consensus Meeting on periprosthetic joint infection. Workgroup 7: Diagnosis of periprosthetic joint infection. 2014. P.202-223. Режим доступа: https://www.efort.org/wp-content/uploads/ 2013/10/ Philadelphia_Consensus.
- Zimmerli W. Clinical presentation and treatment of orthopaedic implant-associated infection. J Intern Med. 2014 Aug; 276(2):111-119. https://doi:10.1111/joim.12233.


