Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 1. Кристаллогеометрический анализ
Автор: Окишев Константин Юрьевич, Мирзаев Джалал Аминулович, Верховых Анастасия Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 2 т.13, 2013 года.
Бесплатный доступ
Проведен простой кристаллогеометрический анализ сопряжения решеток феррита и цементита на когерентной межфазной границе с ориентационными соотношениями Багаряцкого. Наилучшее сопряжение решеток обеспечивается, когда на границе находится плоскость (101)ц, состоящая из атомов железа в 5-позициях. При сохранении неизменных положений атомов в обеих решетках часть тетраэдрических пор решетки феррита вблизи границы искажается, и их радиус увеличивается в 1,5 раза. Сделано предположение, что такие искаженные тетраэдрические поры могут выступать в роли мест захвата атомов водорода. Их поверхностная плотность составляет 6,610 14 см -2. Строение границы и возможные позиции захвата водорода в дальнейшем должны быть уточнены при помощи первопринципного моделирования.
Перлит, феррит, цементит, межфазная граница, водород, захват водорода, ориентационные соотношения багаряцкого
Короткий адрес: https://sciup.org/147156843
IDR: 147156843 | УДК: 669.14:669.788
Текст научной статьи Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 1. Кристаллогеометрический анализ
Водород – одна из чрезвычайно важных примесей в железе и его сплавах. Входя в ограниченный круг элементов, образующих в железе растворы внедрения, он имеет среди них самый малый атомный радиус (0,46 Å по [1]), и поэтому высокую диффузионную подвижность. В то же время равновесная растворимость водорода в железе невелика и не превышает десятых–сотых долей атомного процента. К настоящему времени считается доказанным, что в α -железе атомы водорода размещаются в тетраэдрических порах ОЦК-решетки [2, 3].
С технической точки зрения водород в сталях является вредной примесью, так как вызывает разнообразные процессы водородного охрупчивания, растрескивания, образование флокенов и т. п. [4–9]. Одним из путей ослабления вредного влияния водорода является создание в сплаве ловушек – позиций захвата атомов водорода, в которых они оказываются неспособными перемещаться по решетке. В роли таких ловушек могут выступать разнообразные дефекты кристаллического строения [8–10]: атомы примесей, вакансии, ядра дислокаций, межзеренные и межфазные границы. В данной работе мы сосредоточимся на последнем их типе и рассмотрим возможности захвата атомов водорода межфазными границами на примере границ феррит / цементит.
Хорошо известно [11], что в поковках многих инструментальных сталей (штамповых, быстрорежущих и др.) практически никогда не наблюдаются флокены, хотя содержание водорода в них может достигать 10 ppm. Поскольку карбиды хрома и железа не растворяют водород [12], то высказывалось предположение об адсорбции водорода на межфазных границах α-фаза/карбид, причем речь идет о карбидах различного типа [12–15]. Но наиболее важными среди них являются границы фер- рит/цементит (Fe3C), так как именно структура перлита – пластинчатой феррито-цементитной смеси – возникает в условиях замедленного охлаждения поковок из низколегированных сталей.
При перлитном превращении в каждом зерне исходного аустенита возникает несколько колоний, состоящих из чередующихся пластин феррита и цементита. Величина среднего межпластиночного расстояния S для перлита, образовавшегося изотермически, зависит от переохлаждения Δ T = A 1 – T [16]:
S = , мкм. (1) Δ T ,
Если Δ T = 30…50 °C, то S ≈ 0,5…0,3 мкм. В случае переохлаждения аустенита до ~550 °C ( Δ T ≈ 180 °C) образуется тонкопластинчатый перлит с межпластиночным расстоянием почти на порядок меньше ( S ≈ 0,1 мкм). При этом величина
F V = S 2 = 1,3 ⋅ 103 ∆ T , см–1, (2) представляющая площадь межфазных границ в единице объема перлитной структуры [17], возрастает с ~ 104 до ~ 105 см2/см3.
В литературе имеются некоторые косвенные данные о захвате атомов водорода межфазными границами феррит / цементит. Так, П.В. Гельд и Р.А. Рябов [5] приводят и анализируют данные о поведении водорода в закаленных и отпущенных сплавах Fe–C. При повышении температуры отпуска коэффициент диффузии водорода уменьшался, достигая минимума в районе 280 °C, тогда как растворимость водорода, наоборот, возрастала до максимума при той же температуре. Выше 280 °C в сталях с любым содержанием углерода наблюдалось возрастание коэффициента диффузии и уменьшение растворимости водорода. Как известно [18], при отпуске в районе 280 °C форми- руются частицы карбидов с максимальной степенью дисперсности. Максимум растворимости и минимум коэффициента диффузии при этой температуре свидетельствуют о захвате атомов водорода межфазными границами феррит/карбид, хотя количественные результаты несколько искажены наличием в мартенсите повышенной плотности дислокаций и вакансий [1], также являющихся центрами захвата атомов водорода.
Рассмотрим подробнее кристаллогеометрию межфазных границ в перлите и возможные позиции захвата атомов водорода. Хорошо известно, что между ферритными и цементитными пластинами в перлите существует ориентационная связь [17–20], которая может быть выражена двумя ориентационными соотношениями (ОС): Багаряцкого (ОС Б )
(100) Ц ||(011) Ф ; (010) Ц ||(111) Ф ;
(001) Ц ||(211) Ф (3а)
и Питча (ОСП)
(100) Ц 2,6° от (311) Ф ; (010) Ц 2,6° от (131) Ф ;
(001) Ц ||(215) Ф . (3б)
При ОСБ габитусная плоскость пластин соответствует (101)Ц||(112)Ф, а при ОСП – (001)Ц||(215)Ф [18–20]. В грубопластинчатом перлите вероятность реализации обоих ОС примерно одинакова, но с понижением температуры превращения ОСБ начинает преобладать, и в тонкопластинчатом перлите с S « 0,1 мкм ОСП встречается заметно реже [20]. Поскольку наиболее интенсивный захват водорода должен происходить именно в низкотемпературном тонкопластинчатом перлите с повышенной объемной плотностью межфазных границ (2), то мы пока ограничимся рассмотрением сопряжения решеток феррита и цементита и возможных положений атомов водорода на меж- фазной границе именно для случая ОС Багаряцкого.
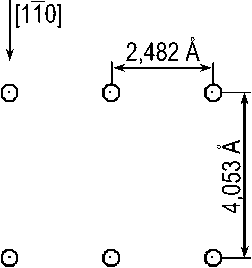
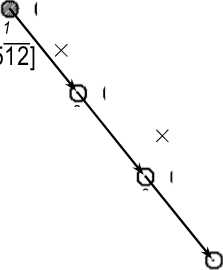
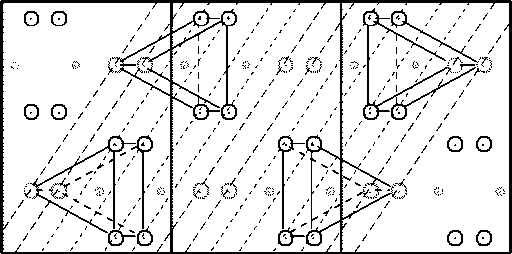
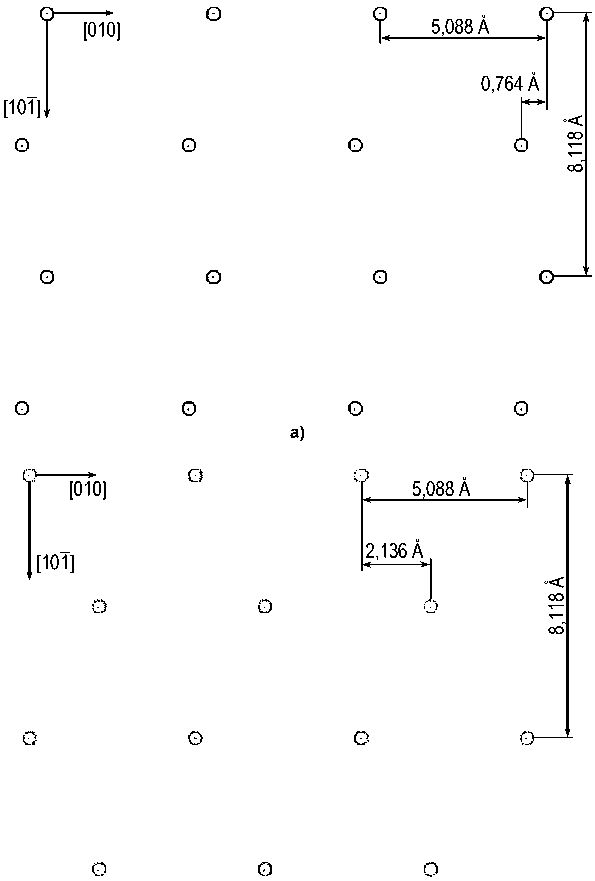
Из двух сопрягающихся на границе фаз феррит, как известно, имеет объемноцентрированную кубическую решетку с параметром a Ф=2,866 Å [18], а цементит – орторомбическую решетку пространственной группы Pnma с 12 атомами железа и 4 атомами углерода в элементарной ячейке и параметрами a Ц = 4,524; b Ц = 5,088; c Ц = 6,741 Å [21]. Как сказано выше, в случае реализации ОС Багаряцкого габитусной плоскостью является (101) Ц || (112) Ф . Плоскости (112) в ОЦК-решетке феррита образуют шестислойную укладку, в которой каждая следующая плоскость смещена относительно предыдущей на вектор a Ф [100], проекция каждой следующей плоскости на предыдущую смещена на вектор 1 6 a Ф[ 512 ], а межплоскостное расстояние равно a Ф V6/6 = 1,170 А (рис. 1). Плоскости (101) в железной подрешетке цементита образуют двенадцатислойную укладку со средним межплоскостным расстоянием ^ а Ц + c Ц /12 = = 0,677 Å (рис. 2), причем можно выделить плоскости двух типов, содержащие атомы железа в так называемых G - и S -позициях [22]; расположение атомов в этих плоскостях несколько различается (рис. 3, а, б). Наиболее вероятно, что плоскости (101) Ц , образующие когерентную межфазную границу, будут содержать S -атомы: во-первых, поскольку укладка атомов в таких плоскостях гораздо ближе к плоскости (112)Ф – ср. рис. 3, а, б и рис. 1, а, а во-вторых, поскольку при этом не нарушается целостность образующих решетку цементита трехгранных призм, внутри которых находятся атомы углерода.
При наложении плоскостей (101) Ц и (112)Ф мы видим, что в плоскости (101) Ц находится соответствие лишь каждому второму атому плоскости
О-^JO О
о о
3 5
о о
3 5
а)
о о
о
6 2
о
о
о
о
о
о
о
о
QO-0-©
2 4 6 2
5 1 3 5
б)
Рис. 1. Строение плоскостей (112) в ОЦК-решетке. а – расположение атомов в одной плоскости; б – проекция шести последовательных плоскостей (112) на первую. Цифры – номера последовательных плоскостей. Крестики – центры тетрапор в плоскости 1 , звездочка – в плоскости 2
13 12 11 10 9 8 7 6 5 4 3 2 1 0
13 12 11 10 9 8 7 6 5 4 3 2 1 0
S S G G G G S S G G G G S S
Рис. 2. Проекция решетки цементита вдоль направления [010]. Показаны плоскости (101). S -атомы изображены светлее; кружочки меньшего размера – атомы углерода в центрах трехгранных призм. Цифры – номера последовательных плоскостей
б)
Рис. 3. Укладка
атомов
в
плоскостях
(101) в решетке
цементита,
состоящих из G - и S -атомов ( а и б соответственно). Масштаб такой же, как на рис. 1
(112)Ф – рис. 4. Однако расположение атомов в двух последовательных плоскостях (101)Ц у границы раздела фаз почти идеально воспроизводит строение плоскости (112)Ф. При этом обе указанные плоскости (101)Ц состоят из атомов типа S, а расстояние между этими плоскостями составляет 0,6236 Å, что почти вдвое меньше межплоскостного расстояния для (112)Ф, равного, напомним, 1,170 Å. Фактически можно считать, что эти две плоскости в решетке цементита образуют одну плоскость, продолжающую укладку плоскостей (112)Ф, но в которой каждый второй атом смещен в направлении [112 ] на расстояние 0,6236 Å; вектор смещения таким образом равен - = - 0,08883аФ [112].
Это приводит к тому, что тетрапоры в решетке феррита, расположенные вблизи границы, искажаются. Такая искаженная пора показана на рис. 5. Вследствие того, что атом 1 смещается на век-
-
- 1 1 1
тор 5 из положения [[ —; —; -— ]] в положение [[0,4112; 0,4112; –0,6777]], центр поры перемещается из положения [[ 0]] в положение [[0,5; 0,6436; –0,1064]]. Расстояние от центра поры до центров всех четырех атомов железа, окружающих пору, равно 0,6231aФ = 1,7859 Å, а так как атомный радиус RFe = аФ V3/= = 1,2410 А, то радиус искаженной тетрапоры оказывается равен 1,7859 – 1,2410 = 0,5449 Å. Напомним, что в неис- каженной решетке a-железа радиус тетрапор равен аФ (V5 - 4)^4= = 0,3611 А. Таким образом, вблизи границы (112)Ф / (101)Ц часть тетрапор решетки феррита увеличивает свой радиус в 1,509 раза. Такие тетрапоры должны быть предпочтительными местами для размещения атомов водорода, то есть могут рассматриваться как позиции захвата.
Указанные искажения приобретает половина тетрапор, центры которых лежат в последней плоскости (112) Ф , и половина тетрапор, центры которых образуют параллельную ей плоскость, расположенную на 1 /3 межплоскостного расстояния (112) Ф вглубь решетки феррита (плоскости 1 и 2 на рис. 6 и 7). Однако часть из этих пор граничат друг с другом (имеют общую грань или ребро). Сомнительно, чтобы атомы водорода могли одновременно занимать две такие граничащие друг с другом поры, поэтому наличие атома в одной из них должно блокировать остальные. Так, пора а на рис. 7 блокирует поры б , д и ж , а пора д – поры а , в , г и е . Таким образом, каждая искаженная тетрапора блокирует две соседних искаженных тетрапоры.
Поскольку на одну тетрапору в плоскости (112) Ф приходится площадь a Ф2 Тб/4 = 5,030 А2, то две параллельные плоскости, в каждой из которых искажена половина тетрапор, причем вследствие блокировки занята атомами водорода может быть лишь третья часть из них, дают в итоге площадь на одну позицию захвата

ОС Бага-
Рис. 4. Укладка атомов на границе (112)Ф / (101)Ц при ряцкого. Черные кружки – атомы в плоскости (112)Ф, серые – в нижележащей плоскости (101)Ц, белые – в следующей нижележащей плоскости (101)Ц
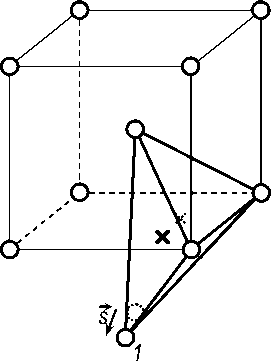
Рис. 5. Искажение тетраэдрической поры вблизи границы раздела (112) Ф / (101) Ц . Серые кружки – атомы железа, входящие в решетку феррита, белые – в решетку цементита
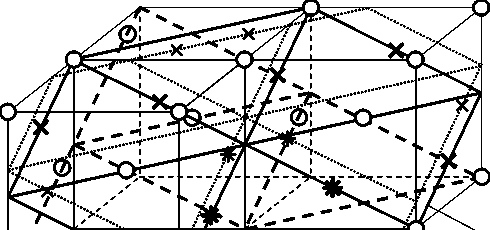

Рис. 6. Положение искаженных тетрапор в решетке феррита вблизи границы (112) Ф / (101) Ц . Серые кружки – атомы железа, входящие в решетку феррита, белые – в решетку цементита. Центры неискаженных тетрапор в плоскостях 1 и 2 показаны крестиками, искаженных – звездочками

Рис. 7. Положение искаженных в решетке феррита у границы тетрапор
(112) Ф / (101) Ц при ОС Багаряцкого. Черные кружки – атомы в плоскости (112) Ф , серые – в нижележащей плоскости (101) Ц , белые – в следующей нижележащей плоскости (101) Ц ; центры неискаженных тетрапор в плоскостях 1 и 2 показаны крестиками, искаженных – звездочками
a 2 — : f 2 ■ 1 ■ 1 ) = a 2 — = 15,090 A2.
Ф 4 I 2 3 J Ф 4
Число позиций захвата на единицу площади тогда равно 4/( а ф зТб) = 6,627 ■ IO14 см-2.
Безусловно, приведенный анализ, основанный лишь на кристаллогеометрических сообра- жениях, является приближенным, и строение межфазной границы, а также положения на ней атомов водорода должны быть уточнены, например, путем компьютерного моделирования «из первых принципов». Но полученные результаты можно использовать как в качестве основы для такого моделирования, так и для предвари- тельного анализа захвата атомов водорода в перлитной структуре.
Работа частично поддержана грантом РФФИ 13-02-00048_а.
Список литературы Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 1. Кристаллогеометрический анализ
- Штремель, М.А. Прочность сплавов. Ч. II. Деформация/М.А. Штремель. -М.: МИСиС, 1997. -528 с.
- Tateyama, Y. Stability and clusterization of hydrogen-vacancy complexes in α-Fe: an ab initio study/Y. Tateyama, T. Ohno//Phys. Rev. B. -2003. -Vol. 67. -174105.
- Counts, W.A. First-principles energetics of hydrogen traps in a-Fe: Point defects/W.A. Counts, C. Wolverton, R. Gibala//Acta Mat. -2010. -Vol. 58, no. 14. -P. 4730-4741.
- Морозов, А.Н. Водород и азот в стали/А.Н. Морозов. -М.: Металлургия, 1968. -284 с.
- Гельд, П.В. Водород в металлах и сплавах/П.В. Гельд, Р.А. Рябов. -М.: Металлургия, 1974. -272 с.
- Шаповалов, В.И. Флокены и контроль водорода в стали/В.И. Шаповалов, В.В. Трофименко. -М.: Металлургия,1987. -161 с.
- Касаткин, Г.Н. Водород в конструкционных сталях/Г.Н. Касаткин. -М.: Интермет инжиниринг, 2003. -336 с.
- Колачев, Б.А. Водородная хрупкость металлов/Б.А. Колачев. -М.: Металлургия, 1985. -218 с.
- Hirth, J.P. Effects of hydrogen on the properties of iron and steel/J.P. Hirth//Met. Trans. -1980. -Vol. 11A, no. 6. -P. 861-890.
- Bernstein, I.M. The role of traps in the microstructural control of hydrogen embrittlement of steels/I.M. Bernstein, G.M. Pressouyre//Hydrogen degradation of ferrous alloys/ed. by R.A. Oriani, J.P. Hirth and M. Smialowski. -Park Ridge, N.J.: Noyes Publications, 1985. -P. 641-685.
- Склюев, П.В. Флокеночувствительность теплостойких сталей для прессового и штампово го инструмента/П.В. Склюев, Е.В. Перцовская//МиТОМ. -1970. -№ 3. -С. 68-70.
- Grabke, H.J. Absorption and Diffusion of Hydrogen in Steels/H.J. Grabke, E. Riecke//Materiali in Tehnologije. -2000. -Vol. 34, no. 6. -P. 331-343.
- Lee, J.L. Hydrogen Trapping in AISI 4340 Steel/J.L. Lee, J.Y. Lee//Metal Science. -1983. -Vol. 17, no. 9. -P. 426-432.
- Einflüsse von Mo, V, Nb, Ti, Zr und deren Karbiden auf die Korrosion und Wasserstoffaufnahme des Eisens in Schwefelsäure/E. Riecke, B. Johnen, H. Liesgang et al.//Werkstoffe und Korrosion. -1988. -Jg. 39, Nr. 11. -S. 525-533.
- Wei, F.G. Precise Determination of the Activation Energy for Desorption of Hydrogen in Two Ti-Added Steels by a Single Thermal-Desorption Spectrum/F.G. Wei, T. Hara, K. Tsuzaki//Met. and Mat. Trans. -2004. -Vol. 35B, no. 3. -P. 587-597.
- Гардин, А.И. Электронная микроскопия стали/А.И. Гардин. -М.: Металлургиздат, 1954. -234 с.
- Тушинский, Л.И. Структура перлита и конструктивная прочность стали/Л.И. Тушинский, А.А. Батаев, Л.Б. Тихомирова. -Новосибирск: ВО «Наука», 1993. -280 с.
- Курдюмов, Г.В. Превращения в железе и стали/Г.В. Курдюмов, Л.М. Утевский, Р.И. Эн-тин. -М.: Наука, 1977. -240 с.
- Перлит в углеродистых сталях/В.М. Счастливцев, Д.А. Мирзаев, И.Л. Яковлева и др. -Екатеринбург: УрО РАН, 2006. -312 с.
- Счастливцев, В.М. Структура термически обработанной стали/В.М. Счастливцев, Д.А. Мирзаев, И.Л. Яковлева. -М.: Металлургия, 1994. -288 с.
- Andrews, K. W. The structure of cementite and its relation to ferrite/K. W. Andrews//Acta Met. -1963. -Vol. 11, no. 8. -P. 939-946.
- Fasiska, E.J. On the cementite structure/E.J. Fasiska, G.A. Jeffrey//Acta Cryst. -1965. -Vol. 19. -Pt. 3. -P. 463-471.
- Shtremel' M.A. Prochnost' splavov. Ch. II. Deformatsiya [Strength of Alloys. Part II. Deformation]. Moscow, MISiS, 1997. 528 p
- Shapovalov V.I., Trofimenko V.V. Flokeny i kontrol' vodoroda v stali [Flakes and Hydrogen йшi in Steel]. Moscow, Metallurgiya, 1987. 161 p.
- Kasatkin G.N. Vodorod v konstruktsionnykh stalyakh [Hydrogen in Structural Steels]. Moscow, Intermet Engineering, 2003. 336 p.
- Kolachev B.A. Vodorodnaya khrupkost' metallov [Hydrogen Brittleness of Metals]. Moscow, Metallurgiya, 1985. 218 p.
- Hirth J.P. Effects of Hydrogen on the Properties of Iron and Steel. Metallurgical Transactions A, 1980, vol. 11, no. 6, pp. 861-890 DOI: 10.1007/BF02654700
- Bernstein I.M., Pressouyre G.M. The Role of Traps in the Microstructural ntel of Hydrogen Embrittlement of Steels. Hydrogen Degradation of Ferrous Alloys. Ed. by R. A. Oriani, J. P. Hirth and M. Smialowski. Park Ridge, N.J., Noyes Publications, 1985, pp. 641-685.
- Sklyuev P.V., Pertsovskaya E.V. Susceptibility to Hairline &acks of Heat-Resisting Steels for Pressing and Punching Tools. Metal Science and Heat Treatment, 1970, vol. 12, no. 3, pp. 263-264 DOI: 10.1007/BF00657819
- Grabke H.J., Riecke E. Absorption and Diffusion of Hydrogen in Steels. Materiali in Tehnologije, 2000, vol. 34, no. 6, pp. 331-343.
- Lee J.L., Lee J.Y. Hydrogen Trapping in AISI 4340 Steel. Metal Science, 1983, vol. 17, no. 9, pp. 426-432 DOI: 10.1179/030634583790420619
- Riecke E., Johnen B., Liesgang H., Thoms A., Reynders B., Grabke H.J. Einflüsse von Mo, V, Nb, Ti, Zr und deren Karbiden auf die Korrosion und Wasserstoffaufnahme des Eisens in Schwefelsäure. Werkstoffe und Korrosion, 1988, vol. 39, no. 11, pp. 525-533 DOI: 10.1002/maco.19880391108
- Wei F.G., Hara T., Tsuzaki K. Precise Determination of the Activation Energy for Desorption of Hydrogen in Two Ti-Added Steels by a Single Thermal-Desorption Spectrum. Metallurgical and Materials Transactions B, 2004, vol. 35, no. 3, pp. 587-597 DOI: 10.1007/s11663-004-0057-x
- Gardin A.I. Elektronnaya mikroskopiya stali [Electron Microscopy of Steel]. Moscow, Metallurgizdat, 1954. 234 p.
- Tushinskii L.I., Bataev A.A., Tikhomirova L.B. Struktura perlita i konstruktivnaya prochnost' stali [Pearlite Structure and Structural Strength of Steel]. Novosibirsk, VO “Nauka”, 1993. 280 p.
- Kurdyumov G.V., Utevskii L.M., Entin R.I. Prevrashcheniya v zheleze i stali [Transformations in Iron and Steel]. Moscow, Nauka, 1977. 240 p.
- Schastlivtsev V.M., Mirzaev D.A., Yakovleva I.L., Okishev K.Yu., Tabatchikova T.I., Khlebnikova Yu.V. Perlit v uglerodistykh stalyakh [Pearlite in Carbon Steels]. Ekaterinburg, Ural Branch of Russian Academy of Science, 2006. 312 p.
- Schastlivtsev V.M., Mirzaev D.A., Yakovleva I.L. Struktura termicheski obrabotannoy stali [Structure of Heat Treated Steel]. Moscow, Metallurgiya, 1994. 288 p.
- Andrews K.W. The Structure of Cementite and Its Relation to Ferrite. Acta Metallurgica, 1963, vol. 11, no. 8, pp. 939-946 DOI: 10.1016/0001-6160(63)90063-4
- Fasiska E.J., Jeffrey G.A. On the Cementite Structure. Acta Crystallographica, 1965, vol. 19, no. 3, pp. 463-471 DOI: 10.1107/S0365110X65003602


