Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 2. Теория адсорбции
Автор: Мирзаев Джалал Аминулович, Яковлева Ирина Леонидовна, Терещенко Наталья Адольфовна, Табатчикова Татьяна Иннокентьевна, Окишев Константин Юрьевич, Мирзоев Александр Аминулаевич, Верховых Анастасия Владимировна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 3 т.14, 2014 года.
Бесплатный доступ
Известно, что межфазные границы феррит / карбид в сталях могут являться центрами захвата атомов водорода. В работе рассмотрена адсорбция атомов водорода на границах феррит / цементит в углеродистых сталях. Проведены экспериментальные исследования по насыщению водородом в сероводородсодержащей среде согласно стандарту NACE Standard TM 0177-2005 образцов углеродистой стали У10 со структурой грубо- и тонкопластинчатого перлита (межпластиночное расстояние S примерно 0,36 и 0,085 мкм). После насыщения и 4-месячного вылёживания при комнатной температуре было определено содержание водорода в образцах. Оно выросло по сравнению с образцами, не подвергавшимися наводороживанию, с 6,85 до 8,4 и с 8,45 до 13,5 мас. ppm для образцов с грубо- и тонкопластинчатым перлитом соответственно. Наблюдение структуры в просвечивающем электронном микроскопе показало, что при наводороживании изменяется состояние цементита в перлитных колониях: его пластины кажутся толще за счёт визуального размывания межфазной поверхности, по длине пластин появляется неоднородный контраст. По-видимому, эти изменения связаны с поглощением межфазной поверхностью водорода. Проведено теоретическое рассмотрение адсорбции водорода на межфазных границах в рамках теории Ленгмюра. Если принять оценку плотности мест захвата водорода на межфазных границах 6,627·10 14 см -2, сделанную в первой части работы из кристаллогеометрических соображений, и сопоставить её с наблюдаемыми в эксперименте значениями количества поглощённого водорода, то доля заполненных мест захвата оказывается значительно меньше единицы (0,15-0,20). Энергия связи водорода с межфазной границей по литературным данным равна 12,66 кДж/моль; тогда на основании полученных экспериментальных результатов предэкспоненциальный множитель в уравнении адсорбции приближённо равен 2,2·10 -4 /S. Это означает, что эффективная растворимость водорода в тонкопластинчатом перлите может повышаться в 1,5-2 раза. Аналогичный анализ может быть применён и для захвата водорода другими межфазными границами. Он укладывается в рамки подхода Ориани и в сочетании с ним может использоваться для оценки общего количества связанного водорода в стали с учётом действия всех типов ловушек.
Перлит, феррит, цементит, межфазная граница, водород, захват водорода, наводороживание, адсорбция
Короткий адрес: https://sciup.org/147156882
IDR: 147156882 | УДК: 669.14
Текст научной статьи Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 2. Теория адсорбции
Как упоминалось в первой части работы [1], в поковках высокоуглеродистых сталей флокены не наблюдаются даже при содержании водорода в 10–12 ppm и отсутствии противофлокенной термической обработки, хотя оценки показывают, что атомы элементов замещения, вакансии, дислокации и границы зёрен могут захватить лишь 3–4 ppm, а для образования флокенов достаточно концентрации диффузионно-подвижного водорода в 1,5–2,0 ppm [3]. Следовательно, в этих сталях существуют и другие центры, которые захватывают водород. Стехиометрические карбиды типа M 7C3, M 23C6, M 3C, M 2C, существующие в подобных сталях, водород не растворяют [4, с. 314–351]. По этим причинам возникло предположение об адсорбции водорода на межфазных границах фер-рит/карбид, причём речь идёт о карбидах разного размера, когерентных или некогерентных с решёткой феррита. Такую гипотезу поддерживают многие исследователи [5–8]. Особого внимания заслуживают границы феррит/цементит, появляющиеся при разнообразных процессах термической обработки углеродистых или низколегированных сталей.
После относительно медленного охлаждения из аустенитного состояния цементит в углеродистых сталях находится в составе перлита – структуры, колонии которой состоят из последовательно чередующихся пластин феррита и цементита. Пластины феррита имеют толщину S α, примерно в 7 раз бóльшую, чем толщина цементитных пластин S ц. Усреднённая сумма S α+ S ц = S представляет межпластиночное расстояние, являющееся важнейшей структурной характеристикой перлита, определяющей, в частности, уровень прочностных свойств стали [2, 9]. Величина S зависит от переохлаждения Δ T = A 1 – T аустенита, превращающегося при температуре T в перлит, относительно критической точки A 1 =727 °C [10]:
S = 15 , мкм. (1)
Δ T
Легко понять, что параметр
FV = 2 = 1,3 ⋅ 103 ∆ T , см–1 (2)
отражает площадь межфазных границ в единице объёма [2]. При изменении температуры образования перлита от ~700 до ~550 °C удельная площадь межфазных границ FV увеличивается на порядок, а значит, на порядок должно возрастать и количество адсорбированного межфазными границами водорода.
Цель данной работы заключается в определении количества водорода, захватываемого перлитными структурами с различными удельными площадями, и в анализе на этой основе процесса захвата водорода межфазными границами феррит / цементит.
Материал и методика исследований
В экспериментах была использована сталь У10 промышленного производства. Пруток из этой стали был разрезан на три части, которые прошли совместную нормализацию от 800 °C. Затем эти заготовки были порознь термообработаны для получения перлитных структур различной морфологии и дисперсности. Структуры грубо- и тонкопластинчатого перлита были получены с использованием малой (с печью) и большой (в масле) скоростей охлаждения образцов, аустенитизированных при 800 °C. Структура зернистого перлита была получена по режиму маятникового отжига: 780 → 670 → 740 → 670 °C. Из заготовок были затем изготовлены образцы цилиндрической формы диаметром 11 мм и высотой 10 мм. Часть этих образцов была подвергнута воздействию сероводородсодержащей среды (5 %-ный раствор хлористого натрия в дистиллированной воде с добавлением 0,5 % ледяной уксусной кислоты; рН 2,9–3,1) при температуре (24 ± 3) °С в течение 720 ч. Концентрация сероводорода в испытательной среде была не менее 2600 мг/л. Отношение объёма раствора к общей площади поверхности образцов составляло более 30 см3/см2. Условия обработки отвечали стандарту NACE Standard TM 0177-2005.
После обработки в сероводородсодержащей среде образцы были выдержаны в течение 4 месяцев на воздухе при комнатной температуре, а затем подвергнуты химическому анализу. Содержание водорода определяли на приборе RH402 фирмы LECO (США) в соответствии с ГОСТ 17745–90.
Структура образцов до и после наводорожи-вания изучалась при помощи просвечивающего электронного микроскопа JEM-200CX Центра коллективного пользования Института физики металлов УрО РАН на фольгах, приготовленных по стандартным методикам.
Результаты экспериментальных исследований
Концентрации водорода в исследованных образцах приведены в табл. 1. В исходном состоянии (до наводороживания) содержание водорода в стали со структурой тонкопластиночного и зернистого перлита близко и составляет 8,45 и 8,85 ppm соответственно. В стали со структурой грубопластиночного перлита эта величина заметно меньше (6,85 ppm), что обусловлено, вероятно, более интенсивным выделением водорода в ходе замедленного охлаждения при термической обработке. После наводороживания концентрация водорода практически не изменилась в стали со структурой зернистого перлита и возросла в стали с пластинчатым цементитом. Для тонкопластинчатого перлита этот прирост был втрое больше, чем для грубопластинчатого (5,05 и 1,55 ppm).
Тонкая структура образцов стали У10, различающихся дисперсностью пластин, была изучена с помощью просвечивающего электронного микроскопа (рис. 1). Колонии тонкопластинчатого перлита состоят из параллельных пластин цементита правильной формы. Протяжённость перлитной колонии вдоль пластин цементита достигает 2–3 мкм. Межпластиночное расстояние было измерено по снимкам, на которых отношение толщин ферритных и цементитных пластин близко к 7. В среднем оно равно 0,085 мкм. Для ферритной составляющей в исходном состоянии характерен однородный контраст, свидетельствующий о низкой плотности дислокаций. У грубопластинчатого перлита величина S вчетверо больше, чем у тонкопластиночного (в среднем 0,36 мкм).
После наводороживания изменилось состояние цементита в перлитных колониях. Пластины цементита визуально кажутся толще за счёт более «мохнатой» межфазной границы с развитой поверх-
Таблица 1
Содержание водорода в стали У10 с различной морфологией перлита, мас. ppm
|
Морфология перлита |
Обработка |
Содержание водорода в образцах |
Изменение после наводороживания (среднее) |
|
Грубопластинчатый |
Исходное состояние |
6,0 7,7 |
1,55 |
|
После наводороживания и выдержки |
7,3 9,5 |
||
|
Тонкопластинчатый |
Исходное состояние |
8,3 8,6 |
5,05 |
|
После наводороживания и выдержки |
13,0 14,0 |
||
|
Зернистый |
Исходное состояние |
8,4 9,3 |
–1,40 |
|
После наводороживания и выдержки |
6,9 8,0 |

а) х 50000
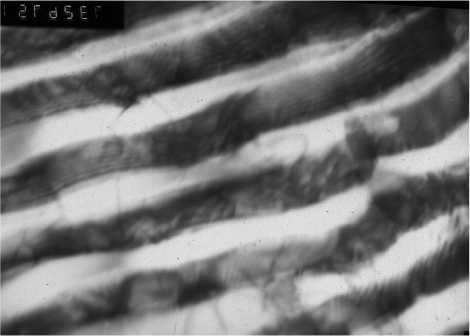
б) х 59000

в) х 73000
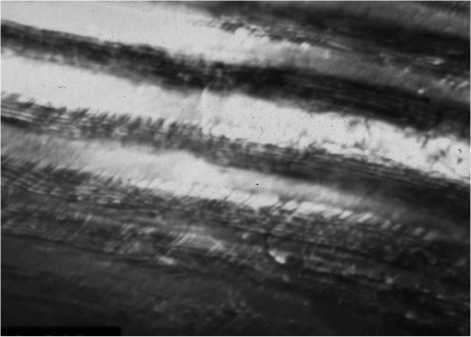
г) х 73000

д) х 37000

е) х 37000
Рис. 1. Структура тонкопластинчатого (а–г) и грубопластинчатого (д, е) перлита в стали У10: а – в исходном состоянии; б–е – после наводороживания; а–в, д – светлопольные изображения; г, е – темнопольные изображения в рефлексе феррита
ностью. Контраст по длине цементитной пластины неоднороден, при растровой электронной микроскопии с увеличениями 8000–15000 практически на каждой пластине с интервалом от 0,5 до 2 мкм наблюдаются более светлые участки. Ранее прямолинейная граница феррит/цементит становится волнистой. Эти наблюдения свидетельствуют о существенном изменении состояния таких границ после наводороживания, что можно объяснить адсорбцией на них водорода. Чем больше удельная протяжённость границ FV, тем большее количество водорода сохраняется после четырёхмесячной выдержки.
Обсуждение
Рассмотрим теперь теоретическую сторону проблемы. При насыщении образцов водородом в α -твёрдом растворе увеличивается концентрация
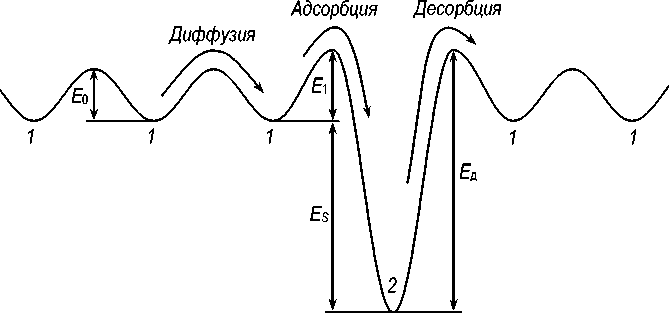
Рис. 2. Схема энергетических уровней иона водорода около межфазной границы по [11]: 1 – энергия иона в решётке; 2 – энергия иона на межфазной границе; E S – энергия связи с межфазной границей; E 1 – барьер при перескоке на межфазную границу; E д = E S + E 1 – энергия активации десорбции (барьер при перескоке с межфазной границы в решётку); E 0 – энергия активации решёточной диффузии
водорода C H, но одновременно водород адсорбируется на межфазных границах феррит / цементит. Будем считать, что на 1 см2 межфазной границы находится M возможных позиций, в которых атом (ион) водорода обладает пониженной на величину E S потенциальной энергией; таким образом, E S есть энергия связи атома водорода с межфазной границей. На рис. 2 показана схема изменения энергии иона водорода при нормальной диффузии по решётке, адсорбции и десорбции согласно [11].
Обозначим через n число позиций (пор) на единицу площади межфазной границы, реально заполненных атомами водорода. Тогда
θ = n (3) M
а
C H =
m
HF 0 ρ
2 M θ A H SN А ρ
= 4, 25 ⋅ 10 - 25
M θ S
представляет долю заполненных атомами водорода пор. Если среднее межпластиночное расстояние в перлите равно S , то при толщине образца H и площади сечения F 0 суммарная площадь межфаз-
= 4,25 ⋅ 10 - 19 M S θ , ppm, (7)
где M выражено в см–2, а S – в см.
Если принять значение M = 6,627·1014 см–2, найденное ранее из кристаллогеометрических соображений [1], то при θ = 1 ёмкость межфазных границ для экспериментально наблюдавшихся значений межпластиночных расстояний S = 3,6·10–5 и 8,5·10–6 см будет равна C H а = 7,8 и 33,1 ppm соответственно. Сравнение этих значений с экспериментально наблюдавшимися изменениями концентрации водорода (см. табл. 1) показывает, что θ ≈ 0,15–0,20, то есть значительно меньше единицы.
Процесс адсорбции водорода на межфазной
H ных границ есть 2 F0 ; количество атомов водо-
рода, адсорбированных на этих границах,
N = 2 HS F 0 M θ ,
а их масса
m = 2 H F M θ A H , S 0 N А
где A H – атомная масса водорода, а N А – число Авогадро. Из выражения (4) следует, что количество центров захвата в единице объёма составляет
N = 2 M . з S
Так как масса образца есть H F 0 ρ , где ρ – плотность стали (7,81 г/см3), то концентрацию водорода, адсорбированного межфазными границами, можно выразить следующим образом:
границе можно просто описать в рамках теории Ленгмюра [12–14], которая основана на следующих положениях:
-
1. Адсорбция происходит не на всей поверхности адсорбента, а на активных центрах, в качестве которых мы будем рассматривать искажённые тетрапоры на когерентных межфазных границах феррит/цементит [1].
-
2. Каждый активный центр способен взаимодействовать только с одним атомом водорода, в результате чего на поверхности может возникать один слой адсорбированных атомов. Впрочем, применительно к водороду это положение может быть неточным, так как известно, например, что вакансии могут вмещать до шести атомов водорода [16–18].
-
3. Процесс адсорбции является обратимым и равновесным [13]: адсорбированный ион водорода удерживается активным центром некоторое время, после чего десорбируется. Тогда между процессами адсорбции и десорбции устанавливается динамическое равновесие, при котором скорости ад-
сорбции и десорбции равны. Скорость десорбции [13, 14] пропорциональна доле занятых активных центров 9, а скорость адсорбции - произведению концентрации адсорбата CH на долю свободных активных центров CH (1 - 9). В итоге d9 = ка Ch(1 -9) - кд 9, (8)
против тетрапоры в плоскости a -Fe расположен центр захвата на межфазной границе. Эта масса атомов рассредотачивается по площади F 0 ; с учё- d mN. d 9
том (5) запишем--= —; следовательно, dt F0AHM dt
где k а и k д – коэффициенты пропорциональности (константы скорости реакций). Элементарное интегрирование дифференциального уравнения (8) даёт результат
d 9 = N A 5р C н dt A H M
V 1 exP I - E 1 C h(1 -9 ). I кт )
Сравнивая это выражение с (8), найдём константу скорости адсорбции:
9 = T C HT [ 1 - exP ( " С k а C H + k д ) t ) ] , (9)
C H + b
k а
N A s 5p
A H
V 1 exp
—
E l 1 кТ )
где b = к д / к а . Очевидно, что равновесное значение 9 * оказывается равным
9 * = -C H- C н + b
.
Тогда кинетическое уравнение адсорбции (9) можно записать в форме
9 = 9 * [ 1 - exp ( - ( к а C н + к д ) t ) ] . (11)
Уравнение (11) есть изотерма мономолекулярной адсорбции по Ленгмюру. Поскольку концентрация водорода в сплаве пропорциональна P H , где
P H – давление молекулярного водорода во внешней атмосфере, то
P
9= 2 . (12)
P^ + + b
Очевидно, что при t ^^ доля заполненных междоузлий 9 стремится к равновесному значению 9 , а в начале процесса 9 = 0.
Оценим далее константы скоростей реакций в приближении модели Ленгмюра, справедливость которых для адсорбции водорода была показана в работе [15]. Будем считать, что первая плоскость нормальной решётки a-фазы расположена на расстоянии 5 от межфазной границы. Масса атомов, сосредоточенных в объёме F0 5, есть F0 5 р, а масса атомов водорода в этом объёме m1 = Fo5p Cн. (13)
Каждый из этих атомов может совершить перескок на межфазную границу с частотой
Г Ел
V 1 exp I--- I (1 - 9 ), где (1 - 9 ) - вероятность того, I кТ )
что данная пора свободна. Поэтому масса атомов водорода, переходящих на одну межфазную гра-
ницу за единицу времени, m1 = ЧрCнv1exPГ-EJ(1 -9)Ms, (14)
I кТ )
где s = 5,030·10–16 см2 представляет площадь на одну тетраэдрическую пору в соседней с межфазной границей плоскости (112) a -фазы, а отноше-
M ние ---= Ms есть вероятность события, что на-
1/ s
где V 1 - частота колебаний атома водорода в решётке, а E 1 – энергия активации десорбции (см. рис. 2).
При анализе десорбции учтём, что согласно (5) масса атомов водорода, адсорбированных одной межфазной границей, равна m2 = FM 9 A" . (17)
2 0 N А
Г Е д 1
Каждый атом может с частотой v2 exp —— пе-
2 ( кТ )
рескочить в позиции решётки, поэтому d9 Г Ед 1 о лол
— = -v 2 exp I - 1-9 , (18)
dt ( кТ )
где v 2 - частота колебаний атомов водорода в позициях захвата на межфазной границе. Следовательно,
Г Е д 1 к д Г Е 1
к„ = v2 exp —д ; b — — — X exp —- , (19)
д 2 I кТ J к I кТ J
а где ES = Eд –E1 есть энергия связи атома водорода с межфазной границей, а X — ——— — . Важно NАs5р V1
отметить, что поскольку реальное значение 9 значительно меньше единицы, то в знаменателе правой части выражения (10) можно пренебречь слагаемым C H по сравнению с b ; тогда
9 * — — exp Г— 1 . (20)
X Ч кТ )
Полученные результаты позволяют преобразовать формулу (7) для концентрации адсорбированного водорода к физически более ясному виду
С а-2 MA А Л MA h C H р ^Г Е ^ 1-
CTJ 9'■ exp н SNАр SNАр X ЧRTJ
2 M V, Г Es 1
= C н^ Q —exp I I (21)
S V 2 ^ RT )
и рассчитать суммарную (полную) концентрацию водорода па
C H = C H + C H =
Г-i 2 M^ Vi Г Ev 11
= C h| 1 + ^Q — exp — I . (22)
( s v 2 v Rт ))
В этих выражениях величина Q = s 5 представляет
объём, приходящийся на один атом в решётке феррита, а энергия E S взята в расчёте на 1 моль. Выражение (22) можно представить в обобщённой форме, как и для центров захвата иных видов [11]:
ное выражение для концентрации водорода в перлите тогда приобретает вид па
C H = C H + C H =
п
C H = C H
I Er I
1 + n N„ exp з ( RT )
= C h | 1 +
3,86 - 10 — 4 1 1520 1
--------------exp I-------I
S [мкм] ( T )
где N з – число мест захвата на единицу объёма,
v, определённое (6), a n = Q — .
v 2
В ранних работах по десорбции предполагалось, что v 1 = v 2, но уже в работе [7] была высказана идея, что частота v 2 может быть существенно меньше, чем v 1 . Энергия активации термодесорбции водорода из межфазных границ в насыщенной водородом перлитной стали составляет E д = 18,35 кДж/моль [19]; она равна сумме E д = ES + E 1 (см. рис. 2). Энергия активации решёточной диффузии составляет E 0 = 5,69 кДж/моль [20]; если принять E 1 = E 0, то для энергии связи водорода с межфазной границей a /Fe3C получается оценка ES = 12,66 кДж/моль. Используем экспериментальные данные табл. 1 для расчёта величи-
v ны 2MQ — в формуле (22). Представим (22) в v2
слегка изменённом виде
A C H
п
H
—
C H
C H
C H
2 M vx\ I Es I =--- Q — exp -- .
S v 2 ( RT J
A C H /
Отношение H измерено экспериментально (см. CH табл. 1): оно равно 0,22 для грубопластинчатого и 0,60 для тонкопластинчатого перлита. Принимая ES = 12,66 кДж/моль, найдём для измеренных значений межпластиночного расстояния S = 3,6·10–5
и 8,5^10-6 см величину 2 M —Q = 4,70 - 10 s и v 2
3,03·10–8 см; в среднем 3,86·10–8 см. Окончатель-
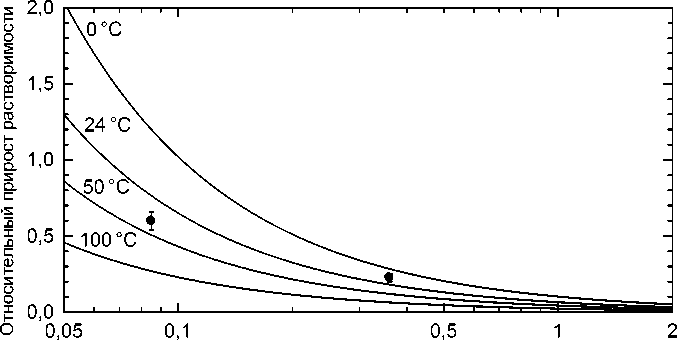
Зависимость прироста концентрации водорода, обусловленного захватом межфазными границами феррит / цементит, от межпластиночного расстояния S согласно этому соотношению показана на рис. 3. Как видно, при малом межпластиночном расстоянии (в перлите, формирующемся при низкой температуре) концентрация водорода может повышаться в полтора-два раза.
Таким образом, если известны межпластиночное расстояние в колониях перлита, температура и концентрация водорода в феррите, то формула (25) позволяет рассчитать как концентрацию водорода, адсорбированного на межфазных границах, так и полное содержание водорода. Из литературных данных известно, что некоторые другие межфазные границы обладают значительно более высокой энергией связи с атомами водорода; упоминаются, в частности, границы a /TiC (62-110 кДж/моль для некогерентной и 40–53 кДж/моль для когерентной границы) [7], a /MnS (66 кДж/моль) [8]. Для описания захвата водорода этими границами можно использовать тот же подход при соответствующем значении энергии E S . Отметим, что в отношении частиц MnS давно существовало мнение об их активном влиянии на зарождение флокенов [21] и процессы водородного растрескивания [22].
Формула (25) позволяет решить и другую задачу. Допустим, что C Hп представляет общее содержание в стали водорода, который находится вдали от внешней поверхности и не может выйти из образца, но перераспределяется между ферритом и межфазными границами; тогда C H есть концентрация водорода в решётке, а C Hа – на межфаз-
Межпластиночное расстояние, мкм
Рис. 3. Относительный прирост концентрации водорода ( C ", - C н)/ с H в зависимости от межпластиночного расстояния в перлите при различных температурах. Линии – расчёт по формуле (25), точки – экспериментальные данные из табл. 1
ных границах. Основываясь на (23), найдём содержание водорода в твёрдом растворе
п
C H
C H = I E/
-
1 + n N, exp
3 4 RT
в виде выражения, отражающего локальное равновесие между решёточным водородом и водородом, захваченным центрами химического притяжения. Но поскольку такое равновесие устанавливается и между решёточным и захваченным ловушками иной природы водородом, то в эту формулу можно включить и другие центры захвата: атомы примесей, вакансии, дислокации, границы зёрен и межфазные границы всех типов [5]:
п C H
H
I E 5 , i
-
1 + X n i N 3, i exp I
i I RT
где индекс i нумерует различные механизмы захвата. Поэтому формулу (27) можно использовать, например, для оценки степени опасности образования флокенов в стали, если известны механизмы и плотность центров захвата Nз, i. В этом случае концентрацию водорода CHп следует заменить на его концентрацию, сохранившуюся после кристаллизации и ковки. Если в результате захвата водорода ловушками содержание диффузионноподвижного водорода окажется ниже 2 ppm, то образование флокенов станет невозможным.
Выводы
-
1. Наводороживание в одинаковых условиях образцов эвтектоидной стали с грубо- и тонкопластинчатым перлитом создаёт существенно более высокую концентрацию водорода во втором случае. Этот эффект следует рассматривать как доказательство захвата атомов водорода межфазными границами феррит/цементит в перлите.
-
2. Представлена теория захвата водорода межфазными границами любого вида, учитывающая явления адсорбции и десорбции, и как компромисс между ними – равновесное распределение атомов водорода между тетрапорами решётки феррита и межфазными границами. Для межфазных границ a /Fe3C определены значения всех численных параметров теории, включая энергию захвата водорода. Уравнение для концентрации водорода, захваченного межфазными границами, отражает усиление захвата при уменьшении межпластиночного расстояния.
Работа частично поддержана грантами РФФИ 13-02-00048 и 14-03-00618. Экспериментальная часть работы выполнена в рамках Программы фундаментальных научных исследований РАН, тема «Структура» (№ 01201463331).
Список литературы Возможности захвата атомов водорода в сталях межфазными границами феррит / цементит. 2. Теория адсорбции
- Окишев, К.Ю. Возможности захвата атомов водорода в сталях межфазными границами феррит/цементит. 1. Кристаллогеометрический анализ/К.Ю. Окишев, Д.А. Мирзаев, А.В. Верховых//Вестник ЮУрГУ. Сер. «Металлургия». -2013. -Т. 13, № 2. -С. 95-102.
- Тушинский, Л.И. Структура перлита и конструктивная прочность стали/Л.И. Тушинский, А.А. Батаев, Л.Б. Тихомирова. -Новосибирск: ВО «Наука», 1993. -280 с.
- Шаповалов, В.И. Флокены и контроль водорода в стали/В.И. Шаповалов, В.В. Трофименко. -М.: Металлургия, 1987. -161 с.
- Штремель, М.А. Прочность сплавов. Ч. II. Деформация/М.А. Штремель. -М.: МИСиС, 1997. -528 с.
- Grabke, H.J. Absorption and Diffusion of Hydrogen in Steels/H.J. Grabke, E. Riecke//Materiali in Tehnologije. -2000. -Vol. 34, no. 6. -P. 331-343.
- Einflüsse von Mo, V, Nb, Ti, Zr und deren Karbiden auf die Korrosion und Wasserstoffaufnahme des Eisens in Schwefelsäure/E. Riecke, B. Johnen, H. Liesgang et al.//Werkstoffe und Korrosion. -1988. -Jg. 39, Nr. 11. -S. 525-533 DOI: 10.1002/maco.19880391108
- Wei, F.G. Precise Determination of the Activation Energy for Desorption of Hydrogen in Two Ti-Added Steels by a Single Thermal-Desorption Spectrum/F.G. Wei, T. Hara, K. Tsuzaki//Met. Mat. Trans. B. -2004. -Vol. 35B, no. 3. -P. 587-597 DOI: 10.1007/s11663-004-0057-x
- Lee, J.L. Hydrogen Trapping in AISI 4340 Steel/J.L. Lee, J.Y. Lee//Metal Science. -1983. -Vol. 17, no. 9. -P. 426-432 DOI: 10.1179/030634583790420619
- Пикеринг, Ф.Б. Физическое металловедение и разработка сталей: пер. с англ./Ф.Б. Пикеринг. -М.: Металлургия, 1982. -184 с.
- Перлит в углеродистых сталях/В.М. Счастливцев, Д.А. Мирзаев, И.Л. Яковлева и др. -Екатеринбург: УрО РАН, 2006. -312 с.
- Oriani, R.A. The Diffusion and Trapping of Hydrogen in Steel/R.A. Oriani//Acta Met. -1970. -Vol. 18, no. 1. -P. 147-157 DOI: 10.1016/0001-6160(70)90078-7
- Лопаткин, А.А. Теоретические основы физической адсорбции/А.А. Лопаткин. -М.: МГУ, 1983. -319 с.
- Адамсон, А. Физическая химия поверхностей/А. Адамсон. -М.: Мир, 1979. -568 с.
- Кельцев, Н.В. Основы адсорбционной техники/Н.В. Кельцев. -М.: Химия, 1984. -591 с.
- McNabb, A. A New Analysis of the Diffusion of Hydrogen in Iron and Steel/A. McNabb, P.K. Foster//Trans. AIME. -1963. -Vol. 227, no. 6. -P. 618-627.
- Fukai, Y. Formation of Superabundant Vacancies in M-H Alloys and Some of Its Consequences: A Review/Y. Fukai//Journal of Alloys and Compounds. -2003. -Vol. 356-357. -P. 263-269 DOI: 10.1016/S0925-8388(02)01269-0
- Tateyama, Y. Stability and Clusterization of Hydrogen-Vacancy Complexes in -Fe: An Ab Initio Study/Y. Tateyama, T. Ohno//Phys. Rev. B. -2003, Vol. 67, 174105 DOI: 10.1103/PhysRevB.67.174105
- Hydrogen-Vacancy Interaction in Bcc Iron: Ab Initio Calculations and Thermodynamics/D.A. Mirzaev, A.A. Mirzoev, K.Yu. Okishev, A.V. Verkhovykh//Molecular Physics. -2014. -Vol. 112, no. 13. -P. 1745-1754 DOI: 10.1080/00268976.2013.861087
- Choo, W.Y. Hydrogen Trapping Phenomena in Carbon Steel/W.Y. Choo, J.Y. Lee//J. Materials Science, 1982. -Vol. 17, no. 7. -P. 1930-1938 DOI: 10.1007/BF00540409
- Kiuchi, K. The Solubility and Diffusivity of Hydrogen in Well-Annealed and Deformed Iron/K. Kiuchi, R.B. McLellan//Acta Metallurgica. -1983. -Vol. 31, no. 7. -P. 961-984 DOI: 10.1016/0001-6160(83)90192-X
- Влияние неметаллических включений на окклюзию водорода сталью в напряжённом состоянии/С.К. Чучмарев, В.Г. Старчак, Л.Г. Барг и др.//Изв. АН СССР. Металлы. -1972. -№ 1. -С. 42-44.
- Lumsden, J.B. Effect of Palladium Additions to AISI 4130 Steel on Its Sulphide Cracking Susceptibility/J.B. Lumsden, B.E. Wilde, P.J. Stocker//Scripta Metallurgica. -1983. -Vol. 17, no. 8. -P. 971-974 DOI: 10.1016/0036-9748(83)90432-5


