Возможные механизмы изменения функциональных свойств полоски диафрагмы мыши при белковой сенсибилизации
Автор: Теплов Александр Юрьевич, Фархутдинов Альберт Мансурович, Теплов Олег Вадимович, Гришин Сергей Николаевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Исследованы механизмы влияния аллергической перестройки организма на сократительную функцию полоски диафраг- мы (ДМ) мыши. Показано, что при белковой сенсибилизации (БС) возрастает сила сокращения (Рос), вызванного холино- миметиком карбахолином (Кx), у ДМ in vitro и снижается неквантовая секреция (НС) ацетилхолина (Аx) в зоне концевой пластинки. Увеличение Рос на Кx является следствием повышения чувствительности постсинаптической мембраны мы- шечных волокон к холиномиметику, что обусловлено снижением уровня НС Аx в зоне концевой пластинки. Экзогенная АТФ также увеличивает Рос и снижает НС АХ полосок ДМ и интактных, и сенсибилизированных мышей. Вектор дина- мики Рос мышцы на Кx при всех вариантах экспериментальных воздействий коррелирует с изменением НС Аx. Однако степень этих изменений у мышцы сенсибилизированного животного менее выражена, чем у несенсибилизированного. Высказывается предположение, что меньшая изменчивость функциональных свойств, вызванная АТФ, у ДМ сенсибили- зированных мышей в сравнении с контролем является свидетельством развития механизмов резистентности к внешним нагрузкам у дыхательных мышц, которая появляется при бронхоспастическом синдроме и бронхиальной астме.
Диафрагмальная мышца, сократительные свойства, неквантовая секреция, белковая сенсибилизация, атф, мышь
Короткий адрес: https://sciup.org/142121508
IDR: 142121508
Текст научной статьи Возможные механизмы изменения функциональных свойств полоски диафрагмы мыши при белковой сенсибилизации
Аллергическая перестройка организма, изменяя функциональные свойства поперечнополосатых мышц, затрагивает холинергические механизмы их возбуждения [1]. Данное предположение было подтверждено нашими исследованиями in vitro , выполненными на «быстрых» и «медленных» мышцах голени мыши [4, 5, 7], в которых было показано изменение характеристик сокращения поперечнополосатых мышц мыши на холиномиметик карбахолин и неквантовой секреции ацетилхолина в зоне концевой пластинки при белковой сенсибилизации.
Ранее на тех же объектах и в тех же экспериментальных моделях была показана способность экзогенной АТФ обратимо изменять сократительную функцию и величину неквантовой секреции ацетилхолина [9, 11]. Одним из объяснений механизмов обнаруженного действия стало предположение, что АТФ влияет на холиноопосредованные процессы возбуждения мышечных волокон (МВ).
Диафрагма, являясь основной дыхательной мышцей, изменяет свои сократительные свойства в условиях нарушенной бронхиальной проводимости при заболеваниях, имеющих в своей основе аллергический компонент, таких как бронхоспастический синдром и бронхиальная астма [12, 13, 16].
Принимая во внимание тот факт, что АТФ, являясь эндогенным модулятором функции поперечнополосатых мышц [9], одновременно способна участвовать в механизмах генерации иммунного ответа [14], мы исследовали влияние экзогенной АТФ на функциональные свойства диафрагмы in vitro у несенсибилизированных и сенсибилизированных чужеродным белком мышей.
Цель работы: изучение влияния экзогенной АТФ на сократительные свойства и уровень неквантовой секреции Ах в зоне концевой пластинки полосок диафрагмы интактных и сенсибилизированных мышей.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование сократительной функции поперечнополосатой мышцы экспериментального животного проводилось методом регистрации со -кратительных свойств in vitro , в изометрическом режиме с помощью фотоэлектрического преобразо-вателя [2].
Эксперименты проводились на препаратах изолированных мышц мыши — диафрагме. Препарат мышцы помещался в термостатируемую ванночку и одним концом крепился к датчику фотоэлектрического преобразователя. Другой конец жестко фиксировался в ванночке. Мышца при постоянной перфузии физиологическим раствором типа Кребса растягивалась в течение 20-30 минут с силой, достаточной для достижения изометрического режима сокращения. Сокращение мышцы вызывалось кар-бахолином (Кх) в конечной концентрации 2x10-4 М, раствор которого добавлялся в ванночку микродозатором при остановленной перфузии. Кривая сокращения регистрировалась самописцем Н-327–1. Для оценки сократительных свойств полоски скелетной мышцы было использовано 3 параметра, позволяющих достаточно объективно отражать функциональное состояние исследуемой полоски мышцы: 1) время развития максимального напряжения (СТ); 2) сила одиночного сокращения (Рос); 3) скорость сокраще- ния (Vос), определяемая отношением Рос / СТ. Сила сокращения определялась в милиграммах; временные характеристики — в секундах; скорость сокращения — отношением мг/сек.
Неквантовую секрецию Ах измеряли с помо-щью стеклянных микроэлектродов (сопротивлением 8–12 МΩ, заполненных 2,5 М KCl) [10]. Для определения ее величины сначала армином устранялось действие ацетилхолинэстеразы, после чего на мышцу в течение 8-12 минут апплицировал-ся блокатор Н-холинорецепторов d-тубокурарин (ТБК) (10–5 М). Разница значений мембранного потенциала (МП) до и после аппликации ТБК соответствует величине неквантовой секреции Ах (Н-эффект).
Методы сенсибилизации мышей яичным альбумином с гелем гидроокиси алюминия и контроля сенсибилизации подробно описаны в работе И. С. Гущина и соавт. [3].
Влияние на диафрагму АТФ (перфузия в концентрации 1x10-4 Мв течение 5 минут) изучалось сравнением показателей сокращения до и после перфузии мышцы раствором, содержащим изучаемое вещество в заданной молярной концентрации; время действия его на мышцу определялось длительностью перфузии.
РЕЗУЛЬТАТЫ
Изучение сократительной функции полоски диафрагмы мыши показало, что карбахолин в концентрации 2 x 10-4 М вызывает ее сократительный ответ со следующими характеристиками: СТ — 11,3 ± 0,63 сек; Рос — 335,2 ± 93,47 мг; Vос — 31,0 ± 1,7 мг/сек. Белковая сенсибилизация изменяет эти показатели: СТ–13,71 ± 0,42 сек, Рос — 469,83 ± 86,78 мг (р < 0,01), Vос — 32,08 ±0,89 мг/сек, приводя к достоверному увеличению силы сокращения.
Изучение неквантовой секреции Ах в диафрагме показало, что МП покоя, изначально составляющий (-70,7) ± 1,9 мВ (n = 150), в присутствии ТБК возрастал до (–75,9) ± 0,7 мВ (n = 150). Таким образом, Н-эффект в контроле составлял 5,2 ± 0,4 мВ (n = 150). В условиях белковой сенсибилизации МП покоя, изначально составляющий (–70,0) ± 1,5 мВ (n = 150), в присутствии ТБК возрастал до (–74,4) ± 0,6 мВ (n = 150). То есть значение Н-эффекта снижалось, составляя в описанных условиях эксперимента 4,4 ± 0,5 мВ (n = 150) (р < 0,05).
Изучение влияния АТФ на сократительную функцию диафрагмы несенсибилизированной мыши показало, что карбахолин в концентрации 2x10-4 М вызывает сократительный ответ полоски мышцы силой 335,2 ± 93,47 мг. Инкубация с АТФ увеличивает этот показатель до 425,2 ± 100,9 мг (р < 0,01).
Изучение неквантовой секреции Ах в диафрагме показало, что МП покоя, изначально составляющий (-70,7) ± 1,9 мВ (n = 150), в присутствии ТБК возрастал до (–75,9) ± 0,7 мВ (n = 150). Таким образом, Н-эффект в контроле составлял 5,2 ± 0,4 мВ (n = 150).
После инкубации с АТФ МП покоя, изначально составляющий (–70,0) ± 0,4 мВ (n = 150), в присутствии ТБК возрастал до (–71,5) ± 0,5 мВ (n = 150). То есть значение Н-эффекта снижалось, составляя в описанных условиях эксперимента 1,5 ± 0,5 мВ (n = 150) (р < 0,001).
Изучение влияния АТФ на сократительную функцию диафрагмы сенсибилизированной мыши показало, что карбахолин в концентрации 2x10-4 М вызывает сократительный ответ полоски мышцы силой 469,83 ± 86,78 мг. Инкубация с АТФ увеличивает этот показатель до 540,67 ± 80,34 мг (р < 0,01).
Изучение неквантовой секреции Ах в диафрагме сенсибилизированной мыши показало, что МП покоя, изначально составляющий (–70,0) ± 1,5 мВ (n = 150), в присутствии ТБК возрастал до (–74,4) ± 0,6 мВ (n = 150). Таким образом, Н-эффект в контроле составлял 4,4± 0,5 мВ (n = 150). После инкубации с АТФ МП покоя, изначально составляющий (-69,1) ± 0,4 мВ (n = 150), в присутствии ТБК возрастал до (–71,5) ± 0,6 мВ (n = 150). То есть значение Н-эффекта снижалось, составляя в описанных условиях эксперимента 2,4 ± 0,6 мВ (n = 150) (р < 0,001).
Предварительная перфузия сурамином (100 мкМ) устраняла влияние АТФ на Кх-вызванное сокращение диафрагмальной мышцы и неквантовую секрецию Ах как интактных, так и сенсибилизированных мышей. Аденозин в той же концентрации, что и АТФ не влиял на неквантовую секрецию Ах и не изменял сократительных свойств полоски диафрагмы как интактных, так и сенсибилизированных мышей.
ОБСУЖДЕНИЕ
Наши исследования показали, что сенсибилизация мыши к яичному альбумину приводит к увеличению силы сокращения полоски диафрагмальной мышцы мыши и снижает уровень неквантовой секреции Ах в зоне концевой пластинки. Увеличение силы сокращения на Кх до 140,16 % является следствием увеличения чувствительности постсинапса к холиномиметику (ослабление механизмов десенситизации холинорецепторов постсинаптической мембраны), отражением чего является снижение Н-эффекта до 84,61 % (рис. 1).
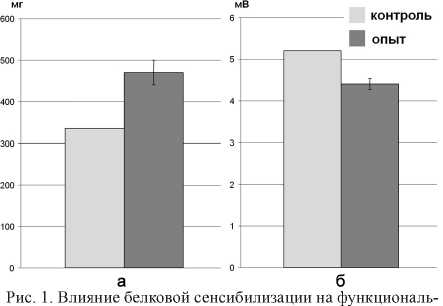
ные характеристики изолированной полоски диафрагмы мыши: а — силу сокращения, вызванного Кх (2 x1g-4 М);
б — величину Н-эффекта
Обнаруженная динамика свидетельствует, что белковая сенсибилизация затрагивает, в первую очередь, холиноопосредованные процессы возбуждения МВ. Дальнейшие наши исследования были посвящены поиску возможных причин, определяющих вариабельность функциональных свойств мышцы при белковой сенсибилизации. Изменения функциональных свойств холиновозбудимой мембраны, лежащие в их основе, могут являться следствием изменений, возникающих в механизмах выделения кофакторов синаптической передачи. Исходя из данных Tsai T. L. et al. [17], показавших участие АТФ в генерации иммунного ответа, мы предположили возможное участие в процессах изменения функции поперечнополосатых мышц при белковой сенсибилизации пуринов. Это определило изучение нами, в рамках выбранных экспериментальных моделей, динамики функциональных свойств полоски диафрагмы мыши после инкубации мышцы с АТФ.
Вопрос влияния АТФ (в том числе и экзогенной) на СМ имеет самостоятельную ценность, поскольку механизмы регуляции их функций с участием пуринов, в отличие от гладкой и сердечной мышц, до настоящего времени исследованы очень слабо.
Нами показано, что экзогенная АТФ повышает силу сокращения полоски диафрагмы мыши на КХ и снижает уровень неквантовой секреции Ах. Вектор динамики силы и величины Н-эффекта совпадал с таковыми при БС, что позволило нам предположить аналогичную последовательность изменения. Увеличение силы сокращения мышцы на Кх после перфузии с АТФ является следствием возрастания чувствительности постсинапса к холиномиметику. Угнетение неквантовой секреции Ах в зоне синапса вызывает снижение механизмов десенситизации ХР постсинаптической мембраны, что приводит к возрастанию ее чувствительности к Кх (рис. 2).
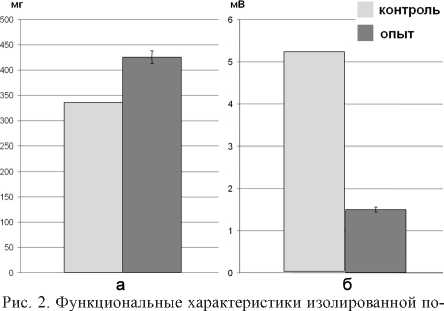
лоски диафрагмы интактной мыши до (контроль) и после (опыт) влияния АТФ: а — сила сокращения, вызванного Кх
(2x10 4 М) (п = 10); б — величина Н-эффекта (n = 150)
Изучение влияния АТФ на динамику вышеперечисленных функциональных свойств диафрагмы сенсибилизированных мышей демонстрирует ту же направленность, что указывает на отсутствие принципиальных различий в механизмах влияния пуринов на мышцы сенсибилизированных и интактных мышей (рис. 3).
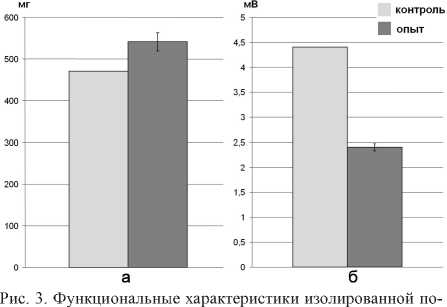
лоски диафрагмы сенсибилизированной мыши до (контроль) и после (опыт) влияния АТФ: а — сила сокращения, вызванного Кх (2x10^ М) (п = 7); б — величина Н-эффекта (n = 150)
Однако количественная оценка этих изменений выявляет определенные различия, указывающие на АТФ как на одного из участников изменения холиноопосредованных механизмов возбуждения в работе дыхательных мышц при белковой сенсибилизации. И у сенсибилизированных, и у интактных животных экзогенная АТФ увеличивала силу сокращения на Кх и уменьшала величину Н-эффекта. Однако, если сила сокращения мышцы у интактных животных возрастала на 26 %, то у сенсибилизированных — лишь на 15 %. Н-эффект диафрагмы несенсибилизированных мышей после влияния АТФ снижался до 28,8 % от исходного, у сенсибилизированных же лишь до 54,5 0%. Менее выра- женная динамика функциональных свойств диафрагмы, вызванная АТФ у сенсибилизированных мышей в сравнении с контролем, позволяет нам предполагать ее участие в механизмах изменений функциональных свойств дыхательных мышц, вызванных белковой сенсибилизацией.
Реализация постсинаптических эффектов на диафрагме мыши аналогична таковым у большинства других скелетных мышц и осуществляется через P2-рецепторы. Подтверждением этому служат как литературные данные, так и результаты собственных исследований. Во-первых, сурамин, антагонист P2-рецепторов, устранял влияние ATФ во всех экспериментальных моделях. Кроме того, замена в наших экспериментах АТФ на аденозин, реализующий свое действие не через Р2, а через аденозиновые Р1-рецепторы [8], не вызывала изменения ни параметров КХ-вызванного сокращения диафрагмы, ни величины Н-эффекта.
К сожалению, в литературе нам не встретилось работ об участии пуринов в механизмах изменения функции поперечнополосатых мышц при аллергии. Однако результаты наших экспериментов свидетельствуют, что внеклеточная АТФ может являться участником изменения свойств диафрагмальной мышцы мыши при сенсибилизации животного к чужеродному белку. Механизмы эти весьма разнообразны и включают в себя как прямое действие пуринов на контрактильную функцию дыхательных мышц, так и их влияние на не- которые этапы генерации иммунного ответа. В первом случае — это влияние АТФ на секрецию медиатора и системы внутриклеточных посредников поперечнополосатых мышц [6, 9, 10]. Также мы можем предположить ее влияние на работу АТФ-зависимых калиевых каналов [17]. Во втором случае, в литературе показана способность АТФ, участвуя в увеличении продукции интерлейкина-1, усиливать специфическое звено иммунитета [14]. Внеклеточная АТФ при генерации иммунного ответа помогает образованию активной каспазы-1, что, в свою очередь, обеспечивает секрецию биологически активных форм интерлейкина-1. Гиперэкспрессия рецептора Р2Х7 приводит к секреции зрелого интерлейкина-1β [15].
Являясь экспериментальной моделью аллергии, белковая сенсибилизация позволяет изучать механизмы как патологических, так и компенсаторных изменений, возникающих в системе внешнего дыхания. В нашей работе было показано, что сенсибилизация животных приводит к увеличению силы сокращения полоски диафрагмы мыши на Кх. Этот факт, а также меньшая изменчивость функциональных свойств диафрагмы, вызванная АТФ у сенсибилизированных мышей в сравнении с контролем, является возможным свидетельством развития механизмов резистентности, устойчивости к внешним нагрузкам у дыхательных мышц, которая должна появляться у них при бронхоспастическом синдроме и бронхиальной астме.
ВЫВОДЫ
-
1. Увеличение силы сокращения на карбахолин диафрагмальной мышцы мыши in vitro при белко-вой сенсибилизации является следствием повышения чувствительности постсинаптической мембраны мышечных волокон к холиномиметику, что обусловлено снижением уровня неквантовой секреции ацетилхолина в зоне концевой пластинки.
-
2. Увеличение силы сокращения полоски диафрагмы мыши на карбахолин, вызванное экзоген-
- ной АТФ, обусловлено снижением уровня неквантовой секреции ацетилхолина в зоне концевой пластинки.
-
3. Белковая сенсибилизация снижает динамику функциональных свойств диафрагмы мыши, вызванную экзогенной АТФ, угнетая увеличение силы сокращения мышцы на карбахолин вследствие адекватного снижения неквантовой секреции ацетилхолина в зоне концевой пластинки.


