Возникновение индуцированного покоя у семян овощных зонтичных культур под действием аллелопатически активных веществ
Автор: Бухаров А.Ф., Балеев Д.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоактивные природные соединения
Статья в выпуске: 5 т.51, 2016 года.
Бесплатный доступ
Аллелопатическое взаимовлияние растений обусловлено сочетанием многочисленных биогенных факторов и имеет адаптивное, экологическое, эволюционное и экономическое значение. Ведутся работы по изучению влияния аллелопатических веществ на прорастание семян с целью разработки новых экологически чистых способов борьбы с сорной растительностью. Целью нашей работы было изучение особенностей становления индуцированного покоя под влиянием экстракта из плодов укропа и его преодоления у овощных зонтичных культур. Опыты проводили в 2012-2013 годах во Всероссийском НИИ овощеводства. Объектами исследований служили семена укропа Anethum graveolens L. сорта Кентавр, моркови Daucus carrota L. сорта Рогнеда, петрушки корневой Petroselinum crispum (Mill.) Nyman ex A.W. Hill. сорта Любаша, сельдерея корневого Apium graveolens L. сорта Купидон, любистока лекарственного Levisticum officinale W.D.J. Koch сорта Дон Жуан, кориандра Coriandrum sativum L. сорта Янтарь и пастернака Pastinaca sativa L. сорта Кулинар. Готовили 15 % водную вытяжку из семян укропа. Инкубацию семян изучаемых культур в экстракте проводили при 23 °С в течение 0 (контроль), 5 и 20 сут в темноте. Прорастание семян изучали в динамике на разных температурных фонах: 20 °С (стандартный режим), 3 °С, 3 °C (8 ч)/20 °C (16 ч). Рассчитывали следующие показатели: ТНП - время от постановки семян до начала прорастания, TСР - средневзвешенное значение периода прорастания семян, T50 - время прорастания 50 % семян. Измеряли длину зародыша, рассчитывали температурный коэффициент (Q10). Экстракт из плодов укропа активно препятствовал росту линейных размеров зародыша и прорастанию семян овощных зонтичных культур. После воздействия аллелопатического фактора в течение 5 сут семена моркови, сельдерея корневого, пастернака и кориандра на фоне стандартной температуры не прорастали. Показатель TСР превысил контроль на 229-328 %, а значение T50 - на 310-379 %. Доля проросших семян укропа, петрушки корневой и любистока лекарственного составляла соответственно 42, 52 и 23 %. После воздействия аллелопатического фактора в течение 20 сут не прорастали семена сельдерея корневого, моркови, пастернака и кориандра. Прорастание семян укропа и любистока лекарственного задерживалось на 21 и 22 сут. Увеличение времени инкубации семян в экстракте приводило к снижению температурного коэффициента (Q10) для скорости роста зародыша при различных температурных режимах проращивания. Воздействие на семена в постинкубационный период пониженной температурой, в том числе постоянной 3 °С и переменной (3/20 °C) способствовало частичному восстановлению этих процессов. По сравнению с контрольным вариантом TСР увеличивалось на 11,7-35,3 сут, T50 - на 11,7-43,1 сут. Анализ взаимодействия аллелопатического и температурного факторов свидетельствовал о том, что процесс торможения прорастания семян под влиянием веществ, содержащихся в вытяжке из плодов укропа, был обусловлен явлением покоя.
Аллелопатия, температура, покой семян, прорастание семян, скорость роста зародыша, температурный коэффициент (q10)
Короткий адрес: https://sciup.org/142213975
IDR: 142213975 | УДК: 635.1/.7:581.524 | DOI: 10.15389/agrobiology.2016.5.714rus
Текст научной статьи Возникновение индуцированного покоя у семян овощных зонтичных культур под действием аллелопатически активных веществ
Аллелопатия, основанная на химическом взаимодействии, — одно из древнейших средств коммуникации между биологическими объектами, различными органами, тканями и клетками. Аллелопатическое взаимовлияние растений обусловлено сочетанием многочисленных, постоянно и временно действующих биогенных факторов (1) и имеет адаптивное, экологическое, эволюционное и экономическое значение (2, 3). Современные исследования показывают, что аллелопатия может быть частью целой сети химической коммуникации (4) и выполнять разнообразные, в том числе защитные, функции (5, 6). Доказаны как стимулирующие, так и ингибирующие эффекты экстрактов из плодов, семян и других органов растений (7).
Сообщения, посвященные действию различных веществ на прорастание семян, многочисленны (8, 9). Исследование аллелопатических веществ позволит разработать новые экологически чистые способы борьбы с 714
сорной растительностью (10, 11). Так, выявлен ингибирующий эффект вытяжки из семян Myrica gale L. и идентифицировано вещество Myrigalone A, влияющее на биосинтез гиббереллинов и работу сигнальных систем прорастающих семян (12, 13). Метаболиты нарушают прорастание семян, негативно воздействуют на рост, дыхание и синтез белка (14, 15).
В корневых выделениях растений обнаружена группа веществ (стриголактоны), способных стимулировать прорастание семян паразитических сорных видов Orobanche и Striga . Эти вещества рассматриваются в качестве нового класса гормонов (16, 17), которые влияют на баланс абсцизовой кислоты и гиббереллина, ответственных за состояние покоя семян (18).
В исследованиях, проведенных нами ранее, было описано влияние 15 % экстракта из семян укропа на индукцию покоя семян-тестеров горчицы сарептской и капусты японской (19).
В настоящей работе мы впервые показали, что действие экстракта из плодов укропа вызывает задержку (вплоть до полной остановки) прорастания семян овощных зонтичных культур. Этот индуцированный покой длительно сохраняется даже после перенесения семян в стандартные условия, но не приводит к их гибели.
Целью нашей работы стало изучение особенностей формирования состояния индуцированного покоя под влиянием экстракта из плодов укропа и его преодоления у овощных зонтичных культур.
Методика . Объектами исследований служили семена укропа ( Ane-thum graveolens L.) сорта Кентавр, моркови ( Daucus carrota L.) сорта Рогнеда, петрушки корневой ( Petroselinum crispum (Mill.) Nyman ex A.W. Hill.) сорта Любаша, сельдерея корневого ( Apium graveolens L.) сорта Купидон, любистока лекарственного ( Levisticum officinale W.D.J. Koch) сорта Дон Жуан, кориандра ( Coriandrum sativum L.) сорта Янтарь и пастернака ( Pasti-naca sativa L.) сорта Кулинар.
Для приготовления водной вытяжки 15 г семян укропа растирали в ступке с песком, добавляли 100 мл дистиллированной воды, настаивали в течение 1 ч, после чего фильтровали через бумажный фильтр. Инкубацию семян изучаемых культур в экстракте проводили при 23 °С в чашках Петри на фильтровальной бумаге без доступа света 0 (контроль), 5 и 20 сут. Повторность опыта 3-кратная (по 1000 семян). После инкубации их промывали в воде и проращивали на фильтровальной бумаге без доступа света.
Прорастание семян изучали в динамике на разных температурных фонах: 20 °С (стандартный режим), 3 °С, 3 °C (8 ч)/20 °C (16 ч). Рассчитывали следующие показатели: ТНП — время от постановки семян до прорастания, TСР — средневзвешенное значение периода прорастания семян, который можно рассматривать как число суток до наступления максимальной скорости прорастания семян (20, 21), T50 — время прорастания 50 % семян (22-24), а также долю проросших семян. О завершении прорастания семян судили по их проклевыванию (25). Повторность опыта 3-кратная (по 100 семян).
Длину зародыша измеряли при просмотре под микроскопом Le-venhuk 670T («Levenhuk», США) с видеоокуляром DCM 300 MD («Micro-scope Digital», Китай) при увеличении ½40 с помощью программы Scope Photo (Image Software v. 3.1.386). Температурный коэффициент (Q10) скорости роста зародыша рассчитывали по формуле Вант-Гоффа.
Статистический анализ осуществляли с использованием языка программирования R (i386 v.3.3.0).
Результаты. В течение 20 сут инкубации семена всех изучаемых культур в вытяжке из плодов укропа (15 %) не прорастали. У моркови и петрушки корневой после 18-20 сут инкубации происходил автолиз части семян (20-40 %). Морфометрический анализ показал, что рост зародыша отсутствовал.
Семена сельдерея корневого, пастернака, моркови и кориандра после инкубации в течение 5 сут и последующего перенесения их в стандартные условия (20 °С) не прорастали. Ростовые процессы в семенах остальных культур постепенно возобновились, однако все показатели, характеризующие интенсивность ростовых процессов, были выше, чем в контроле, что свидетельствовало о замедлении темпов прорастания семян. Так, длительность TНП у укропа, петрушки корневой и любистока лекарственного составляла 15-17 сут, что на 10-14 сут больше, чем в контроле. Показатель TСР превысил контроль на 229-328 %, а значение T50 — на 310-379 %. Семена моркови, петрушки корневой и пастернака при 3 °C не проросли (табл.).
Низкотемпературный (3 °C) режим способствовал (хотя и с задержкой) прорастанию семян укропа, любистока лекарственного, сельдерея корневого и кориандра. Для прорастания семян, испытавших воздействие аллелопатического фактора в течение 5 сут, при пониженной температуре (3 °C) требовалось больше времени. По сравнению с контрольным вариантом показатель TСР повышался на 11,7-35,3 сут, T50 — на 11,7-43,1 сут, а по сравнению со стандартным режимом — соответственно на 9,8 и 2,8 сут. Одновременно увеличилась разница между показателями T СР и T 50 до 5,8-9,2 сут.
Показатели, характеризующие скорость прорастания семян у овощных зонтичных культур под влиянием аллелопатического стресса (инкубация в 15 % вытяжке из семян укропа) и условий проращивания (лабораторные опыты)
|
Культура |
Время инкубации, сут |
T СР , сут |
T 50 , сут |
||||
|
20 °С |
3 °С |
| 3/20 °С |
20 °С |
3 °С |
| 3/20 °С |
||
|
Морковь Daucus |
0 (контроль) |
7,5±0,5 |
16,7±0,6 |
10,2±0,5 |
8,5±0,6 |
18,5±0,6 |
11,9±1,0 |
|
carrota L., сорт Рогнеда |
5 |
35,6±1,2 |
44,3±1,8 |
||||
|
20 |
38,7±2,0 |
49,1±2,7 |
|||||
|
Укроп Anethum |
0 (контроль) |
7,9±0,7 |
14,3±1,1 |
10,3±1,0 |
9,0±0,4 |
20,1±2,3 |
10,0±1,0 |
|
graveolens L., сорт Кентавр5 |
25,9±1,6 |
26,0±0,7 |
27,7±1,7 |
34,1±3,8 |
31,8±2,0 |
51,2±7,9 |
|
|
20 |
37,5±2,0 |
44,7±1,2 |
33,8±1,0 |
45,3±4,1 |
56,2±2,6 |
50,4±7,0 |
|
|
Сельдерей корневой |
0 (контроль) |
11,0±0,6 |
23,5±1,0 |
11,2±0,7 |
14,0±0,3 |
26,9±1,0 |
12,2±0,5 |
|
Apium graveolens L., |
5 |
58,8±1,3 |
48,0±0,8 |
70,0±4,5 |
60,1±4,9 |
||
|
сорт Купидон |
20 |
68,2±2,0 |
53,3±3,1 |
89,8±5,3 |
75,1±5,4 |
||
|
Петрушка корневая |
0 (контроль) |
10,4±0,6 |
20,0±1,0 |
9,0±0,4 |
12,5±1,6 |
23,1±1,2 |
10,5±0,6 |
|
Petroselinum crispum (Mill.) |
5 |
21,9±0,5 |
20,3±1,4 |
27,3±2,6 |
28,9±2,9 |
||
|
Nyman ex A.W. Hill., сорт Любаша |
20 |
29,1±1,1 |
27,2±1,0 |
40,1±3,0 |
35,1±2,0 |
||
|
Пастернак Pastinaca |
0 (контроль) |
16,0±1,0 |
26,7±0,5 |
13,3±0,7 |
21,5±2,0 |
30,8±1,0 |
15,3±2,5 |
|
sativa L., сорт Кулинар |
5 |
43,8±2,9 |
55,0±7,1 |
||||
|
20 |
52,4±0,6 |
64,2±1,4 |
|||||
|
Любисток лекарственный 0 (контроль) |
9,1±0,7 |
12,7±0,8 |
11,0±0,2 |
11,9±2,0 |
16,9±1,1 |
15,0±0,4 |
|
|
Levisticum officinale |
5 |
20,8±1,4 |
30,6±1,0 |
20,5±2,0 |
37,0±7,1 |
39,8±4,0 |
27,6±4,4 |
|
W.D.J. Koch, |
20 |
29,5±1,0 |
42,2±2,0 |
42,4±2,7 |
60,5±11,9 |
57,4±6,5 |
60,1±4,0 |
|
сорт Дон Жуан Кориандр Coriandrum |
0 (контроль) |
9,7±0,3 |
21,8±1,2 |
15,0±0,7 |
13,0±1,0 |
28,2±1,1 |
21,7±1,4 |
|
sativum L., сорт Янтарь |
5 |
46,0±1,2 |
44,2±4,3 |
62,1±3,7 |
62,8±6,4 |
||
|
20 |
71,9±0,8 |
54,0±3,0 |
95,0±7,0 |
67,2±2,7 |
|||
|
Примечание. TСР — |
средневзвешенное значение периода прорастания семян, |
T50 — время прорас- |
|||||
|
тания 50 % семян. Прочерки означают отсутствие прорастания. |
|||||||
Переменная температура обеспечила положительный эффект по сравнению со стандартным режимом, способствуя прорастанию всех изученных культур. Она снижала негативное действие аллелопатического фактора. Однако значения TСР и T50 под влиянием 5-суточной инкубации увеличились соответственно на 329-429 % и 372-492 % по сравнению с контролем.
После воздействия аллелопатического фактора в течение 20 сут семена прорастали еще медленнее. При температуре 20 °C не прорастали семена сельдерея корневого, моркови, пастернака и кориандра. Начало прорастания семян укропа и любистока лекарственного задерживалось на 21 и 22 сут по сравнению с контролем. Показатель TСР увеличивался до 37,5 и 29,5, T50 — до 45,3 и 60,5 сут, что было соответственно на 20,4-29,6 и 36,3-48,6 сут выше, чем в контроле.
Семена укропа и любистока лекарственного при 3 °C (после инкубации в течение 20 сут) прорастали менее активно по сравнению со стандартным режимом. Несмотря на значительную задержку (55 и 58 сут), начинали прорастать семена сельдерея корневого и кориандра, но значение TСР составило соответственно 68,2 и 71,9, а T50 достигало 70,0 и 95,0 сут. Не прорастали только семена пастернака и моркови.
В условиях переменной температуры семена всех культур, которые подверглись воздействию аллелопатического фактора в течение 20 сут, прорастали, но при этом показатели TСР и T50 по сравнению с контролем возросли в 4,0-4,2 раза.
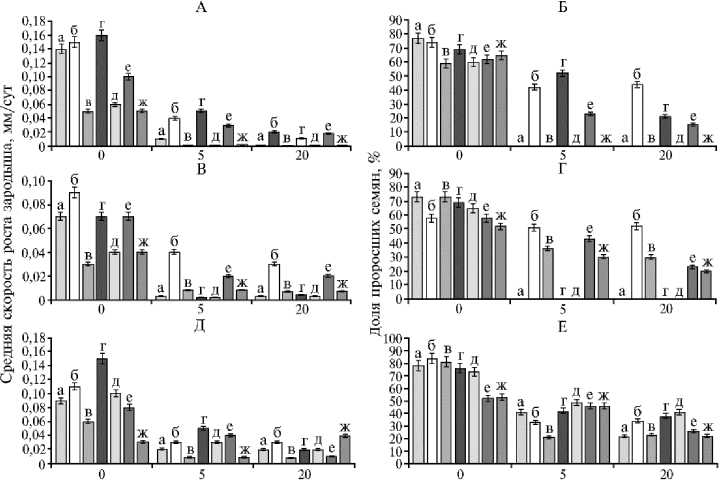
Продолжитсльность инкубации, сут
Рис. 1. Средняя скорость роста зародыша (слева) и доля проросших семян (справа) у моркови Daucus carrota L. сорта Рогнеда (а) , укропа Anethum graveolens L. сорта Кентавр (б) , сельдерея корневого Apium graveolens L. сорта Купидон (в) , петрушки корневой Petroselinum crispum (Mill.) Nyman ex A.W. Hill. сорта Любаша (г) , пастернака Pastinaca sativa L. сорта Кулинар (д) , люби-стока лекарственного Levisticum officinale W.D.J. Koch сорта Дон Жуан (е) , кориандра Coriandrum sativum L. сорта Янтарь (ж) на различных температурных фонах после воздействия аллелопатического фактора (инкубация в 15 % вытяжке из семян укропа) различной продолжительности: А, Б — 20 °С (стандартный режим), В, Г — 3 °С, Д, Е— 3/20 °C (лабораторные опыты).
При проращивании семян в постинкубационный период на фоне положительной постоянной температуры скорость роста зародыша стабильно снижалась при увеличении продолжительности стресса (рис. 1). В семенах укропа, моркови, петрушки корневой в контрольном варианте зародыш рос со скоростью 0,14-0,16 мм/сут. После 5 сут инкубации скорость роста зародыша снижалась до 0,01-0,05 мм/сут, а после 20 сут — до 0,02 мм/сут. Зародыш кориандра, который в контроле рос со скоростью 0,15 мм/сут, по мере увеличения времени инкубации практически прекращал рост.
Один из ключевых эндогенных факторов, влияющих на процесс прорастания семян зонтичных культур, — морфологическое недоразвитие зародыша (26, 27). Независимо от времени созревания семян на материнском растении, недоразвитие зародыша сохраняется. Процесс доразвития зародыша протекает уже после отделения семени, если оно попадет в условия достаточной влажности и благоприятной температуры (28). Этим обусловлены особые требования при работе с семенами зонтичных культур. Для оценки изменений, происходящих во время их прорастания, недостаточно определить размеры и измерить сухую массу. Только анализ динамики роста морфологических элементов семени, прежде всего зародыша, позволяет обнаружить существенные закономерности.
У сельдерея корневого и пастернака скорость роста зародыша в контроле составляла 0,05 и 0,06 мм/сут, после воздействия экстрактом даже в течение 5 сут она резко снижалась до 0,0007 мм/сут.
При температуре 3 °C средняя скорость роста зародыша в постинкубационный период у всех культур (за исключением петрушки) была на 30-60 % выше, чем при стандартном температурном режиме. Тем не менее, темпы прироста линейных размеров зародыша по сравнению с контролем (ниже на 43-93 %) оставались очень низкими.
При переменной температуре наблюдалось увеличение скорости роста зародыша на 20-92 % по сравнению со стандартным режимом у всех культур, а по сравнению с постоянной пониженной температурой — только у моркови, петрушки и кориандра (на 11-96 %). Однако полностью преодолеть негативное воздействие аллелопатического стресса с помощью переменной температуры не удалось. Скорость роста зародыша была на 300-330 % меньше, чем в контроле.
Известно, что температура — один из самых значимых абиотических факторов, обеспечивающих выход семян из состояния покоя (29-31). Воздействие пониженной температуры активизирует механизмы запуска синтеза гиббереллина (32). В недоразвитых семенах, которые характерны для овощных зонтичных культур, в условиях пониженной температуры усиливается процесс распада запасных веществ в эндосперме и стимулируются процессы синтеза в зародыше (33).
В наших опытах торможение прорастания под влиянием экстракта из семян укропа, по-видимому, было следствием индуцированного покоя.
Доля проросших семян у разных культур изменялась в зависимости от сочетания изученных факторов. После воздействия аллелопатического агента в течение 5 сут у изученных форм моркови, сельдерея корневого, пастернака и кориандра на фоне стандартной температуры не наблюдалось проросших семян. У укропа, петрушки корневой и любистока лекарственного их доля составляла 42, 52 и 23 %, что было ниже контроля соответственно на 32, 17 и 39 % (см. рис. 1).
При пониженной температуре (3 °C), помимо укропа, сельдерея корневого и любистока лекарственного, отмечали прорастание семян у кориандра, а при переменной температуре прорастали семена всех изученных культур. С увеличением времени инкубации доля проросших семян, как правило, снижалась на 12-100 %, что было особенно заметно у таких культур, как сельдерей корневой, любисток лекарственный и кориандр.
Увеличение времени инкубации семян в экстракте приводило к снижению температурного коэффициента (Q10) для скорости роста зародыша при различных температурных режимах проращивания (рис. 2).
Корреляционный и регрессионный анализ показали, что темпера- турный коэффициент имел тесную отрицательную зависимость от времени инкубации (r = -0,700), которая описывается уравнением регрессии y = 1,37 - 0,04x.
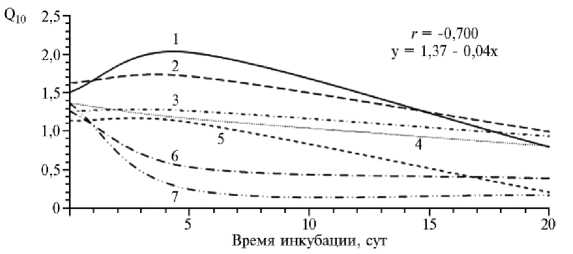
Рис. 2. Динамика изменений температурного коэффициента (Q 10 ) для скорости роста зародыша овощных зонтичных культур в зависимости от продолжительности воздействия аллелопатического фактора (инкубация в 15 % вытяжке из семян укропа): 1 — морковь Daucus carrota L. сорта Рогнеда, 2 — петрушка корневая Petroselinum crispum (Mill.) Nyman ex A.W. Hill. сорта Любаша, 3 — любисток лекарственный Levisticum officinale W.D.J. Koch сорта Дон Жуан, 4 — укроп Anethum graveolens L. сорта Кентавр, 5 — кориандр Coriandrum sativum L. сорта Янтарь, 6 — пастернак Pastinaca sativa L. сорта Кулинар, 7 — сельдерей корневой Apium graveolens L. сорта Купидон (лабораторные опыты).
Для укропа было характерно плавное снижение температурного коэффициента при увеличении времени воздействия стресса: в контроле Q10 составлял 1,37, а после действия высокими температурами в течение 5 и 20 сут постепенно снижался до 0,81. Для петрушки корневой и моркови отмечали увеличение Q10 (в контроле — 1,63-1,51, под действием инкубации – 1,72-2,03), однако дальнейшее влияние аллелопатического стресса приводило к уменьшению температурного коэффициента. Были выделены культуры, у которых при увеличении продолжительности стресса температурный коэффициент резко снижался, — сельдерей корневой, кориандр и пастернак. Минимальное влияния времени инкубации на температурный коэффициент для скорости роста зародыша выявили для любистока лекарственного, хотя некоторое снижение Q10 имело место.
Таким образом, мы установили активное проявление аллелопатического эффекта экстракта из плодов укропа, который оказывает существенное влияние на прорастание семян овощных зонтичных культур и изменение линейных размеров зародыша. Воздействие пониженной температурой на семена в постинкубационный период способствует восстановлению этих процессов. Анализ взаимодействия аллелопатического и температурного факторов свидетельствует о том, что процесс торможения прорастания семян под влиянием веществ, содержащихся в вытяжке из плодов укропа, обусловлен явлением покоя.
Список литературы Возникновение индуцированного покоя у семян овощных зонтичных культур под действием аллелопатически активных веществ
- Гродзинский А.М. Аллелопатия растений и почвоутомление. Киев, 1991.
- Rice E.L., Lin C.Y., Huang C.Y. Effects of decaying rice straw on growth and nitrogen fixation of a blue green alga. Bot. Bull. Acad. Sin., 1980, 21: 111-117.
- Pickett J.A., Birkett M.A., Blassioli-Moraes M.C., Bruce T.J.A., Chamberlain K., Gordon-Weeks R., Matthes M.C., Napier J.A., Smart L.E., Wadhams L.J., Woodcock C.M. Cis-Jasmone as allelopathic agent in inducing plant defence. Allelopathy Journal, 2007, 19: 109-117.
- Harborne J.B. Chemical signals in the ecosystem. Ann. Bot., 1987, 60: 39-57.
- Einhellig F.A. Allelopathy: current status and future goals. In: Allelopathy: Organisms, processes, and applications. Washington, 1995.
- Siemens D.H., Garner S.H., Mitchell-Olds T., Callaway R.M. Cost of defense in the context of plant competition: Brassica rapa may grow and defend. Ecology, 2002, 83: 505-517 ( ) DOI: 10.2307/2680031
- Murrell C., Gerber E., Krebs C., Parepa M., Schaffner U., Bossdorf O. Invasive knotweed affects native plants through allelopathy. Amer. J. Bot., 2011, 98: 38-43 ( ) DOI: 10.3732/ajb.1000135
- Blair A.C., Weston L.A., Nissen S.J., Brunk G.R., Hufbauer R.A. The importance of analytical techniques in allelopathy studies with the reported allelochemical catechin as an example. Biol. Invasions, 2008, 11: 325-332 ( ) DOI: 10.1007/s10530-008-9250-1
- Popovici J., Bertrand C., Jacquemoud D., Bellvert F., Fernandez M.P., Comte G. An allelochemical from Myrica gale with strong phytotoxic activity against highly invasive Fallopia × bohemica taxa. Molecules, 2011, 16: 2323-2333 ( ) DOI: 10.3390/molecules16032323
- Alsaadawi I.S., Khaliq A., Lahmod N.R., Matloob A. Weed management in broad bean (Vicia faba L.) through allelopathic Sorghum bicolor (L.). Allelopathy Journal, 2013, 32(2): 203-212.
- Reigosa M.J., Gonzalez L., Sanchez-Moreiras A., Duran B., Puime D. Comparison of physiological effects of allelochemicals and commercial herbicides. Allelopathy Journal, 2001, 8: 211-220.
- Oracz K., Bailly C., Gniazdowska A., Come D., Corbineau F., Bogatek R. Induction of oxidative stress by sunflower phytotoxins in germinating mustard seeds. J. Chem. Ecol., 2007, 33: 251-264 ( ) DOI: 10.1007/s10886-006-9222-9
- Oracz K., Voegele A., Tarkowska D., Jacquemoud D. Myrigalone A inhibits Lepidium sativum seed germination by interference with gibberellin metabolism and apoplastic superoxide production required for embryo extension growth and endosperm rupture. Plant Cell Physiol., 2012, 53: 81-95 ( ) DOI: 10.1093/pcp/pcr124
- Reigosa M.J., Souto X.C., Gonzalez L. Effect of phenolic compounds on the germination of six weeds species. Plant Growth Regul., 1999, 28: 83-88.
- Alam S.M., Ala S.A., Azmi A.R., Khan M.R., Ansari R. Allelopathy and its role in agriculture. Journal of Biological Sciences, 2001, 1: 308-315 ( ) DOI: 10.3923/jbs.2001.308.315
- Cook C.E., Whichard L.P., Turner B., Wall M.E., Egley G.H. Germination of witch weed (Striga lutea Lour): isolation and properties of a potent stimulant. Science, 1966, 154: 1189-1190.
- Xie X., Yoneyama K., Yoneyama K. The strigolactone story. Annu. Rev. Phytopathol., 2010, 48: 93-117 ( ) DOI: 10.1146/annurev-phyto-073009-114453
- Toh S., Kamiya Y., Kawakami N., Nambara E., McCourt P. Thermoinhibition uncovers a role for strigolactones in Arabidopsis seed germination. Plant Cell Physiol., 2012, 53: 107-117 ( ) DOI: 10.1093/pcp/pcr176
- Бухаров А.Ф., Балеев Д.Н. Водный экстракт плодов укропа как фактор, индуцирующий покой семян горчицы сарептской и капусты японской. Известия ОГАУ (Оренбург), 2012, 4(36): 225-229.
- Леманн Е., Айхеле Ф. Физиология прорастания семян злаков. М., 1936.
- Бухаров А.Ф., Балеев Д.Н., Бухарова А.Р. Кинетика прорастания семян. Система методов и параметров (учебно-методическое пособие). М., 2016.
- Thomson A.J., El-Kassaby Y.A. Interpretation of seed-germination parameters. New Forests, 1993, 7: 123-132 ( ) DOI: 10.1007/BF00034195
- Hayashi E., Aoyama N., Still D.W. Quantitative trait loci associated with lettuce seed germination under different temperature and light environments. Genome, 2008, 51: 928-947 ( ) DOI: 10.1139/G08-077
- Kazmi R.H., Khan N., Willems L.A.J., Van Heusden A.W., Ligterink W., Hilhorst H.W.M. Complex genetics controls natural variation among seed quality phenotypes in a recombinant inbred population of an interspecific cross between Solanum lycopersicum ½ Solanum pimpinellifolium. Plant, Cell and Environment, 2012, 35: 929-951 ( ) DOI: 10.1111/j.1365-3040.2011.02463.x
- Bewley J.D., Black M. The physiology and biochemistry of seeds. V. 2. Springer-Verlag, Berlin, 1982.
- Грушвицкий И.В., Агнаева Е.Я., Кузина Е.Ф. О разнокачественности зрелых семян моркови по величине зародыша. Ботанический журнал, 1963, 48(10): 1484-1489.
- Балеев Д.Н., Бухаров А.Ф. Биология формирования и прорастания семян укропа. Овощи России, 2012, 1(14): 54-60.
- Кордюм Е.Л. Цитоэмбриология семейства зонтичных. Киев, 1967.
- Baskin C.C., Baskin J.M. Seeds: ecology, biogeography, and evolution of dormancy and germination. Academic Press, NY, 1998.
- Probert R.J. The role of temperature in germination ecophysiology. In: Seeds: the ecology of regeneration in plant communities/M. Fenner (ed.). CAB International, Wallingford, 1992: 285-325.
- Batlla D., Benech-Arnold R.L. A quantitative analysis of dormancy loss dynamics in Polygonum aviculare L. seeds: development of a thermal time model based on changes in seed population thermal parameters. Seed Sci. Res., 2003, 13: 55-68 ( ) DOI: 10.1079/SSR2002124
- Николаева М.Г., Лянгузова И.В., Поздова Л.М. Биология семян. СПб, 1999.
- Овчаров К.Е. Физиологические основы всхожести семян. М., 1969.


