Возрастные изменения гидратации и гистоструктуры печени крысы
Автор: Виноградов А.А., Симакова Е.С.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Одна из гипотез старения основана на уменьшении процентного содержания воды в организме с возрастом. В большей степени потеря воды оказывает влияние на наиболее энергозависимые органы, в частности на печень, которая претерпевает ряд структурных изменений компенсаторноприспособительного характера. Параметры возрастных изменений, изученные в настоящее время недостаточно полно, должны быть учтены при определении фактических трансформаций в органе при экспериментальных воздействиях. Цель исследования - на крысах изучить изменение уровня общей воды и гистоструктуры печени в процессе 75-суточного наблюдения. Материалы и методы. В течение 75 сут у молодых беспородных интактных крыс оценивалось изменение уровня общей воды в паренхиме печени. Гистоструктура печени изучалась на срезах, окрашенных гематоксилин-эозином и пикрофуксином по Ван Гизону. Результаты. Установлено, что в течение 75 сут происходит снижение уровня общей воды в паренхиме печени крыс на 0,54±0,042 %. В процессе 75-суточного наблюдения в гистоструктуре печени видимых изменений не выявлено. Выводы. В печени интактных животных в течение 75 сут происходит снижение уровня общей воды, которое не оказывает влияния на изменение гистоструктуры органа.
Крыса, возрастные изменения печени, уровень общей воды, гистоструктура
Короткий адрес: https://sciup.org/14125350
IDR: 14125350 | УДК: 612.66:611.36:612.014.461+612.086 | DOI: 10.34014/2227-1848-2022-3-120-128
Текст научной статьи Возрастные изменения гидратации и гистоструктуры печени крысы
Введение. В процессе жизни организм претерпевает целый ряд изменений. Это связано с тем, что с возрастом в органах и тканях постепенно уменьшается процентное содержание воды – на этом основана гипотеза старения человека [1]. Известно, что вода является универсальным биологическим растворителем и только в водной среде могут протекать все сложнейшие биохимические процессы в живом организме [2–4]. В первую очередь страдают системы и органы, являющиеся наиболее энергозависимыми, в частности печень [5, 6]. В отличие от других органов и систем печень является относительно медленно стареющим органом. Тем не менее с возрастом печень претерпевает ряд структурных изменений, часть которых носит компенсаторно-приспособительный характер. Уменьшается общее число гепатоцитов, а также масса печени [7, 8]. Этот факт должен учитываться при экспериментальных исследованиях на лабораторных животных, например на крысах. Продолжительность экспериментального воздействия на животных чаще всего составляет 2–3 мес., что соответствует 5–8 годам жизни человека [9].
В связи с пандемией COVID-19 настоящее исследование является актуальным. У части пациентов, перенесших заболевание, диагностировали мультисистемное поражение, в т.ч. поражение печени [10–12]. И первостепенной задачей является физическая реабилитация таких пациентов [13–16]. Актуальность настоящей работы связана с планированием комплексного исследования, включающего изучение влияния физической нагрузки на печень. Но для определения фактических изменений, обусловленных экспериментальным воздействием, необходимо иметь данные, касающиеся возрастных изменений, в частности гистоструктуры и уровня гидратации печени. Однако эти данные в доступной литературе отсутствуют или представлены фрагментарно.
Цель исследования. На крысах изучить изменение уровня общей воды и гистоструктуры печени в процессе 75-суточного наблюдения.
Материалы и методы. Работа выполнена на материале, полученном от белых беспородных молодых (14–16 мес.) крыс-самцов массой 200–230 г. Исследование проведено в осенне-зимний период. Крысы содержались в условиях вивария на стандартном рационе. Содержание и обращение с животными в эксперименте (включая эвтаназию передозировкой золетила) осуществлялись в соответствии с принципами Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей [17], приказом Минздрава России от 01.04.2016 № 199н «Об утверждении правил надлежащей лабораторной практики», Санитарно-эпидемиологическими требованиями к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) (СП 2.2.1.3218–14). Животные содержались в стандартных клетках по 5 особей в каждой при температуре воздуха 20–22 °С и относительной влажности 40–60 %, при световом режиме 12:12 с включением света в 8:00, свободном доступе к корму ПК-120 (ООО «Лабо-ратокорм», Россия) и воде [18–20].
В печени животных уровень общей воды (УОВ, %) определялся по методике Ю.В. Исакова и М.В. Ромасенко [21] в первые сутки (исходный показатель), через 15, 30, 45, 60 и 75 сут. Из центральных и периферических участков печени вырезались кусочки размером 10×10 мм, взвешивались на торсионных весах до и после высушивания в термостате при температуре +55 °С до постоянного веса (сухого остатка). Уровень общей воды (%) определялся по формуле
УОВ=[(Б-А)×100]/Б, где А и Б – вес кусочка соответственно после и до высушивания.
Рассчитывался усредненный показатель УОВ с учетом данных, определенных в центральных и периферических участках печени.
Часть препаратов печени фиксировалась в 10 % растворе формалина, приготовленном на фосфатном буфере с рН 7,2–7,4 и охлажденном до +4 ºС. На следующий день материал перекладывался в свежеприготовленный 10 % раствор формалина и фиксировался до 20 сут. После окончания фиксации кусочки печени промывались 24 ч в проточной воде, обезвоживались и заключались в парафиновые блоки по стандартной методике. Гистоструктура печени на срезах толщиной 15 и 20 мкм, окрашенных гематоксилин-эозином или пикро-фуксином по Ван Гизону [22], изучалась под цифровым микроскопом DELTA optical (Китай) и фотодокументировалась.
Цифровые данные обрабатывались методами вариационной статистики с помощью программы StatSoft Statistica 13.0 (США, лицензия № AXA003J115213FAACD-X, Stat-soft.ru) и Microsoft Excel for MAC ver. 16.24 (ID 02984-001-000001). Определялись средняя арифметическая выборки (M); ошибка средней арифметической выборки (±m); вероятность ошибки (p); квартиль – отношение медианы к максимальному и минимальному показателям выборки (δ); достоверность различий по t-критерию Стьюдента. При распределении данных в независимых выборках статистическая значимость отличий от нормального показателя оценивалась U эмп. по U-критерию Манна – Уитни при U кр 3-7. Коэффициент корреляции (R) определялся по Пирсону. Коэффициент корреляции менее 0,3 характеризовал слабую корреляционную зависимость изменений от возраста, 0,3–0,5 – умеренную, 0,5–0,7 – заметную, 0,7–0,9 – высокую, 0,9–1,0 – весьма высокую корреляционную зависимость.
Результаты и обсуждение. При макроскопических исследованиях было установлено, что нативная печень животных содержала от 4 до 5 долей светлого или темного красно-коричневого цвета. Доли имели острые края и гладкую, блестящую поверхность (рис. 1). На срезе паренхима печени была однородной и с умеренным кровенаполнением.
Микроскопическое исследование печени животных позволило выявить лишь небольшое количество соединительной ткани, которая образовывала прослойки вокруг печеночных долек. Соединительная ткань, окружающая глиссоновую триаду (печеночный проток, вену и артерию), была толстая с рыхлой консистенцией. В камбиальной зоне печени – наружной и внутренней пограничных печеночных пластинках [23] – отсутствовали клетки с митотическим делением. Печеночная долька включала балки, глиссоновую триаду, синусо- идные капилляры и центральную вену (рис. 2).
Печеночная балка построена двумя слоями гепатоцитов с находящимся между ними
желчным капилляром. Гепатоциты имели полигональную форму с четко выраженной границей эозинофильной цитоплазмы.
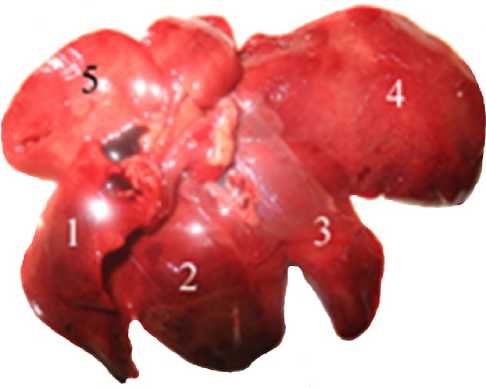
Рис. 1. Печень крысы. Установлено до 5 долей светлого или темного красно-коричневого цвета.
Нативный препарат
Fig. 1. Rat liver. Five parts of light or dark red-brown color. Native drug
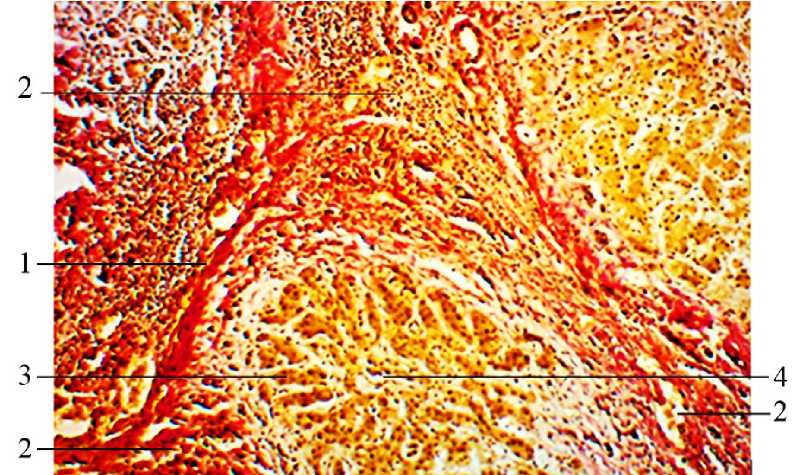
Рис. 2. Печеночная долька окружена прослойкой соединительной ткани 1, которая вокруг глиссоновой триады имеет толстую, рыхлую структуру 2. Печеночная долька сформирована печеночными балками 3, ориентированными радиально к центральной вене 4.
Окраска пикрофуксином по Ван Гизону. Ув. ×200
Fig. 2. The hepatic lobule surrounded by a connective tissue layer (1), with a thick, loose structure around the Glisson triad (2).
The hepatic lobule made of hepatic beams (3), oriented radially to the central vein (4). Van Gieson’s picrofuchsin staining, ×200 magnification
В центре клетки находилось ядро, содержащее от 2 до 4 и более нуклеол (ядрышек), что свидетельствовало в пользу образования зрелых рибосом, которые способны осуществлять трансляцию – синтез клеточных белков.
Хроматин находился преимущественно в диффузном состоянии. В поле зрения микроскопа определялись единичные двуядерные гепатоциты, расположенные, как правило, около кровеносных сосудов (рис. 3).
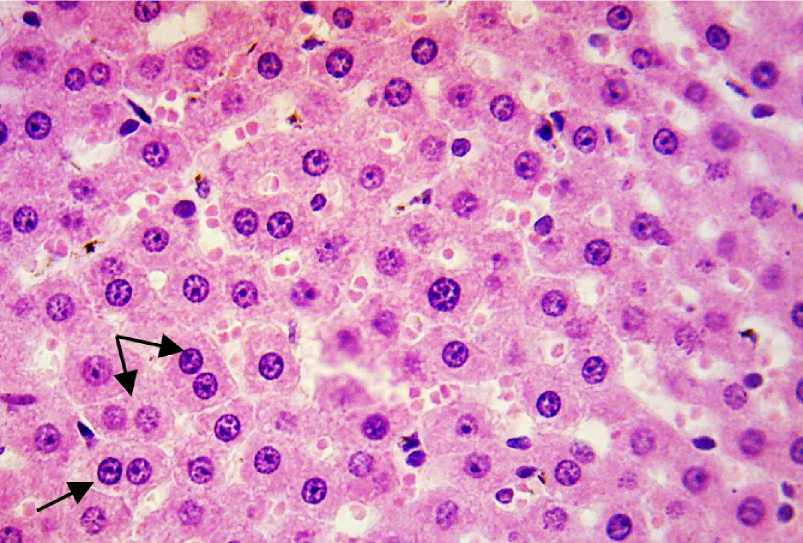
Рис. 3. Гистоструктура печени крысы. В ядрах печеночных клеток хроматин находится преимущественно в диффузном состоянии, контрастируются от 2 до 4 нуклеол. В поле зрения микроскопа определяются единичные двуядерные гепатоциты (показаны стрелкой).
Окраска гематоксилином и эозином. Ув. ×400
Fig. 3. Rat liver histostructure. In the hepatic cell nuclei, chromatin is predominantly in a diffuse state, 2-4 nucleoli are contrasted. Single binuclear hepatocytes are determined in the field of vision of the microscope (arrow).
Hematoxylin and eosin staining, ×400 magnification
Макроскопические исследования, проведенные через 75 сут, видимых изменений печени не установили. На срезе паренхима печени была практически однородной с умеренно выраженным полнокровием. Гепатоциты имели четкие полигональные границы цитоплазмы. Хроматин в ядрах гепатоцитов находился в основном в диффузном состоянии. Количество нуклеол составляло 2–3. В поле зрения микроскопа увеличилось количество двуядерных гепатоцитов (рис. 4).
Исходный показатель УОВ, определенный в начале наблюдения, составлял 78,75±0,096 % (δ=78,66/78,75/78,82). Через 15 сут УОВ сни- зился относительно исходного уровня на 0,30±0,083 % и составил 78,51±0,024 % (p=0,038; δ=78,49/78,50/78,53; Uэмп=2,0; R=0,863). На 30-е сут УОВ снизился на 0,48±0,066 % до 78,38±0,076 % (p=0,014; δ=78,31/78,32/78,42; Uэмп=0; R=0,718); на 45-е сут – на 0,50±0,058 % до 78,36±0,098 % (p=0,019; δ=78,26/78,328/78,41; Uэмп=1,0; R=0,837), на 60-е сут – на 0,52±0,062 % до 78,34±0,093 % (p=0,013; δ=78,24/78,30/78,41; Uэмп=0; R=0,837), на 75-е сут – на 0,54±0,042 % до 78,33±0,061 % (p=0,005; δ=78,25/78,33/78,38; Uэмп=0; R=0,963).
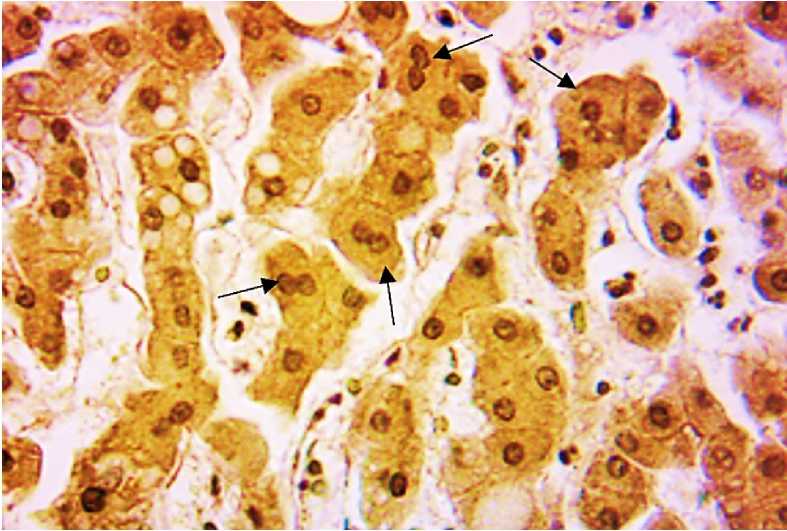
Рис. 4. Печень крысы через 75 сут после начала наблюдения. На фоне умеренно выраженного полнокровия – увеличенное количество двуядерных гепатоцитов (показаны стрелкой).
Окраска пикрофуксином по Ван Гизону. Ув. ×400
Fig. 4. Rat liver, 75 days after the start of observation. An increased number of binuclear hepatocytes is observed against the background of mild hyperemia (arrow).
Van Gieson’s picrofuchsin staining, ×400 magnification
Заключение. Возраст крыс в начале эксперимента при экстраполяции на человека составлял 35–40 лет, а после 75-суточного наблюдения – 40–50 лет. Это второй период зрелого возраста (36–60 лет для мужчин и 36– 55 лет для женщин) [24]. В этом возрасте причиной полисистемных заболеваний являются происходящие в организме человека постепенно нарастающие сдвиги в структуре тканей и функциях органов с нарушением клеточной энергетики. Эти изменения особенно выражены в наиболее энергозависимых органах, в частности в печени [7]. В проведенном исследовании в процессе 75-суточного наблюдения за животными видимых макроструктурных трансформаций в печени выявлено не было. Однако на фоне однородной макроструктуры определено умеренно выраженное полнокровие. Гистоструктурные исследования грубых изменений также не выявили. Гепатоциты сохраняли четкость границ цитоплазмы. Увеличилось количество клеток, содержащих 2–3 нуклеолы. Количество гепатоцитов с двумя ядрами повысилось, особенно около кровеносных сосудов, что является одним из признаков старения печени [25]. Таким образом, в процессе 75-суточного наблюдения было установлено, что в печени животных с возрастом происходит снижение уровня общей воды на 0,54±0,042 %, которое не вызывает видимых изменений в гистоструктуре печени.
Список литературы Возрастные изменения гидратации и гистоструктуры печени крысы
- Ишманов М.Ю., Сертакова А.В., Соловьев А.М., Федяшина Н.А., Щербакова Е.В. 250 показателей здоровья: справочник. М.: Научная книга; 2017. 602.
- Копылова В.Д., Веницианов Е.В. Вода в природе, значение и свойства. Сорбционные и хромато-графические процессы. 2012; 12 (5): 828-838.
- Батырханова Н.М., ПрмагамбетовГ.К., Иманбекова К.Б., Тлеубаев С.С., Чурсин В.В., ред. Физиология и нарушения водно-солевого обмена: методические материалы к практическим и семинарским занятиям. Алматы: КазМУНО (АГИУВ); 2011. 44.
- Ермолаева Е.Л., Грибина Г.А. О значении воды для человека. Международный студенческий научный вестник. 2018; 6. URL: https://eduherald.ru/ru/article/view?id=19387 (дата обращения: 10.05.2022).
- Калинин А.Л. Морфологические и патофизиологические особенности печени у пожилых пациентов. Проблемы здоровья и экологии. 2016; 1: 13-17.
- Коломойцев А.К., Кузьмин А.С., Литвиненко В.А., Нежебовская А.С., Тушинский А.А. Возрастные изменения в печени. Фундаментальные аспекты психического здоровья. 2018; 4: 9-10.
- Радченко В.Г., Селиверстов П.В. Возрастные изменения печени. Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова. 2017; 9 (1): 110-116.
- Цай Г.Е., Копосова С.А., Беганская Н.С. Возрастные изменения печени человека. Морфология. 2008; 133 (2): 147-148.
- КотеровА.Н., УшенковаЛ.Н., Зубенкова Э.С., ВайнсонА.А., БирюковА.П. Соотношение возрастов основных лабораторных животных (мышей, крыс, хомячков и собак) и человека: актуальность для проблемы возрастной радиочувствительности и анализ опубликованных данных. Медицинская радиология и радиационная безопасность. 2018; 63 (1): 5-27. DOI: 10.12737/article_5a82e4a39 08213.56647014.
- Кравчук Ю.А. Особенности ведения пациентов с заболеваниями печени в условиях пандемии COVID-19. Известия Российской Военно-медицинской академии. 2021; 40 (3): 57-62. DOI: org/10.17816/rmmar76270.
- Никитин И.Г., Ильченко Л.Ю., Федоров И.Г., Тополян Г.Г. Поражение печени при COVID-19: два клинических наблюдения. Альманах клинической медицины. 2020; 48 (6): 412-421. DOI: 10.18786/2072-0505-2020-48-053.
- Xu L., Liu J., Lu M., ZhengX. Liver injury during highly pathogenic human Coronavirus infections. Liver Int. 2020; 40 (5): 998-1004. DOI: 10.1111/liv.14435.
- БубноваМ.Г., Персиянова-ДуброваА.Л., ЛяминаН.П. Реабилитация после новой коронавирусной инфекции (COVID-19): принципы и подход. CardioCоматика. 2019; 11 (4): 6-14. DOI: 10.26442/222117185.4.200570.
- Тришкин Д.В., Крюков Е.В., Фролов Д.В., Зайцев А.А. Костюченко О.М., Геворкян А.Р. Физическая реабилитация пациентов с новой коронавирусной инфекцией SARS-CoV-2 (COVID-19) в стационаре. Военно-медицинский журнал. 2020; 341 (9): 13-19.
- Фролов Д.В., Крюков Е.В., Светлицкая М.В., Костюченко О.М., Зайцев А.А., Чернов С.А., Чернецов В.А. Физическая реабилитация пациентов с новой коронавирусной инфекцией COVID-19 в военном стационаре с использованием телекоммуникационных технологий. Физиотерапия, бальнеология и реабилитация. 2020; 19 (4): 266-274. DOI: 10.17816/1681-3456-2020-19-4-10.
- Guan W.J., Ni Z.Y., Hu Y., Liang W.H., Ou C.O., He J.X., Liu L., Shan H., Lei C.L., Hui D.S.C., Du B. China Medical Treatment Expert Group for Covid-19. Clinical Characteristics of Coronavirus disease 2019 in China. N. Engl. J. Med. 2020; 382 (18): 1708-1720. DOI: 10.1056/NEJMoa2002032.
- European convention for the protection of vertebral animals used for experimental and other scientific purpose: Council of Europe. 18.03.1986. Strasbourg; 1986. 52.
- Иванов Д.Г., Александровская Н.В., Афонькина Е.А., Ерошкин П.В., Семенов А.Н., Бусыгин Д.В. Адаптационные изменения у крыс при ежедневном выполнении физической нагрузки в методике «Бег на тредбане». Биомедицина. 2017; 2: 4-22.
- Липатов В.А., Крюков А.А., Северинов Д.А., Саакян А.Р. Этические и правовые аспекты проведения экспериментальных биомедицинских исследований in vivo. Ч. 1. Российский медико-биологический вестник им. академика И.П. Павлова. 2019; 27 (1): 80-92. DOI: 10.23888/PAVLOVJ 201927180-92.
- Липатов В.А., Крюков А.А., Северинов Д.А., Саакян А.Р. Этические и правовые аспекты проведения экспериментальных биомедицинских исследований in vivo. Ч. 2. Российский медико-биологический вестник им. академика И.П. Павлова. 2019; 27 (2): 245-257. DOI: 10.23888/PAVLOV J2019272245-257.
- Исаков Ю.В., Ромасенко М.В. Влияние гипербарической оксигенации на содержание общей воды в мозговой ткани при экспериментальном травматическом отеке мозга. Вопросы нейрохирургии. 1986; 1: 25-27.
- Ромейс Б. Гистологическая техника. М.: Иностранная литература; 1953. 718.
- Лебедева Е.И. Сравнительная морфофункциональная характеристика печени белой крысы и человека в норме и при токсическом поражении: автореф. дис. ... канд. биол. наук. Минск; 2016. 27.
- Антонова В.А. Возрастная анатомия и физиология. М.: Высшее образование; 2006. 192.
- Блинкова Н.Б., Сазонов С.В., Леонтьев С.Л. Полиплоидия гепатоцитов в регенерации печени при хроническом гепатите у пациентов из разных возрастных групп. Екатеринбург: Юника; 2017. 106.


