Возрастные изменения секреторной функции поджелудочной железы и микрофлоры кишечника у цыплят родительских форм и гибридов мясных кур
Автор: Егоров И.А., Вертипрахов В.Г., Грозина А.А., Лаптев Г.Ю., Никонов И.Н., Новикова Н.И., Ильина Л.А., Йылдырым Е.А., Филиппова В.А., Дубровин А.В., Манукян В.А., Ленкова Т.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Птицеводство: наука и технологии
Статья в выпуске: 4 т.52, 2017 года.
Бесплатный доступ
Пищеварение у птицы характеризуется высокой ферментативной активностью. Определенная роль в переваривании трудногидролизуемых компонентов корма отводится микрофлоре в слепых отростках и толстом отделе кишечника. Целью настоящей работы было изучение эмбриональных и постэмбриональных ферментативных и микробных процессов в кишечнике мясных кур исходных линий Б5 (корниш), Б9 (плимутрок) и их гибридов (Б59, кросс Смена 8) селекции СГЦ «Смена» (Россия). Результаты научно-хозяйственного опыта (виварий ВНИТИП) показали, что в эмбриональный период развития мясных кур гибриды характеризуется наличием амилолитической и липолитической активности в гомогенате ткани эмбриона (7-е сут) и ткани кишечника и поджелудочной железы (14-е сут). У цыплят в возрасте 1 сут отмечалась высокая активность панкреатических ферментов в ткани поджелудочной железы, причем в начале постэмбриогенеза показатели у гибридов и родительских линий существенно не различались. В проявлении внешнесекреторной функции поджелудочной железы установили наличие двух периодов: первый (1-14-е сут) был обусловлен интенсивным развитием ее массы и становлением пищеварительного аппарата, второй (15-35-е сут) характеризовался физиологической зрелостью и адекватным количеством панкреатических пищеварительных ферментов, вырабатываемых в соответствии с качеством корма. У амилазы и протеаз активность в плазме крови имела тенденцию уменьшаться с возрастом (в первом случае отмечали статистически значимое снижение к 35-м сут во всех группах, во втором - у гибридов и плимутроков), у липазы - проявляла обратную динамику (волнообразное увеличение активности во всех группах к 35-м сут, у гибридов и цыплят корниш - статистически значимое) (Р ≤ 0,05). Доля целлюлозолитических бактерий достигала высоких значений к 14-м сут, причем между родительскими линиями и гибридами в этом возрасте существенных различий не наблюдали (50,79±1,84 % у гибридов, 50,84±2,32 и 53,23±2,47 % - у отцовской и материнской линий), но к 35-суточному возрасту у гибридов она снижалась с 50,80±1,84 до 20,30±0,85 % (на 60,0 %). У цыплят родительских линий количество целлюлозолитических бактерий изменялось волнообразно, и в 35-суточном возрасте их доля составила у плимутроков 41,00±1,87 %, у породы корниш - 44,80±2,27 %. Полученные данные свидетельствуют о том, что между активностью протеолитических ферментов поджелудочной железы и представленностью целлюлозолитических бактерий существует отрицательная корреляция. Наиболее сильную отмечали у микроорганизмов группы клостридий (для цыплят корниш, плимутроков и гибридов r соответственно -0,64; -0,83 и -0,64). Доля лактобактерий, которые участвуют в ферментации корма, положительно коррелировала с активностью всех панкреатических ферментов у гибридов и плимутроков (для амилазы, липазы и протеаз r соответственно 0,71; 0,56; 0,83 и 0,60; 0,46; 0,45). Имелась положительная корреляция между активностью практически всех панкреатических ферментов и развитием условно-патоген-ной и патогенной микрофлоры - энтеробактерий (для амилазы, липазы и протеаз r у гибридов соответственно 0,65; 0,59 и 0,68; у цыплят корниш - 0,34; 0,68 и 0,64), стафилококков (у цыплят корниш r = 0,46 для протеаз, у плимутроков r = 0,70 для амилазы и r = 0,91 для протеаз), кампилобактерий (у гибридов r = 0,86 для протеаз) и фузобактерий (у гибридов для амилазы и протеаз r = 0,41 и r = 0,90, у цыплят корниш для липазы и протеаз r = 0,63 и r = 0,83, у плимутроков для амилазы и протеаз r = 0,99 и r = 0,92). Таким образом, интенсивное развитие особей обусловлено активностью пищеварительных ферментов, которая взаимосвязана с количественным и качественным составом микробиоты кишечника. Наиболее критичными периодами развития цыплят по анализируемым показателям следует считать эмбриогенез и начальный этап постэмбриогенеза.
Мясные куры, бройлеры, плимутрок, корниш, онтогенез, внешнесекреторная функция поджелудочной железы, микрофлора желудочно-кишечного тракта цыплят, панкреатические ферменты в плазме крови
Короткий адрес: https://sciup.org/142214068
IDR: 142214068 | УДК: 636.52/.58:591.1:612.33/.34 | DOI: 10.15389/agrobiology.2017.4.757rus
Текст научной статьи Возрастные изменения секреторной функции поджелудочной железы и микрофлоры кишечника у цыплят родительских форм и гибридов мясных кур
Эффективное расщепление корма на основные компоненты для дальнейшего усвоения питательных веществ относится к важнейшим фак-
Исследование выполнено при поддержке гранта Российского научного фонда для реализации научного проекта 16-16-04089 «Изучение физиологических и микробиологических особенностей пищеварения кур мясных пород в эмбриональный и постэмбриональный периоды для создания новых технологий кормления, обеспечивающих максимально полную реализацию генетического потенциала птицы».
торам при выращивании поголовья. Фундаментальные исследования пищеварительной системы основаны на выяснении молекулярных и клеточных механизмов ее функционирования во взаимозависимости с другими структурами организма. При проблемах со здоровьем кишечника, которое связано с качеством кормления, состоянием микробиоты и обусловлено физиологическими и биохимическими процессами, пищеварение и усвоение питательных веществ ухудшаются (1-3). Это имеет серьезные последствия для коммерческого птицеводства, так как ведет к ухудшению конверсии корма, повышает риск развития заболеваний и снижает прибыльность (4, 5). Кроме того, недавние изменения законодательства в странах Европейского Союза, касающиеся использования антибактериальных препаратов и кормления, а также генетическое совершенствование самой птицы требуют более глубокого изучения функции и здоровья кишечника.
Результаты исследований альтернативных антибиотикам препаратов показывают, что воздействие на состав микрофлоры кишечника может существенно увеличить прирост живой массы у бройлеров (6-10). Известно, что для птицы характерно собственное пищеварение, когда источником ферментов служат пищеварительные железы. Определенная роль в переваривании трудногидролизуемых компонентов корма отводится микрофлоре в слепых отростках и толстом отделе кишечника (11-13). Маловероятно, что пищеварительные ферменты не влияют на состав микрофлоры в кишечнике птицы. Однако в доступной научной литературе подобные данные практически отсутствуют, особенно в связи с возрастной динамикой и при сравнении родительских линий и гибридов.
В настоящем исследовании, впервые изучив у мясных цыплят исходных линий и их гибридов активность панкреатических ферментов в онтогенезе и сопоставив ее с количественным составом микробиоты кишечника, мы установили корреляцию между этими показателями.
Целью нашей работы было изучение эмбриональных и постэмбриональных ферментативных и микробных процессов в кишечнике родительских линий и гибридов мясных кур.
Методика . Эксперименты проводили на породах корниш (линия Б5), плимутрок (линия Б9) и их гибридах (Б59, кросс Смена 8) селекции СГЦ «Смена» (Россия).
В период инкубации яиц (установка Стимул-1000, «Стимул-Инк», Россия) в группах (гибриды, материнская и отцовская линии) исследовали эмбрионы (на 7-е сут) и их пищеварительную систему (на 14-е сут). В каждом варианте отбирали по 10 яиц из группы. Повторность опыта 2-кратная. Эмбриональный материал гомогенизировали с охлажденным раствором Рингера в соотношении 1:10, центрифугировали при 5000 об/мин в течение 5 мин. Ферментативную активность определяли по Смит-Рою-Уголеву и на автоматическом биохимическом анализаторе Hemwell T2900 («Awareness Technology, Inc.», США) с наборами для панкреатической амилазы Pan-crease-amylase liquicolor и липазы Lipase liquicolor («HUMAN GmbH», Германия) в соответствии с инструкциями изготовителей.
Развитие внешнесекреторной функции поджелудочной железы в онтогенезе изучали в научно-хозяйственном опыте (экспериментальная база ВНИТИП; режим кормления и содержания — согласно принятым зоотехническим требованиям). Для опытов в каждый возрастной период (1, 7, 14, 21, 28 и 35 сут) отбирали по 10 цыплят. Исследования выполняли в 2 повторностях. Кровь для анализа получали после убоя декапитацией. К образцам добавляли цитрат натрия и центрифугировали при 5000 об/мин в течение 5 мин. Брюшную стенку рассекали и извлекали поджелудочную желе-758
зу, которую взвешивали и измельчали с добавлением охлажденного раствора Рингера. Гомогенат центрифугировали в течение 3 мин при 1200 об/мин, соответствующее разведение супернатанта использовали для биохимических исследований. Кишечник перевязывали, извлекали и подвергали глубокой заморозке для последующего микробиологического анализа. Отбор материала содержимого кишечника для молекулярно-генетического анализа проводили в те же сроки, что и биохимические исследования, в соответствии с установленными требованиями (14). В ткани поджелудочной железы активность амилазы определяли по расщеплению крахмала (метод Смит-Роя-Уголева), протеаз — по уменьшению концентрации казеина при колориметрическом контроле (15), липазы — на полуавтоматическом биохимическом анализаторе BS3000P («SINNOWA», КНР) с соответствующим набором диагностических реагентов («ДИАКОН-ВЕТ», Россия). Активность амилазы и липазы в плазме крови исследовали на биохимическом анализаторе Hemwell 2900 (T) («Awareness Technology, Inc.», США) с использованием необходимого набора реагентов («HUMAN GmbH», Германия), протеаз — с N-бензоил-DL-аргинин-п-нитроанилидом (BAPNA) в качестве субстрата на биохимическом анализаторе BS3000P («SINNOWA», КНР) (16).
Тотальную ДНК из образцов выделяли с помощью набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно инструкции производителя. ДНК-амплификацию проводили на приборе Verity («Life Technologies, Inc.», США), используя эубактериальные праймеры 63F (3'-CAGGC-CTAACACATGCAAGTC-5') с меткой на 5'-конце (флуорофор D4 WellRed) и 1492R (3'-TACGGHTACCTTGTTACGACTT-5'), которые позволяют ам-плифицировать фрагмент гена 16S pРНК по позициям с 63-й до 1492-й (нумерация указана для гена 16S pРНК Esherichia coli ); режим амплификации: 3 мин при 95 °С (1 цикл); 30 с при 95 °С, 40 с при 55 °С, 60 с при 72 °С (35 циклов); 5 мин при 72 °С. Флуоресцентно меченные ампликоны гена 16S pРНК очищали с применением 3 М гуанидинизотиоционата. Конечную концентрацию тотальной ДНК в растворе определяли на флуориметре Qubit («Invitrogen, Inc.», США) с использованием наборов Qubit dsDNA BR Assay Kit («Invitrogen, Inc.», США) согласно рекомендациям производителя. Рестрикцию (30-50 нг ДНК, эндонуклеазы HaeIII, HhaI и MspI, «Fermentas», Литва) проводили в течение 2 ч при 37 °С. Продукты рестрикции осаждали этанолом, добавляли 0,2 мкл маркера молекулярной массы Size Standart-600 («Beckman Coulter», США) и 10 мкл формамида Sample Loading Solution («Beckman Coulter», США). Анализировали на приборе CEQ 8000 (погрешность не более 5 %) («Beckman Coulter», США).
Размеры пиков и их площади вычисляли в программе Fragment Analysis («Beckman Coulter», США), на основании чего выделяли подтипы (филотипы) с принятой в исследовании погрешностью в 1 нуклеотид и оценивали их относительное содержание в микробном сообществе. Принадлежность бактерий к определенной таксономической группе определяли с использованием программы Fragment Sorter .
ПЦР в реальном времени для учета общей численности бактерий выполняли на амплификаторе ДТ Lite-4 (ООО «НПО ДНК-Технология», Россия), используя «Набор реактивов для проведения ПЦР-РВ в присутствии интеркалирующего красителя EVA Green» (ЗАО «Синтол», Россия) и праймеры Eub338/Eub518 (5'-ACTCCTACGGGAGGCAGCAG-3' и 5'-AT-TACCGCGGCTGCTGG-3'), в следующем режиме: 3 мин при 95 °С; 13 с при 95°С, 13 с при 57 °С, 30 с при 72 °С (40 циклов).
Для показателей активности ферментов рассчитывали средние ( X )
и стандартные ошибки средних (±SEM), достоверность различий определяли по t-критерию Стьюдента, считая их значимыми при p ≤ 0,05. Для объяснения причинно-следственной связи между факторными и результативными признаками рассчитывали коэффициенты корреляции Пирсона, считая их высокими при абсолютных значениях r ≥ 0,5. Математическую и статистическую обработку данных, расчет коэффициентов корреляции Пирсона проводили в программе Past .
Результаты . У гибридов амилолитическая активность гомогената 7-суточных эмбрионов в 8-19 раз превышала таковую у материнской линии и в 16-22 раза — у отцовской. Активность липазы была на 28,5 на 25,1 % выше, чем у эмбрионов соответственно материнской и отцовской линий. Протеолитическую активность у 7-сточных эмбрионов мы не обнаружили. Учитывая, что развитие кишечника и поджелудочной железы начинается с 3-4-сточного возраста эмбриона, наличие амилолитической и липолитической активности в эмбриональных тканях вполне объяснимо. В яйце имеется незначительное количество моносахаридов, а большинство белков присутствует в форме гликопротеидов. Вероятно, в результате деградации этих белков в процессе эмбриогенеза освободившиеся мономеры углеводов используются на гликозилирование вновь синтезируемых полипептидов. На 14-е сут инкубации у гибридов активность амилазы превышала показатель у родительских линий в 1,4-2,0 раза. По липазе наблюдали противоположную тенденцию: у гибридов активность была почти в 2 раза ниже, чем у родительских линий. В этот период у эмбрионов уже функционирует пищеварение, и полученные результаты указывают на более интенсивные процессы гидролиза жиров в кишечнике у пород плимутрок и корниш по сравнению с их гибридами. Следовательно, наши данные свидетельствуют о том, что активность амилазы у эмбрионов-гибридов, которые в последующем характеризуются высокой скоростью роста, больше, чем у их родителей. Этот показатель может служить одним из критериев оценки развития эмбрионов и определять направление продуктивности птицы в будущем.
1. Возрастные изменения ферментативной активности в ткани поджелудочной железы у гибридов и родительских линий птицы разных пород ( Х ±SEM, научно-производственный опыт)
|
Группа |
Возраст цыплят, сут |
|||||
|
1 |
7 |
14 |
] 21 |
28 |
] 35 |
|
|
Активность амила |
з ы, мг/(г•мин) |
|||||
|
Гибриды |
14040±828,3 |
12287±1017,3 |
18440±443,8 |
13800±2057,2 |
15160±1254,7 |
17343±617,5 |
|
Плимутрок |
13080±1149,2 |
8712±628,5* |
14075±1205,0 |
11500±538,1 |
15480±1234,0 |
16320±1120,0 |
|
Корниш |
14200±1225,2 |
10780±1248,2 |
13300±1116,1 |
9440±401,3 |
10680±2670,7 |
14840±1594,3 |
|
Активность проте |
аз, мг/(г•мин) |
|||||
|
Гибриды |
323±30,7 |
200±12,1 |
317±48,9 |
278±30,1* |
325±46,9 |
487±43,2 |
|
Плимутрок |
314±21,1 |
125±15,7 |
246±32,2 |
192±50,0 |
206±22,6 |
402±32,2 |
|
Корниш |
261±36,1 |
126±14,1 |
175±26,6 |
217±68,6 |
226±24,7 |
403±87,4 |
|
Акт и в но сть л ип аз ы, ед/л |
||||||
|
Гибриды |
31288±4401,7 |
90489±6648,5* |
99882±4621,7* |
107645±6196,0* 83430±7873,0* |
105753±4095,5* |
|
|
Плимутрок 38582±4391,7 |
67074±6735,0* |
81209±7965,0* |
95390±8985,0* |
88906±10569,3* 85940±7808,0* |
||
|
Корниш |
39670±5551,0 |
64255±7044,3* |
92307±4371,3* |
94250±8300,0* |
70135±3634,0* |
88039±11537,5* |
|
П р и м еч а ни е. Размер выборки в каждой группе — 20 особей. |
||||||
|
* Различия с показателями у цыплят в возрасте 1 сут статистически значимы при Р ≤ 0,05. |
||||||
Анализ гомогенатов ткани поджелудочной железы у 1-суточных цыплят выявил значительную амилолитическую, липолитическую и про-теолитическю активность, но существенных различий по этим показателям в разных группах мы не обнаружили (табл. 1). В онтогенезе экзокринная функция поджелудочной железы развивается неравномерно (17). В первые недели постэмбрионального развития происходит адаптация организма цыплят к новым условиям существования, идет становление органов пищеварительной системы, поэтому имеются различия в показате-760
лях роста цыплят разных групп (гибриды, цыплята родительских линий породы корниш и плимутрок) (18, 19).
В возрасте 14 сут активность амилазы в ткани поджелудочной железы у гибридов была выше на 31,3 % (Р ≤ 0,05) по сравнению с показателями 1-суточных цыплят, у исходных линий — существенно не изменилась (см. табл. 1). Активность протеаз после снижения в 7-суточном возрасте (у гибридов — на 38,1 %; у цыплят материнской и отцовской линий — соответственно на 60,2 и 57,1 % при Р ≤ 0,05) повышалась к 14 сут до значений, зарегистрированных в 1-е сут. Активность липазы имела тенденцию к повышению и у 14-суточных цыплят достоверно (Р ≤ 0,05) превысила показатели у 1-суточных: у гибридов — в 3,2 раза, у материнской линии — в 2,1 раза, у отцовской — в 2,3 раза. Сравнительный анализ показывает, что в возрасте 14 сут по амилолитической активности гибриды существенно опережали цыплят родительских линий (материнской — на 23,7 %, отцовской — на 27,9 %). С учетом того, что амилаза участвует в гидролизе углеводов и определяет энергетический баланс в организме, интенсивность обменных процессов у гибридов в этот период значительно выше, чем у сверстников из родительских линий. У 14-суточных цыплят мы не выявили достоверных различий между группами по активности липазы, тогда как панкреатические протеазы были значительно активнее у гибридов, чем у родительских линий (у отцовской показатель ниже на 44,8 %, Р ≤ 0,05; у материнской — на 22,4 %). Различие в гидролизе протеина корма связано с неодинаковой питательностью рационов для гибридов и родительских линий (у цыплят-бройлеров содержание сырого протеина в комбикорме составляет 22,0 %, у родительских линий — не превышает 19,0 %). Различие по протеолитической активности в ткани поджелудочной железы у цыплят из разных групп указывает на особенности, обусловленные генетическим потенциалом, и адаптацию панкреатической секреции к качеству корма. Таким образом, к 14-суточному возрасту внешнесекреторная функция поджелудочной железы у мясных цыплят четко адаптируется к качеству принимаемого корма, что свидетельствует о наступлении ее физиологической зрелости, поскольку по функциональным критериям, в том числе по наличию нейрогуморальной регуляции, орган соответствует таковому у взрослых кур.
Второй период (15-35-е сут) характеризовался снижением активности протеаз к 21 сут (у гибридов — на 14 % относительно показателя в 1-суточном возрасте, Р ≤ 0,05; у цыплят материнской линии — на 38,9 %) с последующим ростом до 35-суточного возраста. По активности амилазы 35-суточные цыплята-гибриды превосходили 1-суточных на 23,5 % (Р ≤ 0,05), по активности протеаз — на 50,8 %, липазы — на 238,0 %. Между группами в 35-суточном возрасте существенных различий по активности ферментов не установили, за исключением липазы, активность которой у цыплят материнской линии была на 18,7 % (Р ≤ 0,05) ниже, чем у гибридов.
Роль поджелудочной железы не ограничивается участием в пищеварении — она также выполняет эндокринную функцию, вырабатывая гормоны (инсулин, глюкагон, соматостатин), и участвует в регуляции обмена веществ за счет поступления панкреатических ферментов в кровь (20, 21), поэтому мы изучили их активность в плазме крови у растущих гибридов и цыплят исходных линий (табл. 2).
В начальный период постэмбрионального развития у гибридов отмечалось повышение активности амилазы на 49,1 % (7-е сут) и на 93,1 % (14-е сут). У цыплят родительских линий в эти сроки существенных изменений по амилазе крови не наблюдали, и ее высокая активность сохранялась до 14-суточного возраста. Это может быть связано с интенсивным ро-761
стом поджелудочной железы и дефицитом вновь синтезируемых ферментов,
2. Возрастные изменения активности панкреатических ферментов в плазме крови у гибридов и родительских линий птицы разных пород ( Х ±SEM, научно-производственный опыт)
|
Группа |
Возраст цыплят, сут |
||||
|
1 1 |
7 1 |
14 1 21 1 |
28 |
35 |
|
|
Гибриды |
671±50,5 |
Актив] 1001±21,4* |
но сть амил аз ы, ед/л 1296±358,3* 525±95,0 |
516±86,7 |
298±28,2* |
|
Плимутрок |
929±92,9 |
926±107,9 |
832±136,3 445±103,7* |
642±82,3* |
605±86,3* |
|
Корниш |
827±132,9 |
704±66,3 |
583±56,6* 382±39,0* |
564±124,0 |
510±71,3* |
|
Гибриды |
14±1,3 |
Актив 15±1,5 |
но сть п р от е аз, ед/л 11±0,5 10±3,6 |
13±1,6 |
8±1,6* |
|
Плимутрок |
14±1,4 |
13±0,9 |
13±1,1 6±0,7* |
10±1,1 |
9±0,7* |
|
Корниш |
15±0,8 |
12±0,7 |
11±0,6 7±0,1 |
8±0,8 |
13±1,4 |
|
Гибриды |
14±0,3 |
Актив 23±1,5* |
но сть л ип аз ы, ед/л 16±1,7 18±2,2 |
10±1,4 |
20±2,8* |
|
Плимутрок |
15±0,9 |
23±1,5* |
21±2,3* 14±1,3 |
11±0,6 |
18±1,1 |
|
Корниш |
15±0,8 |
25±1,7* |
20±3,7 15±0,5 |
10±1,0* |
22±2,2* |
|
П р и м еч а ни е. Размер выборки в каждой |
группе — 20 особей. |
||||
* Различия с показателями у цыплят в возрасте 1 сут статистически значимы при Р ≤ 0,05.
поэтому идет их рекреция из крови в ацинарные клетки железы для удовлетворения возрастающих потребностей организма в пищеварительных энзимах. С 21-суточного возраста и до окончания выращивания у цыплят-бройлеров активности амилазы в плазме крови уменьшалась, становясь к 35-м сут более чем в 2 раза ниже, чем у 1-суточных цыплят. У родительских линий возрастная динамика активности амилазы была иной: к 21-суточному возрасту происходил ее спад, а затем подъем до 35-суточного возраста. По протеолитическим ферментам наблюдали волнообразное снижение активности: в 35-суточном возрасте показатель у гибридов становится ниже на 42,9 %, у цыплят породы плимутрок — на 35,7 %, корниш — на 28,6 % по сравнению с показателем в возрасте 1 сут. Это можно объяснить участием протеаз плазмы крови в регуляции кровяного давления. С возрастом этот показатель становится выше, а интенсивность ассимиляции в организме, наоборот, снижается. Между активностью протеаз в ткани поджелудочной железы и в плазме крови у гибридов была выявлена отрицательная корреляция ( r = -0,75).
В первые 2 нед жизни происходит интенсивное развитие микрофлоры кишечника (22). По нашим данным, численность целлюлозолитических бактерий у мясных цыплят достигала высоких значений к 14-суточному возрасту, причем между цыплятами родительских линий и гибридами в этом возрасте существенных различий не наблюдалось. К 21-суточному возрасту у гибридов отмечали снижение доли целлюлозолитических микроорганизмов на 26,4 % (с 50,8±1,84 до 37,4±1,25 %). Аналогичную тенденцию наблюдали у цыплят породы корниш (уменьшение на 32,0 % — с 53,2±2,47 до 36,2±1,57 %). У гибридов с возрастом численность целлюлозолитических бактерий уменьшалась, и в 35-дневном возрасте они составляли 20,3±0,85 % популяции. У цыплят родительских линий с возрастом происходило волнообразное изменение количества целлюлозолитических бактерий, и в 35-суточном возрасте на них приходился 41,0±1,87 % у породы плимутрок 44,8±2,27 % — у породы корниш. Следовательно, состояние микрофлоры кишечника зависит от многих факторов, причем питание и рацион не всегда играют главную роль.
Вопросы взаимодействия пищеварительных ферментов с микробиотой кишечника имеют особую актуальность, поскольку для стимуляции пищеварения применяется большое количество биологических добавок. Известно, что соединения, не усвоенные в желудочно-кишечном тракте, 762
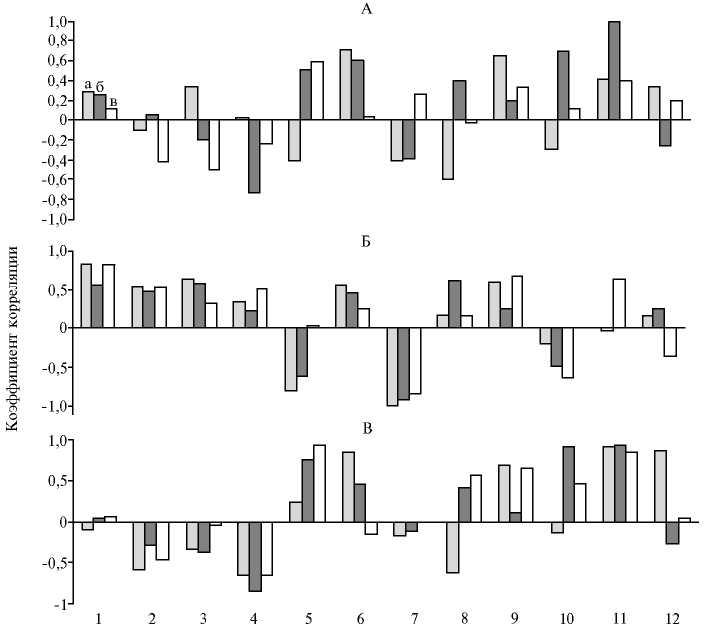
Коэффициенты корреляции Пирсона между представленностью разных групп бактерий в слепых отростках кишечника и активностью панкреатической амилазы (А) , липазы (Б) и протеаз (В) в гомогенате ткани печени у гибридных цыплят-бройлеров (а) и их родительских линий пород плимутрок (б) и корниш (в) в возрасте 35 сут: 1 — семейство Eubacteriaceae , 2 — семейство Ruminococcaceae , 3 — семейство Lachnospiraceae , 4 — семейство Clostridiaceae , 5 — филум Bac-teroidetes , 6 — порядок Lactobacillales , 7 — порядок Bacillaceae , 8 — порядок Selenomonadales , 9 — семейство Enterobacteriaceae , 10 — Staphylococcus sp., 11 — Fusobacterium sp., 12 — Campylobacterium sp. (научно-производственный опыт).
становятся пищей для кишечных микроорганизмов, а также подвергаются в печени окислительному дезаминированию и другим катаболическим процессам, что влечет за собой снижение эффективности использования пищи и накопление в организме промежуточных токсических продуктов обмена (23). Вычисление коэффициентов линейной корреляции по Пирсону между количеством микроорганизмов и показателями активности ферментов позволяет установить прямые связи между переменными величинами по их абсолютным значениям. Мы выполнили анализ таких корреляций для гомогената ткани органа (рис.) и плазмы крови (данные не приведены). Полученные коэффициенты отражали отрицательную взаимозависимость между активностью протеолитических ферментов поджелудочной железы и численностью бактерий-целлюлозолитиков, что указывает на конкурентные отношения пищеварительных ферментов и микроорганизмов. Причина заключается в том, что микрофлора участвует в конечном звене пищеварительных процессов (инактивация кишечных и ряда панкреатических ферментов) и выполняет защитную функцию, препятствуя развитию в кишечнике патогенных микроорганизмов. Число лактобактерий, которые нужны для ферментации корма, положительно коррелировало с активностью всех панкреатических ферментов у гибридов, а также амилазы и протеаз — у родительских линий. У гибридов имелась 763
отрицательная связь между активностью протеаз поджелудочной железы и представленностью микроорганизмов группы клостридий ( r = -0,76). Эту отрицательную корреляцию можно объяснить тем обстоятельством, что от гидролиза протеина в кишечнике во многом зависит состояние условнопатогенной микрофлоры: чем хуже переваривается белок, тем благоприятнее условия (вследствие гнилостных процессов) для патогенных микроорганизмов и развития воспалительных процессов.
Энтеробактерии тоже относятся к группе условно-патогенных микроорганизмов. Однако в этом случае имелась положительная корреляция их численности и активности всех панкреатических ферментов у гибридов и цыплят породы корниш. Аналогичную тенденцию отмечали в отношении патогенных бактерий родов Staphylococcus , Campylobacter , Fusobacterium , многие виды которых служат возбудителями инфекционных заболеваний у птицы. Следовательно, микробы перечисленных групп принимают участие в процессах пищеварения в кишечнике, и их количество связано с активностью панкреатических ферментов. В исследованиях на фистульных свиньях были получены результаты, которые указывают на увеличение количества кишечной палочки после приема корма (24)
Итак, у мясных кур в эмбриональный период гибриды имеют более развитое пищеварение, чем родительские линии, что проявляется в наличии амилолитической и липолитической активности в гомогенате ткани эмбриона и ткани кишечника и поджелудочной железы. В возрасте 1 сут активность ферментов в поджелудочной железе высока и существенно не различается у гибридов и родительских линий. Физиологическое созревание поджелудочной железы у цыплят завершается к 14-суточному возрасту, причем у гибридов оно протекает быстрее. Наиболее высокие показатели корреляции между активностью протеолитических ферментов поджелудочной железы и численностью целлюлозолитических бактерий отмечены для микроорганизмов группы клостридий. У гибридов и плимутроков численность лактобактерий положительно коррелирует с активностью всех панкреатических ферментов. С активностью панкреатических ферментов также положительно коррелирует развитие условно-патогенной и патогенной микрофлоры у гибридов и цыплят отцовской и материнской линий. Следовательно, в эмбриогенезе интенсивное развитие особей определяется активностью пищеварительных ферментов, которая выше у гибридов, а в постэмбриогенезе — ее взаимосвязью с составом микробиоты кишечника.
Список литературы Возрастные изменения секреторной функции поджелудочной железы и микрофлоры кишечника у цыплят родительских форм и гибридов мясных кур
- Torok V.A., Hughes R.J., Mikkelsen L.L., Perez-Maldonado R., Balding K., MacAlpine R., Percy N.J., Ophel-Keller K. Identification and characterization of potential performance-related gut microbiotas in broiler chickens across various feeding trials. Appl. Environ. Microbiol., 2011,77(17): 5868-5878 ( ) DOI: 10.1128/AEM.00165-11
- Sun H., Tang J.W., Yao X.H., Wu Y.F., Wang X., Feng J. Effects of dietary inclusion of fermented cottonseed meal on growth, cecal microbial population, small intestinal morphology, and digestive enzyme activity of broilers. Trop. Anim. Health. Prod., 2013, 45: 987-993 ( ) DOI: 10.1007/s11250-012-0322-y
- Stanley D., Denman S.E., Hughes R.J., Geier M.S., Crowley T.M., Chen H., Haring V.R., Moore R.J. Intestinal microbiota associated with differential feed conversion efficiency in chickens. Appl. Microbiol. Biotechnol., 2012, 96: 1361-1369 ( ) DOI: 10.1007/s00253-011-3847-5
- Scupham A.J. Campylobacter colonization of the Turkey intestine in the context of microbial community development. Appl. Environ. Microbiol., 2009, 75(11): 3564-3571 ( ) DOI: 10.1128/AEM.01409-08
- Alemka A., Whelan S., Gough R., Clyne M., Gallagher M.E., Carrington S.D., Bourke B. Purified chicken intestinal mucin attenuates Campylobacter jejuni pathogenicity in vitro. J. Med. Microbiol., 2010, 59: 898-903 ( ) DOI: 10.1099/jmm.0.019315-0
- Callaway T.R., Edrington T.S., Anderson R.C., Harvey R.B., Genovese K.J., Kennedy C.N., Venn D.W., Nisbet D.J. Probiotics, prebiotics and competitive exclusion for prophylaxis against bacterial disease. Anim. Health. Res. Rev., 2008, 9: 217-225 ( ) DOI: 10.1017/S1466252308001540
- Kerr A.K., Farrar A.M., Waddell L.A., Wilkins W., Wilhelm B.J., Bucher O., Wills R.W., Bailey R.H., Varga C., McEwe S.A. A systematic review-meta-analysis and meta-regression on the effect of selected competitive exclusion products on Salmonella spp. prevalence and concentration in broiler chickens. Prev. Vet. Med., 2013, 111: 112-125 ( ) DOI: 10.1016/j.prevetmed.2013.04.005
- Brisbin J.T., Gong J., Orouji S., Esufali J., Mallick A.I, Parvizi P., Shewen P.E., Sharif S. Oral treatment of chickens with lactobacilli influences elicitation of immune responses. Clin. Vaccine Immunol., 2011, 18: 1447-1455 ( ) DOI: 10.1128/CVI.05100-11
- Шкурин А. Пребиотический эффект НПС-ферментов. Животноводство России, 2016, 12: 18-20.
- Ленкова Т.Н., Егорова Т.А., Манукян В.А., Фисинин В.И., Егоров И.А., Лаптев Г.Ю., Никонов И.Н., Ильина Л.А., Йылдырым Е.А., Филипова В.А., Новикова Н.И. Сравнительная оценка влияния пробиотиков дрожжевой и бактериальной природы на продуктивность и микрофлору кишечника цыплят-бройлеров. Птица и птицепродукты, 2016, 6: 39-42.
- Svihus B., Choct M., Classen H.L. Function and nutritional roles of the avian caeca: a review. World´s Poultry Science Journal, 2013, 69: 249-263 ( ) DOI: 10.1017/S004393391300028
- Qaisrani S.N., Van Krimpen M.M., Kwakkel R.P., Verstegen M.W.A., Hendriks W.H. Dietary factors affecting hindgut protein fermentation in broilers: a review. World´s Poultry Science Journal, 2015, 71: 139-159 ( ) DOI: 10.1017/S0043933915000124
- Zdunczyk Z., Jankowski J., Kaczmarek S., Juskiewicz J. Determinants and effects of postileal fermentation in broilers and turkeys. Part 1: Gut microbiota composition and its modulation by feed additives. World´s Poultry Science Journal, 2015, 71: 37-47 ( ) DOI: 10.1017/S0043933915000045
- Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы. Молекулярно-генетические методы определения микрофлоры кишечника/Под ред. В.И. Фисинина. Сергиев Посад, 2013.
- Батоев Ц.Ж. Фотометрическое определение активности протеолитических ферментов в поджелудочной железе, соке по уменьшению концентрации казеина. Сб. науч. тр. Бурятского СХИ (Улан-Удэ), 1971, 25: 122-126.
- Mikhailova A.G., Khairullin R.F., Demidyuk I.V., Kostrov S.V., Grinberg N.V., Burova T.V., Grinberg V.Y., Rumsh L.D. Cloning, sequencing, expression, and characterization of thermostability of oligopeptidase B from Serratia proteamaculans, a novel psychrophilic protease. Protein Expression and Purification, 2014, 93: 63-76.
- Кырылив Б.Я., Гунчак А.В. Активность гидролитических ферментов органов пищеварительного тракта кур в онтогенезе. Вестник Сумского национального аграрного университета, 2016, 5: 170-174.
- Стрельцов В.А., Ткачева Н.С. Постинкубационное развитие поджелудочной железы у яичных кур. Вестник Брянской ГСХА, 2012, 5: 25-29.
- Сомова О.В. Морфометрические показатели экзокринного отдела поджелудочной железы кур в разные возрастные периоды. Ученые записки УО ВГАВМ, 2012, 48(1): 142-145.
- Егоров И.А., Вертипрахов В.Г., Ленкова Т.Н., Манукян В.А., Грозина А.А., Егорова Т.А. Возрастные изменения панкреатических ферментов в организме цыплят-бройлеров. Птицеводство, 2017, 2: 23-29.
- Вертипрахов В.Г., Грозина А.А., Долгорукова А.М. Активность ферментов поджелудочной железы у цыплят-бройлеров на разных этапах пищеварения. Сельскохозяйственная биология, 2016, 51(4): 509-515 ( ) DOI: 10.15389/agrobiology.2016.4.509rus
- Buzała M., Janicki B., Czarnecki R. Consequences of different growth rates in broiler breeder and layer hens on embryogenesis, metabolism and metabolic rate: а review. Poultry Sci., 2015, 94(4): 728-733 ( ) DOI: 10.3382/ps/pev015
- Hermans D., Pasmans F., Messens W., Martel A., Van Immerseel F., Rasschaert G., Heyndrickx M., Van Deun K., Haesebrouck F. Poultry as a host for the zoonotic pathogen Campylobacter jejuni. Vector Borne Zoonotic Dis., 2012, 12: 89-98 ( ) DOI: 10.1089/vbz.2011.0676
- Seys S.A., Sampedro F., Hedberg C.W. Assessment of meat and poultry product recalls due to Salmonella contamination: product recovery and illness prevention. J. Food Prot., 2017, 12: 1288-1292 ( ) DOI: 10.4315/0362-028X.JFP-16-424


