Временные факторы, влияющие на эффективность и переносимость применения статинов: научные и практические аспекты
Автор: Гиляревский С.Р.
Журнал: Евразийский кардиологический журнал @eurasian-cardiology-journal
Рубрика: Обзор
Статья в выпуске: 3, 2018 года.
Бесплатный доступ
В статье рассматриваются современные подходы к анализу эффективности вмешательств в зависимости от времени, т.е. от продолжительности периода после начала их применения. Обсуждается роль анализа кривых Каплана-Мейера для оценки эффектов сравниваемых вмешательств в зависимости от времени. Рассматриваются различные варианты взаимного расположения кривых Каплана-Мейера в ходе выполнения исследования. Приводятся результаты недавно выполненного анализа, посвященного оценке продолжительности периода между началом приема статинов и развитием клинических преимуществ терапии. В том числе обсуждается возможность использования показателя продолжительности периода до развития преимуществ (ППРП) вмешательства и показателя продолжительности периода до развития вреда (ППРВ), обусловленного вмешательством, при принятии клинического решения об обоснованности выбора определенного метода лечения, в частности показателя ЧБНЛ. Приводятся мнения, подчеркивающие важность оценки эффективности вмешательств с помощью абсолютного, а не относительного риска развития неблагоприятных клинических исходов. Рассматриваются клинические ситуации, в которых имеет особое значение продолжительность периода до развития клинического эффекта, в частности у больных с очень высоким риском развития осложнений сердечно-сосудистых заболеваний (например, после острого коронарного синдрома) и у больных, у которых в большинстве случаев ограничена продолжительность жизни. Подчеркивается роль применения аторвастатина в клинических ситуациях, при которых имеет значение более раннее достижение клинических преимуществ гиполипидемической терапии. Приводятся данные о роли применения статинов, в частности аторвастатина, в ранние сроки после развития острого коронарного синдрома.
Временные факторы, кривые каплана-мейера, аторвастатин, сердечно-сосудистые заболевания
Короткий адрес: https://sciup.org/143165158
IDR: 143165158
Текст научной статьи Временные факторы, влияющие на эффективность и переносимость применения статинов: научные и практические аспекты
Анализ кривых Каплана–Мейера как подход к оценке эффективности терапии
Современная эффективная клиническая практика во многом зависит не только от клинического опыта врача, но и от навыков поиска и оценки доказательной информации, позволяющей выбрать оптимальную тактику лечения. Такая тактика может быть определена только в ходе выполнения достаточно крупных и хорошо спланированных рандомизированных клинических исследований (РКИ). Анализ кривых выживаемости, построенных с использованием метода Каплана-Мейера, стал одним из основных подходов к оценке частоты развития неблагоприятных исходов в современных клинических исследованиях.
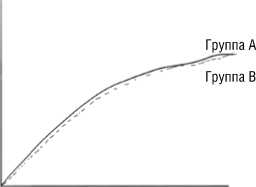
Может быть несколько вариантов «поведения» таких кривых [1]. Такие кривые могут не расходиться в течение всего периода исследования (рисунок 1А), что будет свидетельствовать об отсутствии различий между эффективностью и/или безопасностью сравниваемых вмешательств. Такие кривые могут расходиться, что будет указывать на различие между группами по эффективности и/или безопасности. Причем в таких случаях может быть несколько вариантов. После раннего расхождения такие кривые могут продолжать расходиться (рисунок 1Б) или могут идти параллельно (рисунок 1В). Если вмешательство со-
Рисунок 1А
Число участников с исходом, %
Продолжительность наблюдения, годы
Рисунок 1В
Число участников с исходом, %
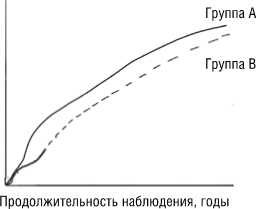
Рисунок 1Б
Число участников с исходом, %
Группа А
Группа В
Продолжительность наблюдения, годы
Рисунок 1Г
Число участников с исходом, %
Группа А
Группа В
Продолжительность наблюдения, годы
Рисунок 1. Варианты взаимного расположения кривых Каплана— Мейера в ходе выполнения клинического исследования провождается увеличением риска развития неблагоприятных исходов в ранние сроки после вмешательства (например, увеличение риска развития инсульта в ранние сроки после коронарного шунтирования), то в последующем, после раннего расхождения кривых, они будут сходиться. Такая ситуация может быть и при наличии преимуществ вмешательства, которое со временем утрачивается (рисунок 1Г). Например, при включении в исследование очень тяжелых больных, на каком-то этапе наблюдения такое схождение кривых выживаемости становится практически неизбежным [2].
Напомним, что в 1958 г. Эдвард Каплан и Пауль Мейер опубликовали статью [3], в которой рассматривался подход к анализу незавершенных наблюдений. В последующем кривые Каплана-Мейера и расчет данных о выживаемости стал стандартным подходом к оценке различий по продолжительности периода до развития определенного клинического исходов (times-to-event), особенно в тех случаях, когда не все участники исследования продолжают наблюдаться до окончания исследования. Кривые «выживаемости» не оценивают актуарную выживаемость (т.е. частоту развития смертельных исходов в целом), но отражают продолжительность периода до развития любого изучаемого клинического исхода (не только
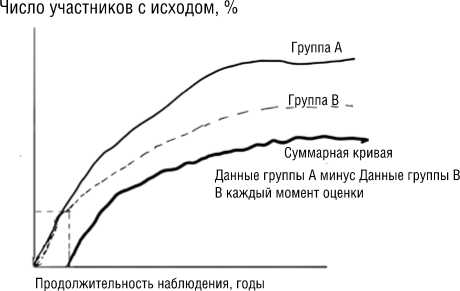
Рисунок 2. Пример построения суммарной кривой для определения момента начала эффекта вмешательства (с помощью вычитания из данных группы сравнения данных для группы вмешательства)
смерти от всех или определенных причин, но и таких исходов, как, например, инфаркта миокарда или инсульта).
При анализе кривых Каплана-Мейера особый интерес представляет момент, когда кривые начинают расходиться. Считается, что продолжительность периода от начала наблюдения до этого момента соответствует продолжительности периода до развития преимуществ (ППРП) изучаемого вмешательства по сравнению с контролем. В литературе, опубликованной на английском языке, такой термин обозначают, как «time to benefit» (TTB). Точнее под термином ППРП понимают продолжительность периода до выявления преимуществ изучаемого вмешательства по сравнению с контролем [4]. Сходно для момента, с которого начинают выявляться вредные последствия изучаемого вмешательства по сравнению с контролем, носит название продолжительность периода до развития вреда — ППРВ («time to harm» – TTH) в группе изучаемого вмешательства по сравнению с контролем [4].
Эксперты выделяют 3 причины, по которым оценка таких временных показателей (ППРП и/или ППРВ) может быть полезной [5]. Во-первых, такие показатели могут предоставлять информацию о наиболее вероятных механизмах действия определенного метода лечения. Например, если применение гиполипидемического препарата, применяемого для снижения концентрации холестерина (ХС) липопротеинов низкой плотности (ЛПНП), приводит к снижению риска развития осложнений сердечно-сосудистых заболеваний (ССЗ) до выявления статистически значимого снижения концентрации ХС ЛПНП, можно предположить, что механизм действия препарата обусловлен не только снижением уровня липидов в крови, но и другими, так называемыми плейотропными, эффектами [6].
Во-вторых, показатель ППРП может быть важным ориентиром при решении вопроса об обоснованности и сроках прекращения клинического исследования в связи невозможностью выявить различия между эффективностью сравниваемых вмешательств [7]. Следует напомнить, что в ходе выполнения 3 крупных РКИ по сравнительной оценке гипо-липидемических препаратов по сравнению с плацебо (правастатина по 40 мг в исследовании CARE — Cholesterol and Recurrent Events [8]; гемфиброзила по 1200 мг в сутки в исследовании VA-HIT — Veterans Affairs High-Density Lipoprotein Cholesterol Intervention Trial [9] и исследования HOPE-3 — Heart Outcomes Prevention Evaluation 3 [10]) кривые Каплана-Мейера, отражающие выживаемость без изучаемых клинических исходов, не расходились в течение 2-3 лет, но в целом в ходе дальнейшего наблюдения были отмечены статистически значимые положительные эффекты приема таких гиполипи-демических средств по сравнению с плацебо. Так что иногда требуется терпение для того, чтобы дождаться клинического эффекта исследуемого препарата.
В-третьих, считается, что показатель ППРП и/или ППРВ и их соотношение можно учитывать при решении вопроса о применении определенного вмешательства у больных пожилого возраста, у которых имеется много сопутствующих заболеваний и ограниченная продолжительность жизни [4]. В таких случаях лечение будет бесполезно, если ППРП будет превышать предполагаемую продолжительность жизни больного. Например, профилактика развития осложнений ССЗ за счет приема аспирина начинается в течение первых 5 лет после начала применения и сохраняется в течение всего периода терапии [11]. В то же время профилактика развития рака прямой и толстой кишки достигается через 5-10 лет после начала ежедневого приема, но, учитывая длительный латентный период, для выявления преимуществ может потребоваться 10-20 лет. В таких случаях у лиц пожилого возраста с относительно небольшой предполагаемой продолжительностью жизни преимущества приема аспирина могут быть недостаточными вследствие большой ППРП. В то же время, ППРВ вследствие увеличения риска кровотечений может быть небольшой. Предлагалось использовать ППРП для определения приоритетов при назначении лекарственной терапии у лиц пожилого возраста с большим числом сопутствующих заболеваний, у которых часто имеется полифармакотерапия [12-14].
Показатель продолжительности периода до развития преимуществ в структуре подходов к оценке эффективности вмешательств
Современные методологические подходы к оценке эффектов терапии стали широко применяться с 60-х годы ХХ века. Были усовершенствованы и приняты статистические методы, которые позволяли выявлять преимущества и/или недостатки применения препаратов для лечения и профилактики ССЗ, которые были установлены в ходе выполнения крупных РКИ. Стандартными подходами к подтверждению преимуществ применения определенных вмешательств стали снижение относительного риска (СОР) и статистическая значимость [15]. Позднее при выполнении анализа данных, полученных в контролируемых исследованиях лекарственных препаратов, стали включать данные о размере наблюдаемого эффекта, т.е. указание в первую очередь снижения абсолютного риска (САР), а не СОР, а также рекомендовали рассчитывать показатель ЧБНЛ (числа больных, которых необходимо лечить определенным препаратом в течение определенного периода для предотвращение 1 неблагоприятного исхода). В литературе, опубликованной на английском языке, такой показатель обозначают как NNT («number needed to treat»). Показатель ЧБНЛ реципрокно отражает САР [16]. Показатель ЧБНЛ должен быть указан для определенного периода, но основное внимание обращают на выраженность эффекта, а не на продолжительность периода, в течение которого был такой эффект. Показатель ППРП связан с показателем ЧБНЛ, но в большей степени отражает вероятность реализации установленных, статистически значимых и клинически значимых положительных (или отрицательных) эффектов в течение периода, который можно соотнести с оставшейся продолжительностью жизни больного.
Очевидно, что показатель ППРП может иметь значение при оценке эффективности вмешательства у пациентов 2 групп: 1) у лиц с очень высоким риском развития осложнений ССЗ, обусловленных атеросклерозом, включая больных с острым коронарным синдромом (ОКС) и/или лиц, имеющих 10-летний расчетный риск развития инфаркта миокарда или инсульта более 20%; 2) у лиц очень пожилого возраста, у которых имеется ограниченная продолжительность жизни.
Что касается лиц очень пожилого возраста, то необходимость оценки показателя ППРП касается случаев назначения статинов с целью первичной профилактики, так как с целью вторичной профилактики статины применяют независимо от возраста и предполагаемой продолжительности жизни. Учитывая противоречивые мнения по поводу применения статинов в такой ситуации, остановимся несколько подробнее на проблеме использования статинов у лиц такой возрастной категории с целью первичной профилактики.
Применение статинов с целью первичной профилактики у лиц пожилого и очень пожилого возраста
В целом в мире существенно увеличивается доля лиц старше 65 лет [17]. У лиц 65 лет предполагаемая продолжительность жизни в экономически развитых странах составляет >20 лет у женщин и >17 лет у мужчин [18]. Распространенность КБС в США к 2030 г. увеличится на 40% ( ≈ 5 млн. человек) только за счет изменения демографии. Это приведет к увеличению прямых затрат на 198% ( ≈ $70 млрд.). Такие данные должны служить основанием для увеличения доли здоровых лиц пожилого возраста [19, 20]. В настоящее время клинические рекомендации по применению статинов с целью первичной профилактики в целом не основаны на строгих научных доказательствах, но в большинстве из них с классом рекомендаций I или IIа считается обоснованным использование препаратов, относящихся к такому классу, у большинства лиц 65 лет [2125]. Следует отметить, что клинические рекомендации существенно варьируют по предоставлению тактики оценки риска развития осложнений ССЗОА у лиц старше 65 лет, результаты которой могут стать основанием для применения статинов с целью первичной профилактики. Так, в европейских рекомендациях возможность оценки риска ограничена возрастом 65 лет, в американских — 75 годами и в рекомендациях, принятых в Соединенном Королевстве — 85 годами.
Более определенный ответ на вопрос о тактике применения статинов с целью первичной профилактики у лиц пожилого возраста может быть получен в ходе выполнения крупного (n=18 000) РКИ STAREE (STAtin Therapy for Reducing Events in the Elderly). Цель данного исследования состоит в проверке гипотезы о том, приведет ли прием статина по сравнению с плацебо к увеличению выживаемости в целом и выживаемости без инвалидности у здоровых лиц пожилого возраста (70 лет и старше). Окончание исследования предполагается в декабре 2022 г. В любом случае, в целом большинство экспертов согласны в необходимости использования статинов с целью первичной профилактики у многих очень пожилых лиц. И в такой ситуации данные о ППРП могут играть роль в выборе статина в связи с необходимостью более быстрого достижения эффекта в таких случаях из-за ограниченной продолжительности жизни у очень пожилых лиц.
Продолжительность периода до развития преимуществ в исследованиях гипохолестеринемических препаратов
К настоящему моменту выполнено более 20 крупных рандомизированных контролируемых двойных слепых исследований по оценке эффективности применения статинов; причем в большинстве из них отмечена статистически значимая эффективность, оцениваемая по основному показателю частоты развития неблагоприятных исходов. В некоторых из таких РКИ эффекты приема статина сравнивали с плацебо [8, 26-38], а в других сравнивали эффективность применения разных статинов или разных доз статинов одного и того же статина [39-41]. Кроме того, были выполнены исследования, подтверждающие эффективность применения гипохолестеринемических препаратов, которые относятся к другим классам (холестирамин, гемфиброзил, эзетимиб, эволокумаб алирокумаб и анацетра-пиб) [9, 42-47].
В ходе выполнения анализа, результаты которого недавно были опубликованы, показатель ППРП оценивали при визуальной оценке кривых Каплана-Мейера, отражающих частоту развития неблагоприятных исходов, включенных в основные показатели, которые были получены в РКИ гиполипидеми-ческих препаратов [5]. В целом в 24 РКИ ППРП варьировала между 1 и 36 мес. (в среднем 13,1 мес.); причем в РКИ по сравнительной оценке статинов с плацебо (n=14) средняя ППРП составляла 11,1 мес., а во всех РКИ статинов в целом (n=17) 10,3 мес. В РКИ по оценке эффектов других гипохо-лестеринемических препаратов средняя ППРП достигала 20 мес. (n=7). Следует отметить, что в обоих исследованиях (EINSTEIN и ODYSSEY) по оценке эффектов применения ингибиторов фермента пропротеинконвертазы субтилизин/кексин 9-го типа (proprotein convertase subtilisin/kexin 9 — PCSK9) ППРП составляло 12 мес. [45, 46].
В ходе выполнения анализа кривых Каплана-Мейера для основного показателя для каждого РКИ строили суммарную кривую с помощью вычитания из данных группы сравнения данных для группы вмешательства (рис. 2). Точка пересечения суммарной кривой с осью X (осью абсцисс), отражающей продолжительность периода наблюдения в ходе исследований, соответствовала точке достижения ППРП для каждого РКИ. Естественно, что такой анализ позволял рассчитать лишь приближение к ППРП, так как в него включали кривые Каплана-Мейера, построенные для отдельных исследований в целом, но не индивидуальные данные об участниках исследований. С целью уменьшения искажений в анализ было включено только 15 из 24 РКИ.
По мнению авторов анализа [5], на выявленные различия по ППРП могло повлиять несколько факторов, включая такие как: 1) число развившихся неблагоприятных исходов, включенных в основной показатель, которое завесит как от объема выборки, так и от частоты развития неблагоприятных исходов; 2) исходная концентрация ХС ЛПНП; 3) выраженность снижения ХС ЛПНП; 4) показания к применению статинов (например, такие, как первичная профилактика ССЗ, коронарная болезнь сердца (КБС) со стабильным течением; вторичная профилактика после перенесенного ОКС); 5) особенность применяемого препарата (статины или гиполипидемические средства, отличные от статинов).
Очевидно, что преимущества в группе лечения не проявятся до тех пор, пока не разовьется хотя бы несколько неблагоприятных исходов. Число неблагоприятных исходов зависит от числа больных, у которых имеется риск развития изучаемого исхода (объем выборки) и частоты развития такого исхода. Например, в ходе выполнения исследования, в котором разовьется 200 исходов в течение первых 6 мес., имеется более высокая вероятность раннего выявления преимуществ по сравнению с исследованием, в котором за такой же период разовьется только 20 исходов.
С другой стороны, можно предполагать, что имеется связь между выраженностью снижения концентрации ХС ЛПНП и степенью снижения риска развития осложнений ССЗ. В ходе выполнения анализа результатов РКИ статинов было установлено, что снижение уровня ХС ЛПНП в крови на каждый 1 ммоль/л соответствует СОР развития осложнений ССЗ на 22% [48]. В ходе выполнения исследований статинов по сравнению с исследованиями гиполипидемических препаратов, не относящихся к классу статинов, при снижении концентрации ХС ЛПНП на каждый 1 ммоль/л в течение первого года СОР осложнений ССЗ составляло 9%, а в последующие годы – на 22-28% [48]. В целом можно предполагать, что чем более выражено снижение числа неблагоприятных исходов, тем меньше будет ППРП. Однако результаты анализа графиков свидетельствовали о слабой связи между такими показателями [5].
Исходную концентрацию ХС ЛПНП также теоретически можно рассматривать как фактор, влияющий на ППРП. Для каждого определенного относительного снижения концентрации ХС ЛПНП в процентах абсолютное снижение уровня ХС ЛПНП будет увеличиваться с увеличением исходной концентрации ХС ЛПНП, т.е. более высокий исходный уровень ХС ЛПНП будет сопровождаться более выраженным его абсолютным снижением. Очень высокий исходный уровень ХС ЛПНП отмечался в исследовании LRC-CPPT (Lipid Research Clinics Coronary Primary Prevention Trial) [42] и исследовании 4S (Scandinavian Simvastatin Survival Study) [26]. Однако ни в одном из них ППРП не был особенно коротким. После получения результатов исследования 4S по этическим соображениям стали считать нецелесообразным оставлять без лечения больных с таким высоким уровнем ХС ЛПНП. Учитывая, что оба указанных исследования завершились с положительным результатом, можно считать, что ППРП не связан с исходным ХС ЛПНП.
Характеристики участников исследования, вероятно, могут влиять на ППРП. В когорте больных с ОКС частота развития неблагоприятных исходов существенно выше по сравнению с когортой больных со стабильным течением КБС. Более высокая частота таких исходов в ранние сроки после рандомизации могла бы быть прогностическим фактором меньшей ППРП.
Применение статинов может оказывать положительные эффекты в ранние сроки после начала их приема за счет положительного влияния на несколько патофизиологических звеньев заболевания у больных с ОКС, включая такие, как дисфункция эндотелия, воспаление, реактивность тромбоцитов и повышенная свертываемость крови [6, 49]. Распространено мнение о том, что прием статинов у таких больных оказывает положительное влияние на риск развития осложнений ССЗ в ранние сроки после начала их применения именно за счет таких механизмов. В связи с этим следует напомнить, что в ходе выполнения крупного РКИ IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) [44] по оценке эффективности добавления эзетимиба по сравнению с плацебо к симвастатину у больных, недавно перенесших ОКС, ППРП не была короткой, т.е. применение гиполипидемического препарата, не относящегося к классу статинов, не сопровождалось более ранним началом клинического эффекта. Известно, что в отсутствие ОКС ППРП была сходной у лиц без установленного диагноза КБС и у больных со стабильным течением КБС. В ходе выполнения исследований статинов с целью первичной профилактики ППРП варьировало в очень широком диапазоне от 1 до 30 мес. [33, 35].
Ну и наконец, наиболее сложный и важный вопрос: зависит ли ППРП от того, какой конкретно препарат применяется для снижения концентрации ХС ЛПНП? Имеющиеся доказательные данные позволяют предположить о правомочности гипотезы о влиянии приема конкретного статина на ППРП.
Результаты анализа, выполненного P.J. Barter и D.D. Waters [5], свидетельствуют о том, что в целом в 17 РКИ статинов ППРП в среднем составляла 10,3 мес., в то время как в 7 РКИ гиполипидемических препаратов, относящихся к другим классам, она в среднем достигала 20 мес. Результаты раздельного анализа РКИ, в которых изучались разные статины, указывали на то, что при применении аторвастатина ППРП была меньше по сравнению с использованием других статинов. В ходе выполнения 6 РКИ по оценке эффективности применения аторвастатина ППРП в среднем составляла лишь 4,75 мес., в то время как в 11 РКИ по оценке эффекта других статинов ППРП достигала в среднем 13,4 мес.
Почему прием аторвастатина мог сопровождаться меньшей ППРП? Ранее возможные факторы, определяющие снижение ППРП, указывались в данной статье. Имеются данные о том, что при метаболизме аторвастатина образуются активные метаболиты, которые действуют как антиоксиданты и оказывают благоприятное влияние на липопротеины [50-52]. Наличие сопоставимых по таким эффектам метаболитов не отмечено [5]. В частности имеются данные экспериментальных исследований, свидетельствующие о том, что только активные метаболиты аторвастатина специфически подавляют окисление мелких плотных частиц ХС ЛПНП [51].
Следует отметить, что обсуждаемый анализ имеет ряд ограничений. В частности в момент расхождения кривых Каплана-Мейера различия между группами в большинстве случаев не достигали уровня статистической значимости и, за одним исключением [6], авторы включенных в анализ РКИ не рассчитывали, в какой момент различия между группами становились статистически значимыми. Причем нужно помнить о том, что при выявлении статистической значимости различий между группами исследование могло прекращаться досрочно [30, 33]. Кроме того, определение точки расхождения могло, по крайней мере, отчасти определяться субъективными факторами и изменяться в зависимости от графического представления результатов РКИ. В частности, при представлении на графике преимущественно интересующей области возможного расхождения кривых изменялись результаты установления точки расхождения кривых [44].
Следует также отметить, что показатель ППРП нельзя считать единственным показателем эффективности исследуемого препарата, так как большое значение имеет и продолжительность сохранения достигнутого эффекта. Установлено, что применение статинов сопровождается продолжением увеличения эффекта даже после прекращения исследования, которое отмечалось даже спустя 20 лет после рандомизации [53]. Однако такая закономерность отмечается не для всех препаратов, применяемых для лечения ССЗ. Например, преимущества применения b -блокаторов после перенесенного инфаркта миокарда в отсутствие сердечной недостаточности представляется сомнительной [54].
Доказательные данные, свидетельствующие о важности достижения раннего эффекта статинов у больных с острым коронарным синдромом
Необходимость достижения быстрого эффекта статинов у больных с ОКС можно проиллюстрировать данными, полученными в ходе выполнения исследований, результаты которых подтверждают быструю стабилизацию атеросклеротической бляшки после применения интенсивных режимов приема статинов. К таким исследованиям можно отнести РКИ EASY-FIT [55] и ESCORT [56]. В ходе выполнения данных исследований с помощью оптической когерентной томографии было установлено, что применение более интенсивного режима приема статина по сравнению с менее интенсивным у больных с нестабильной стенокардией приводит к увеличению толщины покрышки атеросклеротической бляшки, что указывает на более выраженную ее стабилизацию.
Очевидно, что наиболее изученным статином у больных с ОКС остается аторвастатин, эффективность которого была подтверждена в ходе выполнения исследования MIRACL (Myocardial Ischemia Reduction with Acute Cholesterol Lowering)
[28] и особенно исследования PROVE IT–TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy–Thrombolysis in Myocardial Infarction 22) [39]. Применение аторвастатина по 80 мг в сутки у больных с ОКС по этой причине остается «золотым стандартом» гиполипидемической терапии в такой ситуации.
Нельзя точно ответить на вопрос, могут ли более выраженные плейотропные эффекты аторвастатина обусловливать, по крайней мере, отчасти меньшую по сравнению с приемом других статинов ППРП в ходе выполнения РКИ. Однако можно предполагать, что именно плейотропные эффекты связаны с более ранним влиянием на прогноз. Установлено, что у больных, недавно перенесших ОКС, отмечается более высокая экспрессия матриксной металлопротеиназы (ММП) 1-го типа мембран, которая считается важным фактором дестабилизации АБ [57, 58].
В ходе выполнения небольшого РКИ, включавшего 83 больных с ОКС, были получены данные о том, что прием аторвастатина по сравнению с розувастатином приводил к статистически значимому снижению ММП мембран 1-го типа и ММП 9-го типа, несмотря на одинаковое снижение концентрации ХС ЛПНП [59]. Результаты такого исследования позволяют предполагать, что аторвастатин оказывает дополнительное действие, направленное на стабилизацию АБ, которое зависит не только от влияния на уровень ХС ЛПНП в крови, а также, что статины могут различаться по выраженности плейотроп-ных эффектов. Учитывая результаты достаточно крупного недавно завершившегося исследования SECURE-PCI (Statins Evaluation in Coronary Procedures and Revascularization), можно предполагать, что для клинической реализации эффектов раннего начала использования высокой дозы аторвастатина при ОКС требуется более 30 дней [60].
ЗАКЛЮЧЕНИЕ
Таким образом, недавно выполненный анализ позволил получить данные о том, что ППРП при применении статинов, по данным РКИ, варьирует в достаточно широком диапазоне. В то же время можно предполагать отсутствие статистически значимой связи между ППРП и исходной концентрацией ХС ЛПНП или выраженностью ее снижения за счет приема статинов. Кроме того, в исследованиях, включавших больных с ОКС, отмечалось раннее развитие клинического эффекта вследствие преимуществ приема статинов, не связанных только с влиянием на уровень ХС ЛПНП в крови. В целом ППРП при использовании статинов была меньше, чем при применении гиполипидемических препаратов, не относящихся к классу статинов. Причем ППРП была меньше при приеме аторвастатина (препарат Липримар, производимый компанией Пфайзер) по сравнению с применением других статинов. В то же время в ходе выполнения РКИ новых гиполипидеми-ческих препаратов преимущества терапии могут начать выявляться раньше, чем через 1-2 года после начала терапии.
Список литературы Временные факторы, влияющие на эффективность и переносимость применения статинов: научные и практические аспекты
- Malkin C.J., Channer K.S. Life-saving or life-prolonging? Interpreting trial data and survival curves for patients with congestive heart failure. Eur J Heart Fail 2005;7:143-148.
- Swedberg K., Kjekshus J., Snapinn S. Long-term survival in severe heart failure in patients treated with enalapril. Ten year follow-up of CONSENSUS I. Eur Heart J 1999;20:136-139.
- Kaplan E.L., Meier P. Nonparametric estimation from incomplete observations. Journal of the American Statistical Association. 1958;53:457-481.
- Holmes H.M., Min L.C., Yee M., et al. Rationalizing prescribing for older patients with multimorbidity: considering time to benefit. Drugs Aging 2013;30:655-666. doi: 10.1007/s40266-013-0095-7.
- Barter P.J., Waters D.D. Variations in time to benefit among clinical trials of cholesterol-lowering drugs. J Clin Lipidol 2018 Apr 21 DOI: 10.1016/j.jacl.2018.04.006
- Ray K.K., Cannon C.P., McCabe C.H., et al. Early and late benefits of high-dose atorvastatin in patients with acute coronary syndromes: results from the PROVE IT-TIMI22 trial. J Am Coll Cardiol 2005;46:1405-1410.
- Hart R.G., Sharma M., Mundl H., et al. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med 2018;378:2191-2201. doi: 10.1056/NEJMoa1802686].
- Sacks F.M., Pfeffer M.A., Moye L.A., et al. The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Trial investigators. N Engl J Med 1996;335:1001-1009.
- Rubins H.B., Robins S.J., Collins D., et al. Gemfibrozil for the secondary prevention of coronary heart disease in men with low levels of high-density lipoprotein cholesterol. N Engl J Med 1999;341:410-418.
- Yusuf S., Lonn E., Pais P., et al. Blood-Pressure and Cholesterol Lowering in Persons without Cardiovascular Disease. N Engl J Med 2016;374:2032-2043 DOI: 10.1056/NEJMoa1600177
- Bibbins-Domingo K.; U.S. Preventive Services Task Force. Aspirin Use for the Primary Prevention of Cardiovascular Disease and Colorectal Cancer: U.S. Preventive Services Task Force Recommendation Statement. Ann Intern Med 2016;164:836-845 DOI: 10.7326/M16-0577
- Holmes H.M., Hayley D.C., Alexander G.C., Sachs G.A. Reconsidering medication appropriateness for patients late in life. Archives of internal medicine. 2006;166:605-609.
- Scott I.A., Gray L.C., Martin J.H., Mitchell C.A. Minimizing inappropriate medications in older populations: a 10-step conceptual framework. Am J Medicine 2012;125:529-537. e4.
- Stevenson J., Abernethy A.P., Miller C., Currow D.C. Managing comorbidities in patients at the end of life. BMJ (Clinical research ed) 2004;329:909-912.
- A proposal for structured reporting of randomized controlled trials. The Standards of Reporting Trials Group. JAMA 1994;272:1926-1931.
- Schulz K.F., Altman D.G., MoherD. CONSORT2010 statement: updated guidelines for reporting parallel group randomized trials. Annals of Internal Medicine 2010;152:726-732.
- Fuster V. Changing demographics: a new approach to global health care due to the aging population. J Am Coll Cardiol 2017;69:3002-3005.
- Kontis V., Bennett J.E., Mathers C.D., et al. Future life expectancy in 35 industrialised countries: projections with a Bayesian model ensemble. Lancet 2017;389:1323-1335.
- Odden M.C., Coxson P.G., Moran A, et al. The impact of the aging population on coronary heart disease in the United States. Am J Med 2011;124:827-833.e5.
- Heidenreich P.A., Trogdon J.G., Khavjou O.A., et al. Forecasting the future of cardiovascular disease in the United States: a policy statement from the American Heart Association. Circulation 2011;123:933-944.
- Stone N.J., Robinson J.G., Lichtenstein A.H., et al. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults. J Am Coll Cardiol 2014;63:2889-2934.
- National Clinical Guideline Centre. Lipid modification: cardiovascular risk assessment and the modification of blood lipids for the primary and secondary prevention of cardiovascular disease. National Institute for Health and Care Excellence (NICE) July 2014.
- Anderson T.J., Gre goire J., Pearson G.J., et al. 2016 Canadian Cardiovascular Society Guidelines for the Management of Dyslipidemia for the Prevention of Cardiovascular Disease in the Adult. Can J Cardiol 2016;32:1263-1282.
- Bibbins-Domingo K., Grossman D.C., Curry S.J., et al. Statin use for the primary prevention of cardiovascular disease in adults: US Preventive Services Task Force Recommendation Statement. JAMA 2016; 316:1997-2007.
- Catapano A.L., Graham I., De Backer G., et al. 2016 ESC/EAS guidelines for the management of dyslipidaemias. Eur Heart J 2016;37:2999-3058.
- Scandinavian Simvastatin Survival Study Group. Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344:1383-1389.
- Ridker P.M., Danielson E., Fonseca F.A.H., et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 2008;359:2195-2207.
- Schwartz G.G., Olsson A.G., Ezekowitz M.D., et al. Effect of atorvastatin on early recurrent ischemic events in acute coronary syndromes. The MIRACL study: a randomized controlled trial. JAMA 2001;285:1711-1718.
- Shepherd J., Cobbe S.M., Ford I., et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995;333:1711-1718.
- Colhoun H.M., Betteridge D.J., Durrington P.N., et al. Primary prevention of cardiovascular disease with atorvastatin in type 2 diabetes in the Collaborative Atorvastatin Diabetes Study (CARDS): multicenter randomised placebo-controlled trial. Lancet 2004;364:685-696.
- Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002;360:7-22.
- Downs J.R., Clearfield M., Weiss S., et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels. Results of AFCAPS/TexCAPS. JAMA 1998;279:1615-1622.
- Sever P.S., Dalho F.B., Poulter N.R., et al. Prevention of coronary and stroke events with atorvastatin in hypertensive patients who have average or lower-than-average cholesterol concentrations, in the Anglo-Scandinavian Cardiac Outcomes Trial -Lipid Lowering Arm (ASCOT-LLA): a multicenter randomised controlled trial. Lancet 2003;361:1149-1158.
- The Long-Term Intervention with Pravastatin in Ischaemic Heart Disease (LIPID) Study Group. Prevention of cardiovascular events and death with pravastatin in patients with coronary heart disease and a broad range of initial cholesterol levels. N Engl J Med 1998;339:1349-1357.
- Yusuf S., Bosch J., Dagenais G., et al. Cholesterol lowering in intermediate-risk persons without cardiovascular disease. N Engl J Med 2016;374:2021-2031.
- Shepherd J., Blauw G.J., Murphy M.B., et al. Pravastatin in elderly individuals at risk of vascular disease (PROSPER): a randomized controlled trial. Lancet 2002;360:1623-1630.
- Nakamura H., Arakawa K., Itakura H., et al. Primary prevention of cardiovascular disease with pravastatin in Japan (MEGA Study): a prospective randomised controlled trial. Lancet 2006;368:1155-1163.
- Baigent C., Landray M.J., Reith C., et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet 2011;377:2181-2192.
- Cannon C.P., Braunwald E., McCabe C.H., et al. Intensive versus moderate lipid lowering with statins in acute coronary syndromes. N Engl J Med 2004;350:1495-1504.
- LaRosa J.C., Grundy S.M., Waters D.D., et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005;352:1425-1435.
- Pedersen T.R., Faergeman O., Kastelein J.J.P., et al. Highdose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction. The IDEAL study: a randomized controlled trial. JAMA 2005;294:2437-2445.
- Lipid Research Clinics Program. The Lipid Research Clinics Coronary Primary Prevention Trial results. JAMA 1984;251:35-64.
- Frick M.H., Elo O., Haapa K., et al. Helsinki Heart Study: Primary prevention trial with gemfibrozil in middle-aged men with dyslipidemia. N Engl J Med 1987;317:1237-1245.
- Cannon C.P., Blazing MA, Giugliano R.P., et al. Ezetimibe added to statin therapy for acute coronary syndromes. N Engl J Med 2015;372:2387-2397.
- Sabatine M.S., Giugliano R.P., Keech A.C., et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017;376:1713-1722.
- Steg P.G. ODYSSEY Outcomes trial, presented March 10, 2018, at the American College of Cardiology Annual Scientific Sessions, http://www.acc.org/latest-in-cardiology/articles/2018/03/05/15/53/sat-9am-odyssey-outcomes-cv-outcomes-with-alirocumab-after-acs-acc-2018, accessed April 6,2018.
- The HPS3/TIMI55-REVEAL Collaborative Group. Effects of anacetrapib in patients with atherosclerotic vascular disease. N Engl J Med 2017;377:1217-1227.
- Collins R., Reith C., Emberson J., et al. Interpretation of the evidence for the efficacy and safety of statin therapy. Lancet 2016;388:2532-2561.
- Waters D.D. Cholesterol lowering: should it continue to be the last thing we do? Circulation 1999;99:3215-3217.
- Mason R.P., Walter M.F., Day C.A., et al. Active metabolite of atorvastatin inhibits membrane cholesterol domain formation by an antioxidant mechanism. J Biol Chem 2006;281:9337-9345.
- Jacob R.F., Walter M.F., Self-Medlin Y., et al. Atorvastatin active metabolite inhibits oxidative modification of small dense low-density lipoprotein. J Cardiovasc Pharmacol 2013;62:160-166.
- Mason R.P., Sherratt S.C.R, Jacob R.F. Eicosapentaenoic acid inhibits oxidation of apoB-containing lipoprotein particles of different size in vitro when administered alone or in combination with atorvastatin active metabolite compared with other triglyceride-lowering agents. J Cardiovasc Pharmacol 2016;68:33-40.
- Ford I., Murray H., McCowan C., Packard C.J. Long-term safety and efficacy of lowering low-density lipoprotein cholesterol with statin therapy. 20-year follow-up of West of Scotland coronary prevention study. Circulation 2016;133:1073-1080.
- Waters D.D., Bangalore S. The evolution of myocardial infarction: when the truths we hold to be self-evident no longer have evidence. Can J Cardiol 2017;33:1209-1211.
- Komukai K., Kubo T., Kitabata H., et al. Effect of atorvastatin therapy on fibrous cap thickness in coronary atherosclerotic plaque as assessed by optical coherence tomography: the EASY-FIT study. J Am Coll Cardiol 2014;64:2207-2217 DOI: 10.1016/j.jacc.2014.08.045
- Nishiguchi T., Kubo T., Tanimoto T., et al. Effect of Early Pitavastatin Therapy on Coronary Fibrous-Cap Thickness Assessed by Optical Coherence Tomography in Patients With Acute Coronary Syndrome: The ESCORT Study. JACC Cardiovasc Imaging 2018;11:829-838. doi: 10.1016/j. jcmg.2017.07.011.
- Ogita M., Miyauchi K., Morimoto T., et al. Association between circulating matrix metalloproteinase levels and coronary plaque regression after acute coronary syndrome-subanalysis of the JAPAN-ACS study. Atherosclerosis 2013;226:275-280 DOI: 10.1016/j.atherosclerosis.2012.10.063
- Ylä-Herttuala S., Bentzon J.F., Daemen M., et al. Stabilisation of atherosclerotic plaques. Position paper of the European Society of Cardiology (ESC) Working Group on atherosclerosis and vascular biology. Thromb Haemost 2011;106:1-19 DOI: 10.1160/TH10-12-0784
- Uzui H., Nakano A, Mitsuke Y,et al. Comparison of lipophilic and hydrophilic statins on atheroma stabilizing effects in hypercholesterolemic patients. Presented at: European Society of Cardiology Congress 2010. August 28-September 1,2010; Stockholm, Sweden. Abstract P5565.
- Berwanger O., Santucci E.V., de Barros e Silva P.G.M., et al. Effect of Loading Dose of Atorvastatin Prior to Planned Percutaneous Coronary Intervention on Major Adverse Cardiovascular Events in Acute Coronary Syndrome: The SECURE-PCI Randomized Clinical Trial. JAMA 2018;319:1331-1340 DOI: 10.1001/jama.2018.2444


