Врожденные пороки сердца лечение послеоперационного стерномедиастинита у детей до 1 года
Автор: Сойнов Илья Александрович, Войтов А.В., Кулябин Ю.Ю., Иванцов С.М., Галстян М.Г., Зубрицкий А.В., Омельченко А.Ю., Архипов А.Н., Горбатых Ю.Н., Лейкехман А.В., Струнин О.В., Богачев-прокофьев А.В.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Врожденные пороки сердца
Статья в выпуске: 4 т.23, 2019 года.
Бесплатный доступ
Цель. Оценить результаты лечения стерномедиастинита с использованием вакуумной терапии и проточно-промывного дренирования у пациентов первого года жизни. Методы. В одноцентровое ретроспективное исследование включены 69 пациентов со стерномедиастинитом с 2008 по 2018 г. Пациенты разделены на две группы: вакуумной терапии (англ. Vacuum assisted closure, VAC) и проточно-промывного дренирования. После выполнения propensity score matching пациенты разделены по 25 человек в каждой группе. Результаты. Возраст, пол, масса тела, площадь поверхности тела, RACHS-1, операции с искусственным кровообращением, хирургический диастаз грудины были сопоставимы между группами после propensity score matching. Госпитальная летальность была у 8 (32%) пациентов в группе проточно-промывного дренирования, в то время как в группе VAC ни одного летального случая не было, p = 0,004. Среднее время искусственной вентиляции легких при проведении процедуры в группе VAC составило 79 (28; 176) ч, в группе проточно-промывного дренирования - 154 (24; 356) ч, p = 0,38. Ранняя экстубация была только в группе VAC у 8 (32%) пациентов, p = 0,028. Реме-диастинит был у 1 (4%) в группе VAC и у 8 (32%) пациентов в группе проточно-промывного дренирования, p = 0,01. Единственным фактором риска ремедиастинита являлась группа проточно-промывного дренирования, которая увеличивала отношение шансов в 13,9 раза. Средний срок пребывания в стационаре после лечения медиастинита составил 14 (10; 30) дней в группе VAC и 23 (18; 33) дня в группе проточно-промывного дренирования, p = 0,045. Заключение. VAC-терапия обладает положительными результатами, включая низкую госпитальную летальность и частоту ремедиастенитов, по сравнению с проточно-промывным дренированием, у пациентов с медиастинитом первого года жизни.
Ремедиастинит, сепсис, стерномедиастинит
Короткий адрес: https://sciup.org/142230714
IDR: 142230714 | DOI: 10.21688/1681-3472-2019-4-53-62
Текст научной статьи Врожденные пороки сердца лечение послеоперационного стерномедиастинита у детей до 1 года
В детской кардиохирургии доступ к сердцу, как правило, выполняют из срединной стернотомии. Несмотря на большое количество кардиохирургических операций, частота инфекционных осложнений средостения невысока и варьирует от 0,4 до 6,0% [1, 2], однако лечение острых и хронических ран средостения остается проблемой здравоохранения из-за высокой летальности (от 14 до 47%) и дорогостоящего лечения [2]. В отличие от взрослых пациентов [3], в педиатрической популяции нет единого протокола лечения медиастинита [1]. Из-за небольшого числа случаев стерномедиастинита у новорожденных и младенцев не было попыток разработать альтернативные методы лечения, кроме тех, которые созданы для взрослых пациентов. Новорожденные и младенцы, имеющие раневую инфекцию средостения, представляют особую группу пациентов, которая отличается незрелостью всех систем организма, включая иммунную, поэтому хирургические вмешательства должны быть максимально щадящими [1]. Некоторые авторы для минимизации хирургических вмешательств предлагают использовать проточно-аспирационное дренирование антисептическими растворами, указывая на хорошие результаты [4]. Однако частая реинфекция сопровождается высоким риском инвалидности и летальности, что заставило искать альтернативные способы лечения [5]. В 1997 г. L.C. Argenta и соавт. впервые применили вакуумную терапию (англ. Vacuum assisted closure, VAC) для лечения гнойных ран у взрослого пациента [6]. В настоящее время вакуумная терапия является «золотым стандартом» в лечении стерномедиастинита у взрослых пациентов, в то время как данные по детям первого года жизни в кардиохирургической практике по-прежнему противоречивы.
Целью нашего исследования являлось сравнение двух методов лечения стерномедиастинита — проточно-аспирационного дренирования и VAC-терапии — у детей до 1 года.
Методы
Настоящее одноцентровое ретроспективное исследование проведено в Национальном медицинском исследовательском центре имени академика Е.Н. Мешалкина. С января 2008 г. по март 2018 г. в отделении врожденных пороков сердца выполнено хирургическое лечение медиастинита 69 (1,48%) из 3 985 пациентов (рис. 1).
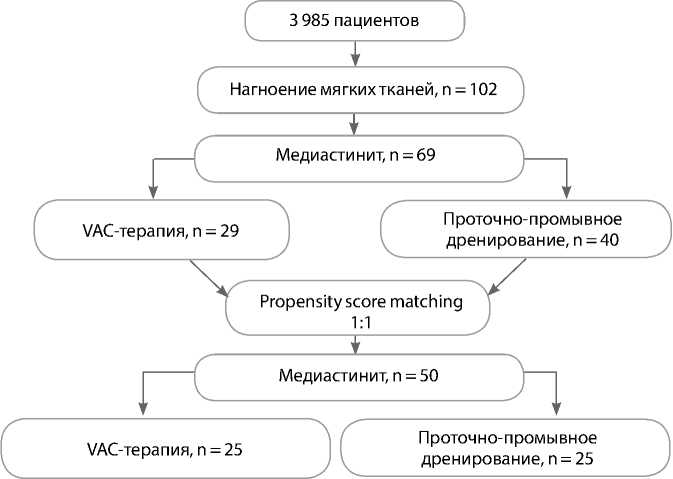
Рис. 1. Дизайн исследования
Пациенты разделены на две группы: проточноаспирационное дренирование (n = 34; 57,6%) и VAC-терапия (n = 25; 42,4%). Критериями включениями были пациенты до 1 года с врожденным пороком сердца, операция которым выполнялась из стерно-томного доступа.
Степень почечной дисфункции оценивалась по классификации pRIFLE [7].
Диагноз «медиастинит» устанавливался на основании клинических данных: лихорадка более 3 дней (выше 37,5 °С), лейкоцитоз в общем анализе крови, положительный прокальцитониновый тест (более 2 нг/мл), гиперемия или нагноение послеоперационного шва (у всех пациентов), симптомы патологического движения грудины («щелчок» при дыхании и «клавиши пианино» при пальпации грудины). При выявлении 2 и более симптомов выполнялась мультиспиральная компьютерная томография: при жидкости в ретростернальном пространстве окончательно устанавливался диагноз «медиастинит».
Диагноз «медиастинит» подтверждался при наличии гноя в ретростернальном пространстве и положительных результатах при бактериальных посевах. Диагноз «распространенный медиастинит» устанавливался при вовлечении всего перикардиального пространства гноем [8].
Тяжесть основного заболевания и метода коррекции оценивали с использованием классификации Risk Adjustment in Congenital Heart Surgery версии 1 (RACHS-1) [9].
Этический комитет НМИЦ им. ак. Е.Н. Мешалкина рассмотрел и утвердил данное исследование.
Хирургические детали
Всем пациентам с медиастинитом проведена срочная хирургическая ревизия для оценки грудины. Инфицированные и некротизированные ткани удаляли и промывали 10% раствором повидона-йо-да в разведении 1 к 30.
VAC-терапия
Проточно-промывное дренирование
Два силиконовых дренажа диаметром 4 мм (ЗАО НПП «МедИнж», Пенза, Россия) установлены в переднее средостение: приточный дренаж — в верхнюю часть, а отточный — в нижнюю. Выполнялась стернометаллография с помощью хирургической стали. Мягкие ткани ушивали узловыми швами нитью из полипропилена 5/0 (Premilene, B.Braun, Великобритания). В приточный дренаж подавался теплый раствор 0,1% повидона-йода, разведенный физиологическим раствором 1 к 10. Раствор нагнетался со скоростью 80–100 мл/ч с помощью инфузомата. Отделяемая жидкость из отточного дренажа ежедневно отправлялась на бактериологическое исследование. Основными критериями для удаления дренажей были стерильные посевы в течение 2 дней подряд и менее 30 лейкоцитов при микроскопическом исследовании.
Антибактериальная терапия
Перед операцией все пациенты получали однократно болюсно дозу цефуроксима 100 мг/кг, в течение двух суток — ту же дозировку цефурок-сима 3 раза в день. После диагностирования медиастинита назначался меропенем 30 мг/кг внутривенно 3 раза в день. Лечение меропенемом продолжалось до получения положительных бактериологических посевов. После этого антибактериальную терапию корректировали в соответствии с бактериальной чувствительностью. Антибактериальная терапия была одинаковой в группах VAC-терапии и проточно-промывного дренирования.
Статистический анализ
Анализ данных хирургического лечения проводился с помощью программы Stata 13 (StataCorp LP, College Station, США). Проверка гипотезы о нормальности распределения признаков выполнялась с помощью критерия Шапиро – Уилка. Непрерывные данные представлены в виде медианы и межквартильного интервала (25-й; 75-й процентили), категориальные — в виде чисел и процентов. Различия между группами сравнивались с использованием критерия Фишера для категориальных переменных и U-критерия Манна – Уитни для непрерывных переменных. Анализ propensity score matching использовался для уменьшения влияния смещения выборки и потенциального смешения пациентов. С помощью многофакторного логистического регрессивного анализа для каждого пациента выполнена псевдорандомизация с определением вероятности применения проточнопромывного дренирования у пациента. Базовые переменные, использованные при псевдорандомизации: возраст, пол, масса тела, площадь поверхности тела, RACHS-1, операции с искусственным кровообращением, хирургический диастаз грудины. Методика propensity score matching выполнена с применением алгоритма nearest neighbor matching с калипером 0,2 и с использованием сопоставления 5 к 1 при соотношении случай – контроль 1:1. Баланс между переменными до и после сопоставления оценивался в единицах стандартизированного смещения в процентах. Стандартизированные различия (d) изучены для оценки баланса между переменными до и после сопоставления. Тест Мак-Немара использовался для сравнения категориальных переменных, парный t-тест — для непрерывных переменных с нормальным распределением. Результат логистического регрессивного анализа выражен в виде отношения шансов с 95% доверительным интервалом (95% ДИ). Принятый уровень значимости р<0,05.
Таблица 1 Базовые характеристики пациентов до propensity score matching
|
Показатель |
Группа VAC-терапии, n = 29 |
Группа проточно-промывного дренирования, n = 40 |
d |
p |
|
Вес, кг |
4,9 (3,1; 6,2) |
4,3 (3,3; 5,9) |
18,5 |
0,11 |
|
Рост, см |
53 (49; 65) |
57 (50; 67) |
0,09 |
|
|
Площадь поверхности тела, м2 |
0,27 (0,20; 0,37) |
0,26 (0,20; 0,34) |
14,6 |
0,14 |
|
Возраст, дни |
97 (8; 167) |
75 (12; 129) |
30,1 |
0,47 |
|
Пол (мужской), n (%) |
19 (65,5) |
18 (45,0) |
27,9 |
0,07 |
|
1-2 (6,9) |
1-5 (12,5) |
-18,7 |
0,44 |
|
|
2-5 (17,2) |
2-8 (20,0) |
-7,0 |
0,77 |
|
|
3-7 (24,2) |
3-9 (22,5) |
3,8 |
0,87 |
|
|
RACHS-1, n (%) |
4-15 (51,7) |
4-18 (45) |
13,3 |
0,58 |
|
5-0 (0) |
5-0 (0) |
|||
|
6-0 (0) |
6-0 (0) |
|||
|
Первичная коррекция, n (%) |
22 (75,8) |
30 (75,0) |
0,58 |
|
|
Операции с ИК, n (%) |
22 (75,8) |
29 (72,5) |
9,5 |
0,48 |
|
Время ИК, мин |
108 (81; 122) |
90 (61; 105) |
0,16 |
|
|
Температура ИК, °C |
27 (25; 33) |
30 (25; 36) |
0,16 |
|
|
Время окклюзии аорты, мин |
53 (33; 69) |
46 (29; 57) |
0,22 |
|
|
Кровопотеря, мл/кг |
11,9 (5,7; 27,4) |
10,3 (6,4; 22,9) |
0,44 |
|
|
Рестернотомия, n (%) |
11 (37,9) |
17 (42,5) |
0,44 |
|
|
Хирургический диастаз грудины, n (%) |
15 (51,7) |
16 (40,0) |
16,4 |
0,15 |
|
Недоношенные, n (%) |
10 (34,5) |
11 (27,5) |
0,36 |
|
|
Новорожденные, n (%) |
12 (41,4) |
16 (40,0) |
0,55 |
Примечание. Представлена медиана (25-й; 75-й процентили) или числовой показатель (%). ИК — искусственное кровообращение
Результаты
Базовые характеристики до propensity score matching представлены в табл. 1.
После анализа propensity score matching в каждой группе отобрано по 25 пациентов (табл. 2).
Медиастинит диагностировался в группе VAC через 13 (10; 15) дней после первичной операции, в группе проточно-промывного дренирования — через 14 (12; 17) дней. При проведении хирургических манипуляций из раны брался бактериологический посев. Спектр выявленных микроорганизмов представлен в табл. 3.
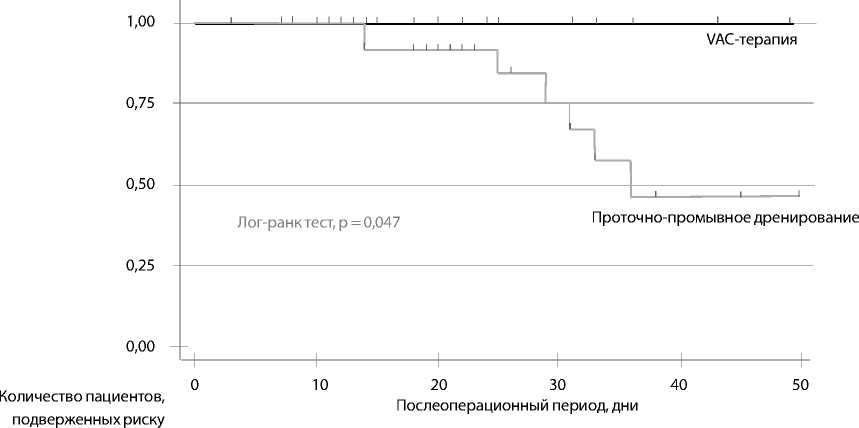
Продолжительность лечения была значительно выше в группе проточно-промывного дренирования — 12 (8; 15) дней по сравнению с 4 (3; 8) днями в группе VAC (p = 0,0001). Госпитальная летальность была у 8 (32%) пациентов в группе проточно-промывного дренирования, в то время как в группе VAC ни одного летального случая не было, p = 0,047 (рис. 2). Среднее время искусственной вентиляции легких при проведении процедуры в группе VAC составило 79 (28; 176) ч, в группе проточно-промывного дренирования — 154 (24; 356) ч, p = 0,38. Ранняя экстубация была только в группе VAC у 8 (32%) пациентов, p = 0,028. Продолжительность лечения в отделении реанимации в группе VAC — 6 (3; 10) дней, в группе проточно-промывного дренирования — 8 (5; 14) дней, p = 0,29. Время антибактериальной терапии составило 11 (8; 21) дней в группе VAC и 16 (12; 30) дней в группе проточно-промывного дренирования, p = 0,22. Осложнения обнаружены у 7 (28%) в группе VAC и у 13 (52%) пациентов группы проточно-промывного дренирования, p = 0,29. Полиорганная недостаточность выявлена в 2 (8%) случаях в группе VAC и в 4 (16%) в группе проточно-промывного дренирования, p = 0,38. Дисфункция почек, требующая заместительной почечной терапии, наблюдалась у 3 (12%) больных группы VAC и у 5 (20%) из группы проточно-промывного дренирования, p = 0,7. Кровотечение име-
Таблица 2 Базовые характеристики пациентов после propensity score matching
|
Показатель |
Группа VAC-терапии, n = 25 |
Группа проточно-промывного дренирования, n = 25 |
d |
p |
|
Вес, кг |
4,6 (4,0; 5,4) |
4,8 (3,2; 6,4) |
7,9 |
0,75 |
|
Рост, см |
59 (56; 63) |
57 (52; 63) |
0,34 |
|
|
Площадь поверхности тела, м2 |
0,26 (0,24; 0,30) |
0,26 (0,21; 0,34) |
6,6 |
0,91 |
|
Возраст, дни |
98 (38; 134) |
100 (8; 134) |
-1,9 |
0,94 |
|
Пол (мужской), n (%) |
16 (64) |
15 (60) |
-8,1 |
0,77 |
|
1-1 (4) |
1-5 (12,5) |
0 |
>0,99 |
|
|
2-4 (16) |
2-8 (20,0) |
0 |
>0,99 |
|
|
3-5 (20) |
3-9 (22,5) |
-9,5 |
0,73 |
|
|
RACHS-1, n (%) |
4-15 (60) |
4-18 (45) |
7,9 |
0,77 |
|
5-0 (0) |
5-0 (0) |
|||
|
6-0 (0) |
1-1 (4) |
|||
|
Первичная коррекция, n (%) |
21 (84) |
23 (92) |
0,66 |
|
|
Операции с ИК, n (%) |
20 (80) |
20 (80) |
0 |
>0,99 |
|
Время ИК, мин |
98 (79; 119) |
87 (61; 107) |
0,55 |
|
|
Температура ИК, °C |
28 (25; 35) |
32 (26; 36) |
0,23 |
|
|
Время окклюзии аорты, мин |
47 (31; 67) |
41 (29; 54) |
0,37 |
|
|
Кровопотеря, мл/кг |
11,6 (5,7; 27,2) |
10,4 (6,40; 22,85) |
0,79 |
|
|
Рестернотомия, n (%) |
10 (40) |
8 (32) |
0,55 |
|
|
Хирургический диастаз грудины, n (%) |
13 (52) |
12 (48) |
0,77 |
|
|
Недоношенные, n (%) |
9 (36) |
6 (24) |
0,35 |
|
|
Новорожденные, n (%) |
10 (40) |
11 (44) |
0,77 |
Примечание. Представлена медиана (25-й; 75-й процентили) или числовой показатель (%). ИК — искусственное кровообращение
Таблица 3 Спектр микроорганизмов, выявленных при бактериологическом посеве
Факторы риска ремедиастинита представлены в табл. 4. Единственным фактором риска ремедиастинита являлась группа проточно-промывного дренирования, которая увеличивала отношение шансов в 13,9 раза.
Средний срок пребывания в стационаре после лечения медиастинита составил 14 (10; 30) дней в группе VAC и 23 (18; 33) дня в группе проточно-промывного дренирования, p = 0,045.
Обсуждение
Среди острых воспалительных процессов у детей особое место занимает острый медиастинит — одно из самых сложных заболеваний органов средостения [10]. Хорошо изучены факторы риска медиастинита, к которым относятся малый возраст, длительное пребывание в отделении реанимации, открытая грудная клетка, цианотический врожденный порок сердца, высокий риск кардиохирургической процедуры, низкое качество обработки операционного поля, недостаточные опыт хирургической команды и качество воздуха в операционной [10–13]. Прогноз заболевания более положильный для педиатрических пациентов, чем для взрослых, однако трудность ранней диагностики, тяжесть течения (особенно когда медиастинит связан с эндокардитом) ведет к длительному пребыванию в больнице, увеличению расходов на лечение и высокой летальности [13]. Существует большое количество сообщений, в которых оценивают частоту медиастинита у новорожденных и младенцев, однако по-прежнему очень мало работ, посвященных оптимальному способу лечения [14].
Таблица 4 Одно- и многофакторный регрессионный анализ для ремедиастинита
|
Показатель |
Однофакторный анализ Многофакторный анализ ОШ (95% ДИ) p ОШ (95% ДИ) p |
|
Вес Группа проточного дренирования Пневмония после первичной операции Сепсис после операции |
0,55 (0,27;0,96) 0,046 11,3 (1,3; 98,9) 0,029 13,9 (1,2; 152,5) 0,031 15,4 (1,7; 136,0) 0,014 24,8 (2,7; 223,3) 0,004 |
Примечание. ОШ — отношение шансов, ДИ — доверительный интервал
VAC-терапия
Проточно-промывное дренирование
Рис. 1. Кривая Каплана – Майера для госпитальной летальности при медиастините
Для всех видов лечения медиастинита существуют 3 основные рекомендации: хирургическая некроэктомия мягких и костных тканей; бактериальные мазки из раны для чувствительности к антибиотикам и внутривенное эмпирическое лечение антибактериальными препаратами [10, 13, 15].
Первым способом лечения медиастинита был открытый способ с помощью повязок [10]. Однако данный способ имел множество недостатков [14] (длительная искусственная вентиляция легких, открытая грудная клетка, частый ремедиастинит и сепсис), что привело к созданию в 1963 г. метода проточно-аспирационного дренирования [16]. Метод проточноаспирационного дренирования, по данным многих авторов, прост в управлении лечения медиастинита, не влияет на гемодинамику у новорожденных, однако из-за большой частоты осложнений, за которыми следовали летальные исходы, продолжен поиск технологии лечения медиастинита [10, 14, 17–19]. После первого опыта лечения медиастинита у взрослых пациентов с помощью отрицательного давления появились первые сообщения в детской хирургии [1, 2, 6]. Несмотря на продемонстрированную эффективность VAC-терапии у младенцев и новорожденных, некоторые авторы отмечают негативное воздействие отрицательного давления на гемодинамику [10, 20, 21]. При лечении стерномедиастинита с помощью как VAC-терапии, так и проточно-промывного дренирования мы не наблюдали негативного влияния давления на гемодинамику и нарушения ритма сердца.
Реинфекция является одним из главных показателей качества лечения при медиастините. Ремедиастинит в нашем исследовании наблюдался в 18%. Наиболее часто манифестацию инфекции средостения (32% случаев) мы наблюдали у пациентов после проточно-промывного дренирования. Похожие данные описывали S. Ugaki и коллеги в исследовании, в котором частота реинфекций достигала 30% [8].
Основным фактором риска реинфекции средостения в нашем исследовании являлась группа проточно-промывного дренирования. Y. Durandy основной причиной ремедиастинита при проточно-промывном дренировании называл остаточные полости средостения, в которых сохранялась инфекция [10]. По мнению других авторов, инфекция могла оставаться в костной ткани грудины и вызывать ремедиастинит [14, 22].
VAC-терапия обеспечивает целостность грудины, снижает частоту рецидивов инфекции средостения и обеспечивает быстрое очищение гнойной раны и развитие грануляционной ткани [21]. По сравнению с традиционными методами лечения, равномерное отрицательное давление, приложенное к ране, приводит к дилатации артериол и увеличению микроциркуляции и, как следствие, концентрации антибактериальных препаратов и иммунных клеток в инфицированных тканях [2]. Путем непрерывного всасывания снижается отек и бактериальная колонизация тканей [2]. Эти положительное влияние на рану способствует быстрой пролиферации грануляционной ткани и ускоренному заживлению ран. Кроме того, воздухонепроницаемый барьер, создаваемый VAC-терапией, предотвращает повторную контаминацию инфекции и ее размножение в ране [2, 20, 21].
Быстрое очищение гнойной раны с помощью VAC-терапии значительно уменьшало в нашем исследовании длительность терапии и средний срок пребывания в стационаре. Как доказано для взрослой популяции пациентов, респираторная поддержка не является необходимой в процессе лечения VAC-терапией, так как стабильность грудной клетки достигается c помощью негативного давления [23, 24]. В нашем исследовании ранняя экстубация была у 32% пациентов группы VAC-терапии, в то время как у всех пациентов с проточно-промывным дренированием требовалась вентиляционная поддержка в связи с тяжестью состояния в течение длительного времени. Однако экстубированные дети с VAC-терапией должны находиться под легкой седацией для снижения риска разгерметизации системы.
Госпитальная летальность в нашем исследовании наблюдалась только в группе проточно-аспирационного дренирования и составляла 32%. Причинами летальности у 5 (16%) пациентов был сепсис и у 3 (12%) пациентов был сепсис в сочетании с полиорганной недостаточностью. Скорее всего, причинами септического состояния пациентов с последующим летальным исходом послужила остаточная инфекция в средостении. Сепсис, как и пневмония, был вторичен на фоне медиастинита.
Еще одним осложнением в нашем исследовании было кровотечение. Кровотечение наблюдалось у 8% пациентов из группы VAC-терапии. Ранее в разных исследованиях описаны кровотечения из-за разрыва правого желудочка и магистральных сосудов [25, 26], поэтому в 2003 г. для уменьшения риска разрывов магистральных сосудов и правого желудочка R.I. Gustafsson и соавт. предложили использовать парафиновую марлю [27]. В нашем исследовании, несмотря на использование парафиновой марли, уложенной в рану в 3 слоя, мы имели 2 случая кровотечения из левой брахиоце- фальной вены. Возможно, неполное прилегание парафиновой марли привело к разрыву левой брахиоцефальной вены. Стенки вен в обоих случаях были ушиты, однако объем кровопотери составил 37 мл/кг в первом и 30 мл/кг во втором случае.
Ограничения
Это исследование имеет ограничения, связанные с ретроспективным и нерандомизированным дизайном. Рандомизированное исследование может предоставить дополнительную информацию, но идеальный дизайн не всегда возможен в клинических условиях по практическим или этическим причинам. Это исследование было частично предвзятым из-за того, что две группы сравнивались в разные периоды времени, однако показало значительное улучшение общей выживаемости пациентов после VAC-терапии. Исследование выполнено в одном центре, что также является ограничением. Малое количество пациентов могло повлиять на результаты.
Заключение
VAC-терапия обладает положительными результатами, включая низкую госпитальную летальность и частоту ремедиастенитов, по сравнению с проточно-промывным дренированием, у пациентов с медиастинитом первого года жизни.
Список литературы Врожденные пороки сердца лечение послеоперационного стерномедиастинита у детей до 1 года
- Иванцов С.М., Сойнов И.А., Омельченко А.Ю., Ничай Н.Р., Кулябин Ю.Ю., Горбатых А.В., Войтов А.В., Горбатых Ю.Н. VAC терапия: новый метод лечение медиастинитов у новорожденных детей. Медицинский альманах. 2016;(2):102-104. DOI: 10.21145/2499-9954-2016-2-102-104
- Filippelli S., Perri G., Brancaccio G., Iodice F.G., Albanese S.B., Trimarchi E., Carotti A. Vacuum-assisted closure system in newborns after cardiac surgery. J Card Surg. 2015;30(2):190-93. DOI: 10.1111/jocs.12463
- Рузматов Т.М., Эфендиев В.У., Бобошко А.В., Малахов Е.С., Несмачный А.С., Разумахин Р.А., Карева Ю.Е., Чернявский А.М. Вакуумная терапия послеоперационного стерномедиастинита. Хирургия. Журнал им. Н.И. Пирогова. 2015;(8);14-17. DOI: 10.17116/hirurgia2015814-17
- Иванцов С.М., Сойнов И.А., Кулябин Ю.Ю., Ничай Н.Р., Войтов А.В., Горбатых А.В., Зубрицкий А.В., Горбатых Ю.Н. Отрицательное давление в терапии раневых инфекционных осложнений после кардиохирургических операций у детей в возрасте до 1 года. Детская хирургия. 2019;23(2):68-71. DOI: 10.18821/1560-9510-2019-23-2-68-71
- Levy I., Ovadia B., Erez E., Rinat S., Ashkenazi S., Birk E., Konisberger H., Vidne B., Dagan O. Nosocomial infections after cardiac surgery in infants and children: incidence and risk factors. J Hosp Inf. 2003;53(2):111-6. PMID: 12586569. DOI: 10.1053/ihin.2002.1359


