Введение разных сортов Muscari botryoides L. в культуру in vitro
Автор: Вельмяйкин Иван Николаевич, Мокшин Евгений Владимирович, Лукаткин Александр Степанович
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Физиология растений и животных
Статья в выпуске: 3-4, 2013 года.
Бесплатный доступ
В статье раскрывается влияние стерилизующих растворов на инфицированность экс-плантов для двух сортов луковичных растений; выявляется, что применение ступенчатой стерилизации обеспечивает максимальный процент выхода стерильного материала для обоих сортов.
Экспланты, стерилизация, срок изоляции, инфицированность
Короткий адрес: https://sciup.org/14720048
IDR: 14720048 | УДК: 581.1:
Текст научной статьи Введение разных сортов Muscari botryoides L. в культуру in vitro
Среди декоративных многолетников луковичные и клубнелуковичные цветочно-декоративные растения с каждым годом приобретают все большее значение в промышленном цветоводстве и озеленении. Однако при размножении традиционным способом невозможно получить большое количество посадочного материала в короткие сроки. Поэтому реальная возможность обогатить рынок – это воспользоваться достижениями и знаниями в области биотехнологии растений [7; 8]. Использование технологий клонального микроразмножения позволяет значительно сократить сроки выращивания до товарного стандарта [4; 5]. Размножая какой-либо новейший сорт луковичных растений, можно вырастить несколько миллионов луковичек за один год, и, дорастив их в течение 2–3 лет, получить качественный посадочный материал. При обычных методах размножения для этого понадобилось бы около 20 лет [4].
Muscari botryoides L. – декоративное луковичное растение семейства Liliaceae, цветки миниатюрные, бочонковидные, с короткими белыми зубчиками, собраны в плотную многоцветковую кисть длиной 5–10 см на прямостоячем стебле [1; 2]. Соцветия мускари напоминают соцветия гиацинта, отчего его иногда называют «мышиный гиацинт». Окраска цветков густого синего с фиолетовым оттенком цвета. Обладает легким, приятным ароматом. Цветочная
масса плотная, очень насыщена цветом; цветочная поверхность горизонтальная, кружевного рисунка. Цветет обильно в конце апреля-мае, до 28 дней [3; 6]. В настоящее время для быстрого размножения Muscari прибегают к биотехнологическим методам, которые являются наиболее успешными. В литературе имеются данные по клональному микроразмножению Muscari, но в последнее время появляется все больше сортов, сведения по которым довольно противоречивы [9; 10].
Целью данной работы было выявить оптимальные сроки изоляции эксплантов из луковиц и изучить действие стерилизующих растворов на инфи-цированность эксплантов. В качестве объектов исследования использовались луковицы двух сортов M. botryoides L. – Альбум и Суперстар. Для введения в культуру in vitro использовали чешуи луковиц, которые стерилизовали в различных растворах (50%-ный Domestos, 6 %-ный хлорамин и 70%-ный спирт) при разных режимах экспозиции. После этого сегменты чешуй помещали на питательную среду по прописи Мурасиге-Скуга дополненную агаром и сахарозой. Пробирки с растениями культивировали 6 недель в условиях непрерывного освещения и комнатной температуры (23–25 °С). Измерения проводили спустя 6 недель после посадки, учитывали жизнеспособность и зараженность фитопатогенами.
Первым этапом введения в культуру in vitro является определение срока изоляции растительного материала. Наши исследования показали, что для всех изучаемых сортов оптимальным сезоном изоляции первичных эксплантов является весна, а период, при котором экспланты характеризуются низкой регенерационной способностью – с октября до конца декабря. Наибольшая регенерационная активность наблюдалась в период с апреля по май. При этом среднее колличество микролуковичек составило: 7 шт./экс-плант у сорта Альбум (рис. 1), 8 шт./ эксплант – у сорта Суперстар (рис. 2).
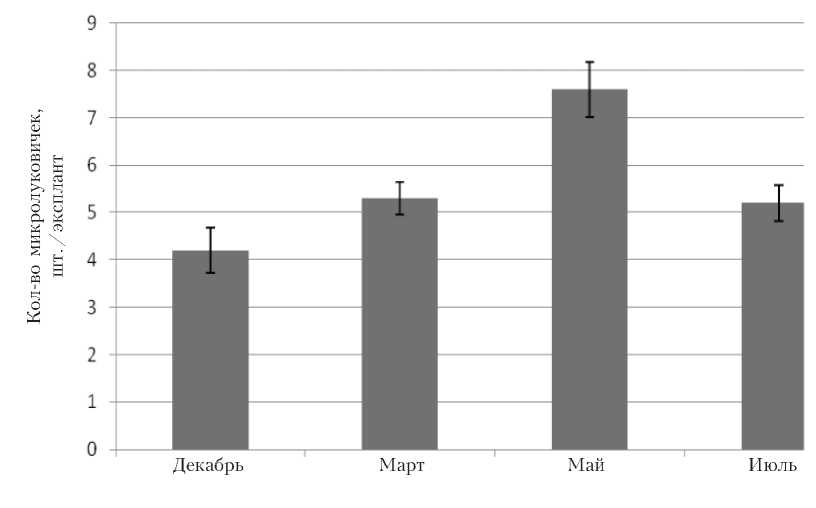
Рис. 1 . Влияние сроков изоляции на формирование микролуковичек в культуре in vitro (сорт Альбум)
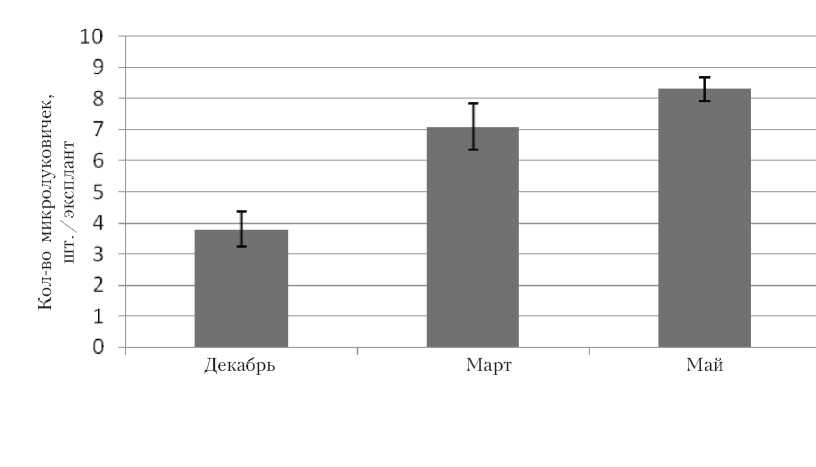
Рис . 2 . Влияние сроков изоляции на формирование микролуковичек в культуре in vitro (сорт Суперстар)
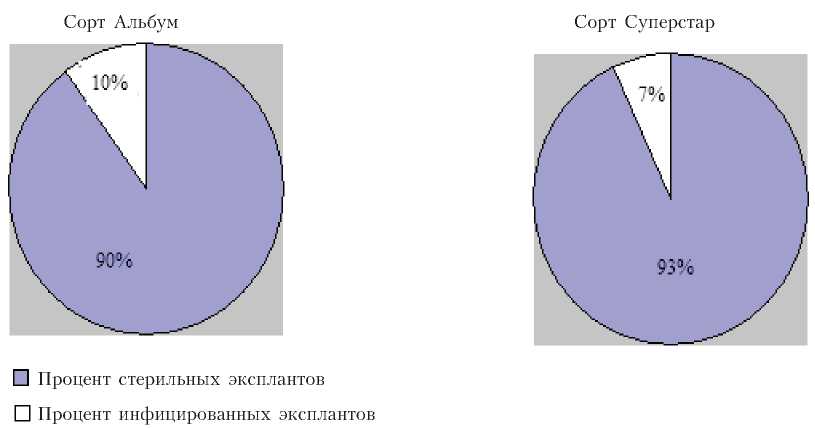
Рис. 3. Режим стерилизации: 6%-ный хлорамин (20 мин), 50%-ный Domestos (25 мин), 70%-ный спирт (2 мин).
Такие различия можно объяснить физиологическим циклом развития растений. Видимо, это связано с различной активностью в луковицах таких гормонов, как ИУК и АБК. Известно, что в период глубокого покоя активность ИУК низкая, а активность АБК – высокая. На этапе вынужденного покоя прослеживалось обратное соотношение. В связи с этим образование регенерантов, в данном случае – луковиц, на одной и той же питательной среде сильно зависело от стадии периода покоя, в которой находились исходные луковицы.
При исследовании различных стерилизующих агентов на инфицированность эксплантов было выявлено, что применение данных растворов по отдельности не дало положительных результатов. При этом наблюдался большой процент эксплантов, зараженных различными фитопатогенами.
Применение поэтапной стерилизации оказалось наиболее эффективным против различных патогенов, что обеспечило наименьшую инфицированность. Большой вклад в степень снижения инфицирован-ности внесло различное время экспозиции в растворе Domestos. Экспланты, перво- начально обработанные 6%-ным хлорамином в течении 20 мин, далее помещались в 50%-ный Domestos (на 10, 20, 25 мин), затем – в 70%-ный спирт на 2 мин. Оказалось, что при 10-минутной экспозиции в растворе Domestos процент инфицированных эксплантов составил 40%, а при 20-минутной – только 20%. Однако наиболее эффективной для подавления сапрофитной микрофлоры оказалась комбинация 6 %-ный хлорамин (20 мин) + 50%-ный Domestos (25 мин) + 70% спирт (2 мин). При этом процент инфицированных эксплантов составил лишь 7–10% (рис. 3).
В ходе исследований посредством ступенчатой стерилизации удалось достичь максимального процента (в среднем 90%) стерильного материала для сортов Альбум и Суперстар.
Таким образом, можно констатировать, что оптимальным сроком для эксплантации данных сортов Мускари является период с апреля по май; применение поэтапной стерилизации 50%-ный Domestos (25 мин) – 6%-ный хлорамин (2 мин) – 70%-ный спирт (2 мин) обеспечивает максимальный выход стерильного материала для обоих сортов.
Список литературы Введение разных сортов Muscari botryoides L. в культуру in vitro
- Вакуленко В. В. Справочник цветовода/В. В. Вакуленко, Е. Н. Зайцева, Т. М. Клевенская. -М.: Колос, 2001. -560 с.
- Володин В. Я. Цветы и другие декоративные растения/В. Я. Володин, В. Г. Шайкин. -М.: Стройиздат, 1999. -560 с.
- Иванова И. В. Приусадебное хозяйство: Декоративное садоводство/И. В. Иванова. -М.: ЭКСМО-Пресс; Лик пресс, 2000. -664 с.
- Лутова Л. А. Биотехнология высших растений: учебник/Л. А. Лутова. -СПб.: Изд-во С.-Петербург. ун-та, 2003. -130 с.
- Родин А. Р. Получение посадочного материала древесных, цветочных и травянистых растений с использованием методов биотехнологии: учеб. пособие/А. Р. Родин, Е. А. Калашникова. -М.: МГУЛ, 2004. -84 с.
- Тавлинова Г. К. Приусадебное цветоводство/Г. К. Тавлинова. -СПб.: Диамант, 1996. -544 с.
- Черенок Л. Цветы: Лукович. и клубнелукович. растения/Л. Черенок. -Минск: Сэр-Вит, 1997. -288 с.
- Юскевич Н. Н. Промышленное цветоводство России/Н. Н. Юскевич, Л. В. Висящева, Т. Н. Краснова. -М.: Росагропромиздат, 1996. -306 с.
- Rybczinski J. J. Engagement of biotechnology in the protection of threatened plant species in Poland/J. J. Rybczinski, A. Mikula//Biodiv. Res. Conserv. -Vol. 3-4. -2006. -P. 361-368.
- Uranbey S. In vitro bulblet regeneration from immature embryos of Muscari azureum/S. Uranbey//African Journal of Biotechnology. -2010. -Vol. 9 (32). -P. 5121-5125.


