Введение редиса и огурца в культуру in vitro
Автор: Егорова И.В., Латюк И.Д., Мокшин Е.В., Лукаткин А.С.
Журнал: Инженерные технологии и системы @vestnik-mrsu
Рубрика: Ботаника и физиология растений
Статья в выпуске: 1, 2009 года.
Бесплатный доступ
Отработана методика получения каллусной ткани огурца и редиса для их внедрения в культуру in vitro. При этом подобран оптимальный состав среды для каллусогенеза на отдельных эксплантах. Выявлено влияние концентраций 2,4-Д и 6-БАП на образо- вание каллуса. Каллусная ткань лучше всего образуется на гипокотиле у огурца и на листьях у редиса, независимо от варианта среды. Получены стабильно растущие кал- лусные линии огурца и редиса.
Короткий адрес: https://sciup.org/14719206
IDR: 14719206
Текст научной статьи Введение редиса и огурца в культуру in vitro
ВВЕДЕНИЕ РЕДИСА И ОГУРЦА
В КУЛЬТУРУ in vitro*И. В. Егорова, И. Д. Латюк,Е. В. Мокшин, А. С. Лукаткин
Отработана методика получения каллусной ткани огурца и редиса для их внедрения в культуру in vitro. При этом подобран оптимальный состав среды для каллусогенеза на отдельных эксплантах. Выявлено влияние концентраций 2,4-Д и 6-БАП на образование каллуса. Каллусная ткань лучше всего образуется на гипокотиле у огурца и на листьях у редиса, независимо от варианта среды. Получены стабильно растущие кал-лусные линии огурца и редиса.
Современный уровень развития биологии и растениеводства немыслим без использования в качестве исходного посадочного материала растений, подготовленных посредством клеточных технологий. Оздоровление растительного материала с помощью технологий in vitro позволяет резко повысить качество посадочного материала без изменений сортовых характеристик [9].
Клональное микроразмножение растений в культуре in vitro позволяет за короткий срок получать большое количество посадочного материала растений [3]. Коэффициенты 1 микроразмножения достигают 105—107 расте-: ний в год, что в несколько тысяч раз больше, i чем при использовании традиционных методов вегетативного размножения. Также клональное микроразмножение значительно ускоряет селекционный процесс, сокращая сроки получения товарной продукции до 2— 3 лет вместо 10—12 [2]. Для проведения работ по клеточной селекции растений в условиях in vitro в качестве объекта исследования могут быть использованы каллусные, суспензион-। ньге культуры или изолированные протопла-| сты [1]. Каллусная ткань представляет собой легкодоступный материал, наиболее часто используемый для клеточной селекции. Обычно работу проводят на первичной или пересадочной каллусной ткани, которая не утрачи-1 вает способности к регенерации на протяжении ряда субкультивирований [8]. Использование каллусной культуры в селекционных целях открывает огромные возможности в создании новых форм растений, несущих : ценные признаки, необходимые для человечества [7].
Определяющим фактором получения кал-лусных культур является соотношение экзогенных гормональных препаратов в питательной среде. Примеры формирования каллусной ткани и регенерации растений из нее показывают большое разнообразие применяемых концентраций и соотношений регуляторов роста. Не существует общей формулы в отношении концентраций гормонов, пригодных для каллусогенеза каждого вида. При этом специальная среда, разработанная, как правило, эмпирически для индукции дифференциации и органообразования у тканей одного вида, совсем не обязательно будет индуктивной в культуре тканей другого вида. Одна из главных причин такой вариабельности в ответе тканей на внешние гормональные факторы лежит в различной способности тканей синтезировать собственные эндогенные фитогормоны [4].
Имеются данные об использовании кал-лусных культур огурца in vitro с использованием различных вариантов сред для каллусогенеза [6]. Однако не вполне понятно, насколько оптимальны использованные ранее варианты сред для каллусогенеза у огурца. По редису данные о переводе в культуру in vitro нам не известны.
Цель данной работы состояла во введении редиса (Raphanus sativus L.) и огурца iCucumis sativus L.) в культуру in vitro. Для ее достижения выполнялись следующие этапы исследования;
-
1) получение стерильных растений;
-
2) получение каллусных тканей из различных эксплантов и их поддержание в культуре in vitro;
Исследование выполнено при поддержке Федерального агентства по образованию (АВЦП «Развитие научного потенциала высшей школы», проект 2.1.1/624).
-
3) эмпирический подбор состава среды для индукции каллусогенеза;
-
4) выявление влияния соотношения регуляторов роста на каллусогенеза
-
5) определение эпигенетических особенностей эксплантов редиса и огурца in vitro.
В качестве объектов исследования были взяты семена огурца и редиса. Сортовые характеристики огурца «единство»: среднеспелый (55 дней), пчелоопыляемый, устойчив к болезням. Производитель: ООО «Агрофирма „Аэлита"». Качество семян проверено и соответствует ГОСТу Р 52171-2005. Редис «красный великан» урожайный, среднеспелый, отличается устойчивостью к неблагоприятным температурным условиям.
Эксперимент включал следующие этапы:
-
1. Проба на прорастание. В чашки Петри помещали по 15 семян (в трехкратной повторности) и проращивали в течение 7 сут.
-
2. Стерилизация семян по схеме: 0,1 % КМпО4 (20 мин) —> 6 % хлорамин (10 мин) —э 70 % спирт (1 мин) —> трехкратное промывание стерильной дистиллированной водой в течение 15 мин.
-
3. Посадка стерильных семян на мостики из фильтровальной бумаги в пробирках со стерильной водой [5] и выращивание стерильных растений в течение 14 дней в лабораторных условиях при температуре 22—25 °C, освещении люминесцентными лампами интенсивностью 2 000 лк, влажности воздуха около 80 %, соотношении периодов,
-
4. Посадка эксплантов на питательную среду для образования каллусной ткани. В качестве эксплантов брали участки семядольных листьев, стебля (гипокотиля), конуса нарастания и корня. Использовали питательную среду Мурасиге — Скуга (МС) с добав
лением регуляторов роста 2,4—дихлорфенок-сиуксусной кислоты (2,4—Д) и 6—бензиламинопурина (6-БАП) в следующих вариантах ко нцентраций:
Первая серия опытов:
I мг / л 2,4-Д и 0,5 мг / л 6-БАП;
-
2 мг / л 2,4-Д и 0,5 мг / л 6-БАП;
-
3 мг / л 2,4-Д и 0,5 мг / л 6-БАП;
-
4 мг / л 2,4-Д и 0,5 мг / л 6-БАП.
Вторая серия опытов:
-
1 мг / л 2,4-Д и 1 мг / л 6-БАП;
-
3 мг / л 2,4-Д и 1 мг / л 6-БАП;
-
4 мг / л 2,4-Д и I мг / л 6-БАП;
-
5 мг / л 2,4-Д и 1 мг / л 6-БАП.
-
5 . Индукция каллусогенеза и выращивание каллусной ткани в термостате при температуре 23 °C.
Во второй серии опытов в среду МС дополнительно добавляли мезоинозит (100 мг / л), глицин (1 мг / л), никотиновую кислоту (0,5 мг / л).
На первом этапе работы с объектом необходимо оценить качество посадочного материала. Определения показали, что всхожесть семян огурца в среднем составила 73,3 %, редиса — 76,0 %. Таким образом, посадочный материал был вполне кондиционным и пригодным для использования. На последующих этапах работы посредством поверхностной стерилизации семян получали стерильные пробирочные растения. Возраст стерильных растений огурца и редиса в пробирках перед эксплантацией на питательную среду составлял 14 дней в первой серии опытов и 30 дней — во второй.
После эксплантации кусочков стериль-, ных растений огурца в первой серии опытов и инкубации чашек Петри с эксплантами в темноте были получены следующие результаты по огурцу (табл. 1).
Таблица I
Каллусогенез на эксплантах огурца in vitro (первая серия опытов)
|
2,4-Д / 6-БАП, мг / л |
Эксплант |
Кол-во эксплантов |
Кол-во эксплантов с каллусом |
Цвет и консистенция каллуса |
|
1 / 0,5 |
семядольные листья |
4 |
1 |
Темно-желтый, зернистый, средней плотности |
|
гипокотиль |
6 |
3 |
То же |
|
|
корнях |
4 |
— |
То же |
|
|
2 / 0,5 |
семядольные листья |
4 |
— |
— |
|
гипокотиль |
5 |
1 |
Темно-желтый, зернистый |
|
|
корнях |
4 |
— |
— |
|
|
4 / 0,5 |
семядольные листья |
2 |
1 |
Темно-желтый, зернистый, средней плотности |
|
гипокотиль |
2 |
2 |
То же |
|
|
корнях |
1 |
— |
Лучше всего каллусогенез на эксплантах огурца шел на среде МС, содержащей 1 мг / л 2,4-Д + 0,5 мг / л 6-БАП (4 экспланта с каллусом); на среде МС, содержащей 4 мг / л 2,4-Д + + 0,5 мг / л 6-БАП, на трех эксплантах образовался каллус; на среде 2 мг / л 2,4-Д + 0,5 мг / л 6-БАП образование каллуса произошло всего лишь на одном экслланте (рис. 1). При сравнении различных эксплантов выявлено, что интенсивнее всего каллусогенез проходил на листьях (4 экспланта), затем на гипокотиле (3 экспланта), а на корнях каллус не образовался совсем. На варианте среды I мг / л 2,4-Д и 0,5 мг/л 6-БАП наблюдались полностью обросшие каллусом желтовато-зеленого цвета, зернистой структуры экспланты редиса (рис. 2). Первыми в чашке начали обрастать экспланты листьев, затем все остальные. После 14 дней инкубирования наблюдался усиленный рост каллуса на эксплантах корней. Образовавшийся каллус полностью покрывал весь эксплант. Экспланты стеблей обрастали каллусом медленнее остальных. При проведении работ с эксплантами редиса во всех вариантах среды наблюдали более интенсивный каллусогенез (табл. 2).
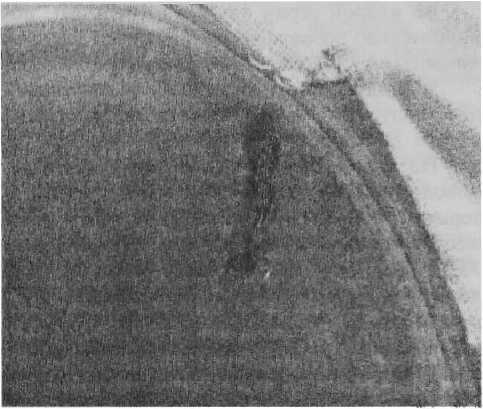
Рисунок /
Каллус на гипокотиле огурца на среде МС с добавлением 2 мг / л 2,4-Д и 0,5 мг / л 6-БАП
Таблица 2
Каллусогенез на эксплантах редиса in vitro (первая серия опытов)
|
2,4-Д / 6-БАП, мг / л |
Эксплант |
Кол-во эксплантов |
Кол-во эксплантов с каллусом |
Цвет и консистенция каллуса |
|
1 / 0,5 |
Семядольные листья |
3 |
3 |
Желтовато-зеленый, зернистый, средней плотности |
|
Гипокотиль |
9 |
6 |
То же |
|
|
Корнях |
7 |
4 |
То же |
|
|
2 / 0,5 |
Семядольные листья |
9 |
8 |
Серый, зернистый |
|
Гипокотиль |
4 |
4 |
Темно-желтый, зернистый |
|
|
Корнях |
7 |
5 |
Темно-коричневый, зернистый |
|
|
4/0,5 |
Семядольные листья |
11 |
И |
Темно-серый, мелкозернистый, средней плотности |
|
Гипокотиль |
3 |
3 |
То же |
|
|
Корнях |
8 |
7 |
То же |
На среде МС с добавлением 1 мг / л 2,4-Д и 0,5 мг/л 6-БАП каллусогенез шел не очень интенсивно; наиболее быстрый рост ткани наблюдали на гипокотилях (рис. 2). На варианте среды МС с добавлением 2 мг / л 2,4-Д и 0,5 мг / л 6-БАП лучший каллусогенез из всех эксплантов наблюдался на семядольных листьях.
Каллус серого цвета, зернистой структуры, плотно покрывающий экспланты (рис. 3). На варианте среды 3 мг / л 2,4-Д и 0,5 мг/л 6- БАП обрастание каллусом отмечено только на начальных этапах, после чего каллус быстро отмирал.
Рисунок 2
Каллусогенез у разных зксплантов редиса на среде МС с добавлением 1 мг / л 2,4-Д и 0,5 мг / л 6-Е АП
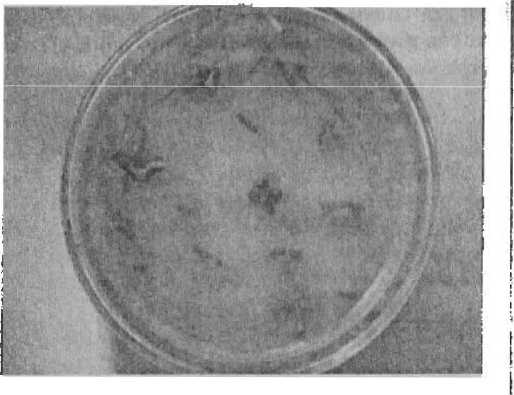
Рисунок 3
Каллусогенез у редиса на среде МС с добавлением 2 мг / л 2,4-Д и 0,5 мг / л 6-БАП
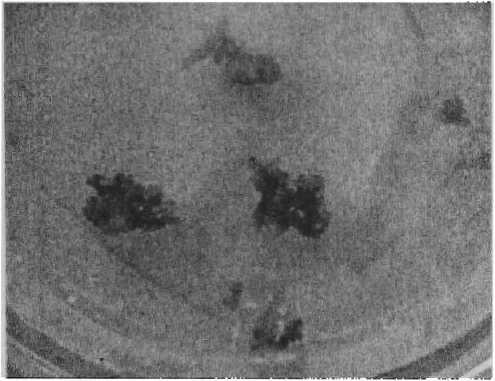
По результатам этого этапа работы наилучшее формирование каллуса на эксплантах редиса наблюдалось на варианте среды с внесением 4 мг / л 2,4-Д и 0,5 мг / л 6-БАП. Возможно, высокое содержание ауксинов способствовало лучшему каллусогенезу, и данное соотношение концентраций регуляторов роста было оптимальным для формирования каллуса. Среди исследованных эксплантов во всех вариантах среды лучше обрастали корни и листья. Непосредственно на листьях образование каллуса было зафиксировано раньше всех остальных эксплантов. Экспланты корня обросли каллусом во всех чашках и во всех вариантах среды.
Во 2-й серии опытов по огурцу были получены несколько иные результаты (табл. 3). Обнаружено, что на корнях каллус образовался только в одном варианте среды (1 мг / л 2,4-Д + 1 мг / л 6-БАП). Значит, данная концентрация регуляторов роста является оптимальной для каллусогенеза на корнях. На всех других эксплантах каллус образовывался на всех вариантах среды независимо от ее состава. В среду дополнительно были добавлены глицин, мезоинозит, никотиновая кислота.
Таблица 3
Каллусогенез на эксплоитах огурца in vitro (2-я серия опытов)
В чашке Петри с концентрацией регуляторов роста 5 мг / л 2,4-Д + 1 мг / л 6-БАП на-
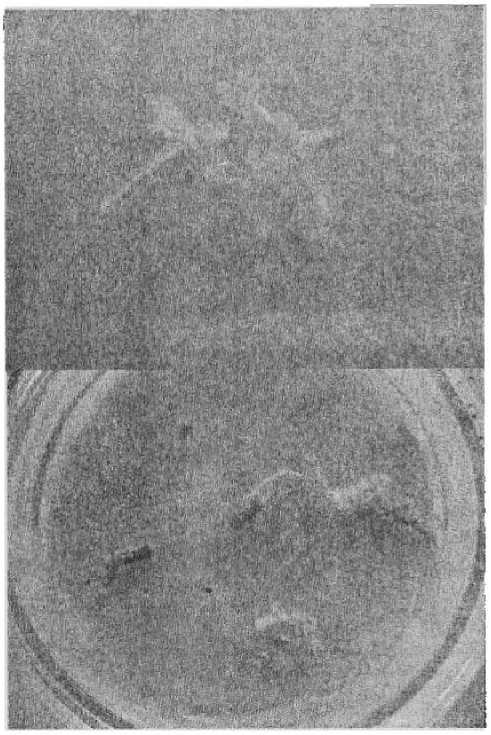
Рисунок 4
Каллусогенез (верхнее фото) и органогенез (нижнее фото) у эксплантов огурца на среде МС с добавлением
5 мг / л 2,4-Д * 1 мг ! л 6-БАП
Во 2-й серии опытов по редису были получены несколько иные результаты (табл. 4). Каллус лучше образовывался в одном варианте среды (1 мг / л 2,4-Д и 4 мг / л б-БАП).
Видимо, данная концентрация регуляторов роста является оптимальной для каллусогене-за. В среду дополнительно были добавлены глицин, мезоинозит, никотиновая кислота.
Каллусогенез
Таблица 4
на эксплантах редиса in vitro (2-я серия опытов)
|
Вариант среды |
Эксплант |
Кол-во эксплантов |
Кол-во эксплантов с каллусом |
Цвет и консистенция каллуса |
|
1 / 1 |
Корни |
4 |
4 |
Светло-серый |
|
1 / 3 |
Гипокотиль |
4 |
4 |
Желто-зеленый |
|
1 / 4 |
Листья |
11 |
8 |
Желто-зеленый |
|
1 / 5 |
Корни |
4 |
4 |
Серый |
1QRI — С fiH— R4
Ж . V ^Z 1 . -_. ■ 1. Г V F I
Список литературы Введение редиса и огурца в культуру in vitro
- Бутенко Р. Г. Изолированные протопласты растений -объект и модель для физиологических исследований/Р. Г. Бутенко//Культура клеток растений. -М.: Наука, 1981. -С. 69-84.
- Бутенко Р. Г. Культура изолированных тканей и физиология морфогенеза растений/Р. Г. Бутенко. -М.: Наука, 1964. -272 с.
- Катаева Н. В. Клональное размножение в культуре ткани. Культура клеток растений/Н. В. Катаева, В. А. Аветисов. -М.: Наука, 1981. -С.13-49.
- Клеточная инженерия/Р. Г. Бутенко, М. В. Гусев, А. Ф. Киркин, Т. Г. Корженевская, Е. Н. Макарова. -М.: Высш. школа, 1987. -127 с.
- Лукаткин А. С. Методические указания к лабораторному практикуму по курсу «Цитология и клеточная инженерия»/А. С. Лукаткин. -Саранск: Изд-во Мордов. ун-та, 1995. -16 с.
- Лукаткин А. С. Использование каллусных культур огурца для изучения холодового повреждения/А. С. Лукаткин//Изв. АН. Сер. Биологическая. -1999. -№ 3. -С. 304-308.
- Лукаткин А. С. Цитология и клеточная инженерия: учеб. пособие/А. С. Лукаткин, А. Н. Дерябин. -Саранск: Изд-во Мордов. ун-та, 1999. -С. 133-185.
- Лукаткин А. С. Холодовое повреждение теплолюбивых растений и окислительный стресс/А. С. Лукаткин. -Саранск: Изд-во Мордов. ун-та, 2002. -208 с.
- Сельскохозяйственная биотехнология/под ред. В. С. Шевелухи. -2-е изд., перераб. и доп. -М.: Высш. школа, 2003. -469 с.


