Введение в культуру и микроклональное размножение жимолости съедобной in vitro
Автор: Хоружева Т.И., Боровая С.А., Богинская Н.Г.
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 1 (75), 2024 года.
Бесплатный доступ
Жимолость съедобная - популярная плодово-ягодная культура. Её лечебные и профилактические свойства обусловлены наличием в плодах высокого содержания биологически активных веществ. В отличие от традиционных способов размножения жимолости, размножение in vitro позволяет получить большое количество качественного посадочного материала в короткие сроки. Исследования проводили на базе лаборатории селекционно-генетических исследований полевых культур ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки. Объект исследования - сорт жимолости Подарок амурчанам селекции Дальневосточного государственного аграрного университета. Стерилизация материала проводилась согласно методическим указаниям ВИР с модификациями. В качестве стерилизующих агентов использовали препараты в следующей последовательности: раствор ПАВ 5%, фунгицид Фундазол, КЭ (1 г/л), свежеприготовленный бытовой отбеливатель АСЕ, разбавленный дистиллированной водой в соотношении 1:9 (0,50% содержание NaOcl в рабочем растворе), 70% этанол. Первичные экспланты пассировали на питательную среду с минеральной основой по Мурасиге-Скуга, содержащую 20 г/л сахарозы и 6 г/л агара (далее - МС), дополненную 6-бензиламино-пурином (БАП) в концентрации 0,5 мг/л. рН среды доводили до 5,7-5,8 с помощью 1 н КОН. Субкультивирование эксплантов в виде микрочеренков с 1-2 междоузлиями осуществляли на питательную среду МС, дополненную БАП 0,5 мг/л. Морфометрические показатели определяли на 35-е сутки культивирования растений. Исследование показало, что стерилизации эксплантов с использованием фундазола 1 г/л и АСЕ, разбавленным дистиллированной водой в соотношении 1:9, позволяет получить достаточное количество жизнеспособных микроклонов (50%). Удаление листовых пластинок при проведении микрочеренкования жимолости приводит к резкому снижению приживаемости и, в большинстве случаев, - к гибели микроклонов (процент гибели 98,7%). Культивирование микрочеренков на МС, дополненной БАП в концентрации 0,5 мг/л, способствует нормальному росту и развитию регенерантов жимолости (среднее значение коэффициента размножения 4,65).
Жимолость, микроклональное размножение, in vitro, морфометрические показатели, fusarium sp
Короткий адрес: https://sciup.org/140304480
IDR: 140304480 | УДК: 634.74:573.6 | DOI: 10.18619/2072-9146-2024-1-55-60
Текст научной статьи Введение в культуру и микроклональное размножение жимолости съедобной in vitro
Оригинальная статья / Original article УДК 634.74:573.6
Р од Жимолость ( Lonicera ) семейства
Жимолостные (Caprifoliaceae) включает около 200 видов, распространенных преимущественно в районах с умеренным климатом [1, 2]. Жимолость съедобная ( Lonicera edulis ) произрастает в Восточной Сибири и на Дальнем Востоке, а также в Корее и Китае. Это популярная плодово-ягодная культура с высоким содержанием биологически активных веществ в плодах. Размножение in vitro , в отличие от традиционных способов размножения жимолости, позволяет получить большое количество качественного посадочного материала в короткие сроки. По данным Н.А. Семеновой (2016) [3], одна введенная в культуру меристема L. edulis продуцирует более тысячи растений в год. Растения жимолости, полученные методом культуры тканей, успешно черенкуются. Как правило, процент укоренения таких черенков близок к 100% [4].
Процесс микроклонального размножения растений начинается с этапа введения в культуру in vitro путем изолирования и стерилизации первичного растительного материала. Это наиболее трудоемкий и затратный процесс, при этом необходимо учитывать сезонность физиологического развития растений [3]. Наиболее эффективен способ введения в культуру L. edulis в фазе выхода из состояния покоя (февраль-апрель), при котором с зимующих растений нарезают черенки и помещают их в светокамеры в сосуды с водой. Отрастающие узлы зеленых однолетних побегов, микрочеренки длиной 15-20 мм, верхушечные и пазушные почки, а также апексы побегов используют для получения первичных эксплантов [5-11].
Отделение экспланта от маточного растения и последующая его стерилизация являются для него двойным стрессом. Поэтому развитие экспланта и начало его быстрой регенерации зависит не только от вида растения и стерилизующего агента, но и от общей методики данного процесса. Обычно стерилизация начинается с промывки эксплантов раствором ПАВ и проточной водой. В дальнейшем поэтапно используют различные фунгициды и стерилизаторы. В качестве стерилизаторов применяют ртутьсодержащие препараты [9-13], растворы гипохлорита натрия или кальция [11-18] и перекиси водорода [19]. При этом нужно отметить, что использование ртутьсодержащих препаратов увеличивает степень стерильности эксплантов, но угнетает их последующее развитие [12,20,21]. Для клонального микроразмножения жимолости в основном используют среду Мурасиге и Скуга с добавлением фитогормонов, обычно 0,5-2 мг/л БАП, иногда дополнительно вводят 0,1-0,2 мг/л ИМК [8,13,17,22]. Имеются также работы по успешному культивированию жимолости на других средах. [14,15,19].
У разных видов и сортов жимолости существуют значительные видовые и сортовые различия по отношению к факторам культивирования in vitro , и эффективность процесса зависит в том числе и от генотипа растений, о чем указывается в работах многих авторов [10,11,13,18,23-26]. В связи с этим введение в культуру in vitro ранее не изученных сортов жимолости является актуальным направлением исследований.
Цель исследований: получение асептической культуры жимолости съедобной сорта Подарок амурчанам in vitro и исследование её регенерационной способности.
Задачи:
-
1. Изучить эффективность применения стерилизующих агентов (фунгицид фундазол 1 г/л + раствор бытового отбеливателя АСЕ (0,50% содержание гипохлорита натрия)) на этапе введения жимолости в культуру in vitro .
-
2. Исследовать морфометрические показатели регенерантов жимолости.
Материалы и методы исследования
Исследования проводили на базе лаборатории селекционно-генетических исследований полевых культур ФНЦ агробиотехнологий Дальнего Востока им. А.К. Чайки.
Исходный растительный материал – сорт жимолости Подарок амурчанам селекции Дальневосточного государственного аграрного университета. Включен в Государственный реестр селекционных достижений в 2015 году, и допущен к использованию во всех регионах РФ [27]. Сорт среднепозднего срока созревания, столового назначения, зимостойкий, устойчивый к засухе. Вкус ягод сладко-кислый с горчинкой, освежающий. В них содержится сахара – 7,9 %, витамина С – 81,7 мг/%. Средняя урожайность – 66,6 ц/га.
Получение асептической культуры. Черенки жимолости длиной 30-35 см, нарезанные в фазу цветения, после удаления листьев промывались мыльным раствором и проточной водопроводной водой. В качестве первичных эксплантов использовали неодревесневшие зеленые микрочеренки длиной 10-15 мм с 1-2 междоузлиями. Стерилизация материала проводилась согласно методических указаний ВИР с модификациями (добавление этапов обработки фунгицидом и 70% этанолом) [28]. Экспланты помещали в колбы с раствором ПАВ 5%, встряхивали на шейкере 20 минут и затем промывали проточной водопроводной водой 20 минут. Дальнейшая схема стерилизации включала: фунгицид Беномил (Фундазол), СП (500 г/кг, 1 г/л) (Союзагрохим, АХП, Россия) (15 минут); свежеприготовленный бытовой отбеливатель АСE (ООО «Проктер энд Гэмбл-Новомосковск», г. Новомосковск, Россия) разбавленный дистиллированной водой в соотношении 1:9 (0,50% содержание NaOCl в рабочем растворе) (20 минут); 70% этанол (1-2 секунды) и промывка автоклавированной дистиллированной водой 3 раза по 5 мин в каждой сменной порции. Две последние операции проводили в стерильных условиях ламинар-бокса. Первичные экспланты пассировали на питательную среду с минеральной основой по Мурасиге-Скуга [29], содержащую 20 г/л сахарозы и 6 г/л агара (далее – МС), дополненную 6-бензиламинопурином (БАП) в концентрации 0,5 мг/л. рН среды доводили до 5,7-5,8 с помощью 1 н КОН. Изолированные in vitro объекты культивировались в стеклянных емкостях объемом 250 мл, температуре 22-25°С, при освещенности 4 тыс. лк, в условиях культуральной комнаты. Стеллажи были укомплектованы лампами для выращивания растений Quantum line ver. 1 (lm281b + pro 3000K + SMD 5050, 660 нм) (Samsung, Япония). Постоянная температура поддерживалась сплит-системой Rovex RS-07MST1 / RS-07MST1 Aux Air, Китай). Аэрацию как элемент микроклимата обеспечивал аэратор AceLine TFSL-6 (Китай). Уровень влажности контролировали с помощью POLARIS PUH 9105 IQ (Китай), при 16±1,25 ч. световом дне [30]. Учет общего количества стерильных эксплантов проводили через три недели культивирования. Эффективность стерилизации рассчитывали по отношению количества неинфицированных эксплантов (n) к числу эксплантов, введенных в культуру in vitro (N) в процентах:
n
P= ———×100
N
По окончании культивирования на 40-е сутки оценивали жизнеспособность эксплантов по соотношению живых эксплантов к общему количеству введенных в культуру.
Микроразмножение и учет морфометрических показателей. Субкультивирование эксплантов в виде микрочеренков с 1-2 междоузлиями осуществляли на свежую питательную среду МС, дополненную БАП 0,5 мг/л. Морфометрические показатели определяли на 35-е сутки культивирования растений. Учитывали количество боковых побегов, высоту растения, количество редь зависит от эффективности процесса получения асептической культуры. В результате проведенных исследований установлено, что из 42 обработанных стерилизующими агентами эксплантов непораженными инфекцией остались 24 микрочеренков, а активно регенерирующих – 20 микрочеренков. Анализ инфицированного материала показал, что при введении в культуру in vitro жимолость поражается преимущественно грибами рода Fusarium (рис. 1). В итоге эффективность стерилизации с поэтапным использованием Фундазола, КЭ (1 г/л) и АСЕ, разбавленного дистиллированной водой в соотношении 1:9, составила 57,1%. Жизнеспособность введенных в культуру эксплантов оказалась на уровне 50,0%.
Инициированные к росту экспланты помещали на свежую питательную среду для микроклонального размножения. Последующие субкультивирования проводили микрочеренками (рис. 2) с интервалом 35-40 суток. Также нами было выявлено, что удаление листовых пластинок при проведении микрочеренкования жимолости приводит к резкому снижению приживаемости и, в большинстве случаев, – к гибели микроклонов (процент гибели 98,7%), при этом увеличиваются затраты времени на проведение данного процесса.
Исследование морфометрических показателей микрорастений жимолости на 35-е сутки культивирования
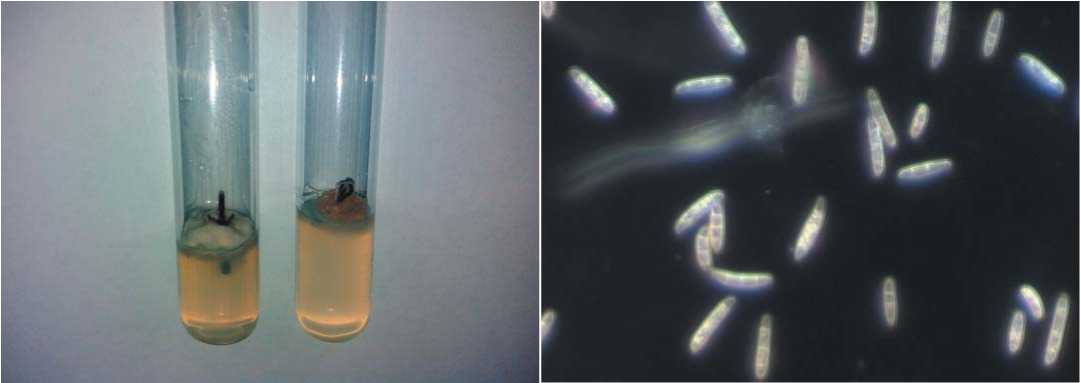
Рис. 1. Инфицированные грибами р.Fusarium первичные экспланты жимолости (слева) и макроконидии Fusarium, 100xи 400х Axiolab 5 (Carl Zeiss) (справа)
-
Fig. 1. Primary honeysuckle explants infected by р. Fusarium (left) and the Fusarium macroconidia, 100x and 400х Axiolab 5 (Carl Zeiss) (right)
междоузлий более 4 мм, количество, длину и ширину листьев. Коэффициент размножения рассчитывался как количество черенков длиной 10-15 мм, полученных с одного микрорастения после этапа пролиферации. Приготовление и стерилизация бокса, посуды, инструментов проводились по общепринятым методикам [31].
Статистическую обработку проводили в программеPASТ v. 4.03 (PAlaeontological Statistics, Норвегия, версия программы 4.03) [32].
Исследования проводились в 2022 году, количество итераций эксперемента – 5.
Результаты исследования и их обсуждение
Успешное культивирование и микроклональное размножение растений в условиях in vitro в первую оче- in vitro показало, что средняя длина побегов достигла 22,1 мм, варьируя от 10 до 40 мм (рис. 2, 3). Близкие результаты получены в исследованиях С.С. Макарова и др. [31], которые на среде МС, обогащенной БАП 0,5 мг/л, наблюдали среднюю длину побегов жимолости сорта Морена в пределах 17 мм. Известно, что при добавлении цитокинина в питательную среду снимается апикальное доминирование, при этом стимулируется развитие боковых побегов [33]. В наших опытах микрорастения жимолости образовывали дополнительно от 1 до 3 микропобегов, в среднем 2,0 шт. Такие показатели, как количество, длина и ширина листьев микрорастений жимолости также варьировали в довольно широком диапазоне, в среднем составив 7,6 шт., 6,2 мм и 4,3 мм соответственно.
Коэффициент размножения растений при микро-

Рис. 2. Микроклоны жимолости на 1-е (слева) и 35-е (справа) сутки культивирования in vitro
Fig. 2. Honeysuckle microclones on the 1st (left) and 35th (right) day of cultivation in vitro
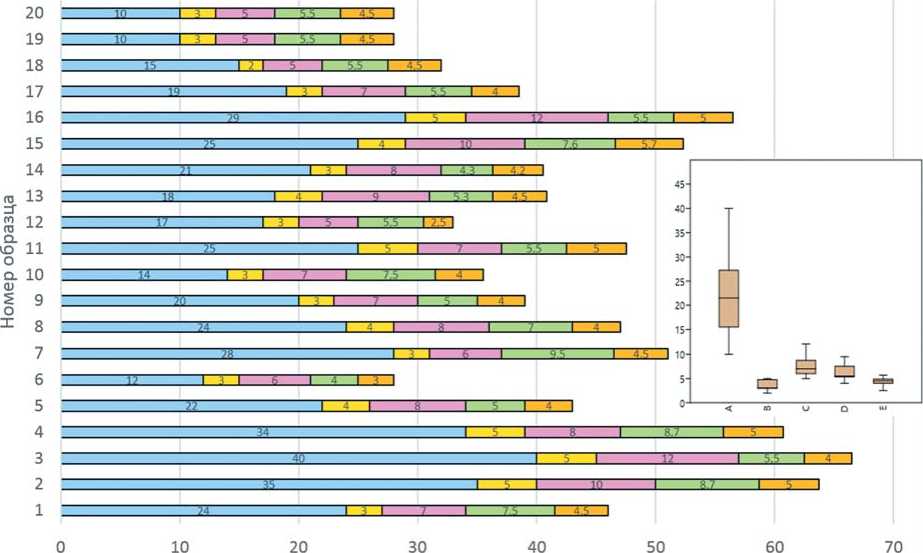
Морфометрические показатели жимолостми съедобной на 35 сутки культивирования in vitro
-
□ Высота растений, мм
-
□ Длина листьев, мм
-
□ Количество междоузлий, шт. □ Количество листьев, шт.
-
□ Ширина листьев, мм
Статистический показатель
Длина побега, мм (А)
Количество междоузлий, шт. (В)
Количество листьев, шт. (C)
Длина листьев, мм (D)
Ширина листьев, мм (E)
MEAN
22,1
3,7
7,6
6,2
4,3
SD
1,9
0,2
0,5
0,3
0,2
MIN
10,0
2,0
5,0
4,0
2,5
MAX
40,0
5,0
12,0
9,5
5,7
25th%
15,5
3,0
6,0
5,4
4,0
75th%
27,3
4,75
8,8
7,5
4,9
V, %
37,5
25,6
28,1
24,9
16,5
Рис. 3. Морфометрические показатели жимолости на 35-е сутки культивирования in vitro (средние показатели 7 пассажей)
Fig. 3. Morphometric parameters of honeysuckle on the 35th day of cultivation in vitro (averages of 7 passages)

Рис. 4. Регенеранты жимолости сорта Подарок амурчанам Fig. 4. Regenerated honeysuckle plants ofvariety Podarok amurchanam размножении зависит от количества и длины междоузлий на побегах, оптимальная длина которых должна достигать 4-10 мм [3]. По нашим данным, количество междоузлий (более 4 мм) колебалось в пределах 2-5 шт., в среднем 3,7 шт. При этом средний коэффициент размножения составил 4,65±0,025.
При дальнейшем микроклоклонировании было проведено 7 пассажей и получено достаточное количество микрорастений жимолости (250 шт.) (рис. 4), что позволило перейти к следующему этапу работы – укоренению черенков в питательной среде для ризогенеза.
Выводы
-
1. Эффективность стерилизации микрочеренков жимолости сорта Подарок амурчанам с поэтапным использованием Фундазола, КЭ (1 г/л) и АСЕ, разбавленного дистиллированной водой в соотношении 1 : 9, составила 57,1%. При этом жизнеспособность введенных в культуру эксплантов оказалась на уровне 50,0%.
-
2. Удаление листовых пластинок при проведении микрочеренкования жимолости приводит к резкому снижению приживаемости и, в большинстве случаев, – к гибели микроклонов (процент гибели 98,7%), при этом увеличиваются затраты времени на проведение данного процесса.
-
3. Культивирование микрочеренков на питательной среде с минеральной основой по Мурасиге-Скуга, дополненной бензиламинопурином (БАП) в концентрации 0,5 мг/л, способствует нормальному росту и развитию регенерантов жимолости. На 35-е сутки культивирования высота растений достигла 10-40 см (среднем 22,1 мм), количество боковых побегов и количество междоузлий составило 1-3 шт. (в среднем 2,0 шт.) и 2-5 шт. (в среднем 3,7 шт.) соответственно, среднее значение коэффициента размножения – 4,65.
(accessed: 10.01.2024).
Об авторах:
Scopus Author ID: 57204034528, SPIN-код: 1789-9633
Наталья Геннадьевна Богинская – младший научный сотрудник лаборатории селекционно-генетических исследований
полевых культур, , , SPIN-код: 2265-0465
Aboutthe Authors:
Tamara I. Khoruzheva – Junior Researcher,
Laboratory of Breeding and Genetic Research on Field Crops,
Correspondence Author, ,
Svetlana A. Borovaya – Researcher, Laboratory of Breeding and Genetic Research on Field Crops, ,
Scopus Author ID: 57204034528
Natalya G. Boginskaya – Junior Researcher,
Laboratory of Breeding and Genetic Research on Field Crops, ,
ISSN 2618-7132 (Online) Овощи России №1 2024 [ 60 ] Vegetable crops of Russia №1 2024 ISSN 2072-9146 (Print)
Список литературы Введение в культуру и микроклональное размножение жимолости съедобной in vitro
- Svarcova I., Heinrich J., Valentova K. Berry fruits as a source of biologically active compounds: The case of Lonicera caerulea. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub. 2007;151(2):163-74. https://doi.org/10.5507/bp.2007.031.
- Miyashita T., Ohashi T., Shibata F., Araki H., Hoshino Y. Plant regeneration with maintenance of the endosperm ploidy level by endosperm culture in Lonicera caerulea var emphyllocalyx. Plant Cell Tiss Org. 2009;(98):291-301.
- Семенова Н.А. Совершенствование технологии размножения in vitro, условий адаптации и доращивания жимолости съедобной: автореф. дис. … канд. с.-х. наук. М., 2016. 18 с.
- Шипунова А.А. Микроклональное размножение малины и жимолости. Плодоводство и ягодоводство России. 2009;22(2):381-384. EDN KXWPDB.
- Высоцкий В.А. Морфогенез и клональное микроразмножение растений. Культура клеток растений и биотехнология. М., 1986. С. 91-102.
- Куклина А.Г., Семерикова Е.А. Возможности размножения перспективных сортов жимолости синей. Актуальные проблемы садоводства России и пути их решения. 2007. С.163-164.
- Муратова С.А., Янковская М.Б., Шорников Д.Г. Особенности введения в культуру in vitro плодовых и ягодных растений. Плодоводство. Ин-т плодоводства Нац. акад. наук Беларуси. Самохваловичи. 2005;17(2):182-185.
- Сорокин А.А. Размножение жимолости в культуре in vitro. Состояние и перспективы развития нетрадиционных садовых культур: материалы междунар. науч.-метод. конф. 12-14 авг. 2003 г., Мичуринск. Воронеж: Кварта, 2003. С. 119-124.
- Макаров С.С., Кузнецова И.Б., Смирнов В.С. Влияние способов стерилизации и типов эксплантов жимолости синей на их жизнеспособность в условиях in vitro. Лесохозяйственная информация. 2018;(2):96-101. https://doi.org/10.24419/LHI.2304-3083.2018.2.10. EDN XQFWKT.
- Китапбаева А.А., Шарипханова А.С., Игисинова Ж.Т., Карменова Б.К., Кабатаева Ж.К. Введение в культуру in vitro и микроклональное размножение двух видов жимолости. Science and world. 2017;9-2(49):16-18. EDN NXSLXX.
- Krupa-Makiewicz M., Ochmian I. Propagation of Blue Honeysuckles (Lonicera caerulea L.) in In Vitro Culture. Journal of Basic & Applied Sciences. 2014;(10):164-169.
- Dziedzic E. Propagation of blue honeysuckle (Lonicera caerulea var. kamtscatica Pojark.) in in vitro culture. J. Fruit and Ornamental Plant Res. 2008;(16):93-100.
- Sedlák J., Paprštein F. In vitro propagation of blue honeysuckle. Hort. Sci. (PRAGUE). 2007;(34):129-131.
- Mihaljeviс I., Tomas V., Vukovic D., Dugalic K. Propagation of three Blue Honeysuckle (L. caerulea) cultivars in in vitro culture. Pomologia croatica. 2019;(23):41-48.
- Osburn L.D., Yang X., Li Y., Cheng Z-M. Micropropagation of Japanese Honeysuckle (Lonicera japonica) and Amur Honeysuckle (L. maackii) by Shoot Tip Culture. Journal of Environmental Horticulture. 2009;(27):195-199.
- Fira A., Clapa D., Cristea V., Plopa C. In vitro propagation of Lonicerakamtschatica. Agriculture - Science and Practice. 2014;1-2(89-90):90-99
- Orlova N.D., Molkanova O.I., Koroleva O.V. Improvement of clonal micropropagation technique of promising Lonicera caerulea L. cultivars. IOP Conf. Series: Earth and Environmental Science. 2021;941(1):012030. https://doi.org/10.1088/1755-1315/941/1/012030.
- Karhu S.T. Axillary shoot proliferation of blue honeysuckle. Plant Cell, Tissue and Organ Cult. 1997;(48):195-201. https://doi.org/10.1023/A:1005842022064
- Маркова М.Г., Сомова Е.Н. Оптимизация этапа введения в культуру ткани в клональном микроразмножении жимолости синей. Вестник Марийского государственного университета. Серия: Сельскохозяйственные науки. Экономические науки. 2016;2(3(7):30-35. EDN WNCRHN.
- Муратова С.А., Янковская М.Б., Шорников Д.Г., Особенности введения в культуру in vitro плодовых и ягодных растений. Плодоводство: Ин-т плодоводства Нац. акад. наук Беларуси. Самохваловичи. 2005;17(2):182-185.
- Zapolsky Ya.S., Medvedeva T.V., Natalchuk T.A., Bublyk M.O. Propagation of edible honeysuckle (Lonicera edulis turcz) in in vitro conditions. Agricultural science and practice. 2018;5(2):18-26.
- Матушкина О.В., Пронина И.Н. Клональное микроразмножение плодовых и ягодных культур в системе производства высококачественного посадочного материала. Научные основы эффективного садоводства: Труды ВНИИС им. И.В. Мичурина. Воронеж: Кварта, 2006. С. 327-342.
- Шорников Д.Г., Брюхина С.А., Муратова С.А. [и др.] Оптимизация условий культивирования in vitro ягодных и декоративных культур. Вестник Тамбовского университета. Серия: Естественные и технические науки. 2010;15(2):640-645. EDN MSOGXL.
- Georges D., Chenieux J.C., Ochatt S.J. Plant regeneration from aged-callus of the woody ornamental species Lonicera japonica cv. Hall’s Prolific. Plant Cell Rep. 1993;(13):91-94.
- Cambecеdes J., Duron M., Decourtye L. Adventitious bud regeneration from leaf explants of the shrubby ornamental honeysuckle, Lonicera nitida Wils cv. Maigrün: effects of thidiazuron and 2,3,5-triiodobenzoic acid. Plant Cell Rep. 1991;(10):471-474.
- Ochatt S.J. Requirements for plant regeneration from protoplasts of the shrubby ornamental honeysuckle, Lonicera nitida cv. Maigrün. Plant Cell, Tissue Organ Cult. 1991;(25):161-167
- Государственный реестр селекционных достижений, допущенных к использованию. Т.1. «Сорта растений» (официальное издание). М.: ФГБНУ «Росинформагротех», 2022. С. 646.
- Дунаева С.Е., Пендинен Г.И., Антонова О.Ю., Швачко Н.А., Ухатова Ю.В., Шувалова Л.Е., Волкова Н.Н., Гавриленко Т.А. Сохранение вегетативно размножаемых культур в in vitro и крио коллекциях: метод. yказания. 2-е изд, расширенное и доп. Спб., 2017. С 71.
- Murashige T., Skoog F. A revised medium for rapid growth and bio assays with tobacco tussue cultures. Physiol. Plant. 1962;(15):473-497. https://doi.org/10.1098/rstb.2000.0713.
- Мацишина Н.В., Фисенко П.В., Ермак М.В., Собко О.А., Волков Д.И., Балеевских А.Г. Пища как фактор плодовитости, продолжительности развития и изменения морфометрических показателей у Henosepilachna vigintioctomaculata (Motschulsky). Овощи России. 2021;(5):81-88. https://doi.org/10.18619/2072-9146-2021-5-81-88. EDN ZWRISM.
- Авксентьева О.А., Петренко В.А. Биотехнология высших растений: культура in vitro: учеб.-метод. пособие. Харьков: ХНУ им. В.Н. Каразина, 2011. 60 с.
- Hammer O., Harper D.A.T., Ryan P.D. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica. 2001;4(1):1-9. https://palaeoelectronica.org/2001_1/past/past.pdf (accessed: 10.01.2024).
- Макаров С.С., Калашникова Е.А. Влияние состава питательной среды на клональное микроразмножение жимолости съедобной. Плодоводство и ягодоводство России. 2017;(49):217-222. EDN YZJZPL


