Выбор оптимальной среды для разведения пулированных концентратов тромбоцитов, размороженных после криохранения
Автор: Макаров М.С., Сторожева М.В., Боровкова Н.В., Буланов А.Ю., Пономарев И.Н.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 3 т.15, 2025 года.
Бесплатный доступ
Актуальность. В настоящее время методика криоконсервирования пулированных концентратов тромбоцитов (ПулКТ) требует оптимизации. Актуальной задачей является подбор адекватного препарата для разведения размороженных доз с целью снижения токсического действия криопротекторов. Цель работы: оценить влияние плазмозамещающих растворов на морфофункциональные свойства пулированных концентратов тромбоцитов после их криоконсервирования, криохранения и разморозки. Материалы и методы. В работе исследовали морфофункциональные свойства тромбоцитов ПулКТ, криоконсервированных в присутствии 5–6% диметилсульфоксида и 0,5% декстрана и разведённых после разморозки разными средами. Для ресуспендирования тромбоцитов использовали аутологичную бесклеточную среду, выделенную из ПулКТ до заморозки тромбоцитов, аллогенную свежезамороженную плазму, плазмозамещающий раствор InterSol, препарат-заменитель плазмы – реополиглюкин. Для оценки качества тромбоцитов использовали метод тромбоэластографии и метод оценки морфофункционального статуса тромбоцитов с помощью витального окрашивания флуорохромными красителями. Результаты. Исходные ПулКТ заметно различались по жизнеспособности и структурно-функциональным особенностям тромбоцитов в их составе. При разведении размороженных ПулКТ аутологичной средой или свежезамороженной плазмой в соотношении 1:9 сохранность общего числа биологически полноценных тромбоцитов составляла в среднем 52–53%, раствором InterSol – 37%, реополиглюкином – 8%. Раствор InterSol вызывал спонтанную активацию тромбоцитов, реополиглюкин – спонтанную активацию, сопряжённую с массовым разрушением тромбоцитов. Выявлена корреляционная взаимосвязь между сохранностью биологически полноценных тромбоцитов после разморозки ПулКТ и морфофункциональными параметрами в исходных ПулКТ. При разведении размороженных ПулКТ аутологичной средой или свежезамороженной плазмой в соотношении 1:9 морфофункциональный статус тромбоцитов не менялся в течение 2–3 часов, при разведении в соотношении 1:4 – в течение 30 мин. Выводы. В ПулКТ перед криоконсервированием наблюдается снижение ряда морфофункциональных характеристик тромбоцитов на фоне их повышенной реактивности. Ресуспендирование размороженных ПулКТ в чистом растворе InterSol или полиглюкине приводит к быстрой потере качества тромбоцитов и является неэффективным. Для разведения размороженных пулированных концентратов тромбоцитов рекомендуется использовать аутологичную среду с плазмой или аллогенную свежезамороженную плазму.
Концентрат тромбоцитов, криоконсервирование, размораживание, среда для разведения, пулированные тромбоциты, функциональная активность, агрегация тромбоцитов, адгезия тромбоцитов, физиологический раствор
Короткий адрес: https://sciup.org/143184583
IDR: 143184583 | УДК: 615.38:612.115.1:577.115.3 | DOI: 10.20340/vmi-rvz.2025.3.MORPH.4
Текст научной статьи Выбор оптимальной среды для разведения пулированных концентратов тромбоцитов, размороженных после криохранения
Концентраты тромбоцитов (КТ) широко востребованы в клинической практике для предотвращения и купирования кровотечений. Актуальной задачей современной трансфузиологии является внедрение новых эффективных способов хранения тромбоцитов, в частности КТ, полученных путём пулированных тромбоцитных фракций из доз консервированной крови доноров [1]. На сегодняшний день криоконсервирование тромбоцитов является единственным технологически эффективным и безопасным способом длительного хранения КТ, предназначенных для клинического использования в трансфузиологии. При этом все известные эффективные методики криоконсервирования и разморозки тромбоцитов предназначены для работы с КТ, полученными путём аппаратного афереза [2, 3]. Ранее нами было показано, что в пулированных КТ тромбоциты имеют более высокую реактивность на фоне снижения других морфофункциональных характеристик, проявляют склонность к спонтанной активации [4]. Тромбоциты человека являются высокочувствительными к изменению физикохимических свойств среды [5–7], поэтому большое значение имеет выбор адекватного препарата для разведения размороженных доз с целью снижения токсического действия криопротекторов.
Цель настоящей работы – оценить влияние плазмозамещающих растворов на морфофункциональные свойства пулированных концентратов тромбоцитов после их криоконсервирования, криохранения и разморозки.
Материалы и методы
Исследование проведено в 2024 году на базе Научного отделения биотехнологий и трансфузиологии, Отделения клинической, производственной трансфузиологии и гравитационной хирургии крови ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ». В работе исследовали образцы консервированной крови доноров и КТ, полученных путём пулирования тромбоцитных фракций, выделенной из единичных доз цельной крови доноров. У доноров в ходе процедуры донации забирали кровь в объёме 450 мл в полимерные гемоконтейнеры CPD/PAGGSM с фильтром Leucoflex LXT (Macophаrma, Франция). В последующем все дозы консервированной крови подвергали процедуре тромбо- и лейкоредукции для проведения тромбоэластографического исследования гемостатической активности пулированных КТ in vitro. Отбор проб для исследований осуществляли из гемоконтейнеров с консервированной кровью на этапах до и после лейкоредукции, используя сте-рилл-коннектор TSCD-II (Terumo BCT, США) и пластиковые контейнеры-спутники объёмом 3–4 мл.
Пулированные концентраты тромбоцитов (ПулКТ) изготавливали с использованием тромбоцитных фракций, полученных в ходе фракционирования доз консервированной крови доноров на аппарате Reveos (Therumo BCT, США). Для этого смешивали в новом стерильном контейнере образцы тромбоцитных фракций от 4 кадровых доноров, имевших одинаковые группу крови и резус-принадлежность. Перенос биоматериала между контейнерами проводили через закрытую одноразовую стерильную систему, включавшую лейкоцитарный фильтр. После пулирования получали концентрат объёмом 100–120 мл с содержанием тромбоцитов не менее 200×109 клеток, в который дополнительно вносили 180–190 мл плазмозамещающего раствора SSP из расчёта не менее 40 мл раствора на 60×109 тромбоцитов [7]. Инактивацию патогенов в пулирован-ных КТ проводили на аппарате Intercept Illuminator (Cerus Corporation, США). Для криоконсервирования ПулКТ был выбран известный способ, включающий редуцирование объёма тромбоцит-содержащей среды, использование комбинированного криопротектора на основе диметилсульфоксида (ДМСО) и декстрана [8]. Образцы ПулКТ разделяли на тромбоцитсодержащую часть и бесклеточную среду центрифугированием при 1100–1400g. Исходный комбинированный криопротектор, содержащий 55% ДМСО и 5% декстрана 40, разводили аутологичной бесклеточной средой, выделенной из ПулКТ, до конечной концентрации ДМСО 10–12% и ресуспендировали тромбоцитсодержащую часть разведённым криопротектором до конечной концентрации ДМСО 5–6%. Тромбоцитсодержащую часть и аутологичную бесклеточную среду замораживали со скоростью 1–3°/мин при минус 80 °С – минус 100 °С и хранили при минус 85 °С – минус 196 °С. Размораживали ПулКТ нагреванием при 32–36 °С в течение 2–10 мин. Для ресуспендирования тромбоцитов и разведения ДМСО использовали следующие среды: аутологичная бесклеточная среда, выделенная из ПулКТ до заморозки тромбоцитов (аутологичная плазма + консервант SSP); аллогенная свежезамороженная плазма (СЗП), полученная у доноров компонентов крови; добавочный раствор для хранения тромбоцитов/плазмозамещающий раствор InterSol (Baxter, США); препарат-заменитель плазмы реополиглюкин. Образцы каждого размороженного ПулКТ ресуспендировали в 4 указанных средах в соотношении 1:4 и 1:9 для оценки влияния разных концентраций остаточного ДМСО на сохранность тромбоцитов при 20–22 °С.
Оценку качества тромбоцитов проводили до криоконсервирования, а также после размораживания и разведения образцов ПулКТ. Для оценки тромбоцитов выполняли морфофункциональный анализ с использованием флуоресцентной микро- скопии и тромбоэластографию (ТЭГ). Морфофункциональный анализ проводили на микроскопе Eclipse 80i (Nikon, США) со встроенной флуоресцентной насадкой Declipse C1si (Nikon, США). Перед микроскопическим исследованием тромбоциты окрашивали смесью витальных (прижизненных) флуорохромных красителей трипафлавина и акридинового оранжевого на 0,15М фосфатном буфере Зеренсена (рН = 7,3) в соотношении 1:1. Витально окрашенные клетки исследовали под объективом с увел. ×100, числовая апертура – 1,25. Для получения флуоресцентного изображения использовали светофильтр (λ-возбуждения – 450–490 нм, λ-эмиссии – от 520 нм). Полученные изображения фотографировали с помощью цифровой фотокамеры «Nikon» (Nikon, США) при экспозиции 0,25–0,5 сек. Для морфометрического исследования тромбоцитов использовали программу Adobe Photoshop 7. В процессе работы оценивали следующие параметры: общая концентрация тромбоцитов, 109/л; относительное содержание тромбоцитов с гранулами, Dтр.гр., % (норма 35–75%); абсолютное содержание тромбоцитов с гранулами, 109/л; содержание тромбоцитов, богатых гранулами, ТБГ, % (норма 8–40%); адгезивная активность тромбоцитов, ААТ, баллы (норма 30–75 баллов), уровень тромбоцитов с повреждёнными мембранами, ТПМ, % (норма 2–3%); скорость адгезии тромбоцитов на стекле (норма 10–30 мин); сохранность общего числа тромбоцитов (в % от исходного содержания в ПулКТ); сохранность тромбоцитов с гранулами Схтр.гр (в % от исходного содержания). В процессе ТЭГ-исследования сравнивали результаты тромбоэластографии цельной крови (положительный контроль), крови, фильтрованной через тромбо-лейкоцитаный фильтр (отрицательный контроль) и фильтрованной крови, совмещенной с ПулКТ в соотношении 9:1 (опытный образец). Исследования проводили на тромбоэластографе Hemoscope Thrombelastograph с программой TEG Analitical Software 4,3. Для проведения ТЭГ 340 мкл крови смешивали с 20 мкл 0,2М раствора хлористого кальция в одноразовой пластиковой кювете и помещали в анализатор. Оценивали следующие параметры: k – время от начала образования сгустка до достижения амплитуды 20 мм, в мин., (норма 4–9 минут) и максимальную амплитуду MA (норма 44–64 мм). Для оценки гемостатического потенциала тромбоцитов в КТ было предложено оценивать изменение параметра МА между пробой исходной крови доноров и пробой фильтрованной крови с тромбоцитами КТ и параметр k в пробе фильтрованной крови с КТ. Для оценки изменения МА предложен коэффициент восстановления гемостатической функции HR (hemostasis recovery), который рассчитывают по формуле:
HR = (MAs – MAn) / (MAp – MAn)×100%, где МАs – максимальная амплитуда фильтрованной крови с добавлением КТ; MAn – максимальная амплитуда фильтрованной крови без тромбоцитов; MAp – максимальная амплитуда исходной донорской крови.
Статистический анализ проводили при помощи программ Statistica 10.0. и BioStat Pro 5.9.8. Для статистической обработки вычисляли медиану (Ме), 1-й и 3-й квартили (25%; 75%), коэффициент корреляции Спирмена. Для оценки различий между выборками использовали U-критерий Манна – Уитни для независимых переменных и критерий Вилкоксона для связанных выборок. Для исследования взаимосвязи признаков использовали метод корреляционного анализа Спирмена (r). Различия считали достоверными при уровне значимости p < 0,05.
Результаты и обсуждение
В исходных ПулКТ значения Dтр.гр. составили 22 [17; 25]%, концентрация тромбоцитов с гранулами – 198 [136; 225]×109/л, ТБГ – 7 [4; 10]%, ААТ – 20 [15; 25] баллов, ТПМ – 35 [29; 42]%. Среди обследованных ПулКТ в 43% случаев скорость адгезии тромбоцитов на стекле была нормальной, в 18% – повышенной, в 17% – высокой и очень высокой, в 22% – низкой. Таким образом, исходные ПулКТ заметно различались по жизнеспособности и структурно-функциональным особенностям тромбоцитов в их составе. В образцах ПулКТ до криоконсервирования с нормальным содержанием тромбоцитов значения МА составили 49 [44; 52] мм, значения k – 3,8 [3,4; 4,2], что соответствовало норме. При этом также наблюдалась неоднородность ПулКТ по функциональному потенциалу тромбоцитов. Установлена прямая взаимосвязь между параметром ААТ и МА в исходных ПулКТ, коэффициент корреляции r составил 0,57 (р < 0,05). После криоконсерви- рования, разморозки и разведения ПулКТ при использовании всех типов сред морфофункциональные параметры были достоверно ниже, чем в исходных ПулКТ, однако степень этого снижения заметно варьировала. Было установлено, что при разведении размороженных ПулКТ аутологичной средой или СЗП качество тромбоцитов заметно не различается, в то время как при использовании раствора InterSol качество тромбоцитов снижено по сравнению с использованием аутологичной среды или СЗП (табл. 1).
Этот эффект сохраняется и в процессе хранения размороженных ПулКТ в течение 1–4 часов при 20–22 °С. При разведении размороженных ПулКТ раствором InterSol в 75% образцов наблюдалась спонтанная активация тромбоцитов, которая приводила к их очень быстрой адгезии на стекле, образованию in vitro конгломератов и ускоренной дегрануляции тромбоцитов в их составе. Этот эффект усиливался при добавлении хлорида кальция: при микроскопическом исследовании наблюдалось быстрое формирование тромбофибриновых сгустков при температуре 20–22 °С. При использовании реополиглюкина качество тромбоцитов резко снижалось уже через 5–10 минут после разморозки и сопровождалось массовым разрушением тромбоцитов или их спонтанной активацией.
При ТЭГ-исследовании медианные значения параметра k соответствовали норме в КТ, разведённых аутологичной средой, СЗП и раствором InterSol, что может быть связано с высвобождением из тромбоцитов факторов свертывания в процессе их криодеструкции и их участием на начальных этапах формирования сгустка. При разведении размороженных КТ реополиглюкином параметр k заметно удлинялся, что отражает нарушенную тромбообразующую функцию тромбоцитов.
Таблица 1. Оценка качества тромбоцитов ПулКТ после криоконсервирования, разморозки и ресуспендирования в разных средах Table 1. Quality assessment of platelets in pooled platelet concentrates after cryopreservation, thawing and resuspension in different media
|
Параметры оценки качества тромбоцитов |
ПулКТ до криоконсервирования |
ПулКТ после криоконсервирования, разморозки и ресуспендирования в разных средах |
|||
|
Аутологичная среда (плазма+SSP) |
СЗП |
InterSol |
Реополи-глюкин |
||
|
Dтр.гр., % |
20 [17; 21] |
9 [8; 10]* |
9 [9; 12] * |
6 [6; 8] *# |
2 [1; 3] *# |
|
ААТ, баллы |
17 [16; 19] |
8 [6; 10] * |
9 [8; 12] * |
6 [5; 7] * |
1 [1; 2] *# |
|
Скорость адгезии тромбоцитов на стекле, мин |
12 [8; 20] |
14 [10; 30] |
11 [10; 30] |
2 [1; 3] *# |
35 [26; 40] *# |
|
ТПМ, % |
36 [27; 44] |
60 [56; 64] * |
56 [52; 62] * |
67 [64; 70] *# |
77 [75; 80] *# |
|
Максимальная амплитуда, мм |
54 [40; 56] |
35 [32; 37] * |
40 [37; 41] * |
35 [34; 39] * |
29 [26; 31] *# |
|
k |
3,4 [3; 4,2] |
5,4 [4,2;6] * |
4,4[3,2; 5,2] |
4,4 [3; 5,3] |
9 [7; 12] *# |
|
Сохранность общего числа тромбоцитов (в % от исходного содержания) |
- |
93 [83; 100] |
98 [92; 100] |
98 [93; 100] |
98 [90; 97] |
|
Сохранность тромбоцитов с гранулами (в % от исходного) |
- |
53 [42; 61] |
52 [41; 63] |
37 [31; 42] # |
8 [5; 15] # |
Примечание: * – относительно ПулКТ до криоконсервирования при р < 0,05; # – относительно аналогичного образца в аутологичной среде при р < 0,05.
Медианные значения параметра МА были во всех случаях ниже нормы, что может быть обусловлено низким содержанием тромбоцитов с гранулами. Необходимо учитывать, что ещё до этапа криоконсервирования ПулКТ имели сниженные или низкие значения морфофункционального статуса тромбоцитов, часто на фоне их повышенной реактивности. В связи с этим было важно оценить сохранность функционально полноценных тромбоцитов в ПулКТ. Сохранность общего числа тромбоцитов была высокой при использовании всех типов разводящих сред, однако сохранность тромбоцитов с гранулами заметно различалась. При использовании аутологичной среды или СЗП сохранность тромбоцитов с гранулами составляла в среднем 52–53%, тогда как при использовании раствора InterSol – 37%, реопо-лиглюкина – 8%. Таким образом, для разведения размороженных ПулКТ необходимо использовать аутологичную среду или СЗП. СЗП может быть применена в тех случаях, когда по трансфузиологическим показаниям пациенту назначается доза СЗП для коррекции плазменного звена гемостаза. Если трансфузионная тактика не подразумевает использование СЗП, более оправданно использовать аутологичную среду.
При разведении размороженных ПулКТ аутологичной средой или СЗП до концентрации ДМСО 0,5–0,6% (соотношение тромбоцитсодержащей части и разводящей среды 1:9) морфофункциональный статус тромбоцитов значимо не менялся в течение 2–3 часов, при разведении до концентрации ДМСО 1,0–1,5% (соотношение тромбоцитсодержа-щей части и разводящей среды 1:4) морфофункциональный статус не менялся в течение 30 минут, затем наблюдалось его постепенное снижение (рис. 1).
Таким образом, в условиях переливания крио-консервированных ПулКТ сразу после их разморозки достаточно разведение размороженных тромбо- цитов аутологичной средой или СЗП в соотношении 1:4. Если после разморозки ПулКТ требуется транспортировка или другие процедуры, рекомендуется разведение размороженных тромбоцитов аутологичной средой или СЗП в соотношении 1:9.
В процессе морфофункционального анализа тромбоцитов до и после криоконсервирования была выявлена корреляционная связь между параметрами качества тромбоцитов исходных ПулКТ и сохранностью тромбоцитов с гранулами после криоконсервирования и разморозки КТ в аутологичной среде или СЗП (табл. 2).
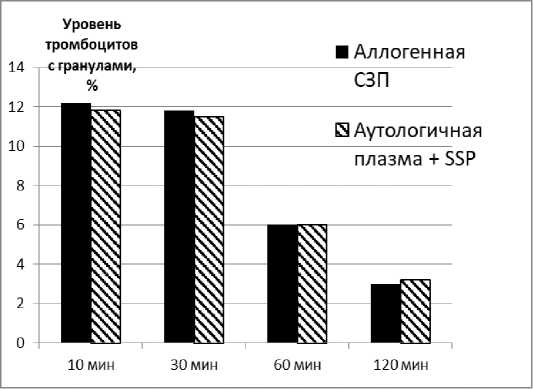
Рисунок 1. Изменение содержания тромбоцитов с гранулами в размороженных ПулКТ, разведённых аутологичной бесклеточной средой из ПулКТ (плазма + SSP) и аллогенной СЗП с остаточной концентрацией ДМСО 1,0–1,5%
Figure 1. Changes in the content of platelets with granules in thawed pooled platelet concentrates diluted with autologous cell-free medium from pooled platelet concentrates (plasma + SSP) and allogeneic fresh frozen plasma with residual DMSO concentration of 1.0–1.5%
Таблица 2. Корреляционная взаимосвязь между морфофункциональными параметрами исходных ПулКТ до заморозки и сохранностью тромбоцитов с гранулами после криоконсервирования
Table 2. Correlation between morphofunctional parameters of initial pooled platelet concentrates before freezing and preservation of platelets with granules after cryopreservation
|
Параметр ПулКТ до заморозки |
Коэффициент корреляции, отражающий взаимосвязь параметра и сохранности тромбоцитов с гранулами после криоконсервирования (р < 0,05) |
|
|
Аутологичная среда (плазма+SSP) |
Аллогенная СЗП |
|
|
Dтр.гр., % |
0,18 (p = 0,147) |
0,02 (p = 0,205) |
|
ААТ, % |
0,34 (p = 0,046) |
0,05 (p = 0,091) |
|
ТБГ, % |
0,78 (p = 0,012) |
0,73 (p = 0,016) |
|
ТПМ, % |
–0,25 (p = 0,088) |
–0,77 (p = 0,021) |
|
МА, мм |
0,28 (p = 0,049) |
0,02 (p = 0,206) |
В обеих группах выявлена высокая положительная корреляция между уровнем ТБГ (тромбоциты, богатые гранулами) в исходных ПулКТ и Схтр.гр, тогда как корреляция между общим уровнем тромбоцитов с гранулами Dтр.гр и Схтр.гр. отсутствовала или была слабой. В опытах с разведением аутологичной средой наблюдалась достоверная прямая корреляция между ААТ, МА в ПулКТ и Схтр.гр. В опытах с разведением СЗП достоверная корреляция между ААТ, МА в ПулКТ и Схтр.гр. не выявлялась, но при этом отмечена сильная обратная корреляция между ТПМ и Схтр.гр. Можно заключить, что при размораживании тромбоцитов в СЗП конечное качество тромбоцитов сильно зависит от исходного содержания наиболее жизнеспособных клеток (ТБГ) и клеток с сильно поврежденными мембранами (ТПМ), при этом параметры, отражающие только функциональную активность тромбоцитов (ААТ, МА), являются недостаточными для прогнозирования сохранности крио-консервированных тромбоцитов при использовании СЗП. Напротив, при размораживании тромбоцитов в аутологичной среде ПулКТ (плазма+SSP) параметры ААТ и МА являются значимыми. С учётом того, что при размораживании криоконсерви-рованных ПулКТ могут быть использованы в равной степени аутологичная среда и СЗП, для оценки пригодности ПулКТ к криоконсервированию актуальной является оценка всех указанных параметров (ААТ, ТБГ, ТПМ, МА).
Проведённое исследование показало, что разведение размороженных ПулКТ наиболее оправданно проводить плазмой или раствором с высоким содержанием плазмы. В противоположном случае происходит неконтролируемая потеря морфофункционального статуса тромбоцитов. Стоит отметить, что ресуспендирование тромбоцитов человека в простом физиологическом растворе (0,9% раствор хлорида натрия) вовсе не вызывает такого повреждения, при том что такой физиологический раствор не имеет буферной системы, в отличие от препарата InterSol. Резкое изменение редокс-потенциала среды является сильным фактором, способным вызывать спонтанное повреждение или активацию тромбоцитов [5]. К сожалению, в нашей работе не проводилась редоксиметрия плазмозамещающих сред, поэтому нельзя чётко определить, насколько редокс-потенциал InterSol и реополиглю-кина мог влиять на свойства тромбоцитов. Токсическое действие реополиглюкина, по всей видимости, связано с избытком декстрана в его составе. Высокая концентрация декстрана создаёт гипертонию, которая как было нами показано ранее, приводит к быстрому разрушению тромбоцитов [5]. Не исключено, что в условиях плазмы избыток ДМСО не только разводится раствором, но и адсорбируется белками плазмы, в первую очередь альбумином и фибриногеном. Высокая аффинность ДМСО к фибриногену способствует фибринообразованию в условиях высоких концентраций ДМСО [9, 10]. В нашем случае разведение ДМСО в тромбоцитсо-держащей части ПулКТ позволяло снизить токсическое действие ДМСО на тромбоциты как при разведении 1:9, так и при разведении 1:4. Нужно признать, что вопрос дилюции ДМСО-содержащих КТ перед трансфузией пациентов является весьма важным и требует согласования с клиническими транс-фузиологами. Внедрение эффективных методик криоконсервирования и разморозки ПулКТ позволит значительно расширить возможности трансфузиологических отделений и станций службы крови.
Выводы
В пулированных концентратах тромбоцитов перед криоконсервированием наблюдается снижение ряда морфофункциональных характеристик тромбоцитов на фоне их повышенной реактивности. Ресуспендирование размороженных пулированных концентратов тромбоцитов в чистом растворе InterSol или полиглюкине приводит к быстрой потере качества тромбоцитов и является неэффективным. Для разведения размороженных пулирован-ных концентратов тромбоцитов необходимо использовать аутологичную среду с плазмой или аллогенную свежезамороженную плазму. При разведении пулированных концентратов тромбоцитов аутологичной плазмой или свежезамороженной плазмой в соотношении 1:9 морфофункциональный статус тромбоцитов сохраняется в течение 2–3 часов, при разведении 1:4 – в течение 30 минут.


