Выбор способа нутритивной подготовки пациентов раком ободочной кишки, осложненным кишечной непроходимостью, к радикальной операции
Автор: Мельников П.В., Пугаев А.В., Ачкасов Е.Е., Посудневский В.И.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Изучены результаты лечения 210 больных раком ободочной кишки II-IVA стадий, осложненным обтурационной толстокишечной непроходимостью (ОТКН) (средний возраст - 66,2±1,0), за период с 2001 по 2013 гг., в зависимости от способа разрешения ОТКН и типа нутритивной поддержки. Изучали трофический статус, летальность и осложнения, проводили патоморфологическое исследование удаленных макропрепаратов. Энтеральная нутритивная поддержка (ЭНП) способствовала снижению рецидивов ОТКН после консервативного разрешения более чем в 10 раз, что позволило уменьшить летальность и осложнения в 2 раза, а также увеличило количество удаленных лимфоузлов и длину удаленного участка кишки с опухолью. У больных после миниинвазивной декомпрессии существенных различий по патоморфологическим исследованиям не было, однако была достоверно ниже летальность и осложнения - 4,3% и 7,2% против 8,7% и 39,1%. ЭНП является патогенетически обоснованной методикой подготовки больных ОТКН после различных методов декомпрессии к радикальным операциям, ассоциированной со снижением послеоперационных осложнений и летальности, а также более адекватной лимфодиссекцией.
Рак толстой кишки, кишечная непроходимость, колостомия, белково-энергетическая недостаточность, нутритивная поддержка, энтеральное питание
Короткий адрес: https://sciup.org/142211559
IDR: 142211559 | УДК: 613.2/.3;616.34-007.272
Текст научной статьи Выбор способа нутритивной подготовки пациентов раком ободочной кишки, осложненным кишечной непроходимостью, к радикальной операции
Заболеваемость раком толстой кишки (РТК) неуклонно растет в последние годы. В мире ежегодно регистрируется более 600 тыс. вновь заболевших этой формой рака, а в России в 2008 г. зарегистрировано 55719 новых случаев РТК [3]. Длительное бессимптомное течение, неспецифичность ранней симптоматики и поздняя диагностика являются причинами того, что до 60–90% всех больных с РТК экстренно госпитализируются в общелечебные стационары [7, 8], а РТК занимает до 72% в структуре неотложных операций по поводу осложненных гастроинтестинальных опухолей [6]. Обтурационная толстокишечная непроходимость (ОТКН) – наиболее частое и тяжелое осложнение РТК и выявляемое в 15–80%, а в 60–80% случаев является его первым клиническим проявлением. При этом, от 66% до 90% опухолей, вызывающих ОТКН локализуются дистальнее селезеночного изгиба [1, 4, 7, 8].
Для снижения летальности предложены малоинвазивные методики: транстуморальная декомпрессия (т.е. декомпрессии ободочной кишки через опухоль путем установки саморасправ-ляющихся стентов, гипо- или гипертермической деструкции опухоли) и колостомия из мини-доступа, позволяющие на высоте ОТКН снизить летальность в 20–30 раз, в 2–4 раза – частоту послеоперационных осложнений [2, 8, 12, 13], производить более точное предоперационное дообследование и отбор больных для радикальной операции, тем самым избежать 75–94% напрасных операций, выявлять сопутствующие хирургические заболевания, выполняя симультанные и комбинированные операции [2]. Предоперационная подготовка со стентированием или малоинвазивной колостомией позволяет в 2–2,5 раза чаще, нежели при экстренных резекциях без предварительной декомпрессии, накладывать первичный межкишечный анастомоз со снижением частоты его несостоятельности с 11–14% до 0–3%, а частоты превентивных кишечных стом – с 58,6% до 15,4% [8, 12, 15].
В условиях прогрессирующего опухолевого процесса и в отсутствие нутритивной поддержки у больных РТК развивается синдром гиперметаболизма-гиперкатаболизма. Развивающиеся на фоне прогрессирующего онкологического процесса клинически значимые нарушения приводят к потере массы тела вплоть до развития кахексии-анорексии [9]. Скорость пролиферации опухолевых клеток РТК, особенно ранних стадий, идет медленно и увеличивается по мере опухолевой инвазии [14]. Для того, чтобы достигнуть клинически значимого объема, опухоли необходимо около 2–7 лет [8]. Постепенное опухолевое сужение просвета кишки приводит к нарастанию кишечного стаза, вследствие чего отмечается хроническая ин-тралюминальная гипертензия [4], приводящая к изменению функции и цитоархитектоники стенки толстой и тонкой кишки [8]. Вышеперечисленные изменения ведут к первичному расстройству мембранного пищеварения, переваривания (маль-дигестия) и всасывания (мальабсорбция), что проявляется белково-энергетической недостаточностью [5], способствующей полиорганной недостаточности (ПОН) [8].
Неоднозначным вопросом является предоперационная подготовка после миниинвазивного или консервативного разрешения ОТКН, а именно ликвидация белково-энергетической недостаточности (БЭН) и профилактика рецидива ОТКН. С одной стороны, недостаточность питания у хирургических больных приводит к увеличению послеоперационных осложнений в 3–6, а летальности в 11 раз, а своевременное назначение пациентам нутриционной поддержки (НП), уменьшает частоту послеоперационных осложнений в 2–3, а летальности – в 7 раз [16]. В то же время данных об ухудшении онкологического прогноза при применении энтерального питания (ЭП) нет [10, 11]. Наоборот, медиана выживаемости показывает положительное влияние НП или, по крайней мере, отсутствие ухудшение прогноза [11]. С другой стороны, не определена наиболее оптимальная методика нутритивной поддержки при подготовке больных ОТКН к радикальным операциям после кон- сервативного и малоинвазивного ее разрешения, позволяющая не только коррегировать в максимально короткие сроки нарушения трофического статуса, но и являться мерой профилактики рецидива ОТКН после ее консервативного разрешения.
Цель исследования
Определение роли нарушения трофического статуса в патогенезе полиорганной недостаточности у больных с ОТКН с разработкой оптимального способа нутритивной поддержки при подготовке больных к радикальным операциям после консервативного и малоинвазивного разрешения ОТКН, позволяющего эффективно устранять белко-энергеическую недостаточность и предотвращать рецидив непроходимости кишечника.
Материалы и методы
Анализированы результаты лечения 210 пациентов среднего возраста 66,2±1,0 лет с ОТКН, обусловленной раком ободочной кишки II–IVА стадий (по классификации TNM 2009 г.). Наиболее часто отметили локализацию опухоли в левой половине ободочной кишки – 175 больных (83,3%): ректосигмоидного изгиба – 41 (19,5%), сигмовидной кишки – 82 (39,0%), нисходящей – 28 (13,3%), селезеночного изгиба – 24 (11,4%). Правостороннюю локализацию обнаружили у 35 (16,7%): поперечной ободочной кишки – у 6 (2,8%), печеночного изгиба – 8 (3,7%), восходящей ободочной кишки – 16 (7,5%), слепой кишки – 6 (2,8%) (табл. 1).
Из всех обследованных больных компенсированную ОТКН выявили у 58 (27,6%): в I группе – 39 (67,2%) больных, 12 (20,7%) больных – во II группе, и в III группе – 7 (12,1%) больных. Субкомпенсированную ОТКН диагностировали у 53 (25,2%) больных: 5 (7,5%) больных в I группе, во II группе – 24 (38,2%) и 24 (45,3%) больных – в III группе. Декомпенсированную степень ОТКН обнаружили у 99 (47,1%) больных: во II группе – 28 (28,1%) больных и в III группе – 77 (71,7%) больных,
Локализация опухоли ободочной кишки
Таблица 1
|
Сегмент ободочной кишки |
Количество больных в группах |
Общее кол-во, % |
||
|
I группа |
II группа |
III группа |
||
|
Слепая кишка |
– |
4 |
2 |
6 (2,8%) |
|
Восходящая ободочная кишка |
– |
10 |
6 |
16 (7,5%) |
|
Печеночный изгиб |
– |
4 |
4 |
8 (3,7 %) |
|
Поперечная ободочная кишка |
2 |
– |
4 |
6 (2,8 %) |
|
Селезеночный изгиб |
4 |
6 |
12 |
24 (11,4 %) |
|
Нисходящая ободочная кишка |
8 |
6 |
14 |
28 (13,3 %) |
|
Сигмовидная кишка |
19 |
21 |
42 |
82 (39,0 %) |
|
Ректосигмоидный изгиб |
11 |
12 |
18 |
41 (19,5 %) |
|
Всего: |
44 |
64 |
102 |
210 (100,0%) |
в то время как в I группе таких больных не выявили. Сопутствующие заболевания, согласно МКБ-10, были проанализированы по Шкале сопутствующих заболеваний Elixhauser. Установлено, что у 15 (7,1%) больных коморбидность по Elixhauser была 0 баллов, от 1–5 – у 115 больных (54,7%). А у 44 (21,8%) больных сумма баллов была от 6 до 13 и у 35 (16,4%) – более 14. Таким образом, сопутствующие заболевания, определенные по шкале Elixhauser, в значительной степени указывали на высокую степень вероятности внутрибольничной летальности в течение 30-дневной госпитализации у 79 (37,1%) больных.
После разрешения ОТКН все пациенты разделены на 3 группы, в которых лечение всегда начинали с консервативных мероприятий (возмещение ОЦК за счет ресусцитации, сифонные клизмы и т.д.). В I группу включили 44 (20,9%) больных, у которых ОТКН разрешили консервативно. Во II группу объединили 64 (30,4%) больных, которым при выполнении срединного чревосечения принимали решение о нецелесообразности радикальной операции и необходимости наружной или внутренней декомпрессии кишки без удаления опухоли. III группу составили 102 (48,5%) пациента, которым в зависимости от места расположения опухоли накладывали илео- или колостому через мини-доступ (табл. 2). Основные этапы колостомии из мини-доступа представлены на рис. 1.
Таблица 2
Распределение больных на группы в зависимости от способа разрешения ОТКН
|
№ группы |
Вид операции |
кол-во б-х |
% |
|
I |
Консервативное разрешение ОТКН с отсроченными радикальными операциями |
44 |
20,9 |
|
II |
Срединное чревосечение, разрешение ОТКН без удаления опухоли, из них: |
64 |
30,4 |
|
– с наружной декомпрессией ободочной или подвздошной кишки |
51 |
24,3 |
|
|
– с формированием обходных межкишечных соустий |
13 |
6,2 |
|
|
III |
Разрешение ОТКН наложением кишечного свища через мини-доступ, из них: |
102 |
48,5 |
|
– колостомия |
100 |
47,7 |
|
|
– илеостомия |
2 |
0,9 |
|
|
В с е г о : |
210 |
100 |
Во всех группах радикальные операции выполняли через срединную лапаротомию под эндотрахеальным наркозом с мобилизацией ободочной кишки с опухолью либо в латеральномедиальном, либо медиально-латеральном, либо в комбинированном направлении. В I группе при рецидиве ОТКН выполняли колостомию через срединный доступ – 2 (4,5%) или через мини-доступ – 2 (4,5%) или первично-радикальную операцию, при которой у больных с субкомпенсированной ОТКН до мобилизации кишки выполняли интраоперационную назоинтестинальную декомпрессию зондом Эббота–Мюллера. Во II и III группе (после предварительной коло- или илеостомии из мини-доступа) операцию начинали с ушивания полного двуствольного наружного толстокишечного, реже тонкокишечного, свища на передней брюшной стенке, а затем выполняли лапаротомию и резекцию кишки с опухолью вышеописанной методикой вместе со свищом. По показаниям (высокий риск несостоятельности межкишечного анастомоза) накладывали превентивную колостому выше межкишечного анастомоза.
Всех 44 больных I группы разделили на 2 подгруппы для удобства анализа влияния способа нутритивной поддержки на течение заболевания после консервативного разрешения ОТКН (табл. 3). В п/гр IА включили 15 пациентов, которым после консервативного разрешения ОТКН назначали диетическое питание по Певзнеру с ограничением клетчатки.
В п/гр IВ включены остальные 29 больных I группы, получавшие полное энтеральное питание (ЭП) путем сипинга («Нутрикомп
Диабет», «Нутрикомп Ренал» («Б.Браун», Германия), «Клинутрен Диабет», «Модулен» («Нестле», Швейцария), «Диазон» («Нутриция», Нидерланды), Нутрикомп Стандарт и др.) из расчета 35–40 ккал/кг/сутки. Кроме сбалансированных смесей больные принимали жидкости через рот. Необходимую больным энергию рассчитывали по рекомендациям ESPEN, соотнося с формулой Харриса–Бенедикта с поправкой на коэффициент 1,2–1,5 в зависимости от тяжести нарушений трофического статуса. С целью адаптации тощей кишки к приему энтеральных смесей, стартовый режим начинали с введения ½ суточной дозы питательного изокаллорийного субстрата (т.е. 1 ккал/мл) в объеме 50 мл/час. При хо-
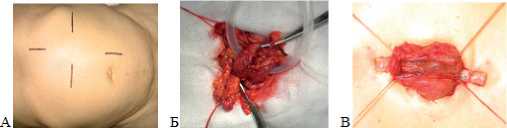
Рис. 1. Колостомия из мини-доступа (этапы на примере трансверзостомии). А – маркером нанесены линии для определения места предстоящего разреза для мини-доступа в зоне проекции поперечной ободочной кишки (ПОК). Б – под ПОК подведена силиконовая трубка. В – кишка и силиконовая трубка фиксирована к коже, вскрыт просвет кишки в поперечном направлении
рошей переносимости скорость кормления могла быть увеличена до 75 мл/ч каждые 4–8 ч с постепенным увеличением энергоемкости на 25% в день до достижения назначенного объема. Таким образом, возможность проведения адекватного БЭО у больных подгруппы IВ появлялась через 2–3 суток после операции. Именно к этому времени больных полностью переводили на питание сбалансированными смесями в зависимости от потребности (35–40 ккал/кг/сут).
В подгруппу IIА включили 29 (45,3%) больных, у которых после разрешения ОТКН по разрешению явлений пареза ки-
Таблица 3
Способ нутритивной поддержки после консервативного разрешения ОТКН (I группа)
В III группе 28 (27,4%) больных получали только традиционное оральное питание по Певзнеру, энергетической ценностью менее 25 ккал/кг/сут и были определены в подгруппу IIIA. Так, больным с суб- и декомпенсированной ОТКН проводили инфузионную терапию электролитными растворами в течение 1–2 суток, затем назначали пробное питье, после чего стол по Певзнеру. У больных с компенсированной ОТКН инфузионную поддержку проводили интраоперационно, спустя 2–3 часа после операции разрешали пить, через 8–10 часов назначали оральное питание.
Таблица 4
Распределение больных II и III группы в зависимости от способа питания после хирургического разрешения ОТКН
|
Номер подгруппы |
Вид нутритивной поддержки |
№ группы |
Количество больных, % |
|
|
II |
III |
|||
|
А |
Оральное питание (диеты по Певзнеру) |
29 |
28 |
57 (34,3%) |
|
В |
Смешанное оральное питание |
35 |
74 |
109 (65,7%) |
|
В с е г о : |
166 (100%) |
|||
В III группе 74 (72,5%) пациентов, которых определили в подгруппу IIIВ, после хирургической декомпрессии кишечника осуществляли плавный переход от ППП до смешанного ораль- ного питания. Им после операции назначали питье по мере появления жажды. Затем при восстановлении всасывательной функции кишечника начинали белково-энергетическое обеспечение (БЭО) пациентов 50% сбалансированной смесью из расчета 1/2 суточной потребности в энергии, доводя ее долю до 35–40 ккал в сутки, объемом не более 50 мл/ч, а остальной объем питания получали за счет диет по Певзнеру.
При суб- и компенсированной ОТКН пробный сипинг (прием сбалансированных диет через рот) начинали через 8– 12 часов после завершения операции из расчета 20–30 ккал/кг/ сутки. При отсутствии тошноты и гастростаза добавляли питание через рот диетой № 1 по Певзнеру, а затем доводили объем энтеральных смесей из расчета 30–35 ккал/кг/сутки.
В послеоперационном периоде функциональные нарушения кишечника у больных во всех подгруппах всех групп протекали по-разному. Проявления зависели как от способа разрешения ОТКН и степени ее компенсации, так и от способа нутритивной поддержки. Срединное чревосечение и традиционное оральное питание усугубляли энтеральную недостаточность, в то время как отсутствие пареза кишки и ЭНП ее нивелируют. Это проявляется в уменьшении продолжительности и объеме жидкого отделяемого по колостоме.
Трофический статус (ТС) оценивали в соответствии с рекомендациями Европейского общества энтерального и парентерального питания (ESPEN). В соответствии с индексом Кетле нормальное питание было выявлено у 85 (40,5%), повышенное 44 (21,0%) больных, ожирение I–IV степени имело место у 38 (18,0%), пониженное – у 43 (20,5%) пациентов. При анализе динамики биохимических маркеров ТС учитывали этапы синтеза трансферрина, альбумина и общего белка: при положительном азотистом балансе нарастание трансферрина начинается с 7 суток, альбумина – через 14 дней, а общего белка – не ранее 3–4 недель. Дополнительно больные вели дневники об объеме и характере съеденной пище с перерасчетом каллоража по стандартным номограммам.
Результаты хирургического лечения, оценивали по частоте послеоперационных осложнений, летальности и по социальным показателям (количество стомированных больных, которым в последующем требовалась еще операция по восстановлению непрерывности кишечника). Для оценки радикальности операции изучали протоколы операций, выписки из истории болезни и патоморфологические заключения (дистальная и проксимальная границы резекции, количество удаленных лимфоузлов) в I и III группах.
Трофический статус был изучен у всех пациентов трех групп тотчас после разрешения ОТКН и перед радикальной операцией. У 55 сопоставимых больных с ОТКН после ее малоинвазивного или консервативного разрешения выявили следующие типы истощения: маразм (кахексия) – 14,5% (8) наблюдений, квашиоркор – 45,4% (25), и маразматический квашиоркор – 40% (22).
По критериям ESPEN была выявлена БЭН у всех больных всех групп, однако в I группе преобладала легкая степень, в то время как во II и III ее средняя и тяжелая степень (табл. 5). При анализе в зависимости от локализации опухоли установлено, что больные с правосторонней ОТКН почти в 1,5 раза больше страдают БЭН тяжелой степени, нежели с левосторонней.
Степень и тип БЭН у больных ОТКН в зависимости от локализации опухоли
Таблица 5
|
Локализация |
Правая половина ободочной кишки, % |
Левая половина ободочной кишки, % |
|
|
Степень |
Легкая |
1 (5,5) |
8 (9,8) |
|
нарушения ТС |
Средняя |
3 (16,6) |
38 (46,9) |
|
Тяжелая |
14 (77,9) |
35 (43,2) |
|
|
Тип |
Маразм (кахексия) |
3 (16,6) |
10 (12,3) |
|
нарушения ТС |
Квашиоркор |
8 (44,4) |
41(50,6) |
|
Мразматический квашиоркор |
7 (39,0) |
40 (37,1) |
|
|
Всего |
18 (100) |
81 (100) |
|
Летальность в I группе в целом составила 13,6%, частота послеоперационных осложнений – 29,5%. Cпособ предоперационной нутритивной подготовки существенно влиял на частоту рецидивов ОТКН после ее консервативного разрешения, частоту осложнений и летальность при радикальной операции (табл. 6). Так, из 15 больных п/гр IA, которым предоперационную подготовку проводили на фоне приема воды и пищи через рот с дополнительным парэнтеральным питанием, у 11(73,3%) больных в сроки от 3 до 10 суток ОТКН рецидивировала. Все они были срочно оперированы. Операция типа Гартмана проведена 4 (26,6%) пациентам, а 3 (20%) больным – правосторонняя гемиколэктомия. Остальным пациентам по срочным показаниям выполнена колостомия: через срединный доступ – 2 (13,3%) или через мини-доступ – 2 (13,3%). После операции осложнения возникли у 7 (63,6%), а умерли 3 (27,2%) больных. Только 4 (26,7%) пациентов удалось оперировать отсрочено на 10–12 сутки от момента разрешения ОТКН. Из них осложнения возникли у 1 (25,0%), вследствие чего он умер после повторной операции по поводу распространенного перитонита на фоне несостоятельности швов соустья.
Структура операций, уровень летальность и осложнений у больных I группы в зависимости от способа НП
|
Характеристика подгруппы и операции, абс. (%) |
Операции типа Гартмана, абс. (%) |
Резекция ОК, абс. (%) |
Резекция ОК + превентивная стома, абс. (%) |
Летальность абс. (%) |
Осложнения, % |
|
Срочные, IA |
4 (72,4) |
3 (27,3) |
(0) |
3 (27,2) |
7 (63,6) |
|
Отсроченные, IA |
2 (50,0) |
1 (25,0) |
1 (25,0) |
1 (25) |
1 (25) |
|
Срочные, IB |
2 (100,0) |
(0) |
(0) |
1 (50) |
1 (50) |
|
Отсроченные, IB |
(0) |
20 (74,1) |
7 (25,9) |
1 (3,7) |
4 (18,5) |
Из 29 пациентов п/гр IВ, находившихся на полном ЭП, лишь у 2(6,9%) при подготовке к отсроченной операции в сроки от 1 до 8 суток после разрешения ОТКН рецидивировала и потребовала срочной операции (операция типа Гартмана) – умер
1 (50,0%) больной от гнойно-септических осложнений. После отсроченных операций у 27 пациентов п/гр IВ осложнения возникли у 4 (18,5%) пациентов, умер 1 (3,7%). Большинству больных (74,1%) выполнили резекцию ободочной кишки с наложением анастомоза и сохранением непрерывности кишечной трубки, в то время как 7 (25,9%) после радикальной операции была наложена превентивная стома.
Итак, существенному снижению общей летальности IВ (7,4%) и послеоперационных осложнений (17,2%) после консервативного разрешения ОТКН у больных IВ группы способствовало полное ЭП за счет снижения количества рецидивов ОТКН до 6,9%. В то время как у больных, получавших традиционные диеты по Певзнеру (группа IA), летальность и частота послеоперационных осложнений составили 26,6% и 53,3% соответственно.
Энергетическая ценность потребляемых продуктов в п/гр IIА и IIIА не превышала 10–25 ккал/кг/сутки и составила от 650 до 1875 ккал/сут (в среднем в п/гр IIА 865±215 ккал/сут; в п/гр IIIА – 1262±613 ккал/сут, р<0,05). При этом п/о период в течение первой недели у пациентов п/гр IIIА при питании диетами по Певзнеру протекал с потерями жидкости со стулом до 1000 мл в сутки у больных с декомпенсированной ОТКН. Формирование каловых масс наступало к концу второй недели. Указанные проявления были связаны, по-видимому, с воспалительными изменениями в стенке тонкой и ободочной кишок. У пациентов п/гр IIB и п/гр IIIB после разрешения ОТКН стул становился оформленным в течение 4–7 дней (в зависимости от степени компенсации).
Раннее и адекватное питание больных п/гр IIIВ способствовало их ранней активизации и оптимальному течению послеоперационного периода с нормализацией гемоглобина и висцерального пула белка в течение 4 недель, что позволяло ставить показания для проведения радикальной операции. Ни один из вариантов предоперационной подготовки не влиял на исходные антропометрические показатели.
Из 64 больных II группы из-за тяжелых сопутствующих заболеваний, прогрессирования опухолевого процесса или страха Таблица 6 больных перед повторной операцией, радикальные операции удалось выполнить лишь 28 (43,75%) больным. В том числе 10 больным п/гр IIА: операция типа Гартмана – 6 (60%), левосторонняя гемиколэктомия – 2 (20%), правосторонняя гемиколэктомия – 2 (20%)). В п/гр IIB радикальные операции выполнили 18 больным: правосторонняя гемиколэктомия – 7 (38,9%), левосторонняя гемиколэктомия – 4 (22,2%) (из них 3 наблюдения с превентивной колостомией), операция типа Гартмана – 7 (38,9%) (табл. 7).
В III группе через 2-4 недели после нутритивной подготовки радикально оперированы 92 (90,2%) больных. В п/гр IIIА радикально оперированы 23 (82%) больных: операция типа Гартмана – 13 (56,5%), левосторонняя гемиколэктомия – 10 (45,5%). Причем превентивную колостомию применили у 8 (80%) больных п/гр IIIА. В п/гр IIIВ радикальную операцию выполнили 69 (93,2%) больным: резекция ободочной кишки с анастомозом – 49 (71,0%) (правосторонняя гемиколэктомия – 18 (26,1%); левосторонняя гемиколэктомия – 24 (34,9%);. резекция сигмовидной кишки – 7 (10,1%)), а операция Гартмана – 20 (29,0%). В п/гр IIIВ наложение превентивной колостомы потребовалась лишь в 6 (8,7%) наблюдениях (табл. 7).
Общая летальность и частота осложнений после радикального хирургического лечения во II группе составили 14,2% и 57,1% соответственно, и в III группе 5,4% и 15,2%, соответственно. Из радикально оперированных пациентов п/гр IIA осложнения возникли у 6 (60,0%), умерло 2 (20%). В п/гр IIB осложнения возникли у 8 (44,4%) пациентов с летальностью 11,1% (2). В то же время в п/гр IIIA послеоперационные осложнения возникли у 9 (39,1%) больных, а умерло 2 (8,7%) больных. В п/гр IIIB, где метаболическая поддержка осуществлялась за счет энтеральных смесей, осложнения возникли у лишь у 5 (7,2%) при летальности 4,3% (из 69 умерли 3 больных) (табл. 7).
Независимыми факторами, ассоциированными с ранними рецидивами ОТКН, являлись отек брыжейки тонкой кишки и мезоколона, а так же дилатация и отек петель тонкой и ободочной кишок различной степени выраженности, что затрудняло проведение лимфодиссекции. При исследовании удаленных препаратов (рис. 2А) установлено, что существенно большее количество лимфоузлов в препарате обнаружено при резекциях ободочной кишки у больных I группы, находившихся на полном энтеральном питании, за счет большего количества отсроченных резекций в сравнении с операциями на фоне рецидивов ОТКН. Среднее количество лимфатических узлов, найденных в удаленном препарате IB п/гр при правосторон-
Таблица 7
Структура выполненных операций, уровень летальность и осложнений у больных II и III групп в зависимости от способа НП
нем раке составило 13,7±4,5 против 7,2±3,2 л/у в IА п/гр, так и при левостороннем раке – 11,2±4,3 против 6,2±4,4 у больных тех же групп соответственно. Незначительно, но так же больше был сегмент удаленной кишки с опухолью – 286±62 мм против 267±67 мм при правосторонней гемиколэктомии, в то время как при левосторонней гемиколэктомии эта разница была достоверно больше 360±74 мм против 238±56 мм (табл. 8).
Таблица 8
Результаты патоморфологического исследования удаленного участка кишки с опухолью у больных I группы
|
Сторона резекции |
Энтеральное питание |
Диеты по Певзнеру |
|
Правосторонний рак |
||
|
Количество лимфоузлов |
13,7 (7–25) |
7,2 (4–15) |
|
Позитивные лимфоузлы |
3,1±2,4 |
2,88±2,4 |
|
Длина удаленного участка кишки с опухолью, мм |
286±62 |
267±67 |
|
Левосторонний рак |
||
|
Количество лимфоузлов |
11,2 (5–16) |
6,2 (1–13) |
|
Позитивные лимфоузлы |
3,205±2,7 |
3,2±2,08 |
|
Длина удаленного участка кишки с опухолью, мм |
360±74 |
238±56 |
В то же время существенных различий по этим параметрам (рис. 2Б, 2В) у больных III группы не найдено. При правостороннем и левостороннем раке у больных было найдено сопоставимое число лимфатических узлов при схожей длине удаленного сегмента с опухолью (табл. 9).
Обсуждение
Обтурационная толстокишечная непроходимость – одно из наиболее грозных осложнений рака толстой кишки, первичнорадикальное лечение которого характеризуется высоким уровнем осложнений и летальности. С целью улучшения результатов, в хирургической практике применяются методики миниинва-зивной декомпрессии ободочной кишки с отсроченной резекцией. РТК – это длительно протекающий процесс, приводящий к постепенному опухолевому сужению просвета кишки и нарастанию кишечного стаза с хрониче-
|
Хар-ка подгруппы и операции, абс. (%) |
Операции типа Гартмана, абс. (%) |
Резекция ободочной кишки, абс. (%) |
Резекция ободочной кишки + превентивная стома, абс. (%) |
Летальность, абс. (%) |
Осложнения, абс. (%) |
|
IIA |
60 |
30 |
10 |
2 (20) |
6 (60) |
|
IIB |
38,8 |
44,6 |
16,6 |
2 (11,1) |
8 (44,4) |
|
IIIA |
56,5 |
8,8 |
34,7 |
2 (8,7) |
9 (39,1) |
|
IIIB |
29,0 |
62,3 |
8,7 |
3 (4,3) |
5 (7,2) |
ской внутрипросветной гипертензией, что приводит к изменению цитоархитектоники стенок толстой и тонкой кишок, мальдигестии и мальабсорбции. Вкупе с синдромом гиперметаболизма-гиперкатаболизма,
Таблица 9
Результаты патоморфологического исследования удаленного участка кишки с опухолью у больных III группы
|
Сторона резекции |
Энтеральное питание |
Диеты по Певзнеру |
|
Правосторонний рак |
||
|
Количество лимфоузлов |
8,9 (2–13) |
9,4 (2–14) |
|
Позитивные лимфоузлы |
4,1±2,9 |
3,9±3,205 |
|
Длина удаленного участка кишки с опухолью, мм |
307±33 |
316±54 |
|
Левосторонний рак |
||
|
Количество лимфоузлов |
8.1 (2–10) |
8,6 (4–12) |
|
Позитивные лимфоузлы |
4,2±3,3 |
3,8±3,3 |
|
Длина удаленного участка кишки с опухолью, мм |
387±50 |
390±45 |
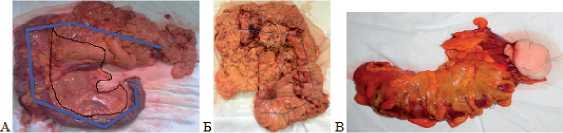
Рис. 2. Удаленные макропрепарат ОК с опухолью после отсроченных резекций у больных I группы. А – удаленный препарат на фоне рецидива ОТНК на 4 сутки (черным выделен мезоколон с питающими сосудами и лимфатическим коллектором, синим выделен участок удаленной кишки с опухолью); Б – удаленный левый фланг ободочной кишки вместе после трансверзоостомии;
В – удаленный участок сигмовидной кишки вместе после сигмостомии свойственным опухолевому процессу, хронические изменения в стенке кишки ведут к нарушению ее функции, что приводит к БЭН, и что является высоким фактором риска осложнений и летальности при радикальном лечении. При диетах Певзнера больные не потребляют достаточное количество пластических элементов и энергии, что ведет к прогрессированию БЭН. В то же время питание энтеральными смесями приводило к раннему восстановлению положительного азотистого баланса и позволяло радикально оперировать больных через 3–4 недели после миниинвазивной декомпрессии. Способ НП после разрешения ОТКН существенно влияет на частоту рецидивов после ее консервативного разрешения. Так, использование в процессе подготовки к отсроченным операциям диет Певзнера приводило к рецидивам ОТКН у 73,4% пациентов, что ведет к летальности 26,6% и осложнениям у 53,3% больных; а полное энтеральное питание (ПЭП) сбалансированными смесями без клетчатки ведет к снижению частоты рецидивов ОТКН до 6,9% со снижением летальности и осложнений более чем в 2,5 раза. ПЭП после разрешения ОТКН является лучшим способом подготовки к отсроченным операциям. Ни в одном наблюдении в I группе при рецидиве ОТКН не была выполнена лимфодис-секция в медиально-латеральном направлении, что, возможно, оказало влияние на результаты анализа патоморфологических исследований: достоверное увеличение найденных лимфоузлов (13,7 против 7,2) и больший удаленный сегмент кишки с опухолью (286 мм против 267 мм). Срок подготовки в течение 10–12 суток приводит только к достижению положительного азотистого баланса с недостаточной коррекцией висцерального и соматического пула белка.
Применение в процессе подготовки к отсроченным операциям диет Певзнера после декомпрессии путем колостомии из мини-доступа сопровождалось осложнениями в 39,1% и летальностью 8,7%, а применение энтеральных смесей в течение 3–5 недель способствовало снижению этих показателей до 7,2% и 4,3% соответственно. При этом качество лимфодиссекции, оцененного морфометрически, достоверно не отличалось в зависимости от способа нутритивной подготовки.
Выводы
-
1. Особенности функциональных нарушений кишечника напрямую зависят от исходной степени ОТКН и обусловлены гистопатологическими изменениями в кишечной стенке: по мере декомпенсации нарастает длительность и тяжесть функциональных недостаточности кишечника.
-
2. Тактика лечения и способы НП имеют определяющее значение для функционального недостаточности кишечника: срединное чревосечение и традиционное оральное питание усугубляют энтеральную недостаточность, в то время как отсутствие пареза кишки и ЭНП ее нивелируют.
-
3. Для всех больных с обтурационной толстокишечной непроходимостью характерно нарушение трофического статуса различной степени выраженности, представлен преимущественно квашиоркором – 40,0% и маразматическим квашиор-кором – 45,4%, при этом у больных с правосторонней локализа-цей опухоли в 1,5 раза чаще выявляли белково-энергетическую недостаточность тяжелой степени тяжести – 77,9%, в сравнении с левосторонней локализацией опухоли, где белковоэнергетическую недостаточность аналогичной тяжести встречали в 43,2% наблюдений.
-
4. После консервативного разрешения обтурационной толстокишечной непроходимости рецидив при использовании диет по Певзнеру достигает 73,4%, в то время как полное энтеральное питание позволяет снизить частоту рецидивирования более чем в 10 раз – до 6,9%, способствуя выполнению операции в отсроченном порядке со снижением частоты послеоперационных осложнений до 14,8% и летальности до 3,7% по сравнению с традиционным оральным питанием.
-
5. Энтеральная нутритивная поддержка после декомпрессии ободочной кишки является оптимальной тактикой лечения обтурационной толстокишечной непроходимости, так как позволяет улучшить трофический статус, и через 3–4 недели проводить радикальные операции со снижением частоты послеоперационных осложнений (7,2%) и летальности (4,3%), а также способствует завершению отсроченных операций формированием большего количества межкишечных анастомозов
(62,3%) с сокращением превентивных (8,7%), и постоянных (29,0%) колостом.
Список литературы Выбор способа нутритивной подготовки пациентов раком ободочной кишки, осложненным кишечной непроходимостью, к радикальной операции
- Алекперов С.Ф., Пугаев А.В., Ачкасов Е.Е., Калачев О.А., Волков В.С., Посудневский В.И. Современные тенденции в хирургическом лечении обтурационной толстокишечной непроходимости опухолевого генеза//Российский онкологический журнал. 2010. №1. с. 54-57.
- Григорьев Е.Г., Цмайло В.М., Нестеров И.В. Роль проекционной колостомии при опухолевой толстокишечной непроходимости с полиорганной дисфункцией//Бюллетень ВСНЦ СО РАМН, 2006. №4 (50). Приложение. с. 65-69.
- Давыдов М.И., Аксель Е.М.//Вестник РОНЦ им. Н. Н. Блохина РАМН. 2010. т. 21, №2 (80). (прил. 1).
- Дибиров М.Д., Малышев Е.А., Джаджиев А.Б. Хирургическая тактика при обтурационной толстокишечной непроходимости//Клиническая геронтология. 2008. т. 14, № 4. С. 11-16.
- Ерюхин И.А., Петров В.П., Ханевич М.Д. Кишечная непроходимость. Руководство для врачей. СПб., 1999.448 с.
- Кравец Б.Б., Пастухов А.А., Пастухова Л.Ю. Структура неотложных оперативных вмешательств при злокачественных новообразованиях и причины, ведущие к появлению осложненных форм рака толстой кишки//Врач-аспирант. 2006. № 1(10). С. 9-12.
- Лотоков А. М., Комов Д. В., Комаров И. Г. Острая кишечная непроходимость опухолевого генеза//Вестник РОНЦ им. Н. Н. Блохина РАМН. 2006. Т. 17, №4. С. 29-33.
- Пугаев А.В., Ачкасов Е.Е. Обтурационная опухолевая толстокишечная непроходимость. М.: Профиль, 2005. 223 с.
- Салтанов А.И., Сельчук В.Ю., Снеговой А.В. Основы нутритивной поддержки в онкологической клинике. М.: МЕДпресс-информ, 2009. 239 с.
- Arends J., Bodoky G., Bozzetti F. ESPEN Guidelines on Enteral Nutrition: Non-surgical oncology//Clinical Nutrition. 2006. Vol. 25. P. 245-259.
- Bossola M., Pacelli F., Rosa F. et al. Does nutrition support stimulate tumor growth in humans?//Nutr. Clin. Pract. 2011. Vol. 26(2). P. 174-180.
- Dauphine´e C.E., Tan P., Beart R.W. Placement of self-expanding metal stents for acute malignant large-bowel obstruction: a collective review.//Ann. Surg. Oncol. 2002. №9. P. 574-557.
- Kim S.Y. Radiologic placement of uncovered stents for the treatment of malignant colorectal obstruction//J. Vasc. Interv. Radiol. 2010. Vol. 21(8). P. 1244-1249.
- Matsui T., Tsuda S., Yao K. et al. Natural history of early colorectal cancer: evolution of a growth curve//Dis. Colon Rectum. 2000. Vol. 43 (Suppl. 10). P. 18-22.
- Park I.J., Choi G.S., Kang B.M. Comparison of one-stage managements of obstructing left-sided colon and rectal cancer: stent-laparoscopic approach vs. intraoperative colonic lavage//J. Gastrointest. Surg. 2009. Vol. 13(5). P. 960-965.
- Schiesser M., Müller S., Kirchhoff P. Assessment of a novel screening score for nutritional risk in predicting complications in gastro-intestinal surgery//Clinical Nutrition. 2008. Vol. 27. Issue 4. P. 565-570.


