Выбор устройств церебральной защиты при каротидном стентировании
Автор: Коробков А.О., Волков С.В., Багин С.А., Лавренко С.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 1 (49), 2021 года.
Бесплатный доступ
В статье проанализирован ретроспективный анализ отдаленных результатов 316-ти каротидных стентирований, выполненных у пациентов с атеросклеротическими стенозами экстракраниальных отделов внутренних сонных артерий при использовании различных типов устройств церебральной защиты - фильтры и устройства проксимальной защиты и их комбинации. В результате проведенного анализа получены данные о влиянии выбора устройств церебральной защиты на риски развития ишемических осложнений. Рассматриваемая тема будет интересна специалистам по рентгенэндоваскулярной диагностике и лечению, сердечно-сосудистым хирургам, неврологам.
Каротидное стентирование, стент, устройства церебральной защиты, фильтр, устройство проксимальной защиты, частота инсульта, отдаленные результаты
Короткий адрес: https://sciup.org/143176788
IDR: 143176788 | УДК: 616.133.3 | DOI: 10.20340/vmi-rvz.2021.1.CLIN.2
Текст научной статьи Выбор устройств церебральной защиты при каротидном стентировании
В РФ заболеваемость инсультом составляет 450 человек на 100 тыс. населения в год по данным обращаемости населения в лечебно-профилактические учреждения, что превышает средний показатель в европейских странах в 200 человек на 100 тыс. населения [1]. Опасность развития повторных острых нарушений мозгового кровообращения (ОНМК) ежегодно составляет до 10 % с крайне высокой летальностью, достигающей 65 % [2]. Наряду с высокой смертностью социально значимыми являются последствия инсульта – стойкая утрата трудоспособности, возможности самообслуживания у людей, выживших после инсульта, а также высокий риск развития повторных инсультов. Лишь 10–20 % пациентов возвращаются к трудовой деятельности, большинство становятся стойкими инвалидами вследствие развивающегося неврологического дефицита и зачастую нуждаются в посторонней помощи. Опасность развития повторных ОНМК ежегодно составляет в среднем 9–10 % с более высокой летальностью, достигающей 62–65 % [3].
Показано, что риск развития повторного ишемического инсульта в первые 2 года после перенесенного ОНМК составляет 4–14 %. Эти показатели актуальны и для людей, перенесших транзиторную ишемическую атаку (ТИА), и превышают в 10 раз риск инсульта в общей популяции для того же возраста и пола [4].
Каротидное стентирование (КС) – это метод эндоваскулярного лечения, позволяющий снизить риск развития как первичного, так и последующих ОНМК у пациентов со стенотическим поражением экстракраниальных отделов внутренней сонной артерии (ВСА) [5–11]. Однако, в процессе стентирования существует риск развития интраоперационных осложнений, связанных с манипуляциями в зоне атеросклеротического поражения ВСА и, как следствие, возможной атеро- и тромбоэмболией дистального русла каротидного бассейна, и развитием неврологического дефицита. Для обеспечения безопасности эндоваскулярного лечения были разработаны специальные устройства церебральной защиты (УЦЗ), позволяющие значительно снизить вероятность подобных осложнений. На сегодняшний день обязательное применение УЦЗ рекомендовано всеми наиболее авторитетными национальными руководствами по КС [10–12].
В настоящее время наиболее часто используются два типа УЦЗ: устройства дистальной защиты (УДЗ), в основном представленные фильтрами, и устройства проксимальной защиты (УПЗ), блокирующие антеградный кровоток, и с реверсией кровотока (вторые не представлены на территории РФ) [13]. УДЗ необходимо провести через стеноз ВСА в сложенном виде, затем открыть за зоной стеноза для обеспечения защиты (фильтрации или блокады кровотока) во время стентирования, после чего УДЗ удаляется. В УПЗ реализован принцип окклюзии антеградного кровотока по общей и наружной сонным артериям баллонными катетерами на стороне поражения с целью создания ретроградного тока крови в бассейне ВСА, что позволяет проводить инструментарий без риска дистальной эмболии [14].
Ранние исследования, посвященные сравнению этих типов УЦЗ, не выявили достоверных преимуществ какого-либо из устройств перед остальными в профилактике интраоперационных неврологических осложнений [15].
Однако, в современной литературе все чаще встречаются данные о более высокой частоте периоперационного инсульта при выполнении каротидного стентирования с применением устройств дистальной защиты в сравнении с устройствами проксимальной защиты [16]. Указанная зависимость наиболее четко прослеживается среди пациентов высокой группы хирургического риска.
Материалы и методы
В основу работы положены результаты каротидного стентирования стенотического поражения экстракраниальных отделов внутренних сонных артерий с применением устройств церебральной защиты двух принципиально разных типов – УДЗ (5 различных моделей фильтров) и УПЗ (MoMa Ultra, Medtronic, USA).
В анализ было включено 303 пациента (выполнено 316 КС), находившихся на стационарном лечении в сосудистом центре ФГАУ «Лечебно-реабилитационный центр» МЗ РФ в период с марта 2006 по апрель 2015 года. Показанием к КС было наличие у пациента симптомных стенозов экстракраниальных отделов ВСА более 50 % или асимптомных стенозов выраженностью более 70 %, подтвержденных по данным КТ-, МР-ангиографии или прямой ангиографии. Степень стеноза оценивалась по методу, описанному в североамериканском исследовании NASCET. В остром периоде ОНМК эндоваскулярное лечение не проводилось. УЦЗ использовались в 99,68 % случаев (315 из 316 КС). Чаще других применялись фильтры – в 252 случаях КС (80 %), УПЗ – в 48 случаях (15,24 %), комбинация двух УЦЗ использовалась в 15 случаях (4,76 %).
Непосредственные и отдаленные результаты КС оценивались как по частоте развития новых ишемических исходов в каротидном бассейне (ТИА, Amaurosis fugax, малый (NIHSS ≤ 4 баллов) или большой инсульт (NIHSS ≥ 5 баллов), так и по частоте развития острого инфаркта миокарда (ОИМ) или смертей от сердечно-сосудистых или неустановленных причин. Оценивался общетерапевтический и неврологический статус пациентов при поступлении, через 24 часа после операции, а также на момент явки на контрольное обследование. Изменения со стороны стентированного участка ВСА оценивались методом ультразвукового дуплексного сканирования (УЗДС) в В-режиме и режиме ЦДК. При выписке всем пациентам были рекомендованы кон- трольное УЗДС экстракраниальных отделов ВСА 1 раз в год, а также модификация факторов риска – отказ от курения, контроль артериального давления, липидного профиля, у пациентов, страдающих сахарным диабетом – контроль уровня гликемии. Всем пациентам рекомендовался прием двойной антиагрегантной терапии (клопи-догрель и ацетилсалициловая кислота) в течение года после КС.
Симптомное течение стеноза ВСА было отмечено у 70 (23,1 %) пациентов. У 233 (76,9 %) пациентов наблюдались асимп-томное течение стенотического поражения ВСА. Одностороннее поражение каротидного бассейна отмечалось у 177 пациентов (58,41 %), против двустороннего у 126 (41,59 %) пациентов. При этом сочетание стеноза ВСА с окклюзией с контрлатеральной стороны наблюдалось в 23 (7,6 %) случаях.
Средний возраст пациентов на момент операции составил 65 ± 8,97 лет (от 38 до 86 лет). Преобладали мужчины – 230 (75,4 %), женщин было 75 (24,6 %).
Результаты
Непосредственные результаты КС оценены в 100 % случаев (все 303 пациента).
Среди всех групп пациентов ишемические осложнения на стороне стентирования в раннем (до 30 дней) послеоперационном периоде были отмечены только у 1 (0,33 %) пациента, при этом использовалась двойная церебральная защита (УПЗ + фильтр).
Доступными для анализа отдаленных результатов были 229 (72,46 %) случаев КС у 216 (71,28 %) пациентов. Средний срок наблюдения составил 56 ± 26 месяцев (максимальный – 120 месяцев). В группе пациентов, где применялись фильтры (средний возраст 64,7 ± 8,5 лет; 184 мужчин из 244), средняя степень стеноза составила 85 ± 8 % против 97,2 ± 7 % в группе, где использовались УПЗ (средний возраст 64,69 ± 10,18 лет, 32 мужчины из 43).
В отдаленном послеоперационном периоде в группе пациентов, где применялись фильтры, было отмечено 23 (9,43 %) сердечно-сосудистых осложнения (любые инсульты, инфаркты миокарда, смерти), из них: 6 – ОНМК (2,46 %), 13 смертей (5,32 %), 2 из них по причине инсульта, 2 (0,82 %) – инфаркта миокарда.
В группе, где использовались УПЗ, было отмечено 3 (6,25 %) случая сердечнососудистых осложнений (любые инсульты, инфаркты миокарда, смерти), из них: 1 (2,08 %) ОНМК, 2 (4,17 %) смертей, инфарктов миокарда отмечено не было.
В третьей группе пациентов, где применялись одновременно фильтры и УПЗ было отмечено лишь 1 (6,67 %) сердечнососудистое осложнение ОНМК на стороне стентирования в раннем послеоперационном периоде.
Проходимость стентированной ВСА в сроки наблюдения 56 ± 26 месяцев (максимальный – 120 месяцев) составила 99,34 %. В отдаленном периоде отмечено 2 (0,66 %) случая тромбоза стента.
Обсуждение
Как показано на рисунке 1 по прошествии более половины десятилетия с момента публикации результатов исследования CREST (Carotid Revascularization Endarterectomy versus Stenting Trial) тенденции к изменению частоты развития перио-перационного инсульта при выполнении КС с УДЗ пока не прослеживается [16–27]. Полученные данные актуальны в том числе и для пациентов высокого хирургического риска, а также лиц пожилого возраста (70 лет и старше). Однако, авторы статьи отмечают, что, сравнивая друг с другом результаты представленных 13 исследований, стоит принять во внимание тот факт, что исследования, включавшие УПЗ, не имеют уровня доказательности рандомизированных клинических исследований, что может стать одной из причин разницы по частоте развития периоперационных инсультов [16].
К похожим выводам пришла группа авторов под руководством Paraskevas при систематическом обзоре 21 регистра [28]. Было показано, что частота развития инсульта или смерти по-прежнему достоверно выше при выполнении КС, чем при каротидной эндатерэктомии, без тенденции к снижению рисков развития интраоперационного инсульта при КС с течением времени. Так в мета-анализе 6 проспективных исследований, посвященных оценке эффективности КС, выполненных с двумя различными типами УПЗ (блокирующих кровоток и с реверсией кровотока), Bersin с коллегами показал, что общая частота периоперационных инсультов составила 1,71 % [21]. Среди факторов, достоверно влияющих на риск развития инсульта, авторы выделили только возраст пациента. Так в группе пациентов от 65 до 80 лет частота инсультов составила 1,65 %, а в группе старше 80 лет – 2,38 %. При этом симптомность стеноза ВСА достоверно не влияла на риск развития инсульта.
Несмотря на приведенные данные, отдельные проспективные исследования демонстрируют крайне убедительную эффективность УПЗ в профилактике периоперационных осложнений. Так, в проспективном исследовании ROADSTER (The Safety and Efficacy Study for Reverse Flow Used During Carotid Artery Stenting Procedure), включавшем 208 пациентов, оценивалась эффективность нового УПЗ с реверсией кровотока, требующего прямого артериотомиче-ского доступа к ОСА – MICHI Neuroprotection System (Silk Road Medical Inc, USA) [25].
Данное устройство пока не зарегистрировано для использования на территории РФ, однако представляет интерес в связи с продемонстрированной низкой частотой пе-риоперационного инсульта – 1,41 %. При этом, ни один из случаев инсульта не отмечался у пациентов с симптомными стенозами или в старшей возрастной группе (75 лет и старше), традиционно относящихся к группе высокого риска.
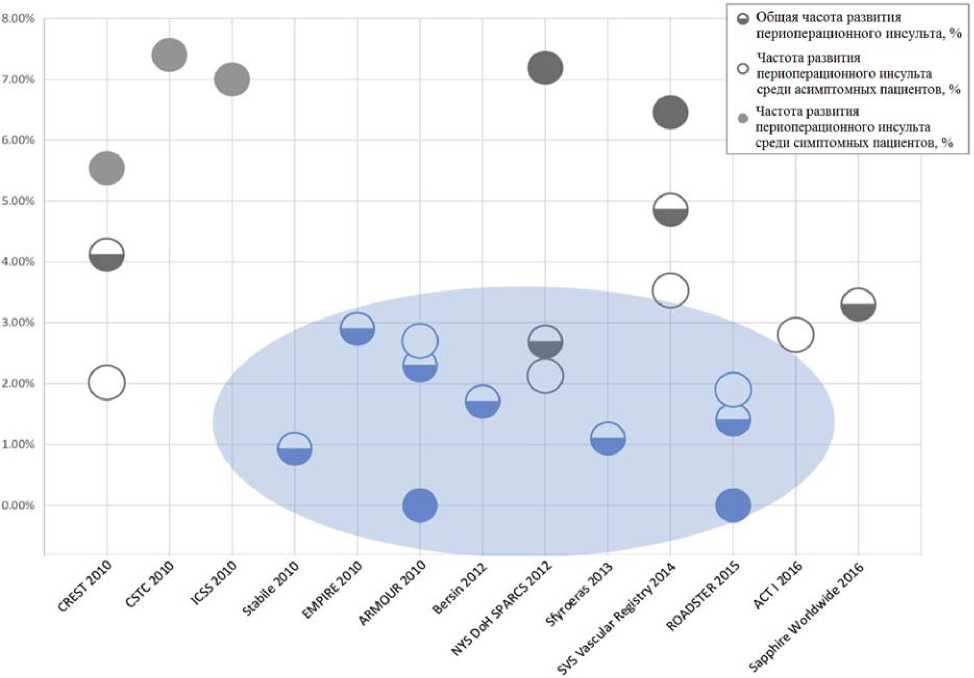
Рис. 1. Частота развития периоперационного (в течение 30 дней после КС) инсульта в современных исследованиях. Серым отмечены исследования, включавшие преимущественно УДЗ, голубым – УПЗ [адаптировано по 16]
Как известно, эмболия дистального русла ВСА при выполнении КС может возникать на любом из этапов операции – при проведении инструментария через зону стеноза, после установки фильтра при его не полной аппозиции или миграции эмболов через поры фильтра в момент имплантации стента или постдилятации, а также в момент удаления фильтра. Чаще всего диаметр пор в фильтрах варьируется от 100 до 200 нм, так как показано, что фильтры с порами меньшего диаметра чаще подвержены тромбозу корзины.
Диффузно-взвешенная МРТ головного мозга (ДВ МРТ ГМ) обладает высокой чувствительностью и специфичностью в выявлении церебральной эмболии, возникшей вследствие КС или КЭА [29–31]. Несмотря на то, что появление новых ишемических очагов приводит к развитию внутриклеточного отека, что, как полагают, предшеству- ет ишемическому некрозу клеток ГМ, прямого влияния новых ДВ-сигналов на развитие острого неврологического дефицита у пациентов показано не было. С другой стороны, Moody D.M. и соавт. в своей работе описали случаи снижения когнитивной функции у пациентов после аортокоронарного шунтирования [32–33]. При вскрытии в микроциркуляторном русле головного мозга таких пациентов выявлялись микроэмболы диаметром от 10 до 70 нм. Клинической манифестации микроэмболии в виде ОНМК или ТИА в период наблюдения у пациентов отмечено не было, таким образом эмболия протекала асимптомно. Однако, прижизненная оценка показала достоверное снижение когнитивных функций у таких пациентов в послеоперационном периоде, что может говорить в пользу необходимости оценки новых ДВ-сигналов, как признаков микроэмболии. В связи с простотой визуа- лизацией, высокой чувствительностью, и специфичностью ДВ МРТ ГМ принято считать одним из способов оценки эффективности и безопасности УЦЗ.
Данные о том, что при использовании УПЗ, в сравнении с УДЗ, регистрируется меньшее количество новых ДВ-сигналов были получены в ряде исследований. В раннем проспективном рандомизированном исследовании PROFI (Prevention of Cerebral Embolization by Proximal Balloon Occlusion Compared to Filter Protection During Carotid Artery Stenting) было показано, что в группе пациентов, которым выполнялось КС с применением УДЗ (фильтры) новые очаги ишемического поражения отмечались достоверно чаще, чем в группе с УПЗ (устройство MoMa), – 87,1 % и 45,5 %, соответственно. Статистически достоверное преимущество в группе УПЗ было получено и в мета-анализе и Е. Stabile, опубликованном в 2014 году [9]. Lee J.H. на выборке из 61 пациента продемонстрировал статистически незначимое преимущество УПЗ – 71 % против 57 % новых ДВ-сигналов в группах УДЗ и УПЗ соответственно [34].
В подтверждение одинаковой эффективности обоих типов устройств стоит привести данные наиболее крупного на сегодняшний день мета-анализа баз данных MEDLINE, EMBASE и the Cochrane Central Register of Controlled Trials, опубликованного в ноябре 2016 года [35]. Всего было проанализировано 18 исследований (13 проспективных и 5 ретроспективных), включавших 12281 пациента, прооперированных с января 1998 года по май 2015 года. Первичными конечными точками были частота периоперационного инсульта или смерти, вторичными – частота развития новых ишемических сигналов и контралатеральных поражений по данным ДВ МРТ ГМ. Средний возраст пациентов составил 69 лет, 64 % из них были мужского пола. Анализ не показал статистически достоверной разницы в обеих группах по частоте развития инсультов (разность рисков (РР) 0,0, 95 % ДИ 20,01–0,01) или смертей
(РР 0,0, 95 % ДИ 20,01–0,01), равно как и по частоте новых ДВ-сигналов или контралатеральных поражений по данным ДВ МРТ. Несмотря на полученные результаты, стоит отметить, что большинство включенных в рассмотренный мета-анализ исследований имели малые по численности выборки, а также отличались критериям оценки эффективности и безопасности УЦЗ (по первичным конечным точкам, критериям п/о инсульта или шкалам оценки клинического состояния пациентов), в связи с чем опубликованные результаты не стоит трактовать однозначно, имея в виду наличие подобной неоднородности.
Одним из способов снижения риск интраоперационной эмболии является применение альтернативного (трансцервикального) доступа. Показано, что до 8 % интраоперационных инсультов отмечаются с контралатеральной от вмешательства стороны, которые возникают как результат манипуляций проводниками или катетерами в области дуги аорты при выраженной извитости сосудов, что часто отмечается среди пожилых пациентов. Применение трансцервикального артериотомического доступа к ВСА позволяет избежать подобных осложнений [25]. Так, в исследовании ROADSTER, посвященном оценке эффективности устройства MICHI Neuroprotection System (Silk Road Medical Inc, USA), ни у одного из пациентов старше 75 лет (47 % от всех пациентов) не было отмечено ишемических осложнений. Leal с коллегами в своем исследовании, оценивая эффективность данного устройства на примере 64 пациентов, показали, что частота развития новых ДВ-сигналов при применении данного устройства значительно ниже, чем при использовании УДЗ (фильтров) классическим трансфеморальным доступом – 12,9 % против 33,3 % (р = 0,03) [36].
Заключение
Отдаленные (максимальные сроки наблюдения до 10 лет, средние – до 4,69 ± 2,2 лет) результаты КС с применени- ем УЦЗ следует признать успешными по таким показателям как частота сердечнососудистых осложнений и частота образования рестенозов. Применение УПЗ позволяет добиться снижения частоты периоперационных осложнений, однако, убедительных данных о преимуществе УПЗ перед
Подводя итог стоит отметить, что несмотря на то, что данные основных метаанализов пока не подтвердили преимуществ в использовании УПЗ, результаты отдельных исследований оставляют достаточно оснований для утверждения, что это является лишь вопросом времени.
фильтрами в отдаленном периоде наблюдения пока получено не было.
Список литературы Выбор устройств церебральной защиты при каротидном стентировании
- Bokeriya L.A., Stupakov I.N., Gudkova R.G. Analiz pokazateley zabolevayemosti razlichnymi formami bolezney sistemy krovoobrashcheniya v federal 'nykh okrugakh RF. Zdravookhraneniye. 2015;6:66-75.
- Suslina Z.A., Piradov M.A. Insul 't: diagnostika, lecheniye, profilaktika. 2-e izd. Moscow: MEDpress-inform -2009. (in Russ).
- Mozaffarian D., Benjamin E.J., Go A.S. Heart Disease and Stroke Statistics-2016 Update: A Report From the American Heart Association. Circulation. 2016;133(4):e38-e360.
- Stakhovskaya L.V., Skvortsova V.I., Chazova I.E. Vtorichnaya profilaktika ishemicheskogo insul 'ta. Consilium Medicum. 2003;5(8). (in Russ).
- Silver F.L. et al. Safety of stenting and endarterectomy by symptomatic status in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST). Stroke. 2011;42:675-680.
- IEderle J, Dobson J, Featherstone RL et al. Carotid artery stenting compared with endarterectomy in patients with symptomatic carotid stenosis (International Carotid Stenting Study): an interim analysis of a randomised controlled trial. Lancet. 2010;375:985-997.
- Yadav JS, et al. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med. 2004;351:1493-1501.
- Rudarakanchana N., Dialynas M., Halliday A. Asymptomatic Carotid Surgery Trial-2 (ACST-2): Rationale for a randomised clinical trial comparing carotid endarterectomy with carotid artery stenting in patients with asymptomatic carotid artery stenosis. Eur J Vasc Endovasc Surg. 2009;38:239-242.
- Stabile E. et al. Cerebral embolic lesions detected with diffusion-weighted magnetic resonance imaging following carotid artery stenting: A meta-analysis of 8 studies comparing filter cerebral protection and proximal balloon occlusion. JACC Cardiovasc Interv. 2014;7:1177-1183.
- European Stroke Organization et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: The Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC). Eur Heart J. 2011 ;32:2851-2906.
- Brott T.G. et al. 2011 ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: Executive summary. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, and the American Stroke Association, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurological Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Neuro-Interventional Surgery, Society for Vascular Medicine, and Society for Vascular Surgery. Circulation. 2011;124:489-532.
- Pokrovskiy A.V. i soavt. Natsional' nyye rekomendatsii po vedeniyu patsiyentov s zabolevaniyami brakhi-otsefal 'nykh arteriy. Angiologiya i sosudistaya khirurgiya. 2013;2:1-72. (in Russ).
- Mousa A.Y. et al. Current update of cerebral embolic protection devices. J Vasc Surg. 2012;56:1429-1437.
- Stabile E., Salemme L., Sorropago G. et al. Proximal endovascular occlusion for carotid artery stenting: results from a prospective registry of 1,300 patients. J Am Coll Cardiol. 2010;55:1661 -1667.
- Lam R.C. Contemporary review of embolic distal protection strategies in carotid artery stenting. J Invasive Cardiol. 2009;21:413-414.
- Kassavin D.S., Clair D.G. An update on the role of proximal occlusion devices in carotid artery stenting. J Vasc Surg. 2017;65:271-275.
- Brott T.G., Hobson R.W. 2nd, Howard G et al; CREST Investigators. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med. 2010;363:11-23.
- Carotid Stenting Trialists' Collaboration, Bonati L.H., Dobson J., Algra A. et al. Short-term outcome after stenting versus endarterectomy for symptomatic carotid stenosis: a preplanned meta-analysis of individual patient data. Lancet. 2010;376:1062-1073.
- Clair D.G., Hopkins L.N., Mehta M. et al. EMPiRE Clinical Study Investigators. Neuroprotection during carotid artery stenting using the GORE flow reversal system: 30-day outcomes in the EMPiRE Clinical Study. Catheter Cardiovasc Interv. 2011 ;77:420-429.
- Ansel G.M., Hopkins L.N., Jaff M.R. et al. Investigators for the ARMOUR Pivotal Trial. Safety and effectiveness of the INVATEC MO.MA proximal cerebral protection device during carotid artery stenting: results from the ARMOUR pivotal trial. Catheter Cardiovasc Interv. 2010;76:1 -8.
- Bersin R.M., Stabile E., Ansel G.M. et al. A meta-analysis of proximal occlusion device outcomes in carotid artery stenting. Catheter Cardiovasc Interv. 2012;80:1072-1078.
- Bisdas T., Egorova N., Moskowitz A.J. et al. The impact of gender on in-hospital outcomes after carotid endarterectomy or stenting. Eur J Vasc Endovasc Surg. 2012. Vol. 44. P. 244-250.
- Sfyroeras G.S., Moulakakis K.G., Markatis F. et al. Results of carotid artery stenting with transcervical access. J Vasc Surg. 2013;58:1402-1407.
- Jim J., Dillavou E.D., Upchurch G.R. Jr et al. SVS Outcomes Committee. Gender-specific 30-day outcomes after carotid endarterectomy and carotid artery stenting in the Society for Vascular Surgery Vascular Registry. J Vasc Surg. 2014;59:742-748.
- Kwolek C.J., Jaff M.R., Leal J.I. et al. Results of the ROADSTER multicenter trial of transcarotid stenting with dynamic flow reversal. J Vasc Surg. 2015;62:1227-1234.
- Rosenfield K., Matsumura J.S., Chaturvedi S. et al. ACT I Investigators. Randomized trial of stent versus surgery for asymptomatic carotid stenosis. N Engl J Med. 2016;374:1011-1020.
- H.S. Gurm et al. Long term results of carotid stenting versus endarterectomy (SAPPHIRE) in high-risk patients. N. Engl. J. Med. 2008;358(15):1572-1579.
- Paraskevas K.I., Kalmykov E.L., Naylor A.R. Stroke/death rates following carotid artery stenting and carotid endarterectomy in contemporary administrative dataset registries: a systematic review. Eur J Vasc Endovasc Surg. 2016;51:3-12.
- Schluter M. et al. Focal ischemia of the brain after neuroprotected carotid artery stenting. J Am Coll Cardiol. 2003;42:1007-1013.
- Lovblad K.O. et al. Diffusion-weighted MRI for monitoring neurovascular interventions. Neuroradiology. 2000; 42:134-138.
- Jaeger H.J. et al. Cerebral ischemia detected with diffusionweighted MR imaging after stent implantation in the carotid artery. AJNR Am J Neuroradiol. 2002;23:200-207.
- Moody D.M., Brown W.R., Challa V.R. et al. Brain microemboli associated with cardiopulmonary bypass: a histologic and magnetic resonance imaging study. Ann Thorac Surg. 1995;59:1304-1307.
- Moody M., Panerai R.B., Eames P.J. Cerebral and systemic hemodynamic changes during cognitive and motor activation paradigms. Am J Physiol Regul Integr Comp Physiol. 2005;288(6):1581 -1588.
- Lee J.H., Sohn H.E., Chung S.Y. et al. Clinical Analysis Comparing Efficacy between a Distal Filter Protection Device and Proximal Balloon Occlusion Device during Carotid Artery Stenting. J Korean Neurosurg Soc. 2015; 58(4):316-320.
- Omran J., Mahmud E., White C.J. Proximal balloon occlusion versus distal filter protection in carotid artery stenting: A meta-analysis and review of the literature. Catheter Cardiovasc Interv. 2017;89(5):923-931.
- Leal I. et al. A diffusion-weighted magnetic resonance imaging based study of transcervical carotid stenting with flow reversal versus transfemoral filter protection. J Vasc Surg. 2012;56:1585-1590.


