Выделение и физико-химические свойства альбуминов семян льна
Автор: Козловская Юлия Владимировна, Лапина Галина Петровна
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 8, 2008 года.
Бесплатный доступ
Растения льна - биосистемы, в которых важную роль в регулировании и нормализации течения биохимических процессов играют различные биомолекулы. Именно белковые макромолекулы определяют структурные характеристики биотканей, их специфические функции и биохимические особенности.
Альбумины семян льна, уфспектроскопия, зональный электрофорез в пааге, метод биуретовой реакции
Короткий адрес: https://sciup.org/146116159
IDR: 146116159 | УДК: 577.322.2
Текст научной статьи Выделение и физико-химические свойства альбуминов семян льна
Введение. Содержание индивидуальных белков в растениях различно. Даже в пределах одного и того же сорта качественный состав белков подвергается глубоким изменениям в зависимости от условий выращивания и других факторов. Семена льна ( Linum usitatissimum L.) содержат от 18 до 33% белковых веществ [1; 2]. Биологическая ценность продукта определяется не только общим количеством содержащихся в нем белков, но и их качеством.
Для оценки качества белков растений используют методы определения отдельных белковых групп в общем белковом комплексе. При этом отдельные белковые группы (альбумины, глобулины, проламины, глютелины) извлекаются различными органическими растворителями, солями, с помощью ионов тяжелых металлов и количественно учитываются [3]. Условия экстракции белков обусловлены особенностями их структуры и свойствами.
Одной из основных трудностей анализа растительных белков является полное экстрагирование белков из ткани растений. Прежде чем приступать к изучению белков, они должны быть выделены из ткани растений и освобождены от сопровождающих их других химических веществ. Следует учитывать также, что белки находятся внутри отдельных растительных клеток, через оболочки которых они не могут диффундировать в окружающий раствор. Поэтому при экстракции белков требуется полное разрушение клеток. Для этого используют различные типы гомогенизаторов.
Объектом исследования настоящей работы служили семена травянистого однолетнего растения льна-долгунца сорта Томский-10. Задачи данной работы: выделение фракции альбуминовых белков из семян льна; количественное определение в них содержания альбуминов с использованием двух методов: методом биуретовой реакции и методом УФ-спектроскопии; определение некоторых физико-химических свойств альбуминов семян льна методом электрофореза в ПААГЕ.
Из семян льна вели выделение и очистку альбуминов по следующей общей схеме: биологический объект – экстракция – центрифугирование-фракционирование – очистка.
Из семян растений льна точной общей массой 0,4863 г проводили выделение и очистку белков альбуминов согласно методике [2].
В процессе выделения и очистки белков альбуминов из гомогената семян льна нами сочетались методы экстракции (перевод белков в растворенное состояние слабощелочным (pH 8,3) трис-глициновым буфером, который обеспечивает наряду с растворением стабилизацию белка); методы фракционирования (разделение фракций альбуминов и глобулинов водного экстракта семян льна методами центрифугирования и высаливания: глобулины выпадают в осадок при 50% насыщения полученного экстракта семян льна сульфатом аммония, альбумины – при 100% насыщения (NH4)2 SO4).
В семенах льна содержание активных полифенолоксидаз и их субстратов невелико. Для экстракции белков использовали буферный раствор без защитных добавок.
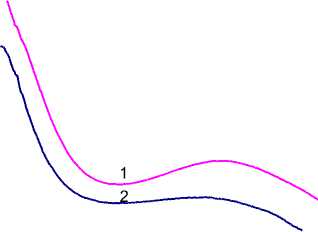
Следующим этапом работы явилось определение концентрации белков альбуминов в водных экстрактах методом УФ-спектроскопии. Для этого в интервале длин волн 220–290 нм были сняты УФ-спектры поглощения водного экстракта альбуминов, выделенных из семян льна, при pH – 6,5, pH – 5,5; выявлен максимум поглощения раствора при длине волны λ = 280 нм (рис.1). Поглощение УФ-лучей растворами белков объясняется присутствием в белках 3-х ароматических аминокислот: триптофана (Три), тирозина (Тир) и фенилаланина (Фен).
D 2,5
2,0
1,5
1,0
0,5
0,0 I-------------------,--------------------,--------------------,--------------------,--------------------,--------------------,--------------------,
230 240 250 260 270 280 290 300
длина волны, нм
Рис.1. УФ-спектры водных экстрактов индивидуальных белков альбуминов из семян льна: 1 - pH – 6,5; 2 – pH – 5,5
Расчет концентрации белков альбуминов в водном экстракте вели по формуле: C=D / l · k, моль/л, где D – оптическая плотность; l – толщина кюветы; k – молярный коэффициент экстинции.
При вычислении концентрации белков альбуминов в водном экстракте использовали значение молярного коэффициента экстинции.
Таким образом, значение концентрации белков альбуминов семян льна в водном экстракте составило (3,60 + 0,15) · 10-5 моль/л или (1,70 + 0,07) · 10-3 г/г сырой массы; n = 3; P = 0,95.
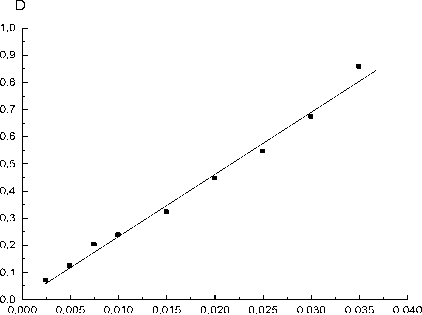
Далее определяли содержания белков альбуминов в семенах льна методом биуретовой реакции. Для этого необходимо построение калибровочного графика, который строили по стандартному белку сывороточного альбумина человека (САЧ) с концентрацией 0,04 г/мл (рис. 2).
Уравнение линейной зависимости оптической плотности от концентрации растворов белков имеет следующий вид:
D = 0,052 + 22,860 С.
С использованием предварительно построенной калибровочной кривой (рис. 2) определяли концентрацию исследуемого белка альбумина семян льна в водном экстракте семян льна (при фотометрировании экстракта альбуминов среднее значение оптической плотности (D) 0,1487), что соответствует 0,005 г/мл.
С, г/мл
Рис. 2. Калибровочный график зависимости оптической плотности (D) от концентрации раствора САЧ (С, г/мл); n = 3, P = 0,95
Используя значение средней молекулярной массы альбуминовых белков, равное 54000, пересчитали значение концентрации 0,005 г/мл и получили величину молекулярной концентрации (9,30 + 0,19) 10-5 моль/л; n = 3, P = 0,95. В расчете на сырую массу семян льна содержание индивидуальных белков альбуминов составило (1,80 + 0,04) 10-3 г/г сырой массы.
Итак, использование двух независимых физико-химических методов позволило получить близкие по значению величины содержания индивидуальной группы альбуминовых белков, составившие в среднем (1,75 + 0,05) ·10-3 г/г сырой массы.
Для подтверждения гомогенности и определения молекулярной массы альбуминов семян льна использовали современный физико-химический метод разделения био-органических молекул – метод зонального электрофореза в ПААГЕ (BioSystems BTS-100 ELECTROPHORESIS POWER SUPPLY, фирма-изготовитель: BioSistems S.A. Barcelona. Spain).
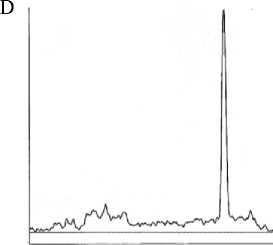
Получены графики зависимости плотности окраски от величины пробега исследуемого образца. Видно (рис. 3), что альбумины семян льна – гомогенная фракция белков.
о.е.
Рис. 3. Электрофореграмма зависимости оптической плотности от длины пробега (альбумины семян льна)
На электрофореграмме четко прослеживается наличие одного крутого пика, который соответствует величине пробега (17±2) о.е. Остальные (минорные) пики свидетельствуют о небольших (возможно, следовых) количествах этих фракций альбуминовых белков. Для расчета значения молекулярной массы альбуминовых белков льна строили калибровочный график с использованием коммерческих препаратов белков- маркеров: алкогольдегидрогеназы (АДГ), сывороточного альбумина человека (САЧ) и пероксидазы хрена (ПОХ).
Было проведено также электрофоретическое разделение белков-маркеров: сывороточный альбумин человека (Mr 45000), алкогольдегидрогеназа (Mr 122000), пероксидаза хрена (Mr 20000) и коммерческих белковых препаратов с известными молеку- лярными массами.
Характер электрофореграммы сывороточного альбумина человека указывает на гомогенность белка и наличие одного доминирующего пика (рис. 4). Следовательно, значения длины пробега, составляющие (17 ± 2) о.е., соответствуют белкам с молеку-
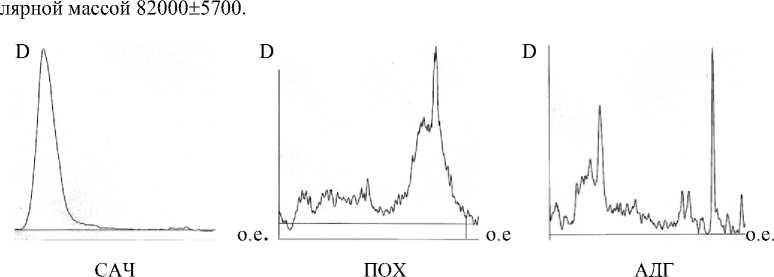
Рис.4. Электрофореграммы зависимости оптической плотности от длины пробега белков-маркеров
В отличие от альбумина человека электрофореграммы пероксидазы хрена и алкогольдегидрогеназы показывают наличие нескольких пиков, что доказывает их гетерогенность. Так, например, в случае алкогольдегидрогеназы на электрофореграмме найдены 2 локализованных пика, свидетельствующих о наличии двух субъединиц у макромолекулы.
Далее строили калибровочный график зависимости молекулярной массы белков от длины пробега (рис. 5) и впервые определили молекулярную массу альбуминов семян льна, составляющую 82000 ± 5700 (с учетом ошибки метода 7%). Полученная характеристика коррелирует с литературными данными. Таким образом, значение молекулярной массы альбуминовой фракции проростков льна составило 75000 до 90000.
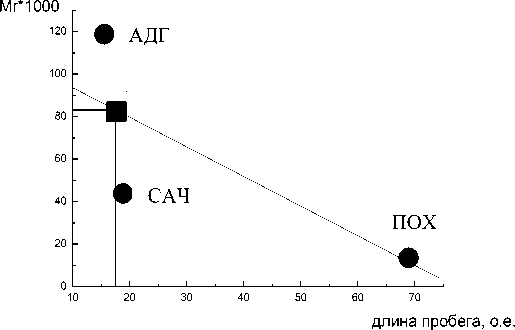
Рис. 5. График зависимости молекулярной массы от длины пробега в о.е.
Выводы. 1. Получен экстракт индивидуальных альбуминовых белков семян льна и проанализирован его УФ-спектр: найден максимум поглощения водных растворов белков, приходящийся на длину волны λ = 278 нм.
-
2. Методами биуретовой реакции и УФ – спектроскопии определено и рассчитано содержание белков альбуминов в семенах растений льна, составившее в среднем (9,30 + 0,19) ·10-5 моль/л, т.е. ∼ 17%.
-
3. Методом зонального электрофореза в ПААГЕ и на агарозе показана гомогенность альбуминовых белков льна с преобладанием одного доминирующего пика, для которого определена молекулярная масса, составившая 82000 ± 5700;
Tver State University
Plants of flax - biosystems in which the important role in regulation and normalization of current of biochemical processes play various biomolecules. Albuminous macromolecules define structural characteristics of biofabrics, their specific functions and biochemical features.


