Выделение, культивирование и характеристика сперматогониев петуха (Gallus gallus)
Автор: Волкова Н.А., Коржикова С.В., Котова Т.О., Ветох А.Н., Волкова Л.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Клеточные технологии в трансгенезе
Статья в выпуске: 4 т.51, 2016 года.
Бесплатный доступ
Использование клеток гонад самцов сельскохозяйственных животных и птицы для получения химерных и генетически модифицированных особей рассматривается как альтернатива традиционным методам селекции и модификации генома и открывает широкие возможности для получения особей с новыми заданными свойствами. В случае трансгенеза такой подход предусматривает целенаправленную генетическую модификацию половых клеток самцов при инъекции рекомбинантной ДНК непосредственно в паренхиму семенников взрослых особей (in vivo) или введении трансформированных донорских сперматогониев в семенники стерильных особей-реци-пиентов (ex vivo) и получении в дальнейшем потомства. В последнем случае ключевые факторы, определяющие эффективность проводимых манипуляций, - получение чистой популяции донорских клеток и элиминация собственных сперматогенных клеток (выключение сперматогенеза). В этой связи остается актуальной разработка эффективных методов выделения и поддержания в культуре стволовых клеток семенников - сперматогониев. Целью наших исследований была оптимизация методических подходов для выделения и культивирования сперматогониев петуха как одного из этапов технологии создания трансгенной птицы. В результате была получена и охарактеризована культура сперматогониев петуха. На основании данных гистологических исследований сперматогенеза у петухов было установлено, что в возрасте до 5 нед сперматогенные клетки представлены преимущественно одним типом клеток - сперматогониями. В связи с этим для получения культуры сперматогониев использовали семенники 2-недельных особей. Выделение сперматогенных клеток из тестикул петуха осуществляли посредством последовательной механической и ферментативной обработок ткани семенника. Для ферментативной диссоциации ткани семенника последовательно обрабатывали раствором коллагеназы в конечной концентрации 1 мг/мл в течение 20 мин и 0,25 % раствором трипсина в течение 30 мин. Для получения максимально чистой популяции сперматогониев учитывали неодинаковую способность разных типов клеток к адгезии. Было установлено, что через 24 ч культивирования первичной культуры тестикул петуха в ростовой среде присутствовали неприкрепившиеся клетки, представленные в основном сперматогенными клетками - сперматогониями. Не прикрепившиеся клетки осаждали и высевали в культуральные чашки с разными фидерными слоями. В качестве фидерных слоев использовали перевиваемую клеточную линию STO, перевиваемые клетки Сертоли свиней (ПТП), клеточную линию Sc, первичные клетки Сертоли петуха. Осуществляли также культивирование сперматогониев на чашках с 0,2 % желатином. Ростовой средой для культивирования сперматогониев служила среда DMEM с высоким содержанием глюкозы (4,5 г/л), дополненная 5 % сывороткой плода коровы («GE Healthcare Life Sciences HyClone Laboratories», США); 2 мМ a-глутамином, МЕМ (Minimum Essential Medium, 10 мкл/мл), антибиотиком (100х), меркаптоэтанолом (5х10-5 М), альбумином (5 мг/мл) («Invitrogen», США); DL-lactic acid (1 мкл/мл), EGF (epidermal growth factor, 20 нг/мл), bFGF (basic fibroblast growth factor, 10 нг/мл) и LIF (leukemia inhibitory factor, 2 нг/мл) («Sigma-Aldrich Сo.», США). Колонии сперматогониев формировались на 3-и-4-е сут культивирования. Оптимальным фидерным слоем для культивирования сперматогониев петуха оказались собственные клетки Сертоли. Наличие колоний сперматогониев подтвердили на 7-суточной культуре иммуногистохимически, использовав специфические антитела к SSEA-1 (stage-specific embryonic antigen-1).
Сперматогонии, сперматогенные клетки, петухи, культура клеток
Короткий адрес: https://sciup.org/142213951
IDR: 142213951 | УДК: 636.52/.58:576.3/.7.086.83:591.04 | DOI: 10.15389/agrobiology.2016.4.450rus
Текст научной статьи Выделение, культивирование и характеристика сперматогониев петуха (Gallus gallus)
Использование клеток гонад сельскохозяйственных животных и птицы для получения трансгенных и химерных особей признано одним из перспективных направлений современной биотехнологии, рассматриваемых в качестве альтернативы традиционным методам селекции и трансгенеза (1-5). Интерес к использованию клеток семенников обусловлен их природной способностью переносить чужеродную ДНК (чДНК) в яйце-
∗ Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-16-10059. В проведении исследований было использовано оборудование ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных» ВИЖ им. академика Л.К. Эрнста.
клетку в процессе оплодотворения. В случае интеграции чДНК в геном хозяина трансген может устойчиво передаваться в ряде поколений. Ввиду проведения манипуляций на взрослых животных значительно сокращается время и затраты на получение трансгенного потомства.
В сперматогенном эпителии можно выделить два типа клеток: поддерживающие клетки (клетки Сертоли) и клетки сперматогенной линии (сперматогонии типа А и В, сперматоциты 1-го и 2-го порядка, сперматиды, спермии) (6). Наибольший интерес представляет генетическая модификация стволовых клеток гонад — сперматогониев типа А, которые служат предшественниками высокоспециализированных зрелых половых клеток самцов — спермиев. Эти клетки представляют собой немногочисленную популяцию сперматогенных клеток, располагающихся на базальной мембране семенных канальцев, и обладают способностью к самообновлению и дифференцировке, что обеспечивает непрерывность сперматогенеза с образованием спермиев (7, 8). Такие свойства сперматогониев открывают широкие возможности для реализации их потенциала при создании трансгенных и химерных особей с заданными свойствами.
В случае трансгенеза рассматриваются два подхода по доставке рекомбинантной ДНК в сперматогенные клетки семенников, в том числе в сперматогонии, — in vivo и ex vivo. В первом случае предполагается введение генных конструкций непосредственно в семенники взрослых самцов. Для этих целей используют, как правило, ретровирусные и лентивирусные векторы, которые способны самостоятельно интегрироваться в геном клетки-хозяина и трансформировать клетки-мишени с высокой эффективностью (9, 10). При введении рекомбинантной ДНК в сперматогенные клетки ex vivo выполняют трансформацию сперматогониев in vitro с последующей трансплантацией в семенники стерильных самцов-реципиентов и получением трансгенной спермы, которая затем используется для осеменения самок с целью рождения трансгенного потомства (11, 12).
Один из ключевых факторов, обеспечивающих результативность этой технологии, — получение культуры сперматогониев. Культивирование и генетическая трансформация сперматогенных клеток самцов in vitro значительно расширяют спектр подходов по доставке рекомбинантной ДНК в клетки-мишени с помощью безопасных систем, позволяют целенаправленно воздействовать на конкретные клетки-мишени. При этом риски появления трансгенных особей-мозаиков с нетрансформированными половыми клетками, от которых в дальнейшем не удается получить трансгенное потомство, полностью нивелируются. Применение позитивной и негативной селекции при модификации половых клеток гарантирует наличие в оплодотворенном ооците единственной копии трансгена, встроенной в определенный локус, и сохранение целостности остального генома. С учетом этого искусственное осеменение трансформированными спермиями в будущем может рассматриваться как элемент программ по массовому получению генетически модифицированной птицы.
Уже выделены и охарактеризованы сперматогонии лабораторных животных — мышей (13, 14) и хомячков (15), некоторых видов сельскохозяйственных животных — свиней (16-20) и коз (21, 22), а также рыб (23). Сообщается о выделении сперматогониев из гонад эмбрионов и семенников 1-суточных цыплят (24, 25).
Ранее нами изучена возрастная динамика сперматогенеза у птицы и показано, что у петушков в возрасте до 5 нед в семенниках среди клеточных популяций превалируют сперматогонии (26). В настоящем исследовании мы показали, что высокую чистоту культуры клеток сперматого- ниев обеспечивает предварительное удаление других типов клеток, в частности самой многочисленной популяции клеток Сертоли. Оставшиеся в клеточной суспензии единичные соматические клетки образуют фидерный слой. Оптимальными свойствами обладает фидерный слой, сформированный собственными клетками Сертоли.
Наша цель заключалась в оптимизации приемов выделения и культивирования сперматогониев петуха в рамках поэтапной разработки технологии получения трансгенной птицы.
Методика. Семенники, изъятые у 2-недельных петухов, обрабатывали 70 % этиловым спиртом, декапсулировали и дважды промывали в физиологическом растворе с двойной дозой антимикотического антибиотика, затем механически измельчали до фрагментов размером 1-2 мм и трижды промывали средой DMEM (среда Игла в модификации Дюльбек-ко), осаждая клетки (300 g, 7 мин) с последующим пипетированием суспензии. Полученную в результате механической обработки клеточную массу подвергали ферментативной обработке: к полученному осадку клеток добавляли раствор коллагеназы («ПанЭко», Россия) в DMEM (конечная концентрация 1 мг/мл) и инкубировали в течение 20 мин при 37 ° С. Клетки осаждали низкоскоростным центрифугированием (200 g, 5 мин), надосадочную жидкость сливали, к осадку добавляли 0,25 % раствор трипсина («Invitrogen», США), пипетировали и инкубировали в течение 30 мин при 37 ° С, периодически встряхивая. После нейтрализации трипсина средой с сывороткой плода крупного рогатого скота (КРС) («GE Healthcare Life Sciences HyClone Laboratories», США) клетки осаждали, промывали несколько раз, повторно осаждая и пипетируя образовавшийся осадок в ростовой среде. Полученную суспензию высевали в культуральные флаконы (1 x 10 6 кл/см2). В качестве ростовой использовали среду DMEM HG («Invitrogen», США) с содержанием глюкозы 4,5 г/л, дополненную 20 % сыворотки плода КРС, а -глутамином (2 мМ; «Invitrogen», США), МЕМ (Minimum Essential Medium, 100 x ; «Invitrogen», США), антимикотическим антибиотиком (100 x ; «Invitrogen», США). Клетки снимали с субстрата с помощью 0,25 % раствора трипсина.
С целью получения первичной культуры клеток Сертоли для дальнейшего использования в качестве фидерного слоя через 24 ч после выделения первичной культуры сперматогониев ростовую среду, содержащую клетки сперматогенного ряда и очень небольшое количество не прикрепившихся к субстрату соматических клеток, сливали. Чашки промывали средой DMEM, после чего к прикрепившимся клеткам, представленным в основном клетками Сертоли и фибробластами, добавляли среду DMEM HG для дальнейшего культивирования. Поскольку указанная среда не оптимальна для роста фибробластов, они постепенно вытеснялись из культуры. Для приготовления фидерных слоев клетки после достижения 90 % монослоя в течение 3 ч обрабатывали раствором митомицина С («Sigma-Aldrich Сo.», США) в конечной концентрации 30 мкг/мл, после чего трижды промывали раствором Хэнкса («ПанЭко», Россия) и использовали для культивирования сперматогониев. Для идентификации клеток Сертоли их фиксировали метанолом и окрашивали жировым красным О (Oil red) в течение 15 мин.
Ростовой средой для сперматогониев служила DMEM HG, дополненная 5 % сыворотк ой плода КРС, а -глутамином (2 мМ), МЕМ (10 мкл/мл), антибиотиком (100 x ), меркаптоэтанолом (5 x 10-5 М; « Invitrogen», США), альбумином (5 мг/мл; «Invitrogen», США), DL-lactic acid (1 мкл/мл; «Sigma-Aldrich Сo.», США), EGF (epidermal growth factor, 20 нг/мл; «Sigma-
Aldrich Сo.», США), bFGF (basic fibroblast growth factor, 10 нг/мл; «Sigma-Aldrich Сo.», США) и LIF (leukemia inhibitory factor, 2 нг/мл; «Sigma-Al-drich Сo.», США). Среду меняли каждые 3 сут.
Морфологическую оценку свежевыделенной популяции спермато-генных клеток петуха проводили визуально под фазово-контрастным микроскопом («Nikon», Япония). Для получения постоянных препаратов спер-матогенные клетки окрашивали по Романовскому-Гимзе: клетки 10 мин фиксировали охлажденным до - 20 ° С метанолом, промывали дистиллированной водой и помещали в краситель Гимзы («Merck», Германия) на 1015 мин, после чего промывали водопроводной водой.
Для идентификации сперматогониев в культуре на 7-е сут культивирования применяли гистохимическое и иммуногистохимическое окрашивание. При гистохимическом окрашивании по Шиффу (на гликоген) по стандартной методике (27) клетки фиксировали 10 % нейтральным забу-ференным формалином. В результате колонии сперматогониев окрашивались в малиновый цвет. Для выявления экспрессии поверхностных антигенов SSEA-1 (stage-specific embryonic antigen-1) клетки фиксировали метанолом. Иммуногистохимическую обработку проводили с использованием авидин-биотиновой системы («Vector Laboratories», США) согласно описанию (15). В качестве первых антител использовали анти-SSEA-1. Комплекс антиген-антитело идентифицировали с помощью пероксидазы, для выявления которой применяли 3,3-диаминобензидин-тетрахлорат (ДАБ) («Vector Laboratories», США).
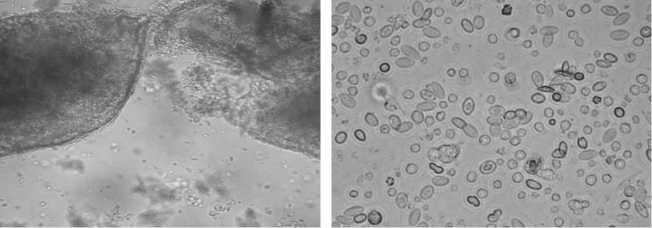
Результаты. Стадии выделения сперматогониев показаны на рисунке 1 (А-Г).
А
В
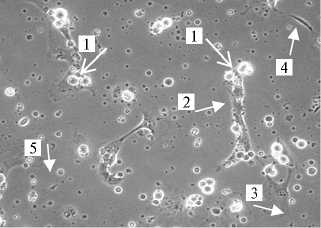
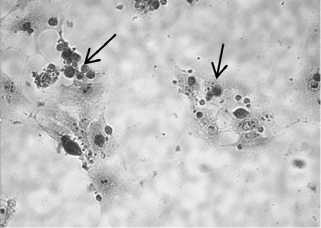
Рис. 1. Стадии выделения сперматогониев из семенника 2-недельного петуха ( Gallus gallus ): А — после механической обработки, видны небольшие фрагменты ткани семенника (нативный препарат, увеличение х 200); Б — после ферментативной обработки, видны обособленные сперматогенные и соматические клетки (нативный препарат, увеличение х 400); В — 2-суточная культура, видны сперматогонии (1), клетки Сертоли (2), клетки Лейдига (3), фибробласты (4), миоидные клетки (5) (нативный препарат, увеличение х 400); Г — 2-суточная культура, сперматогонии отмечены стрелками (окрашивание по Романовскому-Гимзе, увеличение х 400). Световая (А, Б, Г) и фазово-контрастная (В) микроскопия («Nikon», Япония).
После механической обработки семенника на препаратах были видны небольшие фрагменты ткани (см. рис. 1, А). В результате последующей ферментативной обработки (см. рис. 1, Б) получили клеточную суспензию, состоящую преимущественно из обособленных клеток. Через 24 ч культивирования клетки соматического ряда, обладающие высокой адгезией к пластику, прикреплялись и начинали делиться. Основная часть клеток сперматогенного ряда, которые имели вид шарообразных образований, находилась во взвешенном состоянии, и только некоторые прикреплялись к распластавшимся соматическим клеткам, используя их в качестве фидерного слоя. На 2-е сут (см. рис. 1, Г) сперматогенные клетки прикреплялись к фидерному слою и приобретали округлую форму.
Анализ фиксированных препаратов выявил наличие в полученной клеточной популяции нескольких типов клеток. Многочисленную группу составляли сперматогонии и клетки Сертоли. Сперматогонии характеризовались округлой формой. На окрашенных фиксированных препаратах выявлялось крупное сферическое ядро и узкий ободок цитоплазмы. Клетки Сертоли имели крупное ядро и нечеткую цитоплазму размытой формы с липидными включениями. Наряду со сперматогониями и клетками Сертоли выявлялись клетки интерстициальной ткани — фибробласты и клетки Лейдига. Клетки Лейдига имели неправильную форму и большие размеры по сравнению с другими типами клеток семенника. Фибробласты характеризовались веретенообразной формой. Встречались также мелкие сферические миоидные клетки (см. рис. 1, В).
А
Б
В
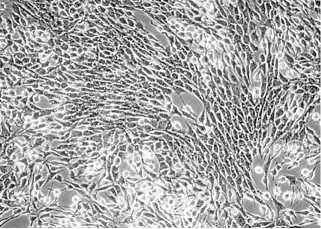
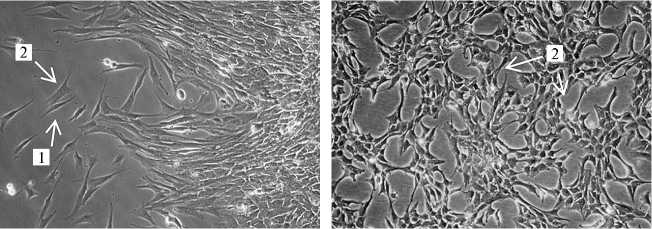
Рис. 2. Первичная культура соматических клеток семенника петуха ( Gallus gallus ): А — 4-суточная культура, отмечается наличие фибробластов (1) и клеток Сертоли (2) (нативный препарат, увеличение х 200); Б — 7-суточная культура, наличие клеток Сертоли (2) (нативный препарат, увеличение х 200); В — 7-суточная культура, представлена клетками Сертоли (окрашивание по Романовскому-Гимзе, увеличение х 100); Г — 7-суточная культура, идентификация клеток Сертоли по наличию липидных включений (3) (окрашивание Oil red, увеличение х 400). Световая микроскопия («Nikon», Япония).
Г
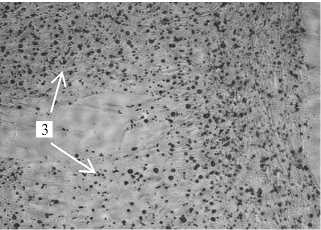
С целью получения гомогенной культуры клеток Сертоли для дальнейшего использования в качестве фидерного слоя проводили культивирование соматических клеток. На 3-и-4-е сут (рис. 2, А) в культуре наблюдались клетки, различающиеся по морфологии: клетки Сертоли, по форме сходные с эпителиальными, и фибробласты, имеющие веретенообразную форму. На 6-7-е сут культивирования клетки Сертоли вытесняли все остальные (см. рис. 2, Б). На препаратах, окрашенных по Романовскому-Гимзе, клетки в популяции имели морфологию, подобную таковой у эпителиальных клеток, и липидные включения, характерные для клеток Сертоли (см. рис. 2, Г).
Для получения максимально чистой популяции сперматогониев использовали метод, основанный на неодинаковых адгезивных способностях разных типов клеток. С этой целью с 1-суточной первичной культуры клеток семенника петуха сливали ростовую среду, содержащую не прикрепившиеся клетки, и осаждали их центрифугированием. Полученный осадок состоял в основном из клеток сперматогенного ряда, так как практически все соматические клетки, обладая по сравнению со сперматого-ниями более высокой адгезией к пластику, оставались в культуральном флаконе. Клетки пипетировали в ростовой среде для культивирования сперматогониев и высевали на фидерные слои, которыми служили клеточная линия STO, перевиваемые клетки Сертоли свиней (ПТП ) , клеточная линия Sc и первичные клетки Сертоли петуха, или на чашки, покрытые 0,2 % желатином. Наилучшие результаты были получены при использовании первичных клеток Сертоли (табл.).
Эффективность культивирования сперматогониев петуха ( Gallus gallus ) в зависимости от фидерного слоя
|
Показатель |
Фидерный слой |
|||
|
клеточная линия STO |
клеточная линия Sc |
перевиваемые клетки Сертоли свиней (ПТП ) |
первичные клетки Сертоли петуха |
|
|
Прикрепление сперматогониев к клеткам фидерного слоя На 1-2-е сут На 1-2-е сут На 1-2-е сут На 1-2 сут Образование колоний сперматогониев На 4-5-е сут На 4-5-е сут На 4-е сут На 3-и сут Сперматогониев на 7-е сут культивирования колонии (среднее для 20 колоний), шт. 6 6 8 10 |
||||
На 3-и-4 сут в культуре формировались колонии сперматогониев, постепенно увеличиваясь в размерах к 7-м сут. При использовании в качестве фидерного слоя желатина сперматогонии прикреплялись на соматические клетки, которые, как уже отмечалось, в небольшом количестве присутствовали в суспензии клеток после сбора ростовой среды с 1-суточной культуры семенников петуха (рис. 3, А, Б).
Наличие колоний сперматогониев на препаратах 7-суточной культуры подтвердило иммуногистохимическое окрашивание на SSEA-1 — маркер стволовых клеток, к которым относят сперматогонии типа А (см. рис. 3, В, Г), а также гистохимическое окрашивание на гликоген с использованием реактива Шиффа (см. рис. 3, Д, Е).
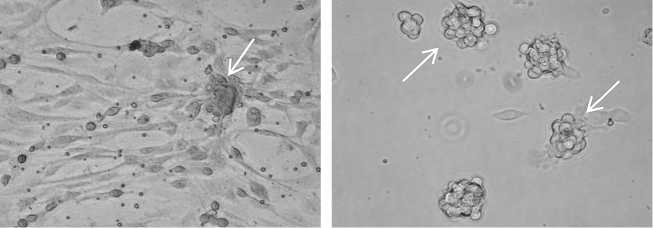
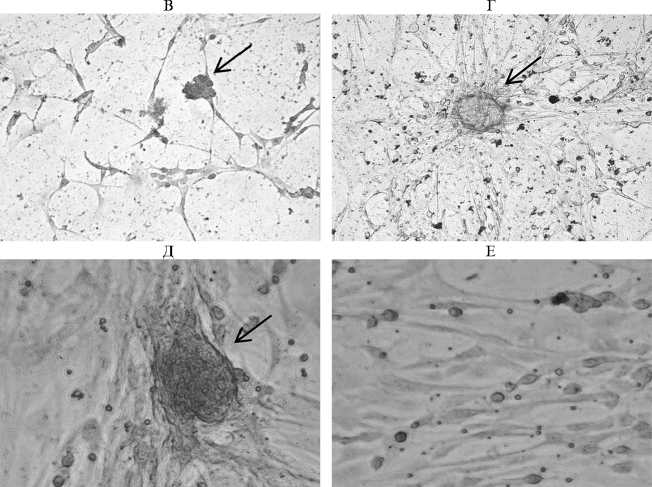
Рис. 3. Колонии сперматогониев петуха ( Gallus gallus ) (показаны стрелками) при культивировании на разных фидерных слоях: А — на собственных клетках Сертоли (окрашивание по Романовскому-Гимзе), Б — на чашках Петри, обработанных 0,2 % желатином (нативный препарат), В — наличие специфического иммуногистохимического окрашивания на экспрессию SSEA-1 (stage-specific embryonic antigen-1), Г — отсутствие специфического иммуногистохимического окрашивания на экспрессию SSEA-1 в контроле (без использования анти-SSEA-1), увеличение х 400; Д — окрашивание колонии по Шиффу, Е — отсутствие специфического окрашивания по Шиффу в контроле (фидерный слой), увеличение х 630. Световая микроскопия («Nikon», Япония).
Таким образом, эффективность получения максимально однородной культуры сперматогониев петуха зависит от метода их отделения от других клеток и используемого фидерного слоя. Разделение клеток по способности к адгезии позволяет максимально очистить культуру сперма-тогониев от остальных клеток, в частности от самой многочисленной популяции клеток Сертоли. Единичные соматические клетки, оставшиеся после этого в клеточной суспензии, при последующем культивировании служат фидерным слоем, на который прикрепляются сперматогонии. Культивирование сперматогониев на фидерных слоях или чашках, обработанных 0,2 % желатином, с использованием соответствующей ростовой среды позволяет получать колонии сперматогониев на 3-и-4-е сут. Оптимальный фидерный слой для культивирования сперматогониев петуха формируется из собственных клеток Сертоли.
Список литературы Выделение, культивирование и характеристика сперматогониев петуха (Gallus gallus)
- Yu F., Ding L.J., Sun G.B., Sun P.X., He X.H., Ni L.G., Li B.C. Transgenic sperm produced by electrotransfection and allogeneic transplantation of chicken fetal spermatogonial stem cells. Mol. Reprod. Dev., 2010, 77: 340-347 ( ) DOI: 10.1002/mrd.21147
- Brinster R.L. Germline stem cell transplantation and transgenesis. Science, 2002, 296: 2174-2176 ( ) DOI: 10.1126/science.1071607
- Oatley J.M. Spermatogonial stem cell biology in the bull: development of isolation, culture, and transplantation methodologies and their potential impacts on cattle production. Soc. Reprod. Fertil. Suppl., 2010, 67: 133-143.
- Zheng Y., Zhang Y., Qu R., He Y., Tian X., Zeng W. Spermatogonial stem cells from domestic animals: Progress and prospects. Reproduction, 2014, 147: 65-74 ( ) DOI: 10.1530/REP-13-0466
- McLean D.J. Spermatogonial stem cell transplantation and testicular function. Cell Tissue Res., 2005, 322(1): 21-31 ( ) DOI: 10.1007/s00441-005-0009-z
- Гистология: атлас, учебное пособие/Под ред. В.Л. Быкова, Л.К. Жункейра, Ж. Карнейро. М., 2009.
- De Rooij D.E., Griswold M.D. Questions about spermatogonia posed and answered since 2000. J. Androl., 2012, 33: 1085-1095 ( ) DOI: 10.2164/jandrol.112.016832
- De Rooij D.G., Russell L.D. All you wanted to know about spermatogonia but were afraid to ask. J. Androl., 2000, 21: 776-798 ( ) DOI: 10.1002/j.1939-4640.2000.tb03408.x
- Volkova N.A., Volkova L.А., Fomin I.K., Zinovieva N.A., Lotsmanova N.S. Optimization of conditions for recombinant DNA injection into spermatogenic cells of the chicken in vivo. Agricultural Biology, 2012, 6: 56-60 ( ) DOI: 10.15389/agrobiology.2012.6.56eng
- Min S., Qing S.Q., Hui Y.Y., Zhi F.D., Rong Q.Y., Feng X., Chun L.B. Generation of antiviral transgenic chicken using spermatogonial stem cell transfected in vivo. African Journal of Biotechnology, 2011, 10(70): 15678-15683 ( ) DOI: 10.5897/AJB11.040
- Dobrinski I. Germ cell transplantation and testis tissue xenografting in domestic animals. Anim. Reprod. Sci., 2005, 89: 137-145 ( ) DOI: 10.1016/j.anireprosci.2005.06.020
- Rodriguez-Sosa J.R., Dobson H., Hahnel A. Isolation and transplantation of spermatogonia in sheep. Theriogenology, 2006, 66: 2091-2103 ( ) DOI: 10.1016/j.theriogenology.2006.03.039
- Kanatsu-Shinohara M., Ogonuki N., Inoue K., Miki H., Ogura A., Toyokuni S., Shinohara T. Long-term proliferation in culture and germline transmission of mouse male germline stem cells. Biol. Reprod., 2003, 69: 612-616 ( ) DOI: 10.1095/biolreprod.103.017012
- Nagano M., Ryu B.Y., Brinster C.J., Avarbock M.R., Brinster R.L. Maintenance of mouse male germ line stem cells in vitro. Biol. Reprod., 2003, 68: 2207-2214 ( ) DOI: 10.1095/biolreprod.102.014050
- Kanatsu-Shinohara M., Muneto T., Lee J., Takenaka M., Chuma S., Nakatsuji N., Horiuchi T., Shinohara T. Long-term culture of male germline stem cells from hamster testes. Biol. Reprod., 2008, 78: 611-617 ( ) DOI: 10.1095/biolreprod.107.065615
- Wang X., Chen T., Zhang Ya., Li B., Xu Q., Song C. Isolation and culture of pig spermatogonial stem cells and their in vitro differentiation into neuron-like cells and adipocytes. Int. J. Mol. Sci., 2015, 16: 26333-26346 ( ) DOI: 10.3390/ijms161125958
- Park M.H., Park J.E., Kim M.S., Lee K.Y., Park H.J., Yun J.I., Choi J.H., Lee E., Lee S.T. Development of a high-yield technique to isolate spermatogonial stem cells from porcine testes. J. Assist. Reprod. Genet., 2014, 31: 983-991 ( ) DOI: 10.1007/s10815-014-0271-7
- Савченкова И.П., Васильева С.А. Культивирование сперматогониев хряка на клетках Сертоли. Цитология, 2016, 58(2): 135-142.
- Goel S., Sugimoto M., Minami N., Yamada M., Kume S., Imai H. Identification, isolation, and in vitro culture of porcine gonocytes. Biol. Reprod., 2007, 77: 127-137 ( ) DOI: 10.1095/biolreprod.106.056879
- Han S.Y., Gupta M.K., Uhm S.J., Lee H.T. Isolation and in vitro culture of pig spermatogonial stem cell. Asian-Aust. J. Anim. Sci., 2009, 22: 187-193 ( ) DOI: 10.3390/ijms161125958
- Pramod R.K., Mitra A. In vitro culture and characterization of spermatogonial stem cells on sertoli cell feeder layer in goat (Сapra hircus). J. Assist. Reprod. Genet., 2014, 31: 993-1001 ( ) DOI: 10.1007/s10815-014-0277-1
- Heidari B., Rahmati-Ahmadabadi M., Akhondi M.M., Zarnani A.H., Jeddi-Tehrani M., Shirazi A., Naderi M.M., Behzadi B. Isolation, identification, and culture of goat spermatogonial stem cells using c-kit and PGP9.5 markers. J. Assist. Reprod. Genet., 2012, 29: 1029-1038 ( ) DOI: 10.1007/s10815-012-9828-5
- Lacerda S.M., Costa G.M., de Franca L.R. Biology and identity of fish spermatogonial stem cell. Gen. Comp. Endocrinol., 2014, 207: 56-65 ( ) DOI: 10.1016/j.ygcen.2014.06.018
- Sisakhtnezhad S., Bahrami A.R., Matin M.M., Dehghani H., Momeni-Moghaddam M., Boozarpour S., Farshchian M., Dastpak M. The molecular signature and spermatogenesis potential of newborn chicken spermatogonial stem cells in vitro. In Vitro Cell Dev. Biol. Anim., 2015, 51: 415-425 ( ) DOI: 10.1007/s11626-014-9843-1
- Li B., Wang X.Y., Tian Z., Xiao X.J., Xu Q., Wei C.X., Sun H.C., Chen G.H. Directional differentiation of chicken spermatogonial stem cells in vitro. Cytotherapy, 2010, 12(3): 326-331 ( ) DOI: 10.3109/14653240903518155
- Белоглазова Е.В., Котова Т.О., Волкова Н.А., Волкова Л.А., Зиновьева Н.А., Эрнст Л.К. Возрастная динамика сперматогенеза у петухов в связи с оптимизацией сроков биоинженерных манипуляций. Сельскохозяйственная биология, 2011, 6: 60-64. Режим доступа: http://agrobiology.ru/6-2011beloglazova.pdf (рус.), http://agrobiology.ru/articles/6-2011beloglazova.pdf (англ.). Без даты.
- Микроскопическая техника/Под ред. Д.С. Саркизова, Ю.П. Перова. М., 1996.


