Выявление антител, специфичных к энтеротоксинам стафилококков, в сыворотке крови и молозиве коров
Автор: Лоскутова И.В., Щанникова М.П., Фурсова К.К., Шепеляковская А.О., Артемьева О.А., Никанова Д.А., Зиновьева Н.А., Бровко Ф.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, иммунология
Статья в выпуске: 6 т.52, 2017 года.
Бесплатный доступ
Мастит - распространенное инфекционное заболевание молочного скота, наносящее существенный экономический ущерб животноводству и влияющее на качество молочной продукции. Основной возбудитель мастита крупного рогатого скота (КРС) - золотистый стафилококк ( Staphylococcus aureus ). Заражение молочной железы S. aureus остается серьезной проблемой для всех стран мира. Болезнетворные свойства S. aureus и устойчивость в организме хозяина определяются набором токсинов. Микроорганизм продуцирует патогенные факторы, которые оказывают значительно влияние на течение заболевания. В настоящее время не существует эффективного способа борьбы с маститом, поэтому исследования иммунного статуса коров по отношению к энтеротоксинам стафилококка актуальны. Цель нашей работы заключалась в выявлении и определении титров антител, специфичных к наиболее распространенным энтеротоксинам стафилококков A, B, C, D, E, G, H, I и TSST, в сыворотке крови и молозиве коров ( Bos taurus taurus ). Объектом исследований были животные голштинизированной черно-пестрой породы второй лактации ( n = 47, 2016 год), которые находились на беспривязном содержании в хозяйстве Калужской области и 2 раза в год подвергались иммунизации вакциной Mastivak («Laboratorios Ovejero S.A.», Испания). Кровь отбирали из хвостовой вены (с последующим центрифугированием для осаждения форменных элементов), молозиво и молоко - непосредственно после доения из всех долей вымени в стерильные флаконы с соблюдением правил асептики. Наличие и титр Ig к энтеротоксинам A, B, C, D, E, G, H, I и TSST стафилококков оценивали методом непрямого иммуноферментного анализа. В 53,19 % образцов сывороток детектировались антитела класса G (IgG), специфичные к SEH. Антитела к TSST обнаружены в 4,26 % образцов, при этом их титр был самым низким по сравнению с антителами к другим энтеротоксинам. Антитела к SEB, SED, SEE, SEG, SEI и TSST вывили соответственно у 10,64; 23,47; 31,91; 29,78; 34,04 и 4,26 % животных. Анализ секретов молочной железы показал наличия в молозиве IgA к SEH, SEG и SEI. IgA к SEA, SEB, SEC, SED, SEE, TSST обнаружены не были. В молоке антитела к энтеротоксинам не выявляли. Таким образом, в сыворотке крови и молозиве клинически здоровых коров голштинизированной черно-пестрой породы установлено наличие антител к стафилококковым энтеротоксинам SEA, SEB, SEC, SED, SEE, SEG, SEH, SEI и TSST, то есть животные могли иметь контакт со стафилококками, продуцирующими такие типы токсинов.
Мастит коров, кровь, молозиво, энтеротоксины, антитела против энтеротоксинов
Короткий адрес: https://sciup.org/142214108
IDR: 142214108 | УДК: 632.2:619:579.62:57.083.3 | DOI: 10.15389/agrobiology.2017.6.1273rus
Текст научной статьи Выявление антител, специфичных к энтеротоксинам стафилококков, в сыворотке крови и молозиве коров
Мастит коров — основная причина экономических потерь в производстве молока во всем мире (1). Заболевание может быть вызвано 137 различными микроорганизмами (2), при этом наиболее часто с ним связывают Staphylococcus aureus , который выявляется как при субклинических, так и хронических инфекциях (3-5). Эффективность лечения мастита, вызываемого стафилококками, с помощью антибиотиков низкая (6) из-за ан-тибиотикорезистентности штаммов, способности S. aureus образовывать биопленки, а также выживать в эпителиальных клетках и макрофагах (7). Иммунные факторы молозива, молока и крови играют важную роль в естественном иммунитете и защите от мастита (8), однако S. aureus выделяет факторы вирулентности, способные подавлять иммунную систему организма хозяина, — энтеротоксины (SE) и токсин синдрома токсического шока (TSST-1) (9, 10), порообразующие токсины (11), фенолрастворимые моду-лины (12). Наиболее важная роль в подавлении иммунной системы хозяина и развитии мастита принадлежит энтеротоксинам. Способностью микроорганизмов продуцировать факторы, регулирующие иммунитет животных, обусловлен интерес к иммунологическим средствам предупреждения заболевания (13). Разработаны вакцины против мастита (14, 15), но вакцина-
Работа выполнена при финансовой поддержке РНФ (проект ¹ 15-16-00020).
ция не обеспечивает 100 % защиты. В этой связи важны сведения о состоянии иммунитета и наличии антител к патогенам, снимающих его напряженность. Антитела класса G могут переноситься из крови в другие биологические жидкости и ткани (16), тогда как продукция IgA носит локальный характер и отражает состояние воспалительных процессов в месте секреции (17). Антитела способны предотвращать размножение микробов и нейтрализовать токсины (18), а при переносе с молозивом и молоком от матери к новорожденному служат факторами пассивной вакцинации.
Комплексная оценка иммунного статуса животных в России в связи с инфицированностью S. aureus не проводилась. Мы впервые показали наличие в биологических жидкостях у коров голштинизированной чернопестрой породы антител сразу к нескольким токсинам этого патогена.
Нашей целью было выявление и определение титров антител, специфичных к наиболее распространенным энтеротоксинам стафилококков A, B, C, D, E, G, H, I и TSST, в сыворотке крови и молозиве коров.
Методика . Исследовали пробы сыворотки крови, молозива и молока от коров ( Bos taurus taurus ) голштинизированной черно-пестрой породы второй лактации ( n = 47, 2016 год). Животные находились на беспривязном содержании в хозяйстве Калужской области и 2 раза в год подвергались иммунизации вакциной Mastivak («Laboratorios Ovejero S.A.», Испания). В состав вакцины входили Streptococcus agalactiae , S. dysgalactiae , S. uberis , S. pyogenes , Staphylococcus aureus , Arcanobacterium pyogenes , Escherichia coli (штаммы Bov-10, Bov-14, Bov-15, Bov-21, J5). Энтеротоксины стафилококков были получены, как описано ранее (19), стафилококковый энтеротоксин H (SEH) — в ФГБУ ФНИЦ эпидемиологии и микробиологии им. почетного академика Н.Ф. Гамалеи (г. Москва).
Кровь отбирали из хвостовой вены в вакуумные пробирки с Clot Activator и центрифугировали для осаждения форменных элементов, молозиво и молоко — непосредственно после доения со всех долей вымени в стерильные флаконы с соблюдением правил асептики. Образцы для анализа доставляли в термоконтейнерах при +4 °С в течение 2 ч либо в замороженном состоянии.
Наличие и титр IgG к энтеротоксинам A, B, C, D, E, G, H, I и TSST стафилококков в сыворотке крови определяли методом непрямого иммуно-ферментного анализа. Использовали 96-луночные планшеты («Corning», США). На иммунопланшеты сорбировали индивидуальные энтеротоксины в концентрации 2 мкг/мл, растворенные в карбонатном буфере (0,1 М NaHCO3, 0,1 М Na2CO3, pH 9,0) по 50 мкл на лунку. Свободные сайты лунок иммунопланшета блокировали 2 % раствором бычьего сывороточного альбумина. Сыворотку крови титровали от разведения 1:100 с дальнейшим двукратным разведением в фосфатно-солевым буфером PBST (30 мМ KCl, 1 мМ KH 2 PO 4 , 1,38 M NaCl, 160 мМ Na 2 HPO4, pH 7,5 с добавлением 0,1 % Tween 20). Положительным контролем служили моноклональные антитела мыши к энтеротоксинам (20). Для идентификации сигнала использовали конъюгат антител кролика, специфичных к IgG коров, с пероксидазой хрена («Sigma», USA). Инкубацию на каждой стадии ИФА проводилю в течение 1 ч при 37 °С. После каждой инкубации, лунки промывали раствором PBST. Реакцию проявляли с помощью ортофенилендиамина (0,4 мг/мл) в цитрат-фосфатном буфере (1,1 мМ Na2HPO4, 0,51 % лимонная кислота, pH 5 с добавлением 0,03 % H2O2). Реакцию пероксидазы с субстратом останавливали добавлением равного объема 10 % серной кислоты. Оптическую плотность определяли на планшетном фотометре при X = 490 нм («Bio-Rad», США).
Определение наличия и титра IgА к энтероткосинам в молозиве и молоке осуществляли как описано выше для сывороток крови. IgA к токсинам детектировали с использованием антител козы, специфичных к IgА коров и конъюгированных с пероксидазой хрена («Abcam», США). За титр антител принимали максимальное разведение сыворотки (молозива), при котором ОD490 превышало фоновое значение сигнала в 2 раза.
Измерения проводились в 3 повторностях. При статистической обработке рассчитывали средние ( M ) и стандартные ошибки средних (±SEM).
Результаты. Энтеротоксин SEH был выявлен в сыворотке крови у 53,19 % исследованных коров. Необходимо отметить его важное значение в патогенезе мастита и способность вызывать апоптоз эпителиальных клеток молочной железы у коров (21). SEH-продуцирующие штаммы стафилококков составляют треть от выделенных у больных маститом овец (22). На территории РФ у больных маститом животных не обнаруживалось стафилококков — носителей гена seh , однако присутствие специфических антител говорит о том, что животные могли иметь контакт со стафилококками, продуцирующими SEH. Высокое содержание в сыворотке крови антител против SEA было выявлено у 42,55 %, SEC — у 36,17 % коров, что согласуется с результатами других исследований (23). Антитела к SEB, SED, SEE, SEG, SEI и TSST были обнаружены соответственно у 10,64; 23,47; 31,91; 29,78; 34,04 и 4,26 % животных.
Самое низкое содержание антител в сыворотке крови наблюдалось к TSST (рис.), что может быть связано с тем, что он редко встречается и играет незначительную роль в развитии мастита у коров (24). В молозиве коров, как и в сыворотке крови, присутствовали антитела с высоким титром к SEH, а также к SEG и SEI (см. рис). IgA к энтеротоксинам SEG встречались у 48,93, SEH — у 53,19, SEI — у 42,56 % животных. IgA к SEA, SEB, SEC, SED, SEE, TSST обнаружены не были.
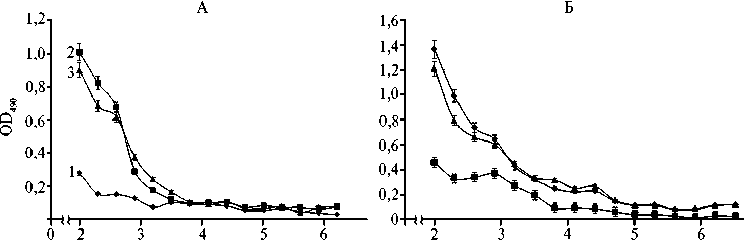
Кратность разведения, -1g
Типичные кривые титрования cыворотки крови (А, образец ¹ 7) и молозива (Б, образец ¹ 10) на наличие энтеротоксина H (1) , энтеротоксина A (2) и энтеротоксина TSST (3) у коров голштинизированной черно-пестрой породы (каждое измерение выполнено в 3 биохимических повторностях; Калужская обл., 2016 год).
Гены, кодирующие энтеротоксины SEG и SEI, находятся в геноме стафилококков и имеют низкую степень экспрессии по сравнению с генами токсинов-суперантигенов (25), локализованными в фагах или плазмидах (25). Сообщалось, что совместное присутствие seg и sei наблюдается в изолятах S. aureus , выделенных из молока больных животных (21). Наличие IgA к энтеротоксинам в молозиве может играть существенную профилактическую роль в случае инфицирования животных стафилококками — продуцентами таких энтеротоксинов (25).
В сыворотках крови и молозиве коров титр антител к SEH находился в пределах 1:800-1:3200, для SEG и SEI — в пределах 1:800-1:1600.
Самый низкий титр антител был выявлен для TSST и SEB (соответственно 1:400 и 1:800).
В процессе исследования проб молока не удалось получить достоверных результатов по наличию в образцах антител к энтеротоксинам.
Таким образом, мы установили наличие в сыворотке крови и молозиве у клинически здоровых коров голштинизированной черно-пестрой породы антител к широкому спектру стафилококковых энтеротоксинов SEA, SEB, SEC, SED, SEE, SEG, SEH, SEI и TSST, что свидетельствует о том, что животные могли иметь контакт со стафилококками, продуцирующими такие типы токсинов. Отсутствие антител в молоке, может говорить об их низкой концентрации в образцах.
Список литературы Выявление антител, специфичных к энтеротоксинам стафилококков, в сыворотке крови и молозиве коров
- Ruegg P.L. Investigation of mastitis problems on farms. Vet. Clin. N. Am.: Food Anim. Pract., 2003, 1: 47-73 ( ) DOI: 10.1016/S0749-0720(02)00078-6
- Ranjan R., Swarup D., Patra R.C., Nandi D. Bovine protothecal mastitis: a review. CAB Reviews: Perspectives in Agriculture, Veterinary Science, Nutrition and Natural Resources, 2006, 1: 1-7 ( ) DOI: 10.13140/RG.2.1.2223.8569
- Шурдуба Н.А., Сотникова В.М., Рыжова М.В., Осипова И.С., Токарев С.В. Видовой состав микрофлоры сырого молока в хозяйствах, неблагополучных по маститу коров. Проблемы ветеринарной санитарии, гигиены и экологии, 2014, 1(11): 65-67.
- Артемьева О.А., Переселкова Д.А., Виноградова И.В., Котковская Е.Н., Гладырь Е.А., Сивкин Н.В., Зиновьева Н.А. Скрининг стада молочных коров на наличие в молоке гемолитических микроорганизмов во взаимосвязи с содержанием соматических клеток. Сельскохозяйственная биология, 2015, 50(6): 810-816 ( ) DOI: 10.15389/agrobiology.2015.6.810rus
- De Visscher A., Piepers S., Haesebrouck F., Supré K., De Vliegher S. Coagulase-negative Staphylococcus species in bulk milk: Prevalence, distribution, and associated subgroup-and species-specific risk factors. J. Dairy Sci., 2017, 100(1): 629-642 ( ) DOI: 10.3168/jds.2016-11476
- Carter E.W., Kerr D.E. Optimization of DNA-based vaccination in cows using green fluorescent protein and protein A as a prelude to immunization against staphylococcal mastitis. J. Dairy Sci., 2003, 4: 1177-1186 ( ) DOI: 10.3168/jds.S0022-0302(03)73701-1
- Almeida R.A., Mathews K.R., Cifrian E., Guidry A.J., Oliver S.P. Staphylococcus aureus invasion of bovine mammary epithelial cells. J. Dairy Sci. 1996, 6: 1021-1026 ( ) DOI: 10.3168/jds.S0022-0302(96)76454-8
- Sordillo L.M. Factors affecting mammary gland immunity and mastitis susceptibility. Livest. Prod. Sci., 2005, 98: 89-99 ( ) DOI: 10.1016/j.livprodsci.2005.10.017
- Oviedo-Boyso J., Valdez-Alarcón J.J., Cajero-Juárez M., Ochoa-Zarzosa A., López-Meza J.E., Bravo-Patiño A., Baizabal-Aguirre V.M. Innate immune response of bovine mammary gland to pathogenic bacteria responsible for mastitis. Journal of Infection, 2007, 54(4): 399-409 ( ) DOI: 10.1016/j.jinf.2006.06.010
- Rainard P., Riollet C. Innate immunity of the bovine mammary gland. Vet. Res., 2006, 37(3): 369-400 ( ) DOI: 10.1051/vetres:2006007
- Spaulding A.R., Salgado-Pabón W., Kohler P.L., Horswill A.R., Leung D.Y., Schlievert P.M. Staphylococcal and streptococcal superantigen exotoxins. Clin. Microbiol. Rev., 2013, 26(3): 422-447 ( ) DOI: 10.1128/CMR.00104-12
- Zecconi A., Cesaris L., Liandris E., Daprà V., Piccinini R. Role of several Staphylococcus aureus virulence factors on the inflammatory response in bovine mammary gland. Microb. Pathogenesis, 2006, 40(4): 177-183 ( ) DOI: 10.1016/j.micpath.2006.01.001
- Deplanche M., Alekseeva L., Semenovskaya K., Fu C.L., Dessauge F., Finot L., Petzl W., Zerbe H., Le Loir Y., Rainard P., Smith D.G., Germon P., Otto M., Berkova N. Staphylococcus aureus phenol-soluble modulins impair interleukin expression in bovine mammary epithelial cells. Infect. Immun., 2016, 84(6): 1682-1692 ( ) DOI: 10.1128/IAI.01330-15
- Schukken Y.H., Günther J., Fitzpatrick J., Fontaine M.C., Goetze L., Holst O., Leigh J., Petzl W., Schuberth H.J., Sipka A., Smith D.G., Quesnell R., Watts J., Yancey R., Zerbe H., Gurjar A., Zadoks R.N., Seyfert H.M. Members of the Pfizer mastitis research consortium. Host-response patterns of intramammary infections in dairy cows. Vet. Immunol. Immunopathol., 2011, 144(3-4): 270-289 ( ) DOI: 10.1016/j.vetimm.2011.08.022
- Ebling T.L., Fox L.K., Bayles K.W., Bohach G.A., Byrne K.M., Davis W.C., Ferens W.A., Hillers J.K. Bovine mammary immune response to an experimental intramammary infection with a Staphylococcus aureus strain containing a gene for staphylococcal enterotoxin C1. J. Dairy Sci., 2001, 84(9): 2044-2050 ( ) DOI: 10.3168/jds.S0022-0302(01)74648-6
- Nawrotek P., Czernomysy-Furowicz D., Borkowski J., Fijałkowski K., Pobucewicz A. The effect of auto-vaccination therapy on the phenotypic variation of one clonal type of Staphylococcus aureus isolated from cows with mastitis. Vet. Microbiol., 2012, 155(2-4): 434-437 ( ) DOI: 10.1016/j.vetmic.2011.09.014
- Pyörälä S. New strategies to prevent mastitis. Reproduction in domestic animals, 2002, 37(4): 211-216 ( ) DOI: 10.1046/j.1439-0531.2002.00378.x
- Brandtzaeg P. Secretory IgA: designed for anti-microbial defense. Front. Immunol., 2013, 4: 222 ( ) DOI: 10.3389/fimmu.2013.00222
- Rubina A.Yu., Filippova M.A., Feizkhanova G.U., Shepeliakovskaya A.O., Sidina E.I., Boziev Kh.M., Laman A.G., Brovko F.A., Vertiev Yu.V., Zaseda-telev A.S., Grishin E.V. Simultaneous detection of seven Staphylococcal enterotoxins: Development of hydrogel biochips for analytical and practical application. Anal. Chem., 2010, 82(21): 8881-8889 ( ) DOI: 10.1021/ac1016634
- Liu Y., Chen W., Ali T., Alkasir R., Yin J., Liu G., Han B. Staphylococcal enterotoxin H induced apoptosis of bovine mammary epithelial cells in vitro. Toxins, 2014, 6: 3552-3567 ( ) DOI: 10.3390/toxins6123552
- Macori G., Giacinti G., Bellio A., Gallina S., Bianchi D.M., Sagrafoli D., Marri N., Giangolini G., Amatiste S., Decastelli L. Molecular epidemiology of methicillin-resistant and methicillin-susceptible Staphylococcus aureus in the ovine dairy chain and in farm-related humans. Toxins, 2017, 9(5): 161 ( ) DOI: 10.3390/toxins9050161
- Havaei S.A., Assadbeigi B., Esfahani B.N., Hoseini N.S., Rezaei N., Havaei S.R. Detection of mecA and enterotoxin genes in Staphylococcus aureus isolates associated with bovine mastitis and characterization of Staphylococcal cassette chromosome mec (SCCmec) in MRSA strains. Iranian Journal of Microbiology, 2015, 7(3): 161-167.
- Günaydın B., Aslanta Ö., Demir C. Detection of superantigenic toxin genes in Staphylococcus aureus strains from subclinical bovine mastitis. Tropical animal health and production, 2011, 43(8): 1633-1637 ( ) DOI: 10.1007/s11250-011-9882-5
- Zschöck M., Kloppert B., Wolter W., Hamann H.P. Lämmler C. Pattern of enterotoxin genes seg, seh, sei and sej positive Staphylococcus aureus isolated from bovine mastitis. Vet. Microbiol., 2005, 108: 243-249 ( ) DOI: 10.1016/j.vetmic.2005.02.012
- Wang X., Li G., Xia X., Yang B., Xi M., Meng J. Antimicrobial susceptibility and molecular typing of methicillin-resistant Staphylococcus aureus in retail foods in Shaanxi, China. Foodborne Pathog. Dis., 2014, 11, 281-286 ( ) DOI: 10.1089/fpd.2013.1643


